アズキ由来の抗ウイルス剤及びその調製方法
【課題】アズキからの滲出物を有効成分とする新規な抗ウイルス剤及びその有効成分の調製方法を提供する。
【解決手段】 生アズキを一晩(10〜30時間)水又は食塩水に浸漬して得られる滲出物中の有効成分を含有することを特徴とする抗ウイルス剤である。狂犬病ウイルス、ヘルペスウイルス、インフルエンザウイルス(A型)、シンドビスウイルス、水疱性口内炎ウイルスその他のウイルスに対する感染成立抑制作用及び殺ウイルス作用を有する。
【解決手段】 生アズキを一晩(10〜30時間)水又は食塩水に浸漬して得られる滲出物中の有効成分を含有することを特徴とする抗ウイルス剤である。狂犬病ウイルス、ヘルペスウイルス、インフルエンザウイルス(A型)、シンドビスウイルス、水疱性口内炎ウイルスその他のウイルスに対する感染成立抑制作用及び殺ウイルス作用を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アズキ由来の滲出物を有効成分として含有する抗ウイルス剤で、ウイルス感染症の予防・治療剤に関する。本発明はまたその調製方法にも関する。
【背景技術】
【0002】
アズキを含有する抗ウイルス剤は下記特許文献1により知られている。この発明によると、アズキ粉末またはアズキ抽出エキスは、顕著な抗ウイルス作用を有するとされている。効果のあるウイルスとして、例えば、オーエスキーウイルス、鶏ガンボロ病ウイルス、ニューカスル病ウイルス、犬ヘルペスウイルス、パルボウイルス等が挙げられている。
【特許文献1】特開平8−27016号
【発明の開示】
【発明が解決しようとする課題】
【0003】
本発明者は、特許文献1とは独立にアズキについて研究を行い、アズキ滲出液に殺ウイルス活性物質を発見した。現時点では、本発明と特許文献1における抗ウイルス活性物質との異同については不明であるが、本発明に係るアズキの産生する殺ウイルス活性物質は、アズキの粉末から抽出したばかりのものには殆ど含まれていないものであり、アズキ粒を生のままで水(あるいは食塩水)に一晩浸漬することにより得られるものである。水に一晩浸漬したアズキは発芽の準備が進むので、発芽という生命活動に依るところが大きいと考えられる。
【0004】
さらにいえば、アズキ粉末から水で室温抽出したものでも1〜2週間保存すると抗ウイルス活性が検出されるようになるが、活性は低い(後記比較例参照)。これに対して、アズキの浸漬液に含まれる抗ウイルス活性(殺ウイルス活性を示す)は、アズキ粉末からの抽出物よりも40〜50倍も高いという相違があるので、同一物質とは考えにくい。
【0005】
したがって、本発明の目的は、アズキからの滲出物を有効成分とする新規な抗ウイルス剤及びその有効成分の調製方法を提供することである。
【課題を解決するための手段】
【0006】
請求項1に係る本発明は、生アズキを水又は食塩水に10〜30時間浸漬して得られる滲出物中の有効成分を含有することを特徴とする抗ウイルス剤である。
【0007】
請求項2に係る本発明は、前記アズキ滲出物を含むアズキ浸漬液からイオン交換樹脂法又は抽出溶媒法を用いて得られた精製有効成分を含むことを特徴とする請求項1記載の抗ウイルス剤である。
【0008】
請求項3に係る本発明は、狂犬病ウイルス、ヘルペスウイルス、インフルエンザウイルス(A型)、シンドビスウイルス、水疱性口内炎ウイルスその他のウイルスに対する感染成立抑制作用及び殺ウイルス作用を有することを特徴とする請求項1または2記載の抗ウイルス剤である。
【0009】
請求項4に係る本発明は、生アズキを水又は食塩水に10〜30時間浸漬して滲出物を得ることを特徴とする抗ウイルス剤有効成分の調製方法である。
【0010】
請求項5に係る本発明は、水又は食塩水に重曹を加えたことを特徴とする請求項4記載の方法である。
【発明の効果】
【0011】
本発明によれば、食料として用いるアズキが産生する滲出物を用いることにより、新規な抗ウイルス剤及びウイルス感染症予防・治療剤が提供される。本発明の抗ウイルス剤は、ヒトを含む動物の感染症の原因となる病原性ウイルスに対して殺ウイルス作用および培養細胞感染系において抗ウイルス作用を有する。また、本発明のウイルス感染症予防・治療用組成物は、安全性に優れ、日常的に長期間にわたり利用あるいは服用が可能であって、ヒトを含む動物のウイルス感染症に対して予防効果あるいは治療効果を有する。
【発明を実施するための最良の形態】
【0012】
本発明の抗ウイルス剤は、ウイルス一般に抗ウイルス作用を有する。例えば、狂犬病ウイルス、ヘルペスウイルス、インフルエンザウイルス(A型)、シンドビスウイルス、水疱性口内炎ウイルスに対して抗ウイルス作用を有する。
【0013】
本発明において使用するアズキは、通常の生の赤アズキが適当である。大納言アズキも使用可能であるが、白アズキは不適当である。
【0014】
アズキからの滲出物を得るためにアズキを浸漬するのに用いる液は、水又は食塩水でよいが、重曹を添加した食塩水を用いた方がより活性が高い原料が得られる。
【0015】
浸漬は、アズキ粒を生のままで浸漬液に10〜30時間浸漬することにより行われる。10〜30時間というのは、俗にいう「一晩」ということであり、より好ましくは約15〜25時間、最も好ましいのは約20時間である。浸漬液の温度は室温でよいが、30〜37℃が最も好ましい。比率はアズキ1に対して浸漬液2〜5程度が好ましく、1:3が最も好ましい。アズキ1に対して浸漬液3のとき、滲出液のpHは約6.5〜6.7である。
【0016】
「アズキ滲出物」には、アズキを滲出原料として得られる滲出液、この滲出液の希釈液もしくは濃縮液、この滲出液を乾燥して得られる乾燥物又はこれらの粗精製物もしくは精製物のいずれもが含まれる。精製は、前記アズキ滲出物を含むアズキ浸漬液からイオン交換樹脂法又は抽出溶媒法により行うことができる。抽出溶媒法では、抽出溶媒として、水または有機溶媒を使用することができる。
【0017】
本発明の抗ウイルス剤は、前記滲出物そのままの形態で用いられる他、常法の製剤技術により、散剤、頼粒剤、丸剤、錠剤、トローチ剤、カプセル剤、含嗽剤、液剤、貼付剤、軟膏剤、リニメント剤、ローション剤、坐剤、注射剤等の形態で提供できる。
【0018】
動物用としては、更に、飼料添加剤、飲水添加剤として調製することもできる。飼料添加剤とする場合には、粉剤か顕粒剤とすることが好ましい。本発明の抗ウイルス剤を飼料添加剤として添加できる飼料は市販されている飼料のいずれでもよい。また、ミネラル、ビタミン、アミノ酸等の飼料添加物を含む飼料であってもよい。
【0019】
これら製剤には、所望ならば、保存性、均質性を保持するために、常法により、賦形剤、保存剤、緩衝剤等の添加剤を加えることもできる。更に、矯味剤、矯臭剤、着色剤を含めることもできる。賦形剤としては、例えば、乳糖、デンプンを使用できる。保存剤としては、例えば、パラオキシ安息香酸メチル、パラオキシ安息香酸エチル、パラオキシ安息香酸プロピル等のパラオキシ安息香酸エステル類、デヒドロ酢酸ナトリウム、フェノール、メチルパラベン、エチルパラベン、ブロビルパラベン等を使用できる。緩衝剤としては、例えば、クエン酸塩、酢酸塩、リン酸塩等が使用できる。
【0020】
本発明の抗ウイルス剤を投与する際の投与量、投与間隔は、担当医師又は獣医師の厳重な管理下、投与対象の年齢、症状、体重、投与効果を勘案して個別に決定される。
【0021】
一応の目安として、人間の成人(60kg)で、経口投与で1μg〜100mg、静脈投与で10 ng〜l mg、経皮投与で100ng〜l mgを1日1回投与することができる。
【0022】
動物では、牛、馬等の大型動物は上記の量の60分の1を体重lkg当たりの量の目安とし、豚、犬猫等の中型、小型の動物ではその2倍量を体重1kg当たりの量の目安とし、鶏等の鳥類では更にその2倍量を体重lkg当たりの量の目安とし投与することができる。
【0023】
以下、実施例(製造例及び試験例)を示して本発明をさらに詳細に説明する。
【実施例1】
【0024】
<製造例1>
冷蔵保存していた乾燥生アズキ20gを約3倍量の生理的食塩水(60ml)に浸し、室温で一晩(20時間前後)置き、アズキ滲出液を調製する。この条件では約40ml回収される。pHは約6.5。この滲出液を加熱処理(浸漬液を入れた容器を煮沸水に10分間つける)し、冷めてから、冷蔵保存する。
【実施例2】
【0025】
<製造例2>
冷蔵保存していた乾燥生アズキ20gを約3倍量の生理的食塩水(60ml)に浸し、37°Cで一晩(20時間前後)置き、アズキ滲出液を調製する。この条件では約40ml回収される。pHは約6.5。この滲出液をろ過滅菌してから、冷蔵保存する。
【実施例3】
【0026】
<製造例3>
冷蔵保存していた乾燥生アズキ20gを生理的食塩水60mlに浸しこれに重曹を約1%加えて(pHは7.8−8.0となる)、37℃で一晩(20時間前後)保温して、アズキ滲出液を調製する。この条件では約40ml回収される。pHは約6.5−6.7。この滲出液を加熱処理(浸漬液を入れた容器を煮沸水に10分間つける)し、冷めてから、低速遠心(毎分2000回転、15分)を行い夾雑物を除き、適当量に小分けして、冷凍保存する。
【実施例4】
【0027】
<薬効確認試験1>
本試験は、培養細胞(BHK-21)に狂犬病ウイルスを接種した時にみられるフォーカス形成モデル実験系として用い、その頻度をアズキ滲出物が抑えることをみる。即ち、アズキ滲出液をウイルス液、あるいは感染細胞用培地に添加することによってフォーカス形成の頻度が減少すること(即ち、抑制作用)および有効濃度を調べるために行った。
(1)試料の調製
【0028】
実施例1(製造例1)による。
(2)試験方法
【0029】
ウイルス感受性の培養細胞のシートをシャーレに準備し、翌日これに狂犬病ウイルス(弱毒株)を接種する(ウイルス量と細胞数の比が約1:100〜200となるようにウイルス量を調整する)。ウイルス吸着操作の後に加える培養液に、アズキ浸漬液をいろいろの濃度で添加する。約24時間培養した後に10%のホルマリンで固定し、ウイルス抗原に対する抗体を用いて蛍光抗体染色を行い、蛍光顕微鏡下に100視野あたりの感染細胞の小集団(フォーカス)を計数し、対照標本で得られた数に対する比率を算出する。
(3)試験結果
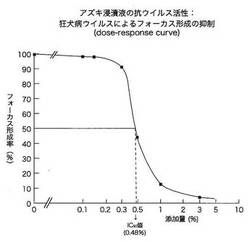
【0030】
本試験の結果は図1に示すとおりである。ウイルスの感染によるフォーカス形成率を50%抑制するのに必要なアズキ浸漬液の添加量は、狂犬病ウイルスに対して0.3〜0.5%(図では0.48%)であった(この値をもとにアズキ浸漬液の狂犬病ウイルスに対する抗ウイルス活性値を計算すると200〜300RIU/mlとなる。図1のデータでは208RIU/ml)。
【0031】
したがって、アズキ滲出物は、ウイルス感染後の培養液に添加すると、少量でも狂犬病ウイルスの感染を抑制する作用を示すことが明らかになった。
【実施例5】
【0032】
<薬効確認試験2>
本試験は、アズキ由来の滲出物が病原性ウイルスに対して直接作用(殺ウイルス作用)を示すことを調べるために行った。
(1)試料の調製
【0033】
前記実施例1(製造例1)による。
(2)試験方法
【0034】
狂犬病ウイルスの感染力を失わせる直接作用(殺ウイルス作用)の試験。ウイルス液にアズキ滲出物を含む液を種々の濃度で添加して一定時間(通常1時間)静置した後、20倍以上希釈し、培養細胞に接種しフォーカス形成率を調べる。未処理のウイルスのフォーカス形成率と比較することにより殺ウイルス効果を判定する。
(3)試験結果
【0035】
本試験の結果は図2に示すとおりである。アズキ滲出物は狂犬病ウイルスに直接作用して、感染力を失わせる(殺ウイルス作用)ことがわかった。その有効濃度はウイルス感染後の培地に添加する実験例(即ち、実施例4)で得られた結果とほぼ同等であった。
【実施例6】
【0036】
<薬効確認試験3>
本試験は、狂犬病ウイルス以外の種々の病原性ウイルスの感染の成立に対するアズキ溶出物の抑制作用(抗ウイルス作用)を調べるために行った。
(1)試料の調製
【0037】
実施例1(製造例1)による。
(2)試験方法
【0038】
実施例4と同様の方法で行った。
(3)試験結果
【0039】
本試験の結果は表1及び図3に示すとおりである。ウイルスの感染によるフォーカス形成率を50%抑制するのに必要なアズキ浸漬液の添加量は、狂犬病ウイルスに対して0.35%、ヘルペスウイルスに対して0.5%、インフルエンザウイルスに対して0.7%、シンドビスウイルスに対して1.3%、水疱性口内炎ウイルスに対して8%であった。したがって、アズキ溶出物は、いろいろの種類の病原性ウイルスの感染成立に対して阻害作用を持つことが明らかになった。
【表1】

【実施例7】
【0040】
<薬効確認試験4>
本試験は、アズキ抽出物の病原性ウイルスに対する感染性不活性化作用(殺ウイルス作用)を調べるために行った。
(1)試料の調製
【0041】
前記実施例1(製造例1)による。
(2)試験方法
【0042】
ウイルス液にアズキ浸漬液を1〜3%になるように添加して室温で静置する。1時間後にこの混合液を20倍以上希釈してからウイルスに感受性を示す培養細胞に細胞数に対して100〜200分の1単位のウイルスを含むように接種し、24時間培養した後にホルマリン固定を行い、蛍光抗体法により感染細胞のフォーカス数を計測する。対照との比をみて判断する。
(3)試験結果
【0043】
本試験の結果は図4に示すとおりである。ウイルスの感染力を50%失活させるのに必要なアズキ浸漬液の濃度は狂犬病ウイルスに対して0.2〜0.3%、インフルエンザウイルスに対して0.5%であった。アズキ滲出物の殺ウイルス作用はウイルス種によって異なり狂犬病ウイルスとインフルエンザウイルスとでは約2倍の違いがみられた。
<細胞毒性試験>
【0044】
アズキ滲出物の細胞毒性を調べるために行った。
(1)試料の調製
【0045】
前記実施例1(製造例1)による。
(2)試験方法
【0046】
試験にはウイルスの感受性宿主として用いる培養細胞(BHK-21など)を用いた。まず細胞のシートを準備し(35mmシャーレを用いる)、翌日培養液を交換した後、アズキ浸漬液を1〜10%に添加して37℃で培養する。24時間後に倒立顕微鏡下に細胞の形態などを観察する。
【0047】
チェック項目:細胞の形態の変化(平たく伸展しているか、円形化しているか)の有無、細胎内の空胞形成の有無、細胞融合(合胞体形成の有無)、細胞表面のbleb形成の有無、細胞崩壊の有無、細胞剥離の有無など。
【0048】
培養液として、通常牛胎児血清を3%添加した維持培地を用いるが、無血清培地を用いてもよい(無血清培地の方が感度を高めることができる)。
(3)試験結果
【0049】
本試験の結果は下記表2及び図5に示すとおりである。
【表2】

<比較例>
【0050】
特許文献1に見られるようなアズキ粉末からの抽出液の抗ウイルス活性を調べた。
(1)試料の調製
【0051】
アズキをコーヒーミルで挽いて粉末とした。この粉末重量の9倍量の食塩水を加えて懸濁し、一晩攪拌した後に遠心し、上澄み液を回収し、ろ過滅菌した。
(2)試験方法
【0052】
実施例4と同様の方法で行った。
(3)試験結果
【0053】
本試験の結果は図6に示すとおりである。図6において、○、□、△はそれぞれ別に抽出したものであり、培養液に50%添加したときにみられる抗ウイルス効果を示している。
【0054】
アズキ粉末から水で室温抽出したものでも1〜2週間保存すると抗ウイルス活性が検出されるようになるが、活性は低い。これに対して、アズキの浸漬液に含まれる抗ウイルス活性(殺ウイルス活性を示す)は、アズキ粉末からの抽出物よりも40〜50倍も高い。
【図面の簡単な説明】
【0055】
【図1】実施例4の結果を示すグラフである。
【図2】実施例5の結果を示すグラフである。
【図3】実施例6の結果を示すグラフである。
【図4】細胞毒性試験の結果を示すグラフである。
【図5】比較例との比較結果を示すグラフである。
【技術分野】
【0001】
本発明は、アズキ由来の滲出物を有効成分として含有する抗ウイルス剤で、ウイルス感染症の予防・治療剤に関する。本発明はまたその調製方法にも関する。
【背景技術】
【0002】
アズキを含有する抗ウイルス剤は下記特許文献1により知られている。この発明によると、アズキ粉末またはアズキ抽出エキスは、顕著な抗ウイルス作用を有するとされている。効果のあるウイルスとして、例えば、オーエスキーウイルス、鶏ガンボロ病ウイルス、ニューカスル病ウイルス、犬ヘルペスウイルス、パルボウイルス等が挙げられている。
【特許文献1】特開平8−27016号
【発明の開示】
【発明が解決しようとする課題】
【0003】
本発明者は、特許文献1とは独立にアズキについて研究を行い、アズキ滲出液に殺ウイルス活性物質を発見した。現時点では、本発明と特許文献1における抗ウイルス活性物質との異同については不明であるが、本発明に係るアズキの産生する殺ウイルス活性物質は、アズキの粉末から抽出したばかりのものには殆ど含まれていないものであり、アズキ粒を生のままで水(あるいは食塩水)に一晩浸漬することにより得られるものである。水に一晩浸漬したアズキは発芽の準備が進むので、発芽という生命活動に依るところが大きいと考えられる。
【0004】
さらにいえば、アズキ粉末から水で室温抽出したものでも1〜2週間保存すると抗ウイルス活性が検出されるようになるが、活性は低い(後記比較例参照)。これに対して、アズキの浸漬液に含まれる抗ウイルス活性(殺ウイルス活性を示す)は、アズキ粉末からの抽出物よりも40〜50倍も高いという相違があるので、同一物質とは考えにくい。
【0005】
したがって、本発明の目的は、アズキからの滲出物を有効成分とする新規な抗ウイルス剤及びその有効成分の調製方法を提供することである。
【課題を解決するための手段】
【0006】
請求項1に係る本発明は、生アズキを水又は食塩水に10〜30時間浸漬して得られる滲出物中の有効成分を含有することを特徴とする抗ウイルス剤である。
【0007】
請求項2に係る本発明は、前記アズキ滲出物を含むアズキ浸漬液からイオン交換樹脂法又は抽出溶媒法を用いて得られた精製有効成分を含むことを特徴とする請求項1記載の抗ウイルス剤である。
【0008】
請求項3に係る本発明は、狂犬病ウイルス、ヘルペスウイルス、インフルエンザウイルス(A型)、シンドビスウイルス、水疱性口内炎ウイルスその他のウイルスに対する感染成立抑制作用及び殺ウイルス作用を有することを特徴とする請求項1または2記載の抗ウイルス剤である。
【0009】
請求項4に係る本発明は、生アズキを水又は食塩水に10〜30時間浸漬して滲出物を得ることを特徴とする抗ウイルス剤有効成分の調製方法である。
【0010】
請求項5に係る本発明は、水又は食塩水に重曹を加えたことを特徴とする請求項4記載の方法である。
【発明の効果】
【0011】
本発明によれば、食料として用いるアズキが産生する滲出物を用いることにより、新規な抗ウイルス剤及びウイルス感染症予防・治療剤が提供される。本発明の抗ウイルス剤は、ヒトを含む動物の感染症の原因となる病原性ウイルスに対して殺ウイルス作用および培養細胞感染系において抗ウイルス作用を有する。また、本発明のウイルス感染症予防・治療用組成物は、安全性に優れ、日常的に長期間にわたり利用あるいは服用が可能であって、ヒトを含む動物のウイルス感染症に対して予防効果あるいは治療効果を有する。
【発明を実施するための最良の形態】
【0012】
本発明の抗ウイルス剤は、ウイルス一般に抗ウイルス作用を有する。例えば、狂犬病ウイルス、ヘルペスウイルス、インフルエンザウイルス(A型)、シンドビスウイルス、水疱性口内炎ウイルスに対して抗ウイルス作用を有する。
【0013】
本発明において使用するアズキは、通常の生の赤アズキが適当である。大納言アズキも使用可能であるが、白アズキは不適当である。
【0014】
アズキからの滲出物を得るためにアズキを浸漬するのに用いる液は、水又は食塩水でよいが、重曹を添加した食塩水を用いた方がより活性が高い原料が得られる。
【0015】
浸漬は、アズキ粒を生のままで浸漬液に10〜30時間浸漬することにより行われる。10〜30時間というのは、俗にいう「一晩」ということであり、より好ましくは約15〜25時間、最も好ましいのは約20時間である。浸漬液の温度は室温でよいが、30〜37℃が最も好ましい。比率はアズキ1に対して浸漬液2〜5程度が好ましく、1:3が最も好ましい。アズキ1に対して浸漬液3のとき、滲出液のpHは約6.5〜6.7である。
【0016】
「アズキ滲出物」には、アズキを滲出原料として得られる滲出液、この滲出液の希釈液もしくは濃縮液、この滲出液を乾燥して得られる乾燥物又はこれらの粗精製物もしくは精製物のいずれもが含まれる。精製は、前記アズキ滲出物を含むアズキ浸漬液からイオン交換樹脂法又は抽出溶媒法により行うことができる。抽出溶媒法では、抽出溶媒として、水または有機溶媒を使用することができる。
【0017】
本発明の抗ウイルス剤は、前記滲出物そのままの形態で用いられる他、常法の製剤技術により、散剤、頼粒剤、丸剤、錠剤、トローチ剤、カプセル剤、含嗽剤、液剤、貼付剤、軟膏剤、リニメント剤、ローション剤、坐剤、注射剤等の形態で提供できる。
【0018】
動物用としては、更に、飼料添加剤、飲水添加剤として調製することもできる。飼料添加剤とする場合には、粉剤か顕粒剤とすることが好ましい。本発明の抗ウイルス剤を飼料添加剤として添加できる飼料は市販されている飼料のいずれでもよい。また、ミネラル、ビタミン、アミノ酸等の飼料添加物を含む飼料であってもよい。
【0019】
これら製剤には、所望ならば、保存性、均質性を保持するために、常法により、賦形剤、保存剤、緩衝剤等の添加剤を加えることもできる。更に、矯味剤、矯臭剤、着色剤を含めることもできる。賦形剤としては、例えば、乳糖、デンプンを使用できる。保存剤としては、例えば、パラオキシ安息香酸メチル、パラオキシ安息香酸エチル、パラオキシ安息香酸プロピル等のパラオキシ安息香酸エステル類、デヒドロ酢酸ナトリウム、フェノール、メチルパラベン、エチルパラベン、ブロビルパラベン等を使用できる。緩衝剤としては、例えば、クエン酸塩、酢酸塩、リン酸塩等が使用できる。
【0020】
本発明の抗ウイルス剤を投与する際の投与量、投与間隔は、担当医師又は獣医師の厳重な管理下、投与対象の年齢、症状、体重、投与効果を勘案して個別に決定される。
【0021】
一応の目安として、人間の成人(60kg)で、経口投与で1μg〜100mg、静脈投与で10 ng〜l mg、経皮投与で100ng〜l mgを1日1回投与することができる。
【0022】
動物では、牛、馬等の大型動物は上記の量の60分の1を体重lkg当たりの量の目安とし、豚、犬猫等の中型、小型の動物ではその2倍量を体重1kg当たりの量の目安とし、鶏等の鳥類では更にその2倍量を体重lkg当たりの量の目安とし投与することができる。
【0023】
以下、実施例(製造例及び試験例)を示して本発明をさらに詳細に説明する。
【実施例1】
【0024】
<製造例1>
冷蔵保存していた乾燥生アズキ20gを約3倍量の生理的食塩水(60ml)に浸し、室温で一晩(20時間前後)置き、アズキ滲出液を調製する。この条件では約40ml回収される。pHは約6.5。この滲出液を加熱処理(浸漬液を入れた容器を煮沸水に10分間つける)し、冷めてから、冷蔵保存する。
【実施例2】
【0025】
<製造例2>
冷蔵保存していた乾燥生アズキ20gを約3倍量の生理的食塩水(60ml)に浸し、37°Cで一晩(20時間前後)置き、アズキ滲出液を調製する。この条件では約40ml回収される。pHは約6.5。この滲出液をろ過滅菌してから、冷蔵保存する。
【実施例3】
【0026】
<製造例3>
冷蔵保存していた乾燥生アズキ20gを生理的食塩水60mlに浸しこれに重曹を約1%加えて(pHは7.8−8.0となる)、37℃で一晩(20時間前後)保温して、アズキ滲出液を調製する。この条件では約40ml回収される。pHは約6.5−6.7。この滲出液を加熱処理(浸漬液を入れた容器を煮沸水に10分間つける)し、冷めてから、低速遠心(毎分2000回転、15分)を行い夾雑物を除き、適当量に小分けして、冷凍保存する。
【実施例4】
【0027】
<薬効確認試験1>
本試験は、培養細胞(BHK-21)に狂犬病ウイルスを接種した時にみられるフォーカス形成モデル実験系として用い、その頻度をアズキ滲出物が抑えることをみる。即ち、アズキ滲出液をウイルス液、あるいは感染細胞用培地に添加することによってフォーカス形成の頻度が減少すること(即ち、抑制作用)および有効濃度を調べるために行った。
(1)試料の調製
【0028】
実施例1(製造例1)による。
(2)試験方法
【0029】
ウイルス感受性の培養細胞のシートをシャーレに準備し、翌日これに狂犬病ウイルス(弱毒株)を接種する(ウイルス量と細胞数の比が約1:100〜200となるようにウイルス量を調整する)。ウイルス吸着操作の後に加える培養液に、アズキ浸漬液をいろいろの濃度で添加する。約24時間培養した後に10%のホルマリンで固定し、ウイルス抗原に対する抗体を用いて蛍光抗体染色を行い、蛍光顕微鏡下に100視野あたりの感染細胞の小集団(フォーカス)を計数し、対照標本で得られた数に対する比率を算出する。
(3)試験結果
【0030】
本試験の結果は図1に示すとおりである。ウイルスの感染によるフォーカス形成率を50%抑制するのに必要なアズキ浸漬液の添加量は、狂犬病ウイルスに対して0.3〜0.5%(図では0.48%)であった(この値をもとにアズキ浸漬液の狂犬病ウイルスに対する抗ウイルス活性値を計算すると200〜300RIU/mlとなる。図1のデータでは208RIU/ml)。
【0031】
したがって、アズキ滲出物は、ウイルス感染後の培養液に添加すると、少量でも狂犬病ウイルスの感染を抑制する作用を示すことが明らかになった。
【実施例5】
【0032】
<薬効確認試験2>
本試験は、アズキ由来の滲出物が病原性ウイルスに対して直接作用(殺ウイルス作用)を示すことを調べるために行った。
(1)試料の調製
【0033】
前記実施例1(製造例1)による。
(2)試験方法
【0034】
狂犬病ウイルスの感染力を失わせる直接作用(殺ウイルス作用)の試験。ウイルス液にアズキ滲出物を含む液を種々の濃度で添加して一定時間(通常1時間)静置した後、20倍以上希釈し、培養細胞に接種しフォーカス形成率を調べる。未処理のウイルスのフォーカス形成率と比較することにより殺ウイルス効果を判定する。
(3)試験結果
【0035】
本試験の結果は図2に示すとおりである。アズキ滲出物は狂犬病ウイルスに直接作用して、感染力を失わせる(殺ウイルス作用)ことがわかった。その有効濃度はウイルス感染後の培地に添加する実験例(即ち、実施例4)で得られた結果とほぼ同等であった。
【実施例6】
【0036】
<薬効確認試験3>
本試験は、狂犬病ウイルス以外の種々の病原性ウイルスの感染の成立に対するアズキ溶出物の抑制作用(抗ウイルス作用)を調べるために行った。
(1)試料の調製
【0037】
実施例1(製造例1)による。
(2)試験方法
【0038】
実施例4と同様の方法で行った。
(3)試験結果
【0039】
本試験の結果は表1及び図3に示すとおりである。ウイルスの感染によるフォーカス形成率を50%抑制するのに必要なアズキ浸漬液の添加量は、狂犬病ウイルスに対して0.35%、ヘルペスウイルスに対して0.5%、インフルエンザウイルスに対して0.7%、シンドビスウイルスに対して1.3%、水疱性口内炎ウイルスに対して8%であった。したがって、アズキ溶出物は、いろいろの種類の病原性ウイルスの感染成立に対して阻害作用を持つことが明らかになった。
【表1】

【実施例7】
【0040】
<薬効確認試験4>
本試験は、アズキ抽出物の病原性ウイルスに対する感染性不活性化作用(殺ウイルス作用)を調べるために行った。
(1)試料の調製
【0041】
前記実施例1(製造例1)による。
(2)試験方法
【0042】
ウイルス液にアズキ浸漬液を1〜3%になるように添加して室温で静置する。1時間後にこの混合液を20倍以上希釈してからウイルスに感受性を示す培養細胞に細胞数に対して100〜200分の1単位のウイルスを含むように接種し、24時間培養した後にホルマリン固定を行い、蛍光抗体法により感染細胞のフォーカス数を計測する。対照との比をみて判断する。
(3)試験結果
【0043】
本試験の結果は図4に示すとおりである。ウイルスの感染力を50%失活させるのに必要なアズキ浸漬液の濃度は狂犬病ウイルスに対して0.2〜0.3%、インフルエンザウイルスに対して0.5%であった。アズキ滲出物の殺ウイルス作用はウイルス種によって異なり狂犬病ウイルスとインフルエンザウイルスとでは約2倍の違いがみられた。
<細胞毒性試験>
【0044】
アズキ滲出物の細胞毒性を調べるために行った。
(1)試料の調製
【0045】
前記実施例1(製造例1)による。
(2)試験方法
【0046】
試験にはウイルスの感受性宿主として用いる培養細胞(BHK-21など)を用いた。まず細胞のシートを準備し(35mmシャーレを用いる)、翌日培養液を交換した後、アズキ浸漬液を1〜10%に添加して37℃で培養する。24時間後に倒立顕微鏡下に細胞の形態などを観察する。
【0047】
チェック項目:細胞の形態の変化(平たく伸展しているか、円形化しているか)の有無、細胎内の空胞形成の有無、細胞融合(合胞体形成の有無)、細胞表面のbleb形成の有無、細胞崩壊の有無、細胞剥離の有無など。
【0048】
培養液として、通常牛胎児血清を3%添加した維持培地を用いるが、無血清培地を用いてもよい(無血清培地の方が感度を高めることができる)。
(3)試験結果
【0049】
本試験の結果は下記表2及び図5に示すとおりである。
【表2】

<比較例>
【0050】
特許文献1に見られるようなアズキ粉末からの抽出液の抗ウイルス活性を調べた。
(1)試料の調製
【0051】
アズキをコーヒーミルで挽いて粉末とした。この粉末重量の9倍量の食塩水を加えて懸濁し、一晩攪拌した後に遠心し、上澄み液を回収し、ろ過滅菌した。
(2)試験方法
【0052】
実施例4と同様の方法で行った。
(3)試験結果
【0053】
本試験の結果は図6に示すとおりである。図6において、○、□、△はそれぞれ別に抽出したものであり、培養液に50%添加したときにみられる抗ウイルス効果を示している。
【0054】
アズキ粉末から水で室温抽出したものでも1〜2週間保存すると抗ウイルス活性が検出されるようになるが、活性は低い。これに対して、アズキの浸漬液に含まれる抗ウイルス活性(殺ウイルス活性を示す)は、アズキ粉末からの抽出物よりも40〜50倍も高い。
【図面の簡単な説明】
【0055】
【図1】実施例4の結果を示すグラフである。
【図2】実施例5の結果を示すグラフである。
【図3】実施例6の結果を示すグラフである。
【図4】細胞毒性試験の結果を示すグラフである。
【図5】比較例との比較結果を示すグラフである。
【特許請求の範囲】
【請求項1】
生アズキを水又は食塩水に10〜30時間浸漬して得られる滲出物中の有効成分を含有することを特徴とするアズキ由来の抗ウイルス剤。
【請求項2】
前記アズキ滲出物を含むアズキ滲出液からイオン交換樹脂法又は溶媒抽出法を用いて得られた精製有効成分を含むことを特徴とする請求項1記載の抗ウイルス剤。
【請求項3】
狂犬病ウイルス、ヘルペスウイルス、インフルエンザウイルス(A型)、シンドビスウイルス、水疱性口内炎ウイルスその他のウイルスに対する感染成立抑制作用及び殺ウイルス作用を有することを特徴とする請求項1または2記載の抗ウイルス剤。
【請求項4】
生アズキを水又は食塩水に10〜30時間浸漬して滲出物を得ることを特徴とする抗ウイルス剤有効成分の調製方法。
【請求項5】
前記水又は食塩水に重曹を加えたことを特徴とする請求項4記載の方法。
【請求項1】
生アズキを水又は食塩水に10〜30時間浸漬して得られる滲出物中の有効成分を含有することを特徴とするアズキ由来の抗ウイルス剤。
【請求項2】
前記アズキ滲出物を含むアズキ滲出液からイオン交換樹脂法又は溶媒抽出法を用いて得られた精製有効成分を含むことを特徴とする請求項1記載の抗ウイルス剤。
【請求項3】
狂犬病ウイルス、ヘルペスウイルス、インフルエンザウイルス(A型)、シンドビスウイルス、水疱性口内炎ウイルスその他のウイルスに対する感染成立抑制作用及び殺ウイルス作用を有することを特徴とする請求項1または2記載の抗ウイルス剤。
【請求項4】
生アズキを水又は食塩水に10〜30時間浸漬して滲出物を得ることを特徴とする抗ウイルス剤有効成分の調製方法。
【請求項5】
前記水又は食塩水に重曹を加えたことを特徴とする請求項4記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2008−290967(P2008−290967A)
【公開日】平成20年12月4日(2008.12.4)
【国際特許分類】
【出願番号】特願2007−137854(P2007−137854)
【出願日】平成19年5月24日(2007.5.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成19年3月5日 日本薬学会第127年会組織委員会主催の「日本薬学会第127年会」において文書を持って発表
【出願人】(000002336)財団法人生産開発科学研究所 (10)
【Fターム(参考)】
【公開日】平成20年12月4日(2008.12.4)
【国際特許分類】
【出願日】平成19年5月24日(2007.5.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成19年3月5日 日本薬学会第127年会組織委員会主催の「日本薬学会第127年会」において文書を持って発表
【出願人】(000002336)財団法人生産開発科学研究所 (10)
【Fターム(参考)】
[ Back to top ]

