アポフェリチン
【課題】産生宿主関連成分あるいはその他の夾雑成分を含まず、着色が充分に抑えられたアポフェリチン及びその製造方法を提供する。
【解決手段】
金属イオンを含有しない緩衝液、及び金属イオンを含有しない塩を用いて、キレート剤共存下にてフェリチン含有試料又はフェリチン産生宿主の培養液からアポフェリチンを精製することにより、産生宿主関連成分あるいはその他の夾雑成分を含まず、着色が充分に抑えられ、かつ含有する金属が特定値以下のアポフェリチンを得る。
【解決手段】
金属イオンを含有しない緩衝液、及び金属イオンを含有しない塩を用いて、キレート剤共存下にてフェリチン含有試料又はフェリチン産生宿主の培養液からアポフェリチンを精製することにより、産生宿主関連成分あるいはその他の夾雑成分を含まず、着色が充分に抑えられ、かつ含有する金属が特定値以下のアポフェリチンを得る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はアポフェリチンに関し、詳しくは産生宿主や培地等に由来する生体成分や金属等の夾雑成分の含有量が顕著に低減され、着色が充分に抑えられたアポフェリチンに関する。
【背景技術】
【0002】
アポフェリチンは、生体内の必須微量元素である鉄の量を調節する役割を担う、生物界に広く存在するかご状のタンパク質である。アポフェリチンと鉄又は鉄化合物との複合体をフェリチンと称し、体内に貯蔵されたフェリチンは、体内の鉄濃度に応じて鉄イオンを放出することが知られている。アポフェリチンは鉄以外にも、コバルト、ニッケル、カドミウムセレナイド等、種々の金属あるいは金属化合物を空洞内に取り込み、ナノメータサイズの金属コアを形成することが知られている。そして、このような金属コアを含有するフェリチンは自己集積化能を有するため、2次元配列化できることが知られている(例えば、非特許文献1〜4参照)。
【0003】
近年、このような性質を有するアポフェリチンを利用して、有用な電子デバイスを製造する研究がなされている。例えば、金属コアを形成させたフェリチンをシリコン基盤上に規則的に整列させた後に、熱処理や紫外線−オゾン処理によりタンパク質を分解除去し、シリコン表面上にパターン化された金属ナノドットを得て、これが半導体記憶装置や単電子トランジスタ、演算素子などに利用されている(例えば、特許文献1、非特許文献1〜4参照)。また、得られた金属ナノドット配列を触媒として、電子輸送特性に優れているカーボンナノチューブを均一に形成させ、配線材料として利用する技術も検討されている(例えば、特許文献2参照)。現在まで、半導体集積回路の微細なパターンを形成するためにはリソグラフィーによるトップダウン技術が用いられてきたが、さらなる微細化については物理的な限界に近づいてきたと言われている。このような背景から、フェリチン等を利用してナノスケールの構造を自己組織化的に作製するボトムアップ技術は、次世代の半導体デバイスを作製する有用な手法として大きな注目を集めている。
【0004】
このような電子デバイスを作製するためには、純度が高いナノスケールの微粒子を作製することが非常に重要である。アポフェリチンが夾雑タンパク質、ペプチド、低分子化合物、所望の金属以外の金属等を含有していると、製造されたデバイスの性能低下や不具合、品質のばらつき、ひいては製造の歩留まり低下という問題が生じるため、夾雑物質、特に不純な金属含有量が顕著に少ないアポフェリチンが強く求められている。
【0005】
従来、天然由来の試料からアポフェリチンを取得する方法として、例えば、ウマ脾臓から単離する方法が報告されている(例えば、非特許文献5参照)。この方法では、精製したフェリチンにチオグリコール等の還元剤を作用させてフェリチン内部の金属を遊離させ、さらにキレート剤を用いて金属を除去する工程を行う。しかし、そのタンパク質の精製度については不明であり、鉄以外の金属の含量も不明である。
【0006】
また、大腸菌や無細胞タンパク質合成系を用いる組換えアポフェリチンの精製方法として、熱処理、硫安沈殿、陰イオン交換クロマトグラフィー、ゲルろ過を組み合わせる方法が開示されている(例えば、非特許文献6,7参照)。しかし、この方法で得られたアポフェリチンにおける不純物混入の度合に関する詳細な知見はない。また、これらの方法で用いられる緩衝液や塩にはナトリウムやカリウム等が含まれるため、精製中にこれらの金属がフェリチン内部に残留している可能性も指摘されている。
【0007】
無色のタンパク質の純度を簡便かつ定量的に評価するひとつの指標としては、350nmと280nmにおける吸光度の比(OD350/OD280)が用いられる(例えば、特許文献3参照)。一般に、金属や補欠分子族等を有しない無色の蛋白質については、吸収ピークは波長220nmと280nmの2つのみであるため、それ以外の波長における吸光度の大きさは、含有する有色不純物(金属、有色低分子化合物等)の量に相関する。そして、この値によれば、市販されている天然のウマ脾臓由来アポフェリチン純度は高いものとは言いがたい。さらに視覚的にも、市販されている天然のウマ脾臓由来アポフェリチンは淡黄色を示しており、この着色は夾雑金属や有色低分子化合物等の存在を示すものと考えられる。そして、前述のような高純度のナノスケール微粒子作製に良好に使用するためには、産生宿主関連成分あるいはその他の夾雑成分を含まず、着色が充分に抑えられたアポフェリチンが求められている。
【0008】
【特許文献1】特開2003−33191号公報
【特許文献2】特開2007−39297号公報
【特許文献3】特開2005−348745号公報
【特許文献4】特開2006−94791号公報
【非特許文献1】Thin Solid Films,2001年,393巻,p.12−18
【非特許文献2】Materials Research Society Symposium Proceedings,2005年,873E巻,p.K5.1.1−K5.1.10
【非特許文献3】Japanese Journal of Applied Physics,2006年,45巻,p.L1−L3
【非特許文献4】Japanese Journal of Applied Physics,2006年,45巻,p.8946−8951
【非特許文献5】The Journal of Biological Chemistry,1982年,257巻,p.7672−7677
【非特許文献6】Biochimica et Biophysica Acta,1993年,1174巻,p.218−220
【非特許文献7】The Journal of Biological Chemistry,1988年,263巻,p.18086−18092
【非特許文献8】Journal of American Chemical Society,2006年,128巻,p.16626−16633
【非特許文献9】Gene,2002年,296巻,p.121−128
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、産生宿主関連成分あるいはその他の夾雑成分含量が著しく少なく、着色が充分に抑えられたアポフェリチン及びその製造方法を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは、前記課題解決のために鋭意研究を重ねた結果、金属イオンを含有しない緩衝液、及び金属イオンを含有しない塩を用いて、キレート剤共存下にてフェリチン含有試料又はフェリチン産生宿主の培養液からアポフェリチンを精製することにより、産生宿主関連成分あるいはその他の夾雑成分含量が著しく少なく、着色が充分に抑えられ、かつ含有する金属が特定値以下のアポフェリチンが得られることを見出し、本発明を完成した。
【0011】
すなわち、本発明は以下に関する。
(1)水又は緩衝液に溶解したとき、350nmと280nmにおける吸光度の比(OD350/OD280)の値が0.09以下であるアポフェリチン。
(2)1.0±0.1mg/mlの濃度でアポフェリチンを水又は緩衝液に溶解したときの色度について、明度L*値が水又は緩衝液のL*値の±1.4以内、色度a*値が水又は緩衝液のa*値の±0.5以内、色度b*値が水又は緩衝液のb*値の±2.8以内である上記(1)に記載のアポフェリチン。
(3)鉄、カルシウム、カリウム、亜鉛の含量の総和が1,800ppm(w/w)以下である、上記(1)又は(2)に記載のアポフェリチン。
(4)鉄含量が5ppm(w/w)以下、カルシウム含量が650ppm(w/w)以下、カリウム含量が400ppm(w/w)以下、亜鉛含量が500ppm(w/w)以下である、上記(1)〜(3)のいずれかに記載のアポフェリチン。
(5)金属イオンを含有しない緩衝液、及び金属イオンを含有しない塩を用いて、キレート剤共存下にてフェリチン含有試料又はフェリチン産生宿主の培養液から上記(1)〜(4)に記載のアポフェリチンを精製、回収することを特徴とする、アポフェリチンの製造方法。
(6)金属イオンを含有しない緩衝液がトリス−塩酸、ビストリスプロパン−塩酸、トリシン−塩酸、各種グッドバッファー−アンモニア、酢酸−アンモニア、グリシン−塩酸から選ばれる1以上の緩衝液である、上記(5)に記載のアポフェリチンの製造方法。
(7)金属イオンを含有しない塩が硫安、リン酸アンモニウム、塩化アンモニウム、酢酸アンモニウム、硝酸アンモニウムから選ばれる1以上の塩である、上記(5)又は(6)に記載のアポフェリチンの製造方法。
(8)キレート剤が、ポリアミンカルボン酸系又はオキシカルボン酸系のキレート試薬から選ばれる1以上のキレート試薬、及び/又はキレート樹脂である、上記(5)〜(7)のいずれかに記載のアポフェリチンの製造方法。
【発明の効果】
【0012】
本発明によれば、産生宿主関連成分あるいはその他の夾雑成分含量が著しく少なく、着色が充分に抑えられ、金属含有量が少ないアポフェリチン、及びその製造方法を提供できる。本発明によって提供される高純度のアポフェリチンは、電子デバイスの作製等の用途において好適に利用でき、このようなアポフェリチンを用いることにより、製造されるデバイスの性能の向上、不具合や品質のばらつきの低減及び製造の歩留まり向上が期待される。
【発明を実施するための最良の形態】
【0013】
以下、本発明を詳細に説明する。本発明におけるアポフェリチンとは、かご状のタンパク質であり、内部空間に各種金属又は金属化合物を取り込み、金属コアを形成して貯蔵する能力を有するものをいう。すでに金属を取り込んで、コアを形成しているタンパク質はフェリチンと呼ばれるが、アポフェリチンとフェリチンを明確に分離できる一般的な定義はない。従って本発明においては便宜上、金属の含有量が10,000ppm以下のものをアポフェリチンと称することとする。その生物起源は、特に限定されないが、例えば、ウマやヒト等の各種動物由来や大豆等の植物由来のアポフェリチン、さらにはリステリアや大腸菌等の各種微生物由来のフェリチン様タンパク質であるDNA−binding protein from starved cells(Dps,このタンパク質も以下同様にアポフェリチンと称する)等が挙げられる。さらに具体的には、動物由来の中でも哺乳類由来のアポフェリチンが用いられ、より好ましくはウマ由来のアポフェリチンが用いられる。
【0014】
一般的に、動物由来のアポフェリチンは、Heavy(H)鎖とLight(L)鎖の2種のサブユニットから構成される24量体である。本発明で用いられるアポフェリチンはH鎖とL鎖のどちらで構成されているものでもよく、その構成比率についても特に限定されない。好ましくは、H鎖又はL鎖のいずれか一方のみから構成される単一なフェリチンが用いられ、特にL鎖のみから構成されるフェリチンは熱安定性が高く、自己集積化能を有することから半導体デバイス製造に有用であり、より好ましい。
【0015】
さらに、上述した本発明アポフェリチンは、遺伝子工学的技術で生産されたものも含む。これらは各種生物種由来のアポフェリチン遺伝子を適当なベクター宿主系に導入するか、又は無細胞タンパク質合成系にて発現させることにより得ることができる。例えば、具体的にはウシ、ウマ、ヒト、大豆、リステリアなどの染色体DNA又はcDNA由来のアポフェリチン遺伝子をクローニングし、これらを遺伝子工学的技術で生産することもできる。
【0016】
発現宿主については特に限定されないが、大腸菌のほか、適宜、他の細菌、酵母、糸状菌、放線菌などの微生物や動物細胞などを用いることができる。好ましくは、大腸菌K−12やB株、さらに好ましくは大腸菌JM109(宝酒造社製)、DH5α(宝酒造社製)、Nova Blue(Novagen社製)、BL21(宝酒造社製)等が用いられる。用いる発現ベクターについても特に限定されないが、大腸菌ラクトースオペロンやトリプトファンオペロン等に由来するプロモーター、オペレーター及びリボゾーム結合部位等の発現領域を含むDNA配列(The Operon,p.227, Cold Spring Harbor Laboratory, 1980を参照)を保有するベクター等を用いることができる。
【0017】
本発明のアポフェリチンは、遺伝子工学的技術により、天然試料由来タンパク質のアミノ酸配列の1から複数個のアミノ酸が欠失、置換及び/又は付加された、天然試料由来のタンパク質のアミノ酸配列との相同性が70%以上、好ましくは80%以上の相同性を示すタンパク質も含まれる。ここで、「1から複数個のアミノ酸が欠失、置換及び/又は付加された」とは、例えば1〜30個、好ましくは1〜15個、さらに好ましくは1〜8個のアミノ酸が欠失、置換及び/又は付加されたことを意味する。
【0018】
本発明の組換え型アポフェリチンをコードする遺伝子としては、例えば、染色体DNA又はcDNA由来のアポフェリチン遺伝子の塩基配列全長と70%、好ましくは80%以上の以上の相同性を示し、かつ金属コアを形成する能力を有するかご状のタンパク質をコードするDNAも含まれる。さらに例えば、染色体DNA又はcDNA由来のアポフェリチン遺伝子の全長又はそのうちの15塩基以上の部分と相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ本発明の金属コアを形成する能力を有するかご状のタンパク質をコードするDNAも含まれる。
【0019】
ここで、「ストリンジェントな条件」とは、コロニー・ハイブリダイゼーション法、プラーク・ハイブリダイゼーション法、あるいはサザンブロット・ハイブリダイゼーション法等(Current Protocols in Molecular Biology (WILEY Interscience,1989))を行った際、特異的なハイブリッドのシグナルが非特異的なハイブリッドのシグナルと明確に識別される条件であり、この条件は使用するハイブリダイゼーションの系と、プローブの種類、配列及び長さによって異なる。このような条件は、ハイブリダイゼーションの温度を変えること、洗浄の温度及び塩濃度を変えることにより決定可能であり、例えば、非特異的なハイブリッドのシグナルまで強く検出してしまう場合には、ハイブリダイゼーション及び洗浄の温度を上げるとともに、必要に応じて洗浄の塩濃度を下げることにより特異性を上げることができる。また、特異的なハイブリッドのシグナルも検出されない場合には、ハイブリダイゼーション及び洗浄の温度を下げるとともに、必要に応じて洗浄の塩濃度を上げることにより、ハイブリッドを安定化させることができる。
【0020】
具体的なハイブリダイゼーション条件としては、例えば、DIG Easy Hyb試薬(ロシュ・ダイアグノスティクス社製)を用いて37〜42℃で一晩行う。洗浄は、例えば、0.5×SSC、0.1% SDSを用い、15分間、2回行う。洗浄温度は、例えば、45℃以上、好ましくは52℃以上、更に好ましくは57℃以上で行うことができる。このようなストリンジェントな条件下でハイブリダイズするDNAは、DNAの塩基配列と一定以上の相同性を有する。
【0021】
以下、一例としてウマ由来の組換えアポフェリチンのアミノ酸配列について説明する。非特許文献6によれば、本アポフェリチン遺伝子は、525bpのORFからなり、175アミノ酸をコードしている。しかし、天然のウマ由来アポフェリチンはN末端側のアミノ酸が8個欠失しており、ウマ由来のL鎖アポフェリチン遺伝子の全塩基配列を組換え発現させて得られるアポフェリチンについては、N末端の最初のメチオニンが欠失していると言われている。本発明においては、例えば、本アミノ酸配列のN末端及び/又はC末端及び/又は内部配列においてアミノ酸(ペプチド)が削除及び/又は付加されたタンパク質についても、それが金属コアを形成する能力を有する球状かつかご状のタンパク質であれば、本発明のアポフェリチンに包含される。削除及び/又は付加されるアミノ酸の数については特に限定がないが、例えば、30個以下、好ましくは15個以下、さらに好ましくは8個以下であることが望ましい。さらに、例えば、特許文献1又は特開2005−200425号公報記載のように、変異によりアミノ酸が1個又は複数個置換されたウマ由来のアポフェリチンも本発明のアポフェリチンに包含される。
【0022】
本発明のアポフェリチンは、夾雑物質が非常に少ないことを特徴とする。ここでいう夾雑物質としては、タンパク質、ペプチド、アミノ酸、脂質、補欠分子族、金属等が挙げられる。各種不純物の量を簡便に評価する方法としては、色調を確認する方法が挙げられる。本来高純度なアポフェリチンは無色透明であると考えられ、もし着色が確認された場合には、夾雑物質として、酵素タンパク質が保有する補欠分子族(例えばFAD、FMN等)、夾雑タンパク質やアポフェリチンが保有する金属類が存在していると考えられる。
【0023】
色調を確認するための方法としては、サンプル溶液の紫外可視吸収スペクトルを測定し、タンパク質が示す約280nmもしくは約220nmの吸光度と、300nm以上のある波長における吸光度を測定し、「300nm以上における、ある波長の吸光度/約280nmもしくは約220nmの吸光度」の比を算出し、その値が小さいほど高純度であると判断する方法が好ましい。この方法を採ることにより、定量性がなく、正確性に劣る肉眼確認等と異なり、夾雑物質の濃度が極めて低いレベルでの色調の確認を行うことができる。ここで測定する波長については特に限定されないが、例えば、特許文献3に記載のように280nmにおける吸光度(OD280)と350nm(OD350)における吸光度の比(OD350/OD280)を用いることができる。
【0024】
各サンプルの吸光度を測定する際には、上記記載の方法によりタンパク質濃度を測定し、事前に各濃度の差が±5%以内となるように上記緩衝液で調整しておくことが好ましい。従来、アポフェリチンは純度が低く、金属イオンを取り込みやすいことから、OD350/OD280の値が0.1程度のものしか得られていなかった。本発明のアポフェリチンにおけるOD350/OD280の値は0.09以下であり、さらに好ましくは0.05以下、さらに好ましくは0.02以下である。このような値を有するアポフェリチンは非常に高純度であり、電子デバイス製造に良好に用いることができる。OD350/OD280の値が0.09を超えるアポフェリチンは、純度が十分でなく、不純物含量が多いものとなる。
【0025】
色調を確認する別の方法として、タンパク質濃度を一定に合わせたアポフェリチン溶液を調製し、その色沢を分光光度計(色彩色差計、測色色差計とも言う)で測定し、L*値、a*値及びb*値を比較評価行う方法も好ましい。測定するサンプルのタンパク質濃度の測定法は特に限定されないが、測定法は統一されていることが好ましく、タンパク質濃度は便宜上1.0±0.1mg/ml程度とすることが好ましい。タンパク質濃度を調整するために用いる希釈用緩衝液は特に限定されないが、アポフェリチンを溶解している緩衝液と同一であることが好ましく、例えば、50mM トリス−塩酸緩衝液(pH8.0)が挙げられる。各サンプルの色度が、アポフェリチンを溶解している緩衝液又は希釈用緩衝液の色度の値に近似しているものほど、サンプルの純度が高いことが示される。
【0026】
本発明のアポフェリチンにおける明度L*値は水又は緩衝液のL*値の±1.4以内、より好ましくは±1.2以内、さらに好ましくは±1.0以内である。色度a*値は、水又は緩衝液のa*値の±0.5以内、より好ましくは±0.35以内、さらに好ましくは±0.2以内である。色度b*値は、水又は緩衝液のb*値の±2.8以内、より好ましくは±1.7以内、さらに好ましくは±0.5以内である。このような値を有するアポフェリチンは、非常に高純度であり、電子デバイス製造に良好に用いることができる。一方、L*値が水又は緩衝液のL*値の±1.4を超えるアポフェリチン、a*値が水又は緩衝液のa*値の±0.5を超えるアポフェリチン、b*値が水又は緩衝液のb*値の±2.8を超えるアポフェリチンは、純度が十分でなく、不純物含量が多いものとなる。
【0027】
また、夾雑物質の中でも、特に金属は、アポフェリチンを用いて製造されるデバイスの性能低下や不具合、品質のばらつき、製造の歩留まり低下という問題を引き起こすため、低減されることが特に好ましい。そして各種金属の中でも、特に鉄、カルシウム、カリウム、亜鉛はアポフェリチンに残留しやすく、透析によっても十分な除去が難しいため、アポフェリチンの純度評価にあたってはこれらの金属の含有量が極めて重要である。なお、本発明において、ナトリウムの含有量については評価対象としていないが、これは、製品の保存、流通のために防腐剤であるアジ化ナトリウムを意図的に添加する場合があるという事情や、その除去は比較的容易に行い得るという事情による。
【0028】
アポフェリチンサンプル中の各種含有金属の測定方法は特に限定されないが、例えば、ICP−発光分析あるいはICP−MS分析、蛍光X線分析等が挙げられる。評価サンプルは、液状のものでも凍結乾燥して粉末化したものを用いてもよい。必要に応じ、アポフェリチンを溶解している緩衝液に含有している各種金属量を測定して、各サンプルの金属含有量から差し引いてもよい。
【0029】
本発明のアポフェリチンにおける金属含有量は、鉄、カルシウム、カリウム、亜鉛の含量の総和が1,800ppm(w/w)以下、好ましくは1,300ppm(w/w)以下、さらに好ましくは800ppm(w/w)以下である。このような金属含有量レベルのアポフェリチンは非常に高純度であり、電子デバイス製造に良好に用いることができる。金属含有量が1,800ppm(w/w)を超えるアポフェリチンは、純度が十分でなく、不純物含量が多いものとなる。
【0030】
さらに各金属の含有量についてより詳細に述べると、本発明のアポフェリチンにおける鉄含量は、5ppm(w/w)以下、好ましくは検出限界以下である。かつ本発明のアポフェリチンにおけるカルシウム含量は650ppm(w/w)以下、好ましくは600ppm(w/w)、さらに好ましくは550ppm(w/w)以下である。本発明のアポフェリチンにおけるカリウム含量は400ppm(w/w)以下、好ましくは300ppm(w/w)、さらに好ましくは200ppm(w/w)以下である。本発明のアポフェリチンにおける亜鉛含量は500ppm(w/w)以下、好ましくは250ppm(w/w)、さらに好ましくは検出限界以下である。
【0031】
その他の各種金属の含量は、特に限定されないが、好ましくは本発明のアポフェリチンにおけるリチウム、バリウム、アルミニウムの含量はそれぞれ5ppm(w/w)以下であり、マグネシウム、バナジウム、カドミウム、銅、コバルト、クロム、マンガン、ニッケル、銀、チタンの含量はそれぞれ検出限界以下である。このような金属含有量レベルのアポフェリチンは非常に高純度であり、電子デバイス製造に良好に用いることができる。各種金属含有量が各々の好適な濃度レベルを超えるアポフェリチンは、純度が十分でなく、不純物含量が多いものとなる。
【0032】
本発明のアポフェリチンを得るために、例えば、天然のフェリチン含有細胞又はアポフェリチン産生菌を、超音波破砕機、フレンチプレス、ダイノミル等によって破砕するか、リゾチーム等の細胞壁溶解酵素、トリトンX−100等の界面活性剤を用いた抽出等の任意の方法によって、アポフェリチンを回収することができる。そして、アポフェリチンを精製する際には、金属イオンを含有しない緩衝液、及び金属イオンを含有しない塩を用いることが重要である。
【0033】
従来、アポフェリチンを精製するために、熱処理法、硫安塩析法、イオン交換樹脂処理法、疎水性樹脂処理法、ゲルろ過法が適宜組み合わせて用いられていた。そして、その各処理には、トリス−塩酸緩衝液やリン酸カリウム緩衝液のような汎用的な緩衝液、HEPES−NaOH等のグッドバッファーが通常的に使用され、イオン交換樹脂処理法においては溶出を行うための塩としてNaClやKCl等の一般的な金属を含有する塩が使用されてきた。しかしながら、本発明のアポフェリチンは、半導体デバイス等への応用を主な目的としているため、不純物となる金属の混入を極力避けることは極めて重要である。
【0034】
本発明において不純物となる金属とは、半導体材料になる物質も含まれており、例えばリチウム、ベリリウム、ホウ素、ナトリウム、マグネシウム、アルミニウム、ケイ素、カリウム、カルシウム、スカンジウム、チタン、バナジウム、クロム、マンガン、鉄、コバルト、ニッケル、銅、亜鉛、ガリウム、ゲルマニウム、ヒ素、セレン、パラジウム、銀、カドミウム、インジウム、スズ、セシウム、バリウム、白金、金、水銀、鉛等を指す。これらの金属が存在する形態については特に制限はなく、例えばイオン、水和物、酸化物等が挙げられる。
【0035】
本発明における、アポフェリチンの精製に用いる緩衝液は、金属を含有しないことが好ましい。金属を含有しない緩衝液としては、組成式に金属を含有しない試薬成分からなる緩衝液が好ましい。このような緩衝液の例として、例えば、トリス−塩酸、ビストリスプロパン−塩酸、トリシン−塩酸、各種グッドバッファー−アンモニア、酢酸−アンモニア、グリシン−塩酸等から選ばれる1以上の緩衝液が挙げられる。精製処理に用いる緩衝液の濃度やpHは特に限定されないが、例えば、1mM〜1,000mMでpH5〜10、好ましくは5〜200mMでpH6〜9が挙げられる。
【0036】
さらに、各種樹脂処理法における吸着・溶出に用いる塩についても、金属を含有しない塩を用いることが、アポフェリチンの純度向上に有効である。金属を含有しない塩としては、組成式に金属を含有しない塩が好ましい。このような塩の例として、硫安、リン酸アンモニウム、塩化アンモニウム、酢酸アンモニウム、硝酸アンモニウム等から選ばれる1種類以上の塩が挙げられる。用いる塩の濃度は特に限定されないが、例えば0.1mM〜4,000mM、好ましくは1〜3,000mMが挙げられる。このような組成式に金属を含有しない緩衝液と塩のみを組み合わせて用いることが、本発明アポフェリチンの製造方法として重要である。なお、組成式に金属を含有しない緩衝液及び塩の市販品の中には、不純物としてごく微量の金属が混入している形で販売されているものもあるが、その含量は組成式に金属を含む塩に比較して非常に微量であるため、金属混入の少ないものを選択することにより、問題なく使用することができる。
【0037】
さらに、アポフェリチンや用いる水、試薬に含まれる金属をトラップするために、精製工程である熱処理法、硫安塩析法、イオン交換樹脂処理法、疎水性樹脂処理法、ゲル濾過法のうち少なくとも1工程以上を、キレート剤の共存下で行うことが好ましい。本発明の精製方法においては、キレート剤を共存させることが重要である。ここで用いるキレート剤とは、金属イオンに配位しキレート化合物を与えるような任意の化合物である。具体的には、例えば、エチレンジアミン4酢酸(EDTA)、trans−1,2−diaminocyclohexane−N,N,N’,N’−tetraacetic acid(CyDTA)、diethylenetriamine−N,N,N’,N”,N”−pentaacetic acid(DTPA)、グリコールエーテルジアミン4酢酸(EGDTA)、1,6−hexametylenediamine−N,N,N’,N’−tetraacetic acid(HDTA)、トリエチレンテトラミン6酢酸(TTHA)、アスパラギン酸等のポリアミンカルボン酸系のキレート試薬や、クエン酸、リンゴ酸、イソクエン酸などのオキシカルボン酸系のキレート試薬、さらにはポリアミン基及びチオ尿素基等をリガンド基とし、担体部分が疎水性を有するキレート樹脂等が挙げられる。好ましくは、ポリアミンカルボン酸系のキレート試薬が用いられ、さらに好ましくはEDTAやCyDTA等が挙げられる。
【0038】
本発明においては、上記キレート剤に配位する塩の有無、種類や数については限定されるものではないが、例えば、遊離酸化合物やナトリウム塩化合物が好ましく用いられる。また上記キレート剤は、それぞれ単独でも複数組み合わせても用いることができる。これらのキレート剤の添加濃度は特に制限されないが、低濃度でも金属イオンのキレート効果を充分有しているため、通常、10mM以下の低濃度で用いられる。本キレート剤中にナトリウム等の金属塩が組成式に含まれている場合、好ましくは最終工程で十分に透析を行い、これらを除去することが好ましい。
【0039】
なお、上記精製処理における加熱処理は、アポフェリチンの精製度向上に関して好ましい効果を奏する。処理温度としては例えば、通常40〜90℃、好ましくは50〜70℃程度が挙げられる。処理時間としては例えば、通常10分間〜10時間、好ましくは30分間〜5時間程度が挙げられる。このような条件下で加熱処理を行うことにより、不純物であるタンパク質を効率よく除去することができる。処理温度や時間が十分でないと、不純物であるタンパク質が多く残留してしまい、一方、処理温度や時間が必要以上に過度であると、目的のアポフェリチン画分に必要以上の熱負荷をかけることとなり、好ましくない。
【0040】
硫安塩析は、添加する硫安濃度については特に限定されないが、はじめに硫安を50〜70%程度添加して、遠心処理後に生じるアポフェリチン含有上清を回収する。その後上清を75〜90%とし、沈殿するアポフェリチンを回収することができる。沈殿は適宜、緩衝液で再溶解させることが可能である。
【0041】
イオン交換樹脂処理は常法に従って行うことができる。イオン交換樹脂処理には、陰イオン交換樹脂がより好ましく用いられるが、陰イオン交換基を有する不溶性担体であればいずれも使用することができる。陰イオン交換基としては、特に限定されないが、Q型[荷電基:−N+(CH3)3]、DEAE型[荷電基:−N+(C2H5)2H]等が例示される。好ましくはQ型が用いられ、具体的には、Q Sepharose Fast Flow、Capto−Q、Q Sepharose High Performance、Q Sepharose XL(GEヘルスケアバイオサイエンス社製)、Toyopearl QAE−650、Toyopearl SuperQ−650(東ソー社製)等が例示される。本工程では、アポフェリチンを吸着画分に回収することができる。接触条件としては、pH6〜9程度、好ましくはpH7〜8程度、塩濃度0.1〜500mM程度が挙げられる。
【0042】
疎水性樹脂処理もまた、常法に従って行うことができる。疎水性樹脂処理用担体としては、炭素数4〜18のアルキル基(ブチル基型、オクチル基型、オクチルデシル基型等)、フェニル基を有する不溶性担体が例示される。好適にはフェニル基型やブチル基型が挙げられ、具体的には、Phenyl Sepharose Fast Flow、Phenyl Sepharose CL−4B、Phenyl Sepharose High Performance、Butyl Sepharose Fast Flow(GEヘルスケアバイオサイエンス社製)、Toyopearl Phenyl−650、Toyopearl Butyl−650(東ソー社製)等が例示される。本工程では、アポフェリチンを吸着画分に回収することができる。接触条件としてはpH6〜9程度、好ましくはpH7〜8程度、塩濃度0.02〜2M程度が挙げられる。
【0043】
ゲルろ過もまた、常法に従って行うことができる。ゲルろ過用担体としては、特に限定されないが、具体的には、各種Superdex、Superose、Sephacryl、Sepharose、Sephadex(GEヘルスケアバイオサイエンス社製)等が例示される。接触条件としてはpH6〜8程度、好ましくはpH7〜8程度、塩濃度0.1〜4M程度が挙げられる。
【0044】
さらに、得られた精製アポフェリチンを還元剤処理に供することにより、内部に取り込まれた金属を遊離させ、さらに上記キレート剤を共存させることによって金属を除去することも可能である。還元剤は、還元作用を有し、アポフェリチンの内部に取り込まれた金属を遊離させる作用を有する物質であれば、特に制限されないが、具体的にはチオグリコール等が好ましく用いられる。添加量としては、終濃度0.01〜10%(v/v)程度、好ましくは0.1〜2%(v/v)程度が例示される。キレート剤としては、金属イオンに配位してキレート化合物を与えるような化合物であり、そのような作用を有する化合物であれば如何なる化合物でも本発明に用いることができる。具体例としては、EDTA、CyDTA、DTPA、EGDTA、HDTA、TTHA、クエン酸等のキレート試薬、Chelex(BioRad社製)、Diaion CRB02(三菱化学社製)、LEWATIT TP214 (バイエル社製)、アンバライトCG4000等のキレート樹脂が挙げられる。キレート剤の添加濃度についても特に制限はないが、例えば、キレート試薬であれば0.1〜200mM、キレート樹脂であれば1〜20%(w/v)が例示される。添加した還元剤やキレート試薬、遊離された金属等は十分量の緩衝液を用いて透析処理することにより除去できる。
【0045】
上述の各種精製工程は全て行ってもよいし、少なくとも2工程以上を適宜選択、組み合わせて行うこともできる。工程の順序については特に限定されない。また、各工程間及び最終工程の後に、適宜、十分量の緩衝液を用いる透析処理を行い、脱塩することができる。
【0046】
なお、得られる精製アポフェリチンや精製中間品を長期間保存するために、アジ化ナトリウムを添加してもよい。添加する濃度は特に限定されないが、好ましくは1%(w/v)以下、さらに好ましくは0.1%(w/v)以下である。
【0047】
本発明アポフェリチン溶液のタンパク質濃度の測定方法としては、広く一般的に知られている、280nmにおける紫外吸光度を測定する方法、Bradford法、Lowry法、又はタンパク質溶液及び同量の緩衝液を凍結乾燥し、得られる各凍結乾燥重量からタンパク質重量を算出し、凍結乾燥前のタンパク質溶液の濃度を計算する方法等が用いられる。280nmにおける紫外吸光度を測定する方法については、便宜上、OD280の値 1=1 mg/mlとしてもよいし、標準物質としてウシ血清アルブミンやγ−グロブリンを用いて検量線を作成して算出してもよいし、Protein Science,1995年,4巻,p.2411−2423を参照して算出することもできる。Bradford法やLowry法については、標準物質としてウシ血清アルブミンやγ−グロブリンを用いて検量線を作成して濃度を算出することができる。
【0048】
本発明アポフェリチンのタンパク質濃度や夾雑物質の量を測定する前には、各タンパク質サンプルを十分量の緩衝液で透析して、低分子化合物やアポフェリチンに取り込まれていない金属等をあらかじめ除去してから評価することが好ましい。用いる緩衝液は、組成式に金属を含有しない試薬成分からなる緩衝液を用いることが好ましく、このような緩衝液の例として、トリス−塩酸、ビストリスプロパン−塩酸、トリシン−塩酸、各種グッドバッファー−アンモニア、酢酸−アンモニア、グリシン−塩酸等から選ばれる1種類以上の緩衝液が挙げられる。その緩衝液の濃度やpHは特に限定されないが、例えば、1〜1,000mMでpH5〜10、好ましくは10〜200mMでpH6〜9が挙げられる。
【0049】
以下、実施例を示して本発明を説明するが、本発明の技術的範囲はこれによって何ら限定されることはない。
【実施例1】
【0050】
1)組換えアポフェリチン生産菌の作製
ウマ由来のアポフェリチンの構造遺伝子(「Biochimica et Biophysica Acta」,1993年,1174巻,p.218−220参照)の、N末端アミノ酸8個分をコードする塩基24bpを削除し、メチオニン1個をコードする3塩基を付加した遺伝子を定法により作製した。本遺伝子を定法によりpKK223−3に挿入し、組換え体プラスミドDNAを得た。続いて、作製された前記プラスミドを用いて大腸菌(E.coli)JM109(宝酒造社製)を形質転換し、組換えアポフェリチン(Fer8)生産菌を得た。
【0051】
2)組換えアポフェリチン生産菌の培養
上記の組換えアポフェリチン生産菌をLB−IPTG−amp培地〔バクトトリプトン1%(w/v),酵母エキス0.5%(w/v), NaCl 0.5%(w/v),イソプロピル−β−D−チオガラクトピラノシド(1mM)及びアンピシリン(50μg/ml)〕中、37℃、15時間、撹拌・培養した。
【0052】
3)組換えアポフェリチンの精製
培養終了後の組換えアポフェリチン生産菌の培養液10Lを遠心処理(8,000rpm、15分)し、沈殿した大腸菌を回収した。得られた菌体を2Lの5mM EDTAを含有する50mM トリス−塩酸緩衝液(pH8.0)に再懸濁し、超音波破砕器(astrasonXL、MISONIX社製)にて菌体を破砕した。これを遠心処理(8,000rpm、15分)することにより、アポフェリチンを含有する菌体破砕上清を得た。次に、菌体破砕上清を50℃、30分間熱処理した。これを遠心分離(8,000rpm、15分)することにより、夾雑タンパク質の熱変性により生成する沈殿を除去した。
【0053】
続いて、Q−sepharose Fast Flow(GEヘルスケアバイオサイエンス社製)を用い、カラムクロマトグラフィー(樹脂量500mL、流速200mL/h)を行った。移動相として、5mM EDTAを含有する50mM トリス−塩酸緩衝液(pH8.0、硫安の塩濃度勾配 0〜300mM)を用いた。
【0054】
次いで溶出液400mLに硫安を50%飽和となるよう加えた後、遠心処理(12,000rpm、15分)を行ってアポフェリチンを含有する上清を回収した。得られた上清にさらに硫安を追加して90%飽和とし、遠心処理を行って沈殿として生じるアポフェリチンを回収した。
【0055】
沈殿したアポフェリチンを500mLの5mM EDTAを含有する50mM トリス−塩酸緩衝液(pH8.0)に再溶解し、さらに2M硫安を添加してPhenyl SepharoseCL−4B(GEヘルスケアバイオサイエンス社製)を用いてカラムクロマトグラフィー(樹脂量500mL、流速200mL/h)を行った。移動相として、5mM EDTAを含有する50mM トリス−塩酸緩衝液(pH8.0、硫安の塩濃度勾配 800〜0mM)を用いた。
【0056】
さらにアポフェリチン画分を5mM EDTAを含有する50mM トリス−塩酸緩衝液(pH8.0)にて透析し、Sephacryl S−300を用いてゲルろ過(樹脂量200mL、流速100mL/h)を行った。アポフェリチン画分を50mM トリス−塩酸緩衝液(pH8.0)にて透析、濃縮することにより、本発明のアポフェリチン1(本発明1)及びアポフェリチン2(本発明2)を得た。
【0057】
4)本発明のアポフェリチンの電気泳動による確認
上述のアポフェリチン1(本発明1)及び2(本発明2)を、Native−PAGE[PAGミニ「第一」10/20(第一化学薬品社製)、タンパク質分子量マーカー「第一」I(第一化学薬品社製)]に供した結果、約430kDaの単一バンドが確認された。また、SDS−煮沸処理を行った後、SDS−PAGE[PAGミニ「第一」10/20(第一化学薬品社製)、BenchMark Protein Ladder(インビトロジェン社製)]に供した結果、約20kDaの単一バンドが確認された。よって、本発明のアポフェリチンは24量体のタンパク質分子であることが示唆された。タンパク質濃度はDC Protein Assay Kit(BioRad社製)を用い、標準物質としてウシ血清アルブミン(Pierce社製)を用いて検量線を作成し、測定、算出した。上述のアポフェリチン1(本発明1)及び2(本発明2)の電気泳動上の純度は同程度であった。
【0058】
5)市販品フェリチンとの目視による純度比較
市販品アポフェリチン(Merck社製(比較例1))及び市販品フェリチン((Sigma社製(比較例2))を50mM トリス−塩酸緩衝液(pH8.0)に溶解後、同緩衝液にて透析した。2種類の比較例及び本発明の各アポフェリチンサンプルの外観を図1に示す。図1より明らかであるように、本発明のアポフェリチンは無色透明であり、極めて純度が高いことが示唆された。一方、比較例1は薄い黄色であり、不純物を含むことが示唆された。さらに、比較例2は褐色であり、一見して不純物を多く含むことが示唆された。
【0059】
6)フェリチンサンプルの紫外可視吸収スペクトル比較
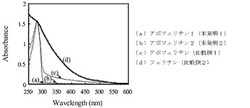
本発明及び比較例(Merck社製(比較例1)、Sigma社製(比較例2))のフェリチンタンパク質を50mM トリス−塩酸緩衝液(pH8.0)にて適宜希釈し、280nmにおける吸光度が同程度になるよう調整した後、分光光度計U−3010(日立製作所社製)にて600〜250nmにおける紫外可視吸収スペクトルを測定した。また、ブランクとして、50mM トリス−塩酸緩衝液(pH8.0)の600〜250nmにおける紫外可視吸収スペクトルを測定し、各サンプルの各波長における測定値から差し引いた。ブランク差し引き後の各サンプルの紫外可視吸収スペクトルを図2に、各波長における吸光度と280nmにおける吸光度の比を表1に示す。
【0060】
【表1】

【0061】
各サンプルの280nmの波長における吸光度に対する350〜600nmの波長における吸光度比の値を比較すると、本発明のアポフェリチン1及び2では全て0.1以下であったのに対して、市販のフェリチンでは各波長において本発明のアポフェリチンよりも値が高く、特に波長が短くなるにつれて高値となった。OD350/OD280の値は、本発明では0.09以下であったが、比較例では0.10及び0.46であり、これより本発明のアポフェリチンの不純物含量が非常に少なく、不純物由来の着色が少ないことが確認された。
【0062】
7)フェリチンサンプルの色度測定値比較
本発明及び比較例(Merck社製(比較例1)、Sigma社製(比較例2))のフェリチンタンパク質を50mM トリス−塩酸緩衝液(pH8.0)にてタンパク質濃度が約1mg/mlとなるように希釈し、各サンプルの色沢を分光光度計Spectrophotometer CM−3700d(ミノルタ社製)を用いて測定した。また、対照として、50mM トリス−塩酸緩衝液(pH8.0)の色度を測定した。測定結果を表2に示す。
【0063】
【表2】

【0064】
各色度測定値を比較すると、緩衝液(対照)の色度との差において、本発明及び比較例の色度が顕著に異なっていた。本発明では、L*値(明度)、a*値(色度)、b*値(色度)の全てにおいて、対照の色度測定値との差がわずかであり、ロット間差を考慮しても、L*値が緩衝液のL*値の±1.4以内、a*値が緩衝液のa*値の±0.5以内、色度b*値が緩衝液のb*値の±2.8以内であった。一方、比較例1では全ての測定値において対照の色度との差が大きく、L*値はより低値となり、色調が暗いことが示された。また、a*値はより低く、緑色の色調が強いことが示された。さらに、b*値が顕著に増大し、黄色の色調が強いことが示された。比較例2では、着色度合がいっそう強く、L*値は非常に低値となり、色調が顕著に暗いことが示された。また、a*値も非常に低値となり、緑色の色調が顕著に強いことが示された。さらに、b*値が顕著に増大しており、黄色の色調が非常に強いことが示された。これらの測定値は目視による外観と一致し、本発明のアポフェリチンにおいては、不純物由来の着色が非常に少なく、明度、色度ともに対照緩衝液とほとんど差がなく、透明度が非常に高いことが確認された。このような特性を有する本発明のアポフェリチンは、ナノスケール微粒子作製・電子デバイス製造等において好適に使用することができる。
【0065】
8)フェリチンサンプルの金属含有量比較
本発明及び比較例(Merck社製(比較例1)、Sigma社製(比較例2))のフェリチンタンパク質及び50mM トリス−塩酸緩衝液(pH8.0)を定法により凍結乾燥した。トリス−塩酸緩衝液の凍結乾燥重量は1mlあたり7.2mgであり、各フェリチンの凍結乾燥サンプル中に含まれるフェリチンタンパク質の重量は、このトリス−塩酸緩衝液の重量を差し引くことによって算出した。
各フェリチン粉末を秤量し、超高純度硝酸(約60%、関東化学社製)に溶解し、マイクロウェーブ分解装置(Perkin Elmer社製)にて処理後、ICP発光分析装置Optima 3300XL(Perkin Elmer社製)を用いてサンプルに含まれる各種金属イオン濃度を分析した。測定結果を表3に示す。
【0066】
【表3】

【0067】
表3の通り、鉄、カルシウム、カリウム、亜鉛等の含量において、本発明のアポフェリチンは比較例よりも金属の夾雑度合が顕著に低いことが示された。鉄、カルシウム、カリウム、亜鉛の総和は、本発明ではロット間差を考慮しても700ppm(w/w)程度であったが、比較例では1,800ppm(w/w)を超え、特に比較例2では約150,000ppm(w/w)という高値となった。これより、本発明のアポフェリチンにおいては、金属夾雑物をほとんど含まず、純度が非常に高いことが確認された。このような特性を有する本発明のアポフェリチンをナノスケール微粒子作製・電子デバイス製造等において好適に使用することができる。
【産業上の利用可能性】
【0068】
本発明によれば、産生宿主関連成分あるいはその他の夾雑成分含量が著しく少なく、着色が充分に抑えられ、金属含有量が少ないアポフェリチン、及びその製造方法を提供できる。本発明によって提供される高純度のアポフェリチンは、電子デバイスの作製等の用途において好適に利用できる。
【図面の簡単な説明】
【0069】
【図1】本発明及び比較例のアポフェリチン及びフェリチンサンプル溶液の外観である。
【図2】本発明及び比較例のアポフェリチン及びフェリチンサンプル溶液の紫外可視吸収スペクトルである。
【技術分野】
【0001】
本発明はアポフェリチンに関し、詳しくは産生宿主や培地等に由来する生体成分や金属等の夾雑成分の含有量が顕著に低減され、着色が充分に抑えられたアポフェリチンに関する。
【背景技術】
【0002】
アポフェリチンは、生体内の必須微量元素である鉄の量を調節する役割を担う、生物界に広く存在するかご状のタンパク質である。アポフェリチンと鉄又は鉄化合物との複合体をフェリチンと称し、体内に貯蔵されたフェリチンは、体内の鉄濃度に応じて鉄イオンを放出することが知られている。アポフェリチンは鉄以外にも、コバルト、ニッケル、カドミウムセレナイド等、種々の金属あるいは金属化合物を空洞内に取り込み、ナノメータサイズの金属コアを形成することが知られている。そして、このような金属コアを含有するフェリチンは自己集積化能を有するため、2次元配列化できることが知られている(例えば、非特許文献1〜4参照)。
【0003】
近年、このような性質を有するアポフェリチンを利用して、有用な電子デバイスを製造する研究がなされている。例えば、金属コアを形成させたフェリチンをシリコン基盤上に規則的に整列させた後に、熱処理や紫外線−オゾン処理によりタンパク質を分解除去し、シリコン表面上にパターン化された金属ナノドットを得て、これが半導体記憶装置や単電子トランジスタ、演算素子などに利用されている(例えば、特許文献1、非特許文献1〜4参照)。また、得られた金属ナノドット配列を触媒として、電子輸送特性に優れているカーボンナノチューブを均一に形成させ、配線材料として利用する技術も検討されている(例えば、特許文献2参照)。現在まで、半導体集積回路の微細なパターンを形成するためにはリソグラフィーによるトップダウン技術が用いられてきたが、さらなる微細化については物理的な限界に近づいてきたと言われている。このような背景から、フェリチン等を利用してナノスケールの構造を自己組織化的に作製するボトムアップ技術は、次世代の半導体デバイスを作製する有用な手法として大きな注目を集めている。
【0004】
このような電子デバイスを作製するためには、純度が高いナノスケールの微粒子を作製することが非常に重要である。アポフェリチンが夾雑タンパク質、ペプチド、低分子化合物、所望の金属以外の金属等を含有していると、製造されたデバイスの性能低下や不具合、品質のばらつき、ひいては製造の歩留まり低下という問題が生じるため、夾雑物質、特に不純な金属含有量が顕著に少ないアポフェリチンが強く求められている。
【0005】
従来、天然由来の試料からアポフェリチンを取得する方法として、例えば、ウマ脾臓から単離する方法が報告されている(例えば、非特許文献5参照)。この方法では、精製したフェリチンにチオグリコール等の還元剤を作用させてフェリチン内部の金属を遊離させ、さらにキレート剤を用いて金属を除去する工程を行う。しかし、そのタンパク質の精製度については不明であり、鉄以外の金属の含量も不明である。
【0006】
また、大腸菌や無細胞タンパク質合成系を用いる組換えアポフェリチンの精製方法として、熱処理、硫安沈殿、陰イオン交換クロマトグラフィー、ゲルろ過を組み合わせる方法が開示されている(例えば、非特許文献6,7参照)。しかし、この方法で得られたアポフェリチンにおける不純物混入の度合に関する詳細な知見はない。また、これらの方法で用いられる緩衝液や塩にはナトリウムやカリウム等が含まれるため、精製中にこれらの金属がフェリチン内部に残留している可能性も指摘されている。
【0007】
無色のタンパク質の純度を簡便かつ定量的に評価するひとつの指標としては、350nmと280nmにおける吸光度の比(OD350/OD280)が用いられる(例えば、特許文献3参照)。一般に、金属や補欠分子族等を有しない無色の蛋白質については、吸収ピークは波長220nmと280nmの2つのみであるため、それ以外の波長における吸光度の大きさは、含有する有色不純物(金属、有色低分子化合物等)の量に相関する。そして、この値によれば、市販されている天然のウマ脾臓由来アポフェリチン純度は高いものとは言いがたい。さらに視覚的にも、市販されている天然のウマ脾臓由来アポフェリチンは淡黄色を示しており、この着色は夾雑金属や有色低分子化合物等の存在を示すものと考えられる。そして、前述のような高純度のナノスケール微粒子作製に良好に使用するためには、産生宿主関連成分あるいはその他の夾雑成分を含まず、着色が充分に抑えられたアポフェリチンが求められている。
【0008】
【特許文献1】特開2003−33191号公報
【特許文献2】特開2007−39297号公報
【特許文献3】特開2005−348745号公報
【特許文献4】特開2006−94791号公報
【非特許文献1】Thin Solid Films,2001年,393巻,p.12−18
【非特許文献2】Materials Research Society Symposium Proceedings,2005年,873E巻,p.K5.1.1−K5.1.10
【非特許文献3】Japanese Journal of Applied Physics,2006年,45巻,p.L1−L3
【非特許文献4】Japanese Journal of Applied Physics,2006年,45巻,p.8946−8951
【非特許文献5】The Journal of Biological Chemistry,1982年,257巻,p.7672−7677
【非特許文献6】Biochimica et Biophysica Acta,1993年,1174巻,p.218−220
【非特許文献7】The Journal of Biological Chemistry,1988年,263巻,p.18086−18092
【非特許文献8】Journal of American Chemical Society,2006年,128巻,p.16626−16633
【非特許文献9】Gene,2002年,296巻,p.121−128
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、産生宿主関連成分あるいはその他の夾雑成分含量が著しく少なく、着色が充分に抑えられたアポフェリチン及びその製造方法を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは、前記課題解決のために鋭意研究を重ねた結果、金属イオンを含有しない緩衝液、及び金属イオンを含有しない塩を用いて、キレート剤共存下にてフェリチン含有試料又はフェリチン産生宿主の培養液からアポフェリチンを精製することにより、産生宿主関連成分あるいはその他の夾雑成分含量が著しく少なく、着色が充分に抑えられ、かつ含有する金属が特定値以下のアポフェリチンが得られることを見出し、本発明を完成した。
【0011】
すなわち、本発明は以下に関する。
(1)水又は緩衝液に溶解したとき、350nmと280nmにおける吸光度の比(OD350/OD280)の値が0.09以下であるアポフェリチン。
(2)1.0±0.1mg/mlの濃度でアポフェリチンを水又は緩衝液に溶解したときの色度について、明度L*値が水又は緩衝液のL*値の±1.4以内、色度a*値が水又は緩衝液のa*値の±0.5以内、色度b*値が水又は緩衝液のb*値の±2.8以内である上記(1)に記載のアポフェリチン。
(3)鉄、カルシウム、カリウム、亜鉛の含量の総和が1,800ppm(w/w)以下である、上記(1)又は(2)に記載のアポフェリチン。
(4)鉄含量が5ppm(w/w)以下、カルシウム含量が650ppm(w/w)以下、カリウム含量が400ppm(w/w)以下、亜鉛含量が500ppm(w/w)以下である、上記(1)〜(3)のいずれかに記載のアポフェリチン。
(5)金属イオンを含有しない緩衝液、及び金属イオンを含有しない塩を用いて、キレート剤共存下にてフェリチン含有試料又はフェリチン産生宿主の培養液から上記(1)〜(4)に記載のアポフェリチンを精製、回収することを特徴とする、アポフェリチンの製造方法。
(6)金属イオンを含有しない緩衝液がトリス−塩酸、ビストリスプロパン−塩酸、トリシン−塩酸、各種グッドバッファー−アンモニア、酢酸−アンモニア、グリシン−塩酸から選ばれる1以上の緩衝液である、上記(5)に記載のアポフェリチンの製造方法。
(7)金属イオンを含有しない塩が硫安、リン酸アンモニウム、塩化アンモニウム、酢酸アンモニウム、硝酸アンモニウムから選ばれる1以上の塩である、上記(5)又は(6)に記載のアポフェリチンの製造方法。
(8)キレート剤が、ポリアミンカルボン酸系又はオキシカルボン酸系のキレート試薬から選ばれる1以上のキレート試薬、及び/又はキレート樹脂である、上記(5)〜(7)のいずれかに記載のアポフェリチンの製造方法。
【発明の効果】
【0012】
本発明によれば、産生宿主関連成分あるいはその他の夾雑成分含量が著しく少なく、着色が充分に抑えられ、金属含有量が少ないアポフェリチン、及びその製造方法を提供できる。本発明によって提供される高純度のアポフェリチンは、電子デバイスの作製等の用途において好適に利用でき、このようなアポフェリチンを用いることにより、製造されるデバイスの性能の向上、不具合や品質のばらつきの低減及び製造の歩留まり向上が期待される。
【発明を実施するための最良の形態】
【0013】
以下、本発明を詳細に説明する。本発明におけるアポフェリチンとは、かご状のタンパク質であり、内部空間に各種金属又は金属化合物を取り込み、金属コアを形成して貯蔵する能力を有するものをいう。すでに金属を取り込んで、コアを形成しているタンパク質はフェリチンと呼ばれるが、アポフェリチンとフェリチンを明確に分離できる一般的な定義はない。従って本発明においては便宜上、金属の含有量が10,000ppm以下のものをアポフェリチンと称することとする。その生物起源は、特に限定されないが、例えば、ウマやヒト等の各種動物由来や大豆等の植物由来のアポフェリチン、さらにはリステリアや大腸菌等の各種微生物由来のフェリチン様タンパク質であるDNA−binding protein from starved cells(Dps,このタンパク質も以下同様にアポフェリチンと称する)等が挙げられる。さらに具体的には、動物由来の中でも哺乳類由来のアポフェリチンが用いられ、より好ましくはウマ由来のアポフェリチンが用いられる。
【0014】
一般的に、動物由来のアポフェリチンは、Heavy(H)鎖とLight(L)鎖の2種のサブユニットから構成される24量体である。本発明で用いられるアポフェリチンはH鎖とL鎖のどちらで構成されているものでもよく、その構成比率についても特に限定されない。好ましくは、H鎖又はL鎖のいずれか一方のみから構成される単一なフェリチンが用いられ、特にL鎖のみから構成されるフェリチンは熱安定性が高く、自己集積化能を有することから半導体デバイス製造に有用であり、より好ましい。
【0015】
さらに、上述した本発明アポフェリチンは、遺伝子工学的技術で生産されたものも含む。これらは各種生物種由来のアポフェリチン遺伝子を適当なベクター宿主系に導入するか、又は無細胞タンパク質合成系にて発現させることにより得ることができる。例えば、具体的にはウシ、ウマ、ヒト、大豆、リステリアなどの染色体DNA又はcDNA由来のアポフェリチン遺伝子をクローニングし、これらを遺伝子工学的技術で生産することもできる。
【0016】
発現宿主については特に限定されないが、大腸菌のほか、適宜、他の細菌、酵母、糸状菌、放線菌などの微生物や動物細胞などを用いることができる。好ましくは、大腸菌K−12やB株、さらに好ましくは大腸菌JM109(宝酒造社製)、DH5α(宝酒造社製)、Nova Blue(Novagen社製)、BL21(宝酒造社製)等が用いられる。用いる発現ベクターについても特に限定されないが、大腸菌ラクトースオペロンやトリプトファンオペロン等に由来するプロモーター、オペレーター及びリボゾーム結合部位等の発現領域を含むDNA配列(The Operon,p.227, Cold Spring Harbor Laboratory, 1980を参照)を保有するベクター等を用いることができる。
【0017】
本発明のアポフェリチンは、遺伝子工学的技術により、天然試料由来タンパク質のアミノ酸配列の1から複数個のアミノ酸が欠失、置換及び/又は付加された、天然試料由来のタンパク質のアミノ酸配列との相同性が70%以上、好ましくは80%以上の相同性を示すタンパク質も含まれる。ここで、「1から複数個のアミノ酸が欠失、置換及び/又は付加された」とは、例えば1〜30個、好ましくは1〜15個、さらに好ましくは1〜8個のアミノ酸が欠失、置換及び/又は付加されたことを意味する。
【0018】
本発明の組換え型アポフェリチンをコードする遺伝子としては、例えば、染色体DNA又はcDNA由来のアポフェリチン遺伝子の塩基配列全長と70%、好ましくは80%以上の以上の相同性を示し、かつ金属コアを形成する能力を有するかご状のタンパク質をコードするDNAも含まれる。さらに例えば、染色体DNA又はcDNA由来のアポフェリチン遺伝子の全長又はそのうちの15塩基以上の部分と相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ本発明の金属コアを形成する能力を有するかご状のタンパク質をコードするDNAも含まれる。
【0019】
ここで、「ストリンジェントな条件」とは、コロニー・ハイブリダイゼーション法、プラーク・ハイブリダイゼーション法、あるいはサザンブロット・ハイブリダイゼーション法等(Current Protocols in Molecular Biology (WILEY Interscience,1989))を行った際、特異的なハイブリッドのシグナルが非特異的なハイブリッドのシグナルと明確に識別される条件であり、この条件は使用するハイブリダイゼーションの系と、プローブの種類、配列及び長さによって異なる。このような条件は、ハイブリダイゼーションの温度を変えること、洗浄の温度及び塩濃度を変えることにより決定可能であり、例えば、非特異的なハイブリッドのシグナルまで強く検出してしまう場合には、ハイブリダイゼーション及び洗浄の温度を上げるとともに、必要に応じて洗浄の塩濃度を下げることにより特異性を上げることができる。また、特異的なハイブリッドのシグナルも検出されない場合には、ハイブリダイゼーション及び洗浄の温度を下げるとともに、必要に応じて洗浄の塩濃度を上げることにより、ハイブリッドを安定化させることができる。
【0020】
具体的なハイブリダイゼーション条件としては、例えば、DIG Easy Hyb試薬(ロシュ・ダイアグノスティクス社製)を用いて37〜42℃で一晩行う。洗浄は、例えば、0.5×SSC、0.1% SDSを用い、15分間、2回行う。洗浄温度は、例えば、45℃以上、好ましくは52℃以上、更に好ましくは57℃以上で行うことができる。このようなストリンジェントな条件下でハイブリダイズするDNAは、DNAの塩基配列と一定以上の相同性を有する。
【0021】
以下、一例としてウマ由来の組換えアポフェリチンのアミノ酸配列について説明する。非特許文献6によれば、本アポフェリチン遺伝子は、525bpのORFからなり、175アミノ酸をコードしている。しかし、天然のウマ由来アポフェリチンはN末端側のアミノ酸が8個欠失しており、ウマ由来のL鎖アポフェリチン遺伝子の全塩基配列を組換え発現させて得られるアポフェリチンについては、N末端の最初のメチオニンが欠失していると言われている。本発明においては、例えば、本アミノ酸配列のN末端及び/又はC末端及び/又は内部配列においてアミノ酸(ペプチド)が削除及び/又は付加されたタンパク質についても、それが金属コアを形成する能力を有する球状かつかご状のタンパク質であれば、本発明のアポフェリチンに包含される。削除及び/又は付加されるアミノ酸の数については特に限定がないが、例えば、30個以下、好ましくは15個以下、さらに好ましくは8個以下であることが望ましい。さらに、例えば、特許文献1又は特開2005−200425号公報記載のように、変異によりアミノ酸が1個又は複数個置換されたウマ由来のアポフェリチンも本発明のアポフェリチンに包含される。
【0022】
本発明のアポフェリチンは、夾雑物質が非常に少ないことを特徴とする。ここでいう夾雑物質としては、タンパク質、ペプチド、アミノ酸、脂質、補欠分子族、金属等が挙げられる。各種不純物の量を簡便に評価する方法としては、色調を確認する方法が挙げられる。本来高純度なアポフェリチンは無色透明であると考えられ、もし着色が確認された場合には、夾雑物質として、酵素タンパク質が保有する補欠分子族(例えばFAD、FMN等)、夾雑タンパク質やアポフェリチンが保有する金属類が存在していると考えられる。
【0023】
色調を確認するための方法としては、サンプル溶液の紫外可視吸収スペクトルを測定し、タンパク質が示す約280nmもしくは約220nmの吸光度と、300nm以上のある波長における吸光度を測定し、「300nm以上における、ある波長の吸光度/約280nmもしくは約220nmの吸光度」の比を算出し、その値が小さいほど高純度であると判断する方法が好ましい。この方法を採ることにより、定量性がなく、正確性に劣る肉眼確認等と異なり、夾雑物質の濃度が極めて低いレベルでの色調の確認を行うことができる。ここで測定する波長については特に限定されないが、例えば、特許文献3に記載のように280nmにおける吸光度(OD280)と350nm(OD350)における吸光度の比(OD350/OD280)を用いることができる。
【0024】
各サンプルの吸光度を測定する際には、上記記載の方法によりタンパク質濃度を測定し、事前に各濃度の差が±5%以内となるように上記緩衝液で調整しておくことが好ましい。従来、アポフェリチンは純度が低く、金属イオンを取り込みやすいことから、OD350/OD280の値が0.1程度のものしか得られていなかった。本発明のアポフェリチンにおけるOD350/OD280の値は0.09以下であり、さらに好ましくは0.05以下、さらに好ましくは0.02以下である。このような値を有するアポフェリチンは非常に高純度であり、電子デバイス製造に良好に用いることができる。OD350/OD280の値が0.09を超えるアポフェリチンは、純度が十分でなく、不純物含量が多いものとなる。
【0025】
色調を確認する別の方法として、タンパク質濃度を一定に合わせたアポフェリチン溶液を調製し、その色沢を分光光度計(色彩色差計、測色色差計とも言う)で測定し、L*値、a*値及びb*値を比較評価行う方法も好ましい。測定するサンプルのタンパク質濃度の測定法は特に限定されないが、測定法は統一されていることが好ましく、タンパク質濃度は便宜上1.0±0.1mg/ml程度とすることが好ましい。タンパク質濃度を調整するために用いる希釈用緩衝液は特に限定されないが、アポフェリチンを溶解している緩衝液と同一であることが好ましく、例えば、50mM トリス−塩酸緩衝液(pH8.0)が挙げられる。各サンプルの色度が、アポフェリチンを溶解している緩衝液又は希釈用緩衝液の色度の値に近似しているものほど、サンプルの純度が高いことが示される。
【0026】
本発明のアポフェリチンにおける明度L*値は水又は緩衝液のL*値の±1.4以内、より好ましくは±1.2以内、さらに好ましくは±1.0以内である。色度a*値は、水又は緩衝液のa*値の±0.5以内、より好ましくは±0.35以内、さらに好ましくは±0.2以内である。色度b*値は、水又は緩衝液のb*値の±2.8以内、より好ましくは±1.7以内、さらに好ましくは±0.5以内である。このような値を有するアポフェリチンは、非常に高純度であり、電子デバイス製造に良好に用いることができる。一方、L*値が水又は緩衝液のL*値の±1.4を超えるアポフェリチン、a*値が水又は緩衝液のa*値の±0.5を超えるアポフェリチン、b*値が水又は緩衝液のb*値の±2.8を超えるアポフェリチンは、純度が十分でなく、不純物含量が多いものとなる。
【0027】
また、夾雑物質の中でも、特に金属は、アポフェリチンを用いて製造されるデバイスの性能低下や不具合、品質のばらつき、製造の歩留まり低下という問題を引き起こすため、低減されることが特に好ましい。そして各種金属の中でも、特に鉄、カルシウム、カリウム、亜鉛はアポフェリチンに残留しやすく、透析によっても十分な除去が難しいため、アポフェリチンの純度評価にあたってはこれらの金属の含有量が極めて重要である。なお、本発明において、ナトリウムの含有量については評価対象としていないが、これは、製品の保存、流通のために防腐剤であるアジ化ナトリウムを意図的に添加する場合があるという事情や、その除去は比較的容易に行い得るという事情による。
【0028】
アポフェリチンサンプル中の各種含有金属の測定方法は特に限定されないが、例えば、ICP−発光分析あるいはICP−MS分析、蛍光X線分析等が挙げられる。評価サンプルは、液状のものでも凍結乾燥して粉末化したものを用いてもよい。必要に応じ、アポフェリチンを溶解している緩衝液に含有している各種金属量を測定して、各サンプルの金属含有量から差し引いてもよい。
【0029】
本発明のアポフェリチンにおける金属含有量は、鉄、カルシウム、カリウム、亜鉛の含量の総和が1,800ppm(w/w)以下、好ましくは1,300ppm(w/w)以下、さらに好ましくは800ppm(w/w)以下である。このような金属含有量レベルのアポフェリチンは非常に高純度であり、電子デバイス製造に良好に用いることができる。金属含有量が1,800ppm(w/w)を超えるアポフェリチンは、純度が十分でなく、不純物含量が多いものとなる。
【0030】
さらに各金属の含有量についてより詳細に述べると、本発明のアポフェリチンにおける鉄含量は、5ppm(w/w)以下、好ましくは検出限界以下である。かつ本発明のアポフェリチンにおけるカルシウム含量は650ppm(w/w)以下、好ましくは600ppm(w/w)、さらに好ましくは550ppm(w/w)以下である。本発明のアポフェリチンにおけるカリウム含量は400ppm(w/w)以下、好ましくは300ppm(w/w)、さらに好ましくは200ppm(w/w)以下である。本発明のアポフェリチンにおける亜鉛含量は500ppm(w/w)以下、好ましくは250ppm(w/w)、さらに好ましくは検出限界以下である。
【0031】
その他の各種金属の含量は、特に限定されないが、好ましくは本発明のアポフェリチンにおけるリチウム、バリウム、アルミニウムの含量はそれぞれ5ppm(w/w)以下であり、マグネシウム、バナジウム、カドミウム、銅、コバルト、クロム、マンガン、ニッケル、銀、チタンの含量はそれぞれ検出限界以下である。このような金属含有量レベルのアポフェリチンは非常に高純度であり、電子デバイス製造に良好に用いることができる。各種金属含有量が各々の好適な濃度レベルを超えるアポフェリチンは、純度が十分でなく、不純物含量が多いものとなる。
【0032】
本発明のアポフェリチンを得るために、例えば、天然のフェリチン含有細胞又はアポフェリチン産生菌を、超音波破砕機、フレンチプレス、ダイノミル等によって破砕するか、リゾチーム等の細胞壁溶解酵素、トリトンX−100等の界面活性剤を用いた抽出等の任意の方法によって、アポフェリチンを回収することができる。そして、アポフェリチンを精製する際には、金属イオンを含有しない緩衝液、及び金属イオンを含有しない塩を用いることが重要である。
【0033】
従来、アポフェリチンを精製するために、熱処理法、硫安塩析法、イオン交換樹脂処理法、疎水性樹脂処理法、ゲルろ過法が適宜組み合わせて用いられていた。そして、その各処理には、トリス−塩酸緩衝液やリン酸カリウム緩衝液のような汎用的な緩衝液、HEPES−NaOH等のグッドバッファーが通常的に使用され、イオン交換樹脂処理法においては溶出を行うための塩としてNaClやKCl等の一般的な金属を含有する塩が使用されてきた。しかしながら、本発明のアポフェリチンは、半導体デバイス等への応用を主な目的としているため、不純物となる金属の混入を極力避けることは極めて重要である。
【0034】
本発明において不純物となる金属とは、半導体材料になる物質も含まれており、例えばリチウム、ベリリウム、ホウ素、ナトリウム、マグネシウム、アルミニウム、ケイ素、カリウム、カルシウム、スカンジウム、チタン、バナジウム、クロム、マンガン、鉄、コバルト、ニッケル、銅、亜鉛、ガリウム、ゲルマニウム、ヒ素、セレン、パラジウム、銀、カドミウム、インジウム、スズ、セシウム、バリウム、白金、金、水銀、鉛等を指す。これらの金属が存在する形態については特に制限はなく、例えばイオン、水和物、酸化物等が挙げられる。
【0035】
本発明における、アポフェリチンの精製に用いる緩衝液は、金属を含有しないことが好ましい。金属を含有しない緩衝液としては、組成式に金属を含有しない試薬成分からなる緩衝液が好ましい。このような緩衝液の例として、例えば、トリス−塩酸、ビストリスプロパン−塩酸、トリシン−塩酸、各種グッドバッファー−アンモニア、酢酸−アンモニア、グリシン−塩酸等から選ばれる1以上の緩衝液が挙げられる。精製処理に用いる緩衝液の濃度やpHは特に限定されないが、例えば、1mM〜1,000mMでpH5〜10、好ましくは5〜200mMでpH6〜9が挙げられる。
【0036】
さらに、各種樹脂処理法における吸着・溶出に用いる塩についても、金属を含有しない塩を用いることが、アポフェリチンの純度向上に有効である。金属を含有しない塩としては、組成式に金属を含有しない塩が好ましい。このような塩の例として、硫安、リン酸アンモニウム、塩化アンモニウム、酢酸アンモニウム、硝酸アンモニウム等から選ばれる1種類以上の塩が挙げられる。用いる塩の濃度は特に限定されないが、例えば0.1mM〜4,000mM、好ましくは1〜3,000mMが挙げられる。このような組成式に金属を含有しない緩衝液と塩のみを組み合わせて用いることが、本発明アポフェリチンの製造方法として重要である。なお、組成式に金属を含有しない緩衝液及び塩の市販品の中には、不純物としてごく微量の金属が混入している形で販売されているものもあるが、その含量は組成式に金属を含む塩に比較して非常に微量であるため、金属混入の少ないものを選択することにより、問題なく使用することができる。
【0037】
さらに、アポフェリチンや用いる水、試薬に含まれる金属をトラップするために、精製工程である熱処理法、硫安塩析法、イオン交換樹脂処理法、疎水性樹脂処理法、ゲル濾過法のうち少なくとも1工程以上を、キレート剤の共存下で行うことが好ましい。本発明の精製方法においては、キレート剤を共存させることが重要である。ここで用いるキレート剤とは、金属イオンに配位しキレート化合物を与えるような任意の化合物である。具体的には、例えば、エチレンジアミン4酢酸(EDTA)、trans−1,2−diaminocyclohexane−N,N,N’,N’−tetraacetic acid(CyDTA)、diethylenetriamine−N,N,N’,N”,N”−pentaacetic acid(DTPA)、グリコールエーテルジアミン4酢酸(EGDTA)、1,6−hexametylenediamine−N,N,N’,N’−tetraacetic acid(HDTA)、トリエチレンテトラミン6酢酸(TTHA)、アスパラギン酸等のポリアミンカルボン酸系のキレート試薬や、クエン酸、リンゴ酸、イソクエン酸などのオキシカルボン酸系のキレート試薬、さらにはポリアミン基及びチオ尿素基等をリガンド基とし、担体部分が疎水性を有するキレート樹脂等が挙げられる。好ましくは、ポリアミンカルボン酸系のキレート試薬が用いられ、さらに好ましくはEDTAやCyDTA等が挙げられる。
【0038】
本発明においては、上記キレート剤に配位する塩の有無、種類や数については限定されるものではないが、例えば、遊離酸化合物やナトリウム塩化合物が好ましく用いられる。また上記キレート剤は、それぞれ単独でも複数組み合わせても用いることができる。これらのキレート剤の添加濃度は特に制限されないが、低濃度でも金属イオンのキレート効果を充分有しているため、通常、10mM以下の低濃度で用いられる。本キレート剤中にナトリウム等の金属塩が組成式に含まれている場合、好ましくは最終工程で十分に透析を行い、これらを除去することが好ましい。
【0039】
なお、上記精製処理における加熱処理は、アポフェリチンの精製度向上に関して好ましい効果を奏する。処理温度としては例えば、通常40〜90℃、好ましくは50〜70℃程度が挙げられる。処理時間としては例えば、通常10分間〜10時間、好ましくは30分間〜5時間程度が挙げられる。このような条件下で加熱処理を行うことにより、不純物であるタンパク質を効率よく除去することができる。処理温度や時間が十分でないと、不純物であるタンパク質が多く残留してしまい、一方、処理温度や時間が必要以上に過度であると、目的のアポフェリチン画分に必要以上の熱負荷をかけることとなり、好ましくない。
【0040】
硫安塩析は、添加する硫安濃度については特に限定されないが、はじめに硫安を50〜70%程度添加して、遠心処理後に生じるアポフェリチン含有上清を回収する。その後上清を75〜90%とし、沈殿するアポフェリチンを回収することができる。沈殿は適宜、緩衝液で再溶解させることが可能である。
【0041】
イオン交換樹脂処理は常法に従って行うことができる。イオン交換樹脂処理には、陰イオン交換樹脂がより好ましく用いられるが、陰イオン交換基を有する不溶性担体であればいずれも使用することができる。陰イオン交換基としては、特に限定されないが、Q型[荷電基:−N+(CH3)3]、DEAE型[荷電基:−N+(C2H5)2H]等が例示される。好ましくはQ型が用いられ、具体的には、Q Sepharose Fast Flow、Capto−Q、Q Sepharose High Performance、Q Sepharose XL(GEヘルスケアバイオサイエンス社製)、Toyopearl QAE−650、Toyopearl SuperQ−650(東ソー社製)等が例示される。本工程では、アポフェリチンを吸着画分に回収することができる。接触条件としては、pH6〜9程度、好ましくはpH7〜8程度、塩濃度0.1〜500mM程度が挙げられる。
【0042】
疎水性樹脂処理もまた、常法に従って行うことができる。疎水性樹脂処理用担体としては、炭素数4〜18のアルキル基(ブチル基型、オクチル基型、オクチルデシル基型等)、フェニル基を有する不溶性担体が例示される。好適にはフェニル基型やブチル基型が挙げられ、具体的には、Phenyl Sepharose Fast Flow、Phenyl Sepharose CL−4B、Phenyl Sepharose High Performance、Butyl Sepharose Fast Flow(GEヘルスケアバイオサイエンス社製)、Toyopearl Phenyl−650、Toyopearl Butyl−650(東ソー社製)等が例示される。本工程では、アポフェリチンを吸着画分に回収することができる。接触条件としてはpH6〜9程度、好ましくはpH7〜8程度、塩濃度0.02〜2M程度が挙げられる。
【0043】
ゲルろ過もまた、常法に従って行うことができる。ゲルろ過用担体としては、特に限定されないが、具体的には、各種Superdex、Superose、Sephacryl、Sepharose、Sephadex(GEヘルスケアバイオサイエンス社製)等が例示される。接触条件としてはpH6〜8程度、好ましくはpH7〜8程度、塩濃度0.1〜4M程度が挙げられる。
【0044】
さらに、得られた精製アポフェリチンを還元剤処理に供することにより、内部に取り込まれた金属を遊離させ、さらに上記キレート剤を共存させることによって金属を除去することも可能である。還元剤は、還元作用を有し、アポフェリチンの内部に取り込まれた金属を遊離させる作用を有する物質であれば、特に制限されないが、具体的にはチオグリコール等が好ましく用いられる。添加量としては、終濃度0.01〜10%(v/v)程度、好ましくは0.1〜2%(v/v)程度が例示される。キレート剤としては、金属イオンに配位してキレート化合物を与えるような化合物であり、そのような作用を有する化合物であれば如何なる化合物でも本発明に用いることができる。具体例としては、EDTA、CyDTA、DTPA、EGDTA、HDTA、TTHA、クエン酸等のキレート試薬、Chelex(BioRad社製)、Diaion CRB02(三菱化学社製)、LEWATIT TP214 (バイエル社製)、アンバライトCG4000等のキレート樹脂が挙げられる。キレート剤の添加濃度についても特に制限はないが、例えば、キレート試薬であれば0.1〜200mM、キレート樹脂であれば1〜20%(w/v)が例示される。添加した還元剤やキレート試薬、遊離された金属等は十分量の緩衝液を用いて透析処理することにより除去できる。
【0045】
上述の各種精製工程は全て行ってもよいし、少なくとも2工程以上を適宜選択、組み合わせて行うこともできる。工程の順序については特に限定されない。また、各工程間及び最終工程の後に、適宜、十分量の緩衝液を用いる透析処理を行い、脱塩することができる。
【0046】
なお、得られる精製アポフェリチンや精製中間品を長期間保存するために、アジ化ナトリウムを添加してもよい。添加する濃度は特に限定されないが、好ましくは1%(w/v)以下、さらに好ましくは0.1%(w/v)以下である。
【0047】
本発明アポフェリチン溶液のタンパク質濃度の測定方法としては、広く一般的に知られている、280nmにおける紫外吸光度を測定する方法、Bradford法、Lowry法、又はタンパク質溶液及び同量の緩衝液を凍結乾燥し、得られる各凍結乾燥重量からタンパク質重量を算出し、凍結乾燥前のタンパク質溶液の濃度を計算する方法等が用いられる。280nmにおける紫外吸光度を測定する方法については、便宜上、OD280の値 1=1 mg/mlとしてもよいし、標準物質としてウシ血清アルブミンやγ−グロブリンを用いて検量線を作成して算出してもよいし、Protein Science,1995年,4巻,p.2411−2423を参照して算出することもできる。Bradford法やLowry法については、標準物質としてウシ血清アルブミンやγ−グロブリンを用いて検量線を作成して濃度を算出することができる。
【0048】
本発明アポフェリチンのタンパク質濃度や夾雑物質の量を測定する前には、各タンパク質サンプルを十分量の緩衝液で透析して、低分子化合物やアポフェリチンに取り込まれていない金属等をあらかじめ除去してから評価することが好ましい。用いる緩衝液は、組成式に金属を含有しない試薬成分からなる緩衝液を用いることが好ましく、このような緩衝液の例として、トリス−塩酸、ビストリスプロパン−塩酸、トリシン−塩酸、各種グッドバッファー−アンモニア、酢酸−アンモニア、グリシン−塩酸等から選ばれる1種類以上の緩衝液が挙げられる。その緩衝液の濃度やpHは特に限定されないが、例えば、1〜1,000mMでpH5〜10、好ましくは10〜200mMでpH6〜9が挙げられる。
【0049】
以下、実施例を示して本発明を説明するが、本発明の技術的範囲はこれによって何ら限定されることはない。
【実施例1】
【0050】
1)組換えアポフェリチン生産菌の作製
ウマ由来のアポフェリチンの構造遺伝子(「Biochimica et Biophysica Acta」,1993年,1174巻,p.218−220参照)の、N末端アミノ酸8個分をコードする塩基24bpを削除し、メチオニン1個をコードする3塩基を付加した遺伝子を定法により作製した。本遺伝子を定法によりpKK223−3に挿入し、組換え体プラスミドDNAを得た。続いて、作製された前記プラスミドを用いて大腸菌(E.coli)JM109(宝酒造社製)を形質転換し、組換えアポフェリチン(Fer8)生産菌を得た。
【0051】
2)組換えアポフェリチン生産菌の培養
上記の組換えアポフェリチン生産菌をLB−IPTG−amp培地〔バクトトリプトン1%(w/v),酵母エキス0.5%(w/v), NaCl 0.5%(w/v),イソプロピル−β−D−チオガラクトピラノシド(1mM)及びアンピシリン(50μg/ml)〕中、37℃、15時間、撹拌・培養した。
【0052】
3)組換えアポフェリチンの精製
培養終了後の組換えアポフェリチン生産菌の培養液10Lを遠心処理(8,000rpm、15分)し、沈殿した大腸菌を回収した。得られた菌体を2Lの5mM EDTAを含有する50mM トリス−塩酸緩衝液(pH8.0)に再懸濁し、超音波破砕器(astrasonXL、MISONIX社製)にて菌体を破砕した。これを遠心処理(8,000rpm、15分)することにより、アポフェリチンを含有する菌体破砕上清を得た。次に、菌体破砕上清を50℃、30分間熱処理した。これを遠心分離(8,000rpm、15分)することにより、夾雑タンパク質の熱変性により生成する沈殿を除去した。
【0053】
続いて、Q−sepharose Fast Flow(GEヘルスケアバイオサイエンス社製)を用い、カラムクロマトグラフィー(樹脂量500mL、流速200mL/h)を行った。移動相として、5mM EDTAを含有する50mM トリス−塩酸緩衝液(pH8.0、硫安の塩濃度勾配 0〜300mM)を用いた。
【0054】
次いで溶出液400mLに硫安を50%飽和となるよう加えた後、遠心処理(12,000rpm、15分)を行ってアポフェリチンを含有する上清を回収した。得られた上清にさらに硫安を追加して90%飽和とし、遠心処理を行って沈殿として生じるアポフェリチンを回収した。
【0055】
沈殿したアポフェリチンを500mLの5mM EDTAを含有する50mM トリス−塩酸緩衝液(pH8.0)に再溶解し、さらに2M硫安を添加してPhenyl SepharoseCL−4B(GEヘルスケアバイオサイエンス社製)を用いてカラムクロマトグラフィー(樹脂量500mL、流速200mL/h)を行った。移動相として、5mM EDTAを含有する50mM トリス−塩酸緩衝液(pH8.0、硫安の塩濃度勾配 800〜0mM)を用いた。
【0056】
さらにアポフェリチン画分を5mM EDTAを含有する50mM トリス−塩酸緩衝液(pH8.0)にて透析し、Sephacryl S−300を用いてゲルろ過(樹脂量200mL、流速100mL/h)を行った。アポフェリチン画分を50mM トリス−塩酸緩衝液(pH8.0)にて透析、濃縮することにより、本発明のアポフェリチン1(本発明1)及びアポフェリチン2(本発明2)を得た。
【0057】
4)本発明のアポフェリチンの電気泳動による確認
上述のアポフェリチン1(本発明1)及び2(本発明2)を、Native−PAGE[PAGミニ「第一」10/20(第一化学薬品社製)、タンパク質分子量マーカー「第一」I(第一化学薬品社製)]に供した結果、約430kDaの単一バンドが確認された。また、SDS−煮沸処理を行った後、SDS−PAGE[PAGミニ「第一」10/20(第一化学薬品社製)、BenchMark Protein Ladder(インビトロジェン社製)]に供した結果、約20kDaの単一バンドが確認された。よって、本発明のアポフェリチンは24量体のタンパク質分子であることが示唆された。タンパク質濃度はDC Protein Assay Kit(BioRad社製)を用い、標準物質としてウシ血清アルブミン(Pierce社製)を用いて検量線を作成し、測定、算出した。上述のアポフェリチン1(本発明1)及び2(本発明2)の電気泳動上の純度は同程度であった。
【0058】
5)市販品フェリチンとの目視による純度比較
市販品アポフェリチン(Merck社製(比較例1))及び市販品フェリチン((Sigma社製(比較例2))を50mM トリス−塩酸緩衝液(pH8.0)に溶解後、同緩衝液にて透析した。2種類の比較例及び本発明の各アポフェリチンサンプルの外観を図1に示す。図1より明らかであるように、本発明のアポフェリチンは無色透明であり、極めて純度が高いことが示唆された。一方、比較例1は薄い黄色であり、不純物を含むことが示唆された。さらに、比較例2は褐色であり、一見して不純物を多く含むことが示唆された。
【0059】
6)フェリチンサンプルの紫外可視吸収スペクトル比較
本発明及び比較例(Merck社製(比較例1)、Sigma社製(比較例2))のフェリチンタンパク質を50mM トリス−塩酸緩衝液(pH8.0)にて適宜希釈し、280nmにおける吸光度が同程度になるよう調整した後、分光光度計U−3010(日立製作所社製)にて600〜250nmにおける紫外可視吸収スペクトルを測定した。また、ブランクとして、50mM トリス−塩酸緩衝液(pH8.0)の600〜250nmにおける紫外可視吸収スペクトルを測定し、各サンプルの各波長における測定値から差し引いた。ブランク差し引き後の各サンプルの紫外可視吸収スペクトルを図2に、各波長における吸光度と280nmにおける吸光度の比を表1に示す。
【0060】
【表1】

【0061】
各サンプルの280nmの波長における吸光度に対する350〜600nmの波長における吸光度比の値を比較すると、本発明のアポフェリチン1及び2では全て0.1以下であったのに対して、市販のフェリチンでは各波長において本発明のアポフェリチンよりも値が高く、特に波長が短くなるにつれて高値となった。OD350/OD280の値は、本発明では0.09以下であったが、比較例では0.10及び0.46であり、これより本発明のアポフェリチンの不純物含量が非常に少なく、不純物由来の着色が少ないことが確認された。
【0062】
7)フェリチンサンプルの色度測定値比較
本発明及び比較例(Merck社製(比較例1)、Sigma社製(比較例2))のフェリチンタンパク質を50mM トリス−塩酸緩衝液(pH8.0)にてタンパク質濃度が約1mg/mlとなるように希釈し、各サンプルの色沢を分光光度計Spectrophotometer CM−3700d(ミノルタ社製)を用いて測定した。また、対照として、50mM トリス−塩酸緩衝液(pH8.0)の色度を測定した。測定結果を表2に示す。
【0063】
【表2】

【0064】
各色度測定値を比較すると、緩衝液(対照)の色度との差において、本発明及び比較例の色度が顕著に異なっていた。本発明では、L*値(明度)、a*値(色度)、b*値(色度)の全てにおいて、対照の色度測定値との差がわずかであり、ロット間差を考慮しても、L*値が緩衝液のL*値の±1.4以内、a*値が緩衝液のa*値の±0.5以内、色度b*値が緩衝液のb*値の±2.8以内であった。一方、比較例1では全ての測定値において対照の色度との差が大きく、L*値はより低値となり、色調が暗いことが示された。また、a*値はより低く、緑色の色調が強いことが示された。さらに、b*値が顕著に増大し、黄色の色調が強いことが示された。比較例2では、着色度合がいっそう強く、L*値は非常に低値となり、色調が顕著に暗いことが示された。また、a*値も非常に低値となり、緑色の色調が顕著に強いことが示された。さらに、b*値が顕著に増大しており、黄色の色調が非常に強いことが示された。これらの測定値は目視による外観と一致し、本発明のアポフェリチンにおいては、不純物由来の着色が非常に少なく、明度、色度ともに対照緩衝液とほとんど差がなく、透明度が非常に高いことが確認された。このような特性を有する本発明のアポフェリチンは、ナノスケール微粒子作製・電子デバイス製造等において好適に使用することができる。
【0065】
8)フェリチンサンプルの金属含有量比較
本発明及び比較例(Merck社製(比較例1)、Sigma社製(比較例2))のフェリチンタンパク質及び50mM トリス−塩酸緩衝液(pH8.0)を定法により凍結乾燥した。トリス−塩酸緩衝液の凍結乾燥重量は1mlあたり7.2mgであり、各フェリチンの凍結乾燥サンプル中に含まれるフェリチンタンパク質の重量は、このトリス−塩酸緩衝液の重量を差し引くことによって算出した。
各フェリチン粉末を秤量し、超高純度硝酸(約60%、関東化学社製)に溶解し、マイクロウェーブ分解装置(Perkin Elmer社製)にて処理後、ICP発光分析装置Optima 3300XL(Perkin Elmer社製)を用いてサンプルに含まれる各種金属イオン濃度を分析した。測定結果を表3に示す。
【0066】
【表3】

【0067】
表3の通り、鉄、カルシウム、カリウム、亜鉛等の含量において、本発明のアポフェリチンは比較例よりも金属の夾雑度合が顕著に低いことが示された。鉄、カルシウム、カリウム、亜鉛の総和は、本発明ではロット間差を考慮しても700ppm(w/w)程度であったが、比較例では1,800ppm(w/w)を超え、特に比較例2では約150,000ppm(w/w)という高値となった。これより、本発明のアポフェリチンにおいては、金属夾雑物をほとんど含まず、純度が非常に高いことが確認された。このような特性を有する本発明のアポフェリチンをナノスケール微粒子作製・電子デバイス製造等において好適に使用することができる。
【産業上の利用可能性】
【0068】
本発明によれば、産生宿主関連成分あるいはその他の夾雑成分含量が著しく少なく、着色が充分に抑えられ、金属含有量が少ないアポフェリチン、及びその製造方法を提供できる。本発明によって提供される高純度のアポフェリチンは、電子デバイスの作製等の用途において好適に利用できる。
【図面の簡単な説明】
【0069】
【図1】本発明及び比較例のアポフェリチン及びフェリチンサンプル溶液の外観である。
【図2】本発明及び比較例のアポフェリチン及びフェリチンサンプル溶液の紫外可視吸収スペクトルである。
【特許請求の範囲】
【請求項1】
水又は緩衝液に溶解したとき、350nmと280nmにおける吸光度の比(OD350/OD280)の値が0.09以下であるアポフェリチン。
【請求項2】
1.0±0.1mg/mlの濃度でアポフェリチンを水又は緩衝液に溶解したときの色度について、明度L*値が水又は緩衝液のL*値の±1.4以内、色度a*値が水又は緩衝液のa*値の±0.5以内、色度b*値が水又は緩衝液のb*値の±2.8以内である請求項1に記載のアポフェリチン。
【請求項3】
鉄、カルシウム、カリウム、亜鉛の含量の総和が1,800ppm(w/w)以下である、請求項1又は2に記載のアポフェリチン。
【請求項4】
鉄含量が5ppm(w/w)以下、カルシウム含量が650ppm(w/w)以下、カリウム含量が400ppm(w/w)以下、亜鉛含量が500ppm(w/w)以下である、請求項1〜3のいずれかに記載のアポフェリチン。
【請求項5】
金属イオンを含有しない緩衝液、及び金属イオンを含有しない塩を用いて、キレート剤共存下にてフェリチン含有試料又はフェリチン産生宿主の培養液から請求項1〜4に記載のアポフェリチンを精製、回収することを特徴とする、アポフェリチンの製造方法。
【請求項6】
金属イオンを含有しない緩衝液がトリス−塩酸、ビストリスプロパン−塩酸、トリシン−塩酸、各種グッドバッファー−アンモニア、酢酸−アンモニア、グリシン−塩酸から選ばれる1以上の緩衝液である、請求項5に記載のアポフェリチンの製造方法。
【請求項7】
金属イオンを含有しない塩が硫安、リン酸アンモニウム、塩化アンモニウム、酢酸アンモニウム、硝酸アンモニウムから選ばれる1以上の塩である、請求項5又は6に記載のアポフェリチンの製造方法。
【請求項8】
キレート剤が、ポリアミンカルボン酸系又はオキシカルボン酸系のキレート試薬から選ばれる1種類以上のキレート試薬及び/又はキレート樹脂である、請求項5〜7のいずれかに記載のアポフェリチンの製造方法。
【請求項1】
水又は緩衝液に溶解したとき、350nmと280nmにおける吸光度の比(OD350/OD280)の値が0.09以下であるアポフェリチン。
【請求項2】
1.0±0.1mg/mlの濃度でアポフェリチンを水又は緩衝液に溶解したときの色度について、明度L*値が水又は緩衝液のL*値の±1.4以内、色度a*値が水又は緩衝液のa*値の±0.5以内、色度b*値が水又は緩衝液のb*値の±2.8以内である請求項1に記載のアポフェリチン。
【請求項3】
鉄、カルシウム、カリウム、亜鉛の含量の総和が1,800ppm(w/w)以下である、請求項1又は2に記載のアポフェリチン。
【請求項4】
鉄含量が5ppm(w/w)以下、カルシウム含量が650ppm(w/w)以下、カリウム含量が400ppm(w/w)以下、亜鉛含量が500ppm(w/w)以下である、請求項1〜3のいずれかに記載のアポフェリチン。
【請求項5】
金属イオンを含有しない緩衝液、及び金属イオンを含有しない塩を用いて、キレート剤共存下にてフェリチン含有試料又はフェリチン産生宿主の培養液から請求項1〜4に記載のアポフェリチンを精製、回収することを特徴とする、アポフェリチンの製造方法。
【請求項6】
金属イオンを含有しない緩衝液がトリス−塩酸、ビストリスプロパン−塩酸、トリシン−塩酸、各種グッドバッファー−アンモニア、酢酸−アンモニア、グリシン−塩酸から選ばれる1以上の緩衝液である、請求項5に記載のアポフェリチンの製造方法。
【請求項7】
金属イオンを含有しない塩が硫安、リン酸アンモニウム、塩化アンモニウム、酢酸アンモニウム、硝酸アンモニウムから選ばれる1以上の塩である、請求項5又は6に記載のアポフェリチンの製造方法。
【請求項8】
キレート剤が、ポリアミンカルボン酸系又はオキシカルボン酸系のキレート試薬から選ばれる1種類以上のキレート試薬及び/又はキレート樹脂である、請求項5〜7のいずれかに記載のアポフェリチンの製造方法。
【図1】


【図2】




【図2】


【公開番号】特開2008−290962(P2008−290962A)
【公開日】平成20年12月4日(2008.12.4)
【国際特許分類】
【出願番号】特願2007−137309(P2007−137309)
【出願日】平成19年5月24日(2007.5.24)
【出願人】(000004477)キッコーマン株式会社 (212)
【Fターム(参考)】
【公開日】平成20年12月4日(2008.12.4)
【国際特許分類】
【出願日】平成19年5月24日(2007.5.24)
【出願人】(000004477)キッコーマン株式会社 (212)
【Fターム(参考)】
[ Back to top ]

