ヒトコラーゲン含有化粧料
【課題】 ヒトの皮膚等との親和性に優れ、保湿性、粘弾性に優れ、また、ヒト繊維芽細胞の増殖効果にも優れた化粧料を提供する。
【解決手段】
ヒトコラーゲン、ヒトコラーゲンペプチド分画または該ヒトコラーゲンの分解生成物ゼラチンおよびこれらの混合物を化粧料材料に配合してなることを特徴とするとする化粧料。
【解決手段】
ヒトコラーゲン、ヒトコラーゲンペプチド分画または該ヒトコラーゲンの分解生成物ゼラチンおよびこれらの混合物を化粧料材料に配合してなることを特徴とするとする化粧料。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒト型コラーゲン(以下、「ヒトコラーゲン」という。)を含有する化粧料に関するものであり、さらに詳しくは、カイコを用いた組換え遺伝子技法により産生したヒトコラーゲンおよびヒトコラーゲンペプチドを含有する化粧料に関するものである。
【背景技術】
【0002】
コラーゲンは、動物の結合組織を構成する主要タンパク質成分であり、肌の弾力を支配する物質である。従来より、皮膚の細胞及び組織を保護し、活性化するため、近年、コラーゲンが化粧用クリーム、化粧水、乳液等の化粧品、美容品、及び健康食品等の配合成分として使用されている。
【0003】
しかし、従来使用されている化粧料等の配合成分としてのコラーゲンは、主としてブタ、ウシ、ウマ等の哺乳動物のコラーゲン及びフグ、ヒラメ、タラ、マグロのほか、特に寒流魚類のサメ、サケ等から抽出した魚類のコラーゲンを原料とするものである。
【0004】
従って、かかる動物および魚類のコラーゲンを用いた化粧料は、ヒトの皮膚とのアレルギー性反応による発疹が生ずるケースがあること、また、ヒトコラーゲンとは、アミノ酸組成が一部異なるため、ヒトの肌との親和性が低いことが指摘されており、例えば、ブタのコラーゲンおよびサケのコラーゲンは、コラーゲンI型の構造からも10%〜20%の相違があり、ヒトの皮膚に適合するものでないことは明らかといえる。
【0005】
しかし、ヒト由来のコラーゲンはその分子の大きさ(約10万ダルトン)とサブユニット構造が、2つのαペプチド鎖と1つのβペプチド鎖からなるヘテロトリマーであるという複雑なものであることから近年にいたるまで工業的生産には至らなかった。
【0006】
ヒトコラーゲンは、長年にわたり、その生産が切望されてきたが、カイコを利用した遺伝子組換えによる生産が報告されるようになり、例えば、特開2006−109722号公報(以下、「特許文献1」という。)には、カイコが有する絹タンパク質の合成能力に着目し、絹タンパク質と共に大量の組換えタンパク質を繭中に分泌する形質転換カイコを開発したことが記載されている。外来遺伝子の導入により、絹タンパク質遺伝子プロモーターの下流に連結したヒトコラーゲンcDNAをカイコに組み込み、組換えヒトコラーゲンを繭または絹糸腺内のタンパク質の一部とし産生する軽質転換カイコの開発をしたことが記載されている。
【0007】
また、特開2008−125366号公報(以下、「特許文献2」という。)にもトランスジェニックカイコの後部絹糸腺細胞または中部絹糸腺において組換えタンパク質を発現させるための融合ポリヌクレオチドが記載されている。
【0008】
さらに、特開2003−277399号公報(以下、「特許文献3」という。)によれば、ヒトコラーゲンI型のC−末端から誘導されたペプチドにTatペプチドが結合された融合ペプチドおよび該ペプチドを含有する皮膚シワ改善化粧品組成物が記載されている。
【0009】
しかしながら、前記の如きいずれの提案においても、ヒトコラーゲンの生産量は依然として少なく、また、生産プロセスにおいても複雑であるなどの問題があるばかりでなく、ヒトコラーゲンを含有成分とする化粧料については、開示もなく、示唆もされていなかった。
【0010】
また、ヒト繊維芽細胞がコラーゲンを生産することから、かかる繊維芽細胞を培養し、これを顔面のシワおよびラインの部分に移植し、ヒトコラーゲンを生産する方法も実用化されたが、かかる方法は細胞を移植することが前提であり、大量に生産することができないし、繊維芽細胞を化粧品成分化する技術は開発されていないという状況にある。
かかる観点から、水溶性のヒト型コラーゲンの提供が切望されてきた。
【0011】
さらに、従来開発されてきたヒトコラーゲンは、分子量が大きく、化粧料の成分として皮膚への親和性および浸透性が十分ではなかったので、分子量の大きさが制御され、皮膚への親和性・浸透性に優れたペプチド分画の開発が切望されてきた。
【0012】
【特許文献1】特開2006−109722号公報
【特許文献1】特開2008−125366号公報
【特許文献1】特開2003−277399号公報
【非特許文献1】田村 他 ネイチャーバイオテクノロジー(Nature Biotechnology 18,81-84 (2000))
【発明の概要】
【発明が解決しようとする課題】
【0013】
従って、本発明の課題は、ヒトの皮膚成分と同一の構造を有し、ヒトの皮膚との親和性が優れた化粧料を提供することにある。
【0014】
さらに、本発明の課題は、皮膚への浸透性をさらに増加させることが可能であり、ヒトの繊維芽細胞を刺激することが可能な化粧料を提供することにある。
【課題を解決するための手段】
【0015】
そこで、本発明者らは、前記の本発明の課題を解決するために、鋭意検討を重ねた結果、従来の動物由来のコラーゲンまたは魚類由来のコラーゲンに代えて、ヒトコラーゲンを用いることにより、前記の問題点を解決できることに着目し、かかる知見に基いて本発明に想到するに至った。
【0016】
なお、本発明に関する明細書において、「ヒトコラーゲン」とは、ヒトのコラーゲンと同一の遺伝子構造を有するものであって、カイコを用いた組換え遺伝子技法等、その他の合成方法により製造されるものを包含する。
【0017】
かくして、本発明によれば、
ヒトコラーゲンまたは該ヒトコラーゲンの低分子化生成物ゼラチンおよびこれらの混合物を化粧料材料に配合してなる化粧料
が提供される。
【0018】
本発明は、前記の通り、ヒトコラーゲンを含有する化粧料を提供するものであるが、さらに、に好ましい実施の形態として次の1)〜10)に掲げるものを包含する。
【0019】
1)前記ヒトコラーゲンのアミノ酸全長配列が、配列表1に記載のヒトコラーゲンI型の配列である前記化粧料。
2)前記ヒトコラーゲンが、ヒトコラーゲンI型(α鎖)のアミノ酸全長配列のうち681番Fから828番Eまでの198個のアミノ酸を含有するヒトコラーゲンヘプチドBである前記化粧料。
3)前記ヒトコラーゲンが、ヒトコラーゲンI型(α鎖)のアミノ酸全長配列のうち264番Kから400番Nまでの136個のアミノ酸を含有するヒトコラーゲンヘプチドCである前記化粧料。
4)前記ヒトコラーゲンが、カイコを利用した組換え遺伝子技法による産生物質に特定されたものである前記化粧料。
5)前記化粧料が、皮膚および頭髪に用いられる化粧品である前記化粧料。
6)前記皮膚および頭髪に用いられる化粧品が化粧用クリーム、化粧水、乳液を含むものである前記化粧料。
7)前記ヒトコラーゲンとヒアルロン酸その他の保湿成分とを含有してなる前記化粧料。
8)前記ヒトコラーゲンと抗酸化物質を含有してなる前記化粧料。
9)前記ヒトコラーゲンとカプサイシン、ミントその他の抗肥満物質を含有してなる前記化粧料。
10)前記ヒトコラーゲンとオレンジ、レモングラス、クラリセージ、ネロリその他の精油を含有してなる前記化粧料。
【発明の効果】
【0020】
本発明に係るヒトコラーゲン含有化粧料は、ヒトコラーゲンと、該ヒトコラーゲンを配合した化粧料材料とからなるものである。本発明に係る化粧料によれば、配合成分であるヒトコラーゲンの効能が生かされ、ヒトの皮膚を構成する繊維芽細胞の増殖を、他の異種(魚類等)のコラーゲンには有しない親和性および構造の類似性により推進し、前記繊維芽細胞を効果的に保護し、皮膚の保湿性を高く維持することができる。
【0021】
また、ヒトコラーゲンの低分子化生成物ゼラチンは、皮膚の一部構造に浸透しやすいことから前記の如き保湿性が高く、皮膚の弾力性が増加し、皮膚の滑らかさが増強される。
【0022】
さらに、本発明に係るヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCは、後述のように、それぞれ特定のアミノ酸配列およびDNA配列を有し、保湿性、繊維芽細胞の増殖において著しく顕著な効果を奏する。
【0023】
また、ヒトの皮膚上でヒアルロン酸等の保湿剤との共存により、保湿性をさらに増加させることができる。
【0024】
ヒトコラーゲンは、抗酸化物質との共存により、皮膚の抗加齢的な効果を奏する。カプサイシン、ミント等の皮膚からの刺戟により脂肪細胞を燃焼させる抗肥満物質とヒトコラーゲンは、その優れた浸透性から著しい相乗効果を奏する。
【0025】
また、抗ストレス物質との相乗効果が認められるので前記精油との共存作用により効果的に心身の疲労および精神的ストレスを軽減することができる。
【発明を実施するための最良の形態】
【0026】
次に本発明に係るヒトコラーゲン含有化粧料の配合成分について詳細に説明する。
1.ヒトコラーゲン
構造および構造上の特異点
本発明に係る化粧料の必須配合成分であるヒトコラーゲンの構造は、下記記載の通りである。
【0027】
ヒトコラーゲン遺伝子は、Homo sapiens Collagen Type I alpha I (COL1 A 1 ,NM000088)OriGene社、Rockville, MD,USA)を使用した。
【0028】
すなわち、本発明に係るヒトコラーゲン含有化粧料の配合成分としてのヒトコラーゲンのDNA配列は、ヒトコラーゲンI型遺伝子のスタートコドンから801番目までの終止コドンまでが発現可能なベクターに組み込まれている。この配列は、原型として、ベクターからベクターへ、細胞から細胞へ、またある生物から他の生物に受け継がれるものである。また、この配列は、修飾されていない作用をもつサブユニットまたは発現された生産物を構成する。すなわち、原型から修飾されていない細胞株や動物種のサブクローン、またDNAやRNAで発現する新規のプラスミドやベクター類、たんぱく質、ハイブリッド細胞から分泌された抗体を指す。
【0029】
さらに、前記の外、この配列の原型から生産された物質であれば、たんぱく質のいかなる形態または明らかに性質を変えた派生物質でも、この配列の生産物と見なされる。
前記ヒトコラーゲンI型(α鎖)のアミノ酸配列全長およびDNA配列全長を下記の通りに示す。
【0030】
配列表1
A.ヒト型コラーゲンI型(α鎖)のアミノ酸配列全長
MFSFVDLRLLLLLAATALLTHGQEEGQVEGQDEDIPPITCVQNGLRYHDRDVWKPEPCRICVCDNGKVLCDDVICDETKNCPGAEVPEGECCPVCPDGSESPTDQETTGVEGPKGDTGPRGPRGPAGPPGRDGIPGQPGLPGPPGPPGPPGPPGLGGNFAPQLSYGYDEKSTGGISVPGPMGPSGPRGLPGPPGAPGPQGFQGPPGEPGEPGASGPMGPRGPPGPPGKNGDDGEAGKPGRPGERGPPGPQGARGLPGTAGLPGMKGHRGFSGLDGAKGDAGPAGPKGEPGSPGENGAPGQMGPRGLPGERGRPGAPGPAGARGNDGATGAAGPPGPTGPAGPPGFPGAVGAKGEAGPQGPRGSEGPQGVRGEPGPPGPAGAAGPAGNPGADGQPGAKGANGAPGIAGAPGFPGARGPSGPQGPGGPPGPKGNSGEPGAPGSKGDTGAKGEPGPVGVQGPPGPAGEEGKRGARGEPGPTGLPGPPGERGGPGSRGFPGADGVAGPKGPAGERGSPGPAGPKGSPGEAGRPGEAGLPGAKGLTGSPGSPGPDGKTGPPGPAGQDGRPGPPGPPGARGQAGVMGFPGPKGAAGEPGKAGERGVPGPPGAVGPAGKDGEAGAQGPPGPAGPAGERGEQGPAGSPGFQGLPGPAGPPGEAGKPGEQGVPGDLGAPGPSGARGERGFPGERGVQGPPGPAGPRGANGAPGNDGAKGDAGAPGAPGSQGAPGLQGMPGERGAAGLPGPKGDRGDAGPKGADGSPGKDGVRGLTGPIGPPGPAGAPGDKGESGPSGPAGPTGARGAPGDRGEPGPPGPAGFAGPPGADGQPGAKGEPGDAGAKGDAGPPGPAGPAGPPGPIGNVGAPGAKGARGSAGPPGATGFPGAAGRVGPPGPSGNAGPPGPPGPAGKEGGKGPRGETGPAGRPGEVGPPGPPGPAGEKGSPGADGPAGAPGTPGPQGIAGQRGVVGLPGQRGERGFPGLPGPSGEPGKQGPSGASGERGPPGPMGPPGLAGPPGESGREGAPGAEGSPGRDGSPGAKGDRGETGPAGPPGAPGAPGAPGPVGPAGKSGDRGETGPAGPAGPVGPVGARGPAGPQGPRGDKGETGEQGDRGIKGHRGFSGLQGPPGPPGSPGEQGPSGASGPAGPRGPPGSAGAPGKDGLNGLPGPIGPPGPRGRTGDAGPVGPPGPPGPPGPPGPPSAGFDFSFLPQPPQEKAHDGGRYYRADDANVVRDRDLEVDTTLKSLSQQIENIRSPEGSRKNPARTCRDLKMCHSDWKSGEYWIDPNQGCNLDAIKVFCNMETGETCVYPTQPSVAQKNWYISKNPKDKRHVWFGESMTDGFQFEYGGQGSDPADVAIQLTFLRLMSTEASQNITYHCKNSVAYMDQQTGNLKKALLLQGSNEIEIRAEGNSRFTYSVTVDGCTSHTGAWGKTVIEYKTTKTSRLRIIDVAPLDVGAPDQEFGFDVGHVCFL*
【0031】
B.ヒト型コラーゲンI型(α鎖)のDNA酸配列全長
ATGTTCAGCTTTGTGGACCTCCGGCTCCTGCTCCTCTTAGCGGCCACCGCCCTCCTGACG
CACGGCCAAGAGGAAGGCCAAGTCGAGGGCCAAGACGAAGACATCCCACCAATCACCTGC
GTACAGAACGGCCTCAGGTACCATGACCGAGACGTGTGGAAACCCGAGCCCTGCCGGATC
TGCGTCTGCGACAACGGCAAGGTGTTGTGCGATGACGTGATCTGTGACGAGACCAAGAAC
TGCCCCGGCGCCGAAGTCCCCGAGGGCGAGTGCTGTCCCGTCTGCCCCGACGGCTCAGAG
TCACCCACCGACCAAGAAACCACCGGCGTCGAGGGACCCAAGGGAGACACTGGCCCCCGA
GGCCCAAGGGGACCCGCAGGCCCCCCTGGCCGAGATGGCATCCCTGGACAGCCTGGACTT
CCCGGACCCCCCGGACCCCCCGGACCTCCCGGACCCCCTGGCCTCGGAGGAAACTTTGCT
CCCCAGCTGTCTTATGGCTATGATGAGAAATCAACCGGAGGAATTTCCGTGCCTGGCCCC
ATGGGTCCCTCTGGTCCTCGTGGTCTCCCTGGCCCCCCTGGTGCACCTGGTCCCCAAGGC
TTCCAAGGTCCCCCTGGTGAGCCTGGCGAGCCTGGAGCTTCAGGTCCCATGGGTCCCCGA
GGTCCCCCAGGTCCCCCTGGAAAGAATGGAGATGATGGGGAAGCTGGAAAACCTGGTCGT
CCTGGTGAGCGTGGGCCTCCTGGGCCTCAGGGTGCTCGAGGATTGCCCGGAACAGCTGGC
CTCCCTGGAATGAAGGGACACAGAGGTTTCAGTGGTTTGGATGGTGCCAAGGGAGATGCT
GGTCCTGCTGGTCCTAAGGGTGAGCCTGGCAGCCCTGGTGAAAATGGAGCTCCTGGTCAG
ATGGGCCCCCGTGGCCTGCCTGGTGAGAGAGGTCGCCCTGGAGCCCCTGGCCCTGCTGGT
GCTCGTGGAAATGATGGTGCTACTGGTGCTGCCGGGCCCCCTGGTCCCACCGGCCCCGCT
GGTCCTCCTGGCTTCCCTGGTGCTGTTGGTGCTAAGGGTGAAGCTGGTCCCCAAGGGCCC
CGAGGCTCTGAAGGTCCCCAGGGTGTGCGTGGTGAGCCTGGCCCCCCTGGCCCTGCTGGT
GCTGCTGGCCCTGCTGGAAACCCTGGTGCTGATGGACAGCCTGGTGCTAAAGGTGCCAAT
GGTGCTCCTGGTATTGCTGGTGCTCCTGGCTTCCCTGGTGCCCGAGGCCCCTCTGGACCC
CAGGGCCCCGGCGGCCCTCCTGGTCCCAAGGGTAACAGCGGTGAACCTGGTGCTCCTGGC
AGCAAAGGAGACACTGGTGCTAAGGGAGAGCCTGGCCCTGTTGGTGTTCAAGGACCCCCT
GGCCCTGCTGGAGAGGAAGGAAAGCGAGGAGCTCGAGGTGAACCCGGACCCACTGGCCTG
CCCGGACCCCCTGGCGAGCGTGGTGGACCTGGTAGCCGTGGTTTCCCTGGCGCAGATGGT
GTTGCTGGTCCCAAGGGTCCCGCTGGTGAACGTGGTTCTCCTGGCCCTGCTGGCCCCAAA
GGATCTCCTGGTGAAGCTGGTCGTCCCGGTGAAGCTGGTCTGCCTGGTGCCAAGGGTCTG
ACTGGAAGCCCTGGCAGCCCTGGTCCTGATGGCAAAACTGGCCCCCCTGGTCCCGCCGGT
CAAGATGGTCGCCCCGGACCCCCAGGCCCACCTGGTGCCCGTGGTCAGGCTGGTGTGATG
GGATTCCCTGGACCTAAAGGTGCTGCTGGAGAGCCCGGCAAGGCTGGAGAGCGAGGTGTT
CCCGGACCCCCTGGCGCTGTCGGTCCTGCTGGCAAAGATGGAGAGGCTGGAGCTCAGGGA
CCCCCTGGCCCTGCTGGTCCCGCTGGCGAGAGAGGTGAACAAGGCCCTGCTGGCTCCCCC
GGATTCCAGGGTCTCCCTGGTCCTGCTGGTCCTCCAGGTGAAGCAGGCAAACCTGGTGAA
CAGGGTGTTCCTGGAGACCTTGGCGCCCCTGGCCCCTCTGGAGCAAGAGGCGAGAGAGGT
TTCCCTGGCGAGCGTGGTGTGCAAGGTCCCCCTGGTCCTGCTGGTCCCCGAGGGGCCAAC
GGTGCTCCCGGCAACGATGGTGCTAAGGGTGATGCTGGTGCCCCTGGAGCTCCCGGTAGC
CAGGGCGCCCCTGGCCTTCAGGGAATGCCTGGTGAACGTGGTGCAGCTGGTCTTCCAGGG
CCTAAGGGTGACAGAGGTGATGCTGGTCCCAAAGGTGCTGATGGCTCTCCTGGCAAAGAT
GGCGTCCGTGGTCTGACCGGCCCCATTGGTCCTCCTGGCCCTGCTGGTGCCCCTGGTGAC
AAGGGTGAAAGTGGTCCCAGCGGCCCTGCTGGTCCCACTGGAGCTCGTGGTGCCCCCGGA
GACCGTGGTGAGCCTGGTCCCCCCGGCCCTGCTGGCTTTGCTGGCCCCCCTGGTGCTGAC
GGCCAACCTGGTGCTAAAGGCGAACCTGGTGATGCTGGTGCTAAAGGCGATGCTGGTCCC
CCTGGCCCTGCCGGACCCGCTGGACCCCCTGGCCCCATTGGTAATGTTGGTGCTCCTGGA
GCCAAAGGTGCTCGCGGCAGCGCTGGTCCCCCTGGTGCTACTGGTTTCCCTGGTGCTGCT
GGCCGAGTCGGTCCTCCTGGCCCCTCTGGAAATGCTGGACCCCCTGGCCCTCCTGGTCCT
GCTGGCAAAGAAGGCGGCAAAGGTCCCCGTGGTGAGACTGGCCCTGCTGGACGTCCTGGT
GAAGTTGGTCCCCCTGGTCCCCCTGGCCCTGCTGGCGAGAAAGGATCCCCTGGTGCTGAT
GGTCCTGCTGGTGCTCCTGGTACTCCCGGGCCTCAAGGTATTGCTGGACAGCGTGGTGTG
GTCGGCCTGCCTGGTCAGAGAGGAGAGAGAGGCTTCCCTGGTCTTCCTGGCCCCTCTGGT
GAACCTGGCAAACAAGGTCCCTCTGGAGCAAGTGGTGAACGTGGTCCCCCTGGTCCCATG
GGCCCCCCTGGATTGGCTGGACCCCCTGGTGAATCTGGACGTGAGGGGGCTCCTGGTGCC
GAAGGTTCCCCTGGACGAGACGGTTCTCCTGGCGCCAAGGGTGACCGTGGTGAGACCGGC
CCCGCTGGACCCCCTGGTGCTCCTGGTGCTCCTGGTGCCCCTGGCCCCGTTGGCCCTGCT
GGCAAGAGTGGTGATCGTGGTGAGACTGGTCCTGCTGGTCCCGCCGGTCCTGTCGGCCCT
GTTGGCGCCCGTGGCCCCGCCGGACCCCAAGGCCCACGTGGTGACAAGGGTGAGACAGGC
GAACAGGGCGACAGAGGCATAAAGGGTCACCGTGGCTTCTCTGGCCTCCAGGGTCCCCCT
GGCCCTCCTGGCTCTCCTGGTGAACAAGGTCCCTCTGGAGCCTCTGGTCCTGCTGGTCCC
CGAGGTCCCCCTGGCTCTGCTGGTGCTCCTGGCAAAGATGGACTCAACGGTCTCCCTGGC
CCCATTGGGCCCCCTGGTCCTCGCGGTCGCACTGGTGATGCTGGTCCTGTTGGTCCCCCC
GGCCCTCCTGGACCTCCTGGTCCCCCTGGTCCTCCCAGCGCTGGTTTCGACTTCAGCTTC
CTGCCCCAGCCACCTCAAGAGAAGGCTCACGATGGTGGCCGCTACTACCGGGCTGATGAT
GCCAATGTGGTTCGTGACCGTGACCTCGAGGTGGACACCACCCTCAAGAGCCTGAGCCAG
CAGATCGAGAACATCCGGAGCCCAGAGGGCAGCCGCAAGAACCCCGCCCGCACCTGCCGT
GACCTCAAGATGTGCCACTCTGACTGGAAGAGTGGAGAGTACTGGATTGACCCCAACCAA
GGCTGCAACCTGGATGCCATCAAAGTCTTCTGCAACATGGAGACTGGTGAGACCTGCGTG
TACCCCACTCAGCCCAGTGTGGCCCAGAAGAACTGGTACATCAGCAAGAACCCCAAGGAC
AAGAGGCATGTCTGGTTCGGCGAGAGCATGACCGATGGATTCCAGTTCGAGTATGGCGGC
CAGGGCTCCGACCCTGCCGATGTGGCCATCCAGCTGACCTTCCTGCGCCTGATGTCCACC
GAGGCCTCCCAGAACATCACCTACCACTGCAAGAACAGCGTGGCCTACATGGACCAGCAG
ACTGGCAACCTCAAGAAGGCCCTGCTCCTCCAGGGCTCCAACGAGATCGAGATCCGCGCC
GAGGGCAACAGCCGCTTCACCTACAGCGTCACTGTCGATGGCTGCACGAGTCACACCGGA
GCCTGGGGCAAGACAGTGATTGAATACAAAACCACCAAGACCTCCCGCCTGCGCATCATC
GATGTGGCCCCCTTGGACGTTGGTGCCCCAGACCAGGAATTCGGCTTCGACGTTGGCCAT
GTCTGCTTCCTGTAA
【0032】
本発明に係るヒトコラーゲン含有化粧料のヒトコラーゲン成分としては、前記のアミノ酸配列全長およびDNA配列全長を有するヒトコラーゲンおよび該ヒトコラーゲンから分画された少なくとも下記の2種のヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCが、特に、ヒト繊維芽細胞の増殖効果をはじめ、後述の品質性能に優れる点で好適である。かかるヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCのアミノ酸配列とDNA配列は、下記の配列表2に示す通りのものである。
【0033】
すなわち、ヒトコラーゲンペプチドBは、配列表1に示すアミノ酸配列全長を有するヒトコラーゲンI型(α鎖)のアミノ酸配列681番Fから828番Eの198個のアミノ酸からなるアミノ酸配列を分画してなるものであり、また、DNA配列としては、前記ヒトコラーゲンI型(α鎖)のDNA全長配列の1891番Aから2484Aまでの594塩基を分画したものである。また、ヒトコラーゲンペプチドCは、前記ヒトコラーゲンI型(α鎖)のアミノ酸配列全長の264番Kから400番Nまでの136個のアミノ酸からなるアミノ酸配列の分画したものであり、また、DNA配列としては、798番Aから1200番Tまでの408塩基を含有するものである。該当する配列については、下線を付して示す。
【0034】
配列表2
A.ヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCのアミノ酸配列
MFSFVDLRLLLLLAATALLTHGQEEGQVEGQDEDIPPITCVQNGLRYHDRDVWKPEPCRICVCDNGKVLCDDVICDETKNCPGAEVPEGECCPVCPDGSESPTDQETTGVEGPKGDTGPRGPRGPAGPPGRDGIPGQPGLPGPPGPPGPPGPPGLGGNFAPQLSYGYDEKSTGGISVPGPMGPSGPRGLPGPPGAPGPQGFQGPPGEPGEPGASGPMGPRGPPGPPGKNGDDGEAGKPGRPGERGPPGPQGARGLPGTAGLPGMKGHRGFSGLDGAKGDAGPAGPKGEPGSPGENGAPGQMGPRGLPGERGRPGAPGPAGARGNDGATGAAGPPGPTGPAGPPGFPGAVGAKGEAGPQGPRGSEGPQGVRGEPGPPGPAGAAGPAGNPGADGQPGAKGANGAPGIAGAPGFPGARGPSGPQGPGGPPGPKGNSGEPGAPGSKGDTGAKGEPGPVGVQGPPGPAGEEGKRGARGEPGPTGLPGPPGERGGPGSRGFPGADGVAGPKGPAGERGSPGPAGPKGSPGEAGRPGEAGLPGAKGLTGSPGSPGPDGKTGPPGPAGQDGRPGPPGPPGARGQAGVMGFPGPKGAAGEPGKAGERGVPGPPGAVGPAGKDGEAGAQGPPGPAGPAGERGEQGPAGSPGFQGLPGPAGPPGEAGKPGEQGVPGDLGAPGPSGARGERGFPGERGVQGPPGPAGPRGANGAPGNDGAKGDAGAPGAPGSQGAPGLQGMPGERGAAGLPGPKGDRDGAGPKGADGSPGKDGVRGLTGPIGPPGPAGAPGDKGESGPSGPAGPTGARGAPGDRGEPGPPGPAGFAGPPGADGQPGAKGEPGDAGAKGDAGPPGPAGPAGPPGPIGNVGAPGAKGARGSAGPPGATGFPGAAGRVGPPGPSGNAGPPGPPGPAGKEGGKGPRGETGPAGRPGEVGPPGPPGPAGEKGSPGADGPAGAPGTPGPQGIAGQRGVVGLPGQRGERGFPGLPGPSGEPGKQGPSGASGERGPPGPMGPPGLAGPPGESGREGAPGAEGSPGRDGSPGAKGDRGETGPAGPPGAPGAPGAPGPVGPAGKSGDRGETGPAGPAGPVGPVGARGPAGPQGPRDGKGETGEQGDRGIKGHRGFSGLQGPPGPPGSPGEQGPSGASGPAGPRGPPGSAGAPGKDGLNGLPGPIGPPGPRGRTGDAGPVGPPGPPGPPGPPGPPSAGFDFSFLPQPPQEKAHDGGRYYRADDANVVRDRDLEVDTTLKSLSQQIENIRSPEGSRKNPARTCRDLKMCHSDWKSGEYWIDPNQGCNLDAIKVFCNMETGETCVYPTQPSVAQKNWYISKNPKDKRHVWFGESMTDGFQFEYGGQGSDPADVAIQLTFLRLMSTEASQNITYHCKNSVAYMDQQTGNLKKALLLQGSNEIEIRAEGNSRFTYSVTVDGCTSHTGAWGKTVIEYKTTKTSRLRIIDVAPLDVGAPDQEFGFDVGHVCFLTAA
[配列の説明]
ペプチドC(136アミノ酸)の配列:配列上部の下線部文字
ペプチドB(198アミノ酸)の配列:配列下部の下線部文字
【0035】
B.ヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCのDNA配列
ATGTTCAGCTTTGTGGACCTCCGGCTCCTGCTCCTCTTAGCGGCCACCGCCCTCCTGACG
CACGGCCAAGAGGAAGGCCAAGTCGAGGGCCAAGACGAAGACATCCCACCAATCACCTGC
GTACAGAACGGCCTCAGGTACCATGACCGAGACGTGTGGAAACCCGAGCCCTGCCGGATC
TGCGTCTGCGACAACGGCAAGGTGTTGTGCGATGACGTGATCTGTGACGAGACCAAGAAC
TGCCCCGGCGCCGAAGTCCCCGAGGGCGAGTGCTGTCCCGTCTGCCCCGACGGCTCAGAG
TCACCCACCGACCAAGAAACCACCGGCGTCGAGGGACCCAAGGGAGACACTGGCCCCCGA
GGCCCAAGGGGACCCGCAGGCCCCCCTGGCCGAGATGGCATCCCTGGACAGCCTGGACTT
CCCGGACCCCCCGGACCCCCCGGACCTCCCGGACCCCCTGGCCTCGGAGGAAACTTTGCT
CCCCAGCTGTCTTATGGCTATGATGAGAAATCAACCGGAGGAATTTCCGTGCCTGGCCCC
ATGGGTCCCTCTGGTCCTCGTGGTCTCCCTGGCCCCCCTGGTGCACCTGGTCCCCAAGGC
TTCCAAGGTCCCCCTGGTGAGCCTGGCGAGCCTGGAGCTTCAGGTCCCATGGGTCCCCGA
GGTCCCCCAGGTCCCCCTGGAAAGAATGGAGATGATGGGGAAGCTGGAAAACCTGGTCGT
CCTGGTGAGCGTGGGCCTCCTGGGCCTCAGGGTGCTCGAGGATTGCCCGGAACAGCTGGC
CTCCCTGGAATGAAGGGACACAGAGGTTTCAGTGGTTTGGATGGTGCCAAGGGAGATGCT
GGTCCTGCTGGTCCTAAGGGTGAGCCTGGCAGCCCTGGTGAAAATGGAGCTCCTGGTCAG
ATGGGCCCCCGTGGCCTGCCTGGTGAGAGAGGTCGCCCTGGAGCCCCTGGCCCTGCTGGT
GCTCGTGGAAATGATGGTGCTACTGGTGCTGCCGGGCCCCCTGGTCCCACCGGCCCCGCT
GGTCCTCCTGGCTTCCCTGGTGCTGTTGGTGCTAAGGGTGAAGCTGGTCCCCAAGGGCCC
CGAGGCTCTGAAGGTCCCCAGGGTGTGCGTGGTGAGCCTGGCCCCCCTGGCCCTGCTGGT
GCTGCTGGCCCTGCTGGAAACCCTGGTGCTGATGGACAGCCTGGTGCTAAAGGTGCCAAT
GGTGCTCCTGGTATTGCTGGTGCTCCTGGCTTCCCTGGTGCCCGAGGCCCCTCTGGACCC
CAGGGCCCCGGCGGCCCTCCTGGTCCCAAGGGTAACAGCGGTGAACCTGGTGCTCCTGGC
AGCAAAGGAGACACTGGTGCTAAGGGAGAGCCTGGCCCTGTTGGTGTTCAAGGACCCCCT
GGCCCTGCTGGAGAGGAAGGAAAGCGAGGAGCTCGAGGTGAACCCGGACCCACTGGCCTG
CCCGGACCCCCTGGCGAGCGTGGTGGACCTGGTAGCCGTGGTTTCCCTGGCGCAGATGGT
GTTGCTGGTCCCAAGGGTCCCGCTGGTGAACGTGGTTCTCCTGGCCCTGCTGGCCCCAAA
GGATCTCCTGGTGAAGCTGGTCGTCCCGGTGAAGCTGGTCTGCCTGGTGCCAAGGGTCTG
ACTGGAAGCCCTGGCAGCCCTGGTCCTGATGGCAAAACTGGCCCCCCTGGTCCCGCCGGT
CAAGATGGTCGCCCCGGACCCCCAGGCCCACCTGGTGCCCGTGGTCAGGCTGGTGTGATG
GGATTCCCTGGACCTAAAGGTGCTGCTGGAGAGCCCGGCAAGGCTGGAGAGCGAGGTGTT
CCCGGACCCCCTGGCGCTGTCGGTCCTGCTGGCAAAGATGGAGAGGCTGGAGCTCAGGGA
CCCCCTGGCCCTGCTGGTCCCGCTGGCGAGAGAGGTGAACAAGGCCCTGCTGGCTCCCCC
GGATTCCAGGGTCTCCCTGGTCCTGCTGGTCCTCCAGGTGAAGCAGGCAAACCTGGTGAA
CAGGGTGTTCCTGGAGACCTTGGCGCCCCTGGCCCCTCTGGAGCAAGAGGCGAGAGAGGT
TTCCCTGGCGAGCGTGGTGTGCAAGGTCCCCCTGGTCCTGCTGGTCCCCGAGGGGCCAAC
GGTGCTCCCGGCAACGATGGTGCTAAGGGTGATGCTGGTGCCCCTGGAGCTCCCGGTAGC
CAGGGCGCCCCTGGCCTTCAGGGAATGCCTGGTGAACGTGGTGCAGCTGGTCTTCCAGGG
CCTAAGGGTGACAGAGGTGATGCTGGTCCCAAAGGTGCTGATGGCTCTCCTGGCAAAGAT
GGCGTCCGTGGTCTGACCGGCCCCATTGGTCCTCCTGGCCCTGCTGGTGCCCCTGGTGAC
AAGGGTGAAAGTGGTCCCAGCGGCCCTGCTGGTCCCACTGGAGCTCGTGGTGCCCCCGGA
GACCGTGGTGAGCCTGGTCCCCCCGGCCCTGCTGGCTTTGCTGGCCCCCCTGGTGCTGAC
GGCCAACCTGGTGCTAAAGGCGAACCTGGTGATGCTGGTGCTAAAGGCGATGCTGGTCCC
CCTGGCCCTGCCGGACCCGCTGGACCCCCTGGCCCCATTGGTAATGTTGGTGCTCCTGGA
GCCAAAGGTGCTCGCGGCAGCGCTGGTCCCCCTGGTGCTACTGGTTTCCCTGGTGCTGCT
GGCCGAGTCGGTCCTCCTGGCCCCTCTGGAAATGCTGGACCCCCTGGCCCTCCTGGTCCT
GCTGGCAAAGAAGGCGGCAAAGGTCCCCGTGGTGAGACTGGCCCTGCTGGACGTCCTGGT
GAAGTTGGTCCCCCTGGTCCCCCTGGCCCTGCTGGCGAGAAAGGATCCCCTGGTGCTGAT
GGTCCTGCTGGTGCTCCTGGTACTCCCGGGCCTCAAGGTATTGCTGGACAGCGTGGTGTG
GTCGGCCTGCCTGGTCAGAGAGGAGAGAGAGGCTTCCCTGGTCTTCCTGGCCCCTCTGGT
GAACCTGGCAAACAAGGTCCCTCTGGAGCAAGTGGTGAACGTGGTCCCCCTGGTCCCATG
GGCCCCCCTGGATTGGCTGGACCCCCTGGTGAATCTGGACGTGAGGGGGCTCCTGGTGCC
GAAGGTTCCCCTGGACGAGACGGTTCTCCTGGCGCCAAGGGTGACCGTGGTGAGACCGGC
CCCGCTGGACCCCCTGGTGCTCCTGGTGCTCCTGGTGCCCCTGGCCCCGTTGGCCCTGCT
GGCAAGAGTGGTGATCGTGGTGAGACTGGTCCTGCTGGTCCCGCCGGTCCTGTCGGCCCT
GTTGGCGCCCGTGGCCCCGCCGGACCCCAAGGCCCACGTGGTGACAAGGGTGAGACAGGC
GAACAGGGCGACAGAGGCATAAAGGGTCACCGTGGCTTCTCTGGCCTCCAGGGTCCCCCT
GGCCCTCCTGGCTCTCCTGGTGAACAAGGTCCCTCTGGAGCCTCTGGTCCTGCTGGTCCC
CGAGGTCCCCCTGGCTCTGCTGGTGCTCCTGGCAAAGATGGACTCAACGGTCTCCCTGGC
CCCATTGGGCCCCCTGGTCCTCGCGGTCGCACTGGTGATGCTGGTCCTGTTGGTCCCCCC
GGCCCTCCTGGACCTCCTGGTCCCCCTGGTCCTCCCAGCGCTGGTTTCGACTTCAGCTTC
CTGCCCCAGCCACCTCAAGAGAAGGCTCACGATGGTGGCCGCTACTACCGGGCTGATGAT
GCCAATGTGGTTCGTGACCGTGACCTCGAGGTGGACACCACCCTCAAGAGCCTGAGCCAG
CAGATCGAGAACATCCGGAGCCCAGAGGGCAGCCGCAAGAACCCCGCCCGCACCTGCCGT
GACCTCAAGATGTGCCACTCTGACTGGAAGAGTGGAGAGTACTGGATTGACCCCAACCAA
GGCTGCAACCTGGATGCCATCAAAGTCTTCTGCAACATGGAGACTGGTGAGACCTGCGTG
TACCCCACTCAGCCCAGTGTGGCCCAGAAGAACTGGTACATCAGCAAGAACCCCAAGGAC
AAGAGGCATGTCTGGTTCGGCGAGAGCATGACCGATGGATTCCAGTTCGAGTATGGCGGC
CAGGGCTCCGACCCTGCCGATGTGGCCATCCAGCTGACCTTCCTGCGCCTGATGTCCACC
GAGGCCTCCCAGAACATCACCTACCACTGCAAGAACAGCGTGGCCTACATGGACCAGCAG
ACTGGCAACCTCAAGAAGGCCCTGCTCCTCCAGGGCTCCAACGAGATCGAGATCCGCGCC
GAGGGCAACAGCCGCTTCACCTACAGCGTCACTGTCGATGGCTGCACGAGTCACACCGGA
GCCTGGGGCAAGACAGTGATTGAATACAAAACCACCAAGACCTCCCGCCTGCGCATCATC
GATGTGGCCCCCTTGGACGTTGGTGCCCCAGACCAGGAATTCGGCTTCGACGTTGGCCAT
GTCTGCTTCCTGTAA
[配列の説明]
ペプチドCのDNA配列(408bp):配列上部の下線部文字
ペプチドBのDNA配列(594bp):配列下部の下線部文字
【0036】
また、本発明に係るヒトコラーゲン含有化粧料の必須配合成分であるヒトコラーゲンの好ましい成分の第二の特異性は、従来提案されてきたヒトコラーゲンに比較して分子量が特定範囲に制御された点にある。すなわち、具体的には、ヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCのSDS−ポリアクリルアミドゲル電気泳動法により測定した分子量が21〜50kDaであり、好ましくは28kDa〜45kDaである。
【0037】
分子量が21kDaに達しないと、ある特定の構造が存在しないこととなり、一方、50kDaを超えると、構造上の効果が限界になり、特性が向上しないという難点が生ずるおそれがある。
【0038】
かかるヒトコラーゲンの分子量の制御は、その製造方法において、プロモーター遺伝子として、ウィルス系の遺伝子を改造したものを使用したことによるものであるが、これに限定されるものではない。
【0039】
ヒトコラーゲンの製造方法
前記の如き構造の本発明に係るヒトコラーゲンは、下記記載の方法により製造することができる。
【0040】
すなわち、
該ヒトコラーゲン遺伝子のcDNAの5‘末端にフィブロイン鎖との融合したベクターを構築し、これにTTAA特異性トランスポゾンpiggyBac法を用いて、前胚盤葉期の蚕Pnd-w1種(生物資源研究所)の卵に注入した。のち孵化した幼虫を成虫に飼育して、交配し次世代蚕の卵を収穫した。緑色蛍光たんぱく質のマーカーを利用して、該コラーゲン遺伝子を持つトランスジェニック蚕を選別した。
【0041】
本製造方法は、基本的にはT.Tamura等による蚕の後部絹糸腺で合成されるたんぱく質の遺伝子を利用して、目的のたんぱく質を繭のたんぱく質とともに発現させかつ分泌させる方法によっている。本製造方法では、ヒトコラーゲンの効率的な生産を目的として特化し、T.Tamura等による方法を改変したものである。
T.Tamura et al,.Nature Biotechnology 18 (2000)81-84
【0042】
選別されたヒトコラーゲン遺伝子を発現する蚕は、この後部絹糸腺で合成された組換え融合たんぱく質を絹糸腺内腔に分泌される。この分泌されたフィブロインたんぱく質とともに該コラーゲンたんぱく質も繭の中に分泌される。
【0043】
この繭からリチウムチオシアネートによりたんぱく質を抽出し、ウエスターン・ブロンテイング方法と電気永動により、ヒトコラーゲンを検出することができる。
産生されたたんぱく質ないしペプチドは、キモトリプシン酵素処理されたのち、DEAEカラムによる液体クロマトグラフィーを用いてコラーゲンを精製した。精製されたたんぱく質ないしペプチドは、硫安塩析により沈澱させ濃縮した。処理後、水溶性ペプチドを集め、凍結乾燥すればよい。
ヒトコラーゲンの純度は、基準品ヒトコラーゲンとの電気泳動のパターンにより測定することができる。
【0044】
ヒトコラーゲンペプチドBおよびCの製造方法
当該2種のヒトコラーゲンペプチドは、本発明に係るヒトコラーゲン全体(139kDa)よりも4分の1から5分の1の大きさであるが、コラーゲン分子の製造方法と同様に蚕(カイコ)による当該製造方法を用いることが可能である。この場合、ぺプチドB遺伝子およびペプチドC遺伝子は次のような挿入方法によってプラスミドに導入される。
目的遺伝子を市販の発現用プラスミドpPIC9K(インヴィトロゲン社、米 加州)のプロモター遺伝子3‘AOX1(TT)に隣接する制限酵素部位EcoRIおよびNotIを両端として、挿入する。目的遺伝子の挿入の確認は、カナマイシンの存在下の培地中でスクリーニングし、挿入後のプラスミドの大きさをSDS-PAGEの電気泳動によって確認することができる。このペプチドBないしCの遺伝子から構成されるプラスミドの発現は、緑色蛍光たんぱく質遺伝子の導入により、蚕の卵中で確認することができる。繭のたんぱく質として生産されたペプチド分画は、該コラーゲンの抽出方法により分離する。また、DEAEセルロースを担体とする液体クロマトグラフィーによる0.01M-0.85M Naリン酸緩衝液の濃度勾配法により、粗の2つのペプチドの分画を分離し、それぞれの分画を再度DEAEセルロースの液体クロマトグラフィーによるNaリン酸緩衝液により精製される。
【0045】
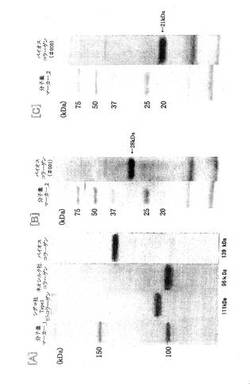
精製されたペプチドは、SDS-PAGE電気泳動により純度を常に標準分子量マーカーにより該分子の大きさから判断さすることができる。図−5の電気泳動図に示された分子量を参照。
【0046】
2.化粧料材料
本発明に係るヒトコラーゲン含有化粧料は、必須成分のヒトコラーゲンを化粧料材料に配合してなるものであり、配合成分としての化粧料材料について説明する。
化粧料材料は、具体的には下記の通り、通常の化粧料に使用される各種成分および添加剤の群から用途に適したものをヒトコラーゲンの作用を阻害しない範囲または相乗効果が得られる範囲で、任意に選択することができる。
【0047】
各種成分としては、アルコール類、脂肪酸類、エステル類、油脂、水溶性高分子化合物、界面活性剤、無機顔料、紫外線吸収剤、角質溶解剤、酸化防止剤、ビタミン類、収斂剤、美白剤、動植物抽出剤、金属イオン封鎖剤等の一般に知られている下記記載のものを挙げることができる。
【0048】
また、溶剤として精製水を使用することができ、アルコール類、多価アルコール類等については、下記記載のなかから適宜選択することができる。油脂類としては、例えば、ヒマシ油、綿実油、落花生油、タートル油、アーモンド油、エゴマ油、オリブ油、オレンジ油、オレンジラファー油、ゴマ油、カカオ脂、カミツレ油、キャロット油、キューカンバー油、牛脂脂肪酸、ククイナッツ油、サフラワー油、大豆油、ツバキ油、トウモロコシ油、ナタネ油、ミンク油、卵黄油、カカオ脂、パーム油、モクロウ、ヤシ油、牛脂、豚脂またはこれら油脂類の水素化物を挙げることができる。
【0049】
アルコール類としては、エタノール、イソプロパノール、プタノール、セタノール、ラウリルアルコール、ステアリルアルコール、イソステアリルアルコール、オレイルアルコール、ラノリンアルコール、コレステロール、、2−ヘキシルデカノール、イソステアリルアルコール、2−オクチルドデカノール、エチレングリコール、ジエチレングリコール、トリエチレングリコール、エチレングリコールモノエチルエーテル、エチレングリコールモノブチルエーテル、ジエチレングリコールモノメチルエーテル、ジエチレングリコールモノエチルエーテル、ポリオキシエチレンセチルエーテル、ポリオキシエチレンラウリルエーテル、ポリオキシエチレンオレイル、ポリエチレングリコール、プロピレングリコール、ポリプロピレングリコール、1,3−ブチレングリコール、グリセリン、ペンタエリトリトール、ソルビトール、マンニトール等を挙げることができる。
【0050】
ロウ類としては、ミツロウ、カルナバロウ、鯨ロウ、ラノリン、カンデリラロウ、モンタンロウ、セラックロウ等を挙げることができる。
【0051】
鉱物油類として、流動パラフィン、ワセリン、パラフィン、セレシン、マイクロクリスタンワックス、スクワレン、スクワラン、プリスタン等が、また、脂肪酸として、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、ベヘン酸、オレイン酸、12-ヒドロキシステアリン酸、ウンデシレン酸、トール油、ラノリン脂肪酸、イソノナン酸、カプロン酸、2−エチルブタン酸、イソペンタン酸、2−メチルペンタン酸、2−エチルヘキサン酸、イソペンタン酸等を挙げることができる。
【0052】
エステル類としては、ミリスチン酸イソプロピル、パルミチン酸イソプロピル、ステアリン酸ブチル、ラウリン酸ヘキシル、ミリスチン酸ミリスチル、オレイン酸オレイル、オレイン酸デシル、ミリスチン酸オクチルドデシル、ジメチルオクタン酸ヘキシルデシル、乳酸セチル、乳酸ミリスチル、フタル酸ジエチル、フタル酸ジブチル、酢酸ラノリン、モノステアリン酸エチレングリコール、モノステアリン酸プロピレングリコール、モノステアリン酸ソルビタン、グリセリンモノステアレート、ジオレイン酸プロピレングリコールなどのエステル等を挙げることができる。
【0053】
界面活性剤としては、アルキルカルボン酸塩、アルキルスルホン酸塩、アルキル硫酸エステル塩、アルキルリン酸エステル塩等の陰イオン性界面活性剤があり、アルキルアミン塩、アルキル四級アンモニウム塩等のカチオン界面活性剤、カルボン酸型両性界面活性剤、硫酸エステル型両性界面活性剤、スルホン酸型両性界面活性剤、リン酸エステル型両性界面活性剤、エーテル型非イオン界面活性剤、エーテルエステル型非イオン界面活性剤、エステル型非イオン界面活性剤、含窒素型非イオン界面活性剤、その他の界面活性剤等を挙げることができる。
【0054】
さらには、α−ヒドロキシ酸としてはグリコール酸、クエン酸等を、また、無水ケイ酸、ケイ酸マグネシウム、タルク、ベントナイト、マイカ、雲母チタン、等の無機酸化物を挙げることができる。
【0055】
水溶性高分子化合物としては、アラビアゴム、ベンゾインゴム、寒天、カゼイン、乳糖、果糖、ショ糖及びそのエステル、トレハロース及びその誘導体、デキストリン、ゼラチン、ペクチン、デンプン、カラギーナン、キトサン、キトサン塩、ヒアルロン酸及びその塩、コンドロイチン硫酸及びその塩、ヘパリン、エチルセルロース、メチルセルロース、カルボキシメチルセルロース、ポリビニルアルコール、ポリビニルメチルエーテル、ポリビニルピロリドン、ポリビニルメタアクリレート、カルボキシビニルポリマー、ポリエチレンイミン等を挙げることができる。
【0056】
ビタミン類としては、レチノール、レチナール(ビタミンA1)、デヒドロレチナール(ビタミンA2)、カロチン、リコピン(プロビタミンA)、チアミン塩酸塩、チアミン硫酸塩(ビタミンB1)、リボフラビン(ビタミンB2)、ピリドキシン(ビタミンB6)、シアノコバラミン(ビタミンB12)等を挙げることができる。
【0057】
紫外線吸収・遮断剤としては、p-アミノ安息香酸誘導体、サルチル酸誘導体、ベンゾトリアゾール誘導体、ジオキサン誘導体、カンファー誘導体、ビタミンB6誘導体、ベンゾフェノン類、オキシベンゾン、タルク、カオリン等を挙げることができる。
【0058】
収斂剤としては、ハイドロキノンモノベンジルエーテル、ハイドロキノン、乳酸菌エキス、ビタミンA、ビタミンE、酵母エキス等を挙げることができる。
【0059】
酸化防止剤としては、SOD、カタラーゼ、グルタチオンパーオキシダーゼなどの活性酸素消去剤、ブチルヒドロキシトルエン(BHT)、ブチルヒドロキシアニソール(BHA)等を挙げることができる。
【0060】
殺菌・消毒剤として、アクリノール、イオウ、塩化ベンザルコニウム、塩化ベンゼトニウム、塩化メチルロザニリン、クレゾール等を挙げることができる。
【0061】
保湿剤として、さらに必要に応じグリセリン、プロピレングリコール、ポリエチレングリコール、1、3-ブチレングリコール、ヒアルロン酸等を挙げることができる。
【0062】
抗肥満物質として、カプサイシン、ミント等を挙げることができる。
【0063】
末梢血管血流促進剤として、ビタミンE及びその誘導体、センブリエキス、ニンニクエキス、人参エキス、アロエエキス等を挙げることができる。
【0064】
代謝活性剤として、ヒノキチオール、パントテン酸及びその誘導体等を挙げることができる。抗脂漏剤として、ピリドキシン及びその誘導体、イオウ、ビタミンB6等、角質溶解剤としては、レゾルシン、サリチル酸、乳酸等を挙げることができる。
【0065】
酸化剤として、過酸化水素水、過硫酸ナトリウム、過硫酸アンモニウム、過ホウ酸ナトリウム、過酸化尿素等を挙げることができる。
【0066】
防腐剤としては、エチルパラペン、ブチルパラペン等が挙げられる。
【0067】
微生物培養代謝物としては、酵母代謝物、酵母菌抽出エキス、米発酵エキス、米糠発酵エキス、ユーグレナ抽出物やトレハロースまたはその誘導体等を挙げることができる。
【0068】
その他、ホルモン類、金属イオン封鎖剤、pH調整剤、キレート剤、清涼剤、安定化剤、乳化剤、動・植物性蛋白質及びその分解物、動・植物性多糖類及びその分解物、動・植物性糖蛋白質及びその分解物、血流促進剤、消炎剤・抗アレルギー剤、細胞賦活剤等が挙げられる。
【0069】
本発明に係るヒトコラーゲン含有化粧料は、ヒトコラーゲンと化粧料材料および溶剤等からなる組成物であり、前記ヒトコラーゲンは、粉体状、液体状の形態により化粧料材料および溶剤等と混合することによりヒトコラーゲン含有化粧料を調製することができる。
【0070】
前記ヒトコラーゲンの含有量は、化粧料の種類、用途により任意に決定することができるが、通常、0.1〜1質量%、好ましくは0.3〜0.8質量%の範囲で採用することができる。化粧料が化粧用クリームの場合、ヒトコラーゲンの含有量は、特に0.4〜0.5質量%の範囲が好ましい。
【実施例】
【0071】
次に、本発明について実施例および比較例により具体的に説明する。もっとも、本発明は、実施例等により限定されるものではない。
なお、本発明に係るヒトコラーゲン含有化粧料に用いるヒトコラーゲンペプチドおよび対照ヒトコラーゲンの測定に用いるSDS−PAGE電気泳動法、実施例および比較例において得られた化粧料の品質性能の評価方法は下記の通りである。
また、本発明に係るヒトコラーゲン含有化粧料の品質性能を評価するための比較対象材料として用いた他社製品は下記の通りである。
【0072】
A.SDS−PAGE電気泳動法
電気泳動装置として、Bio−Rad社Mini−PROTEAN3CELLを使用し、コラーゲン試料を10μg、それぞれ、25mMTris−Hcl(pH6.8)に溶解し、250V/30mAの電気泳動条件で60分間泳動した。
【0073】
B.化粧料の品質性能の評価方法
次の1〜5の試験法により評価した。
1.皮膚の保湿性効果の試験法
クリーム試料0.5グラムを、腕の皮膚に1日4回10時、12時、14時、16時、女性30歳代1名、40歳代2名、50歳代1名の計4名に塗布し、モリテックス社E−0016型アイセンサー水分計を用いて、皮膚の保湿性の増減を計測した。(n=16)
2.皮膚への粘弾性効果の試験法
クリーム試料0.5グラムを、腕の皮膚に1日4回10時、12時、14時、16時、女性30歳代1名、40歳代2名、50歳代1名の計4名に塗布し、キュートメータ(CK社製)を使用して、皮膚の弾性を増加させる効果を測定した。(n=16)
3.皮膚への形状変化の影響試験法
クリーム試料0.5グラムを、腕の皮膚に1日4回10時、12時、14時、16時、女性30歳代1名、40歳代2名、50歳代1名の計4名に塗布し、CCDカメラ(マイクロスクエア社、MS-40型)を使用して、皮膚表面の弾性を皮丘と皮溝の規則性を解析し、皮膚表面への調整機能を測定した。
4.ヒト繊維芽細胞増殖効果
サンヨー製MCO−17AIC型細胞培養器を用い、96ウエルのプラスチック容器に0.8mlMSDS(FX)培地4×103個の繊維芽細胞を播種し、72時間5%CO2のインキュベータ中、37℃で培養し、それぞれのクリーム試料0.5%(w/v)を添加して培養後細胞数をカウントした。
5.アンチエージング試験
クリーム試料を対象者女性4名の手の甲に塗布し60分後の皮膚の皮丘と皮溝の規則性をCCDカメラにより測定した。
【0074】
C.比較対照ヒトコラーゲン
1)シグマ社製コラーゲン
カタログ番号C5488Type1ヒトコラーゲンHuman Skin,Acid Solube Powder(純度95%以上)、CAS番号2007−34−5
前記SDS−PAGE電気泳動法による分子量; 111kDa
2)ネオシルク社製コラーゲン製品
ネオシルク社「ヒト組換ゼラチン」ロット番号09−RI
前記SDS−PAGE電気泳動法による分子量; 96kDa
【0075】
[製造例1]
ヒトコラーゲンの製造方法
ヒトコラーゲン遺伝子(ヒトコラーゲンI型の鎖の594個のDNA鎖を有する。)のcDNAの5‘末端にフィブロイン鎖との融合したベクターを構築し、これにTTAA特異性トランスポゾンpiggyBac法を用いて、前胚盤葉期の蚕Pnd-w1種(生物資源研究所)の卵に注入した。のち孵化した幼虫を成虫に飼育して、交配し次世代蚕の卵を収穫した。緑色蛍光たんぱく質のマーカーを利用して、該コラーゲン遺伝子を持つトランスジェニック蚕を選別した。
【0076】
選別されたヒトコラーゲン遺伝子を発現する蚕は、この後部絹糸腺で合成された組換え融合たんぱく質を絹糸腺内腔に分泌された。この分泌されたフィブロインたんぱく質とともに該コラーゲンたんぱく質も繭の中に分泌された。
【0077】
この繭からリチウムチオシアネートによりたんぱく質を抽出し、ウエスターン・ブロンテイング方法と電気泳動により、ヒトコラーゲンを検出した。
産生されたたんぱく質ないしペプチドは、キモトリプシン酵素処理されたのち、DEAEカラムによる液体クロマトグラフィーを用いてコラーゲンを精製した。精製されたたんぱく質ないしペプチドは、硫安塩析により沈澱させ濃縮した。処理後、水溶性ペプチドを集め、凍結乾燥すればよい。
【0078】
ヒトコラーゲンの純度は、基準品ヒトコラーゲンとの電気泳動のパターンにより測定もした。
得られたヒトコラーゲンは、配列表に示すDNA配列およびアミノ酸配列を有するものであり、SDS−PAGE電気泳動法による分子量は図5に示すように139kDaであった。
【0079】
図5には、バイオスコラーゲン、シグマ社ヒトコラーゲン、ネオシルク社ヒトコラーゲンを[A]区域に、バイオスコラーゲンペプチドBを[B]区域に、また、バイオスコラーゲンペプチドCを[C]区域に表示した。
【0080】
[製造例2]
ヒトコラーゲンペプチドのBおよびヒトコラーゲンペプチドCの製造方法
当該2種のコラーゲンペプチドは、コラーゲン全体(139kD)よりも4分の1から5分の1の大きさであるが、コラーゲン分子の製造方法と同様に蚕による当該製造方法を用いることが可能である。この場合、〔B〕 ぺプチド遺伝子および〔C〕ペプチド遺伝子は次のような挿入方法によってプラスミドに導入された。
【0081】
目的遺伝子を市販の発現用プラスミドpPIC9K(インヴィトロゲン社、米 加州)のプロモター遺伝子3‘AOX1(TT)に隣接する制限酵素部位EcoRIおよびNotIを両端として、挿入した。目的遺伝子の挿入の確認は、カナマイシンの存在下の培地中でスクリーニングし、挿入後のプラスミドの大きさをSDS-PAGEの電気泳動によって確認した。この〔B〕ないし〔C〕 ペプチドの遺伝子から構成されるプラスミドの発現は、緑色蛍光たんぱく質遺伝子の導入により、蚕の卵中で確認された。繭のたんぱく質として生産されたペプチド分画は、該コラーゲンの抽出方法により分離した。また、DEAEセルロースを担体とする液体クロマトグラフィーによる0.01M-0.85M Naリン酸緩衝液の濃度勾配法により、粗の2つのペプチドの分画を分離し、それぞれの分画を再度DEAEセルロースの液体クロマトグラフィーによるNaリン酸緩衝液により精製した。
【0082】
精製されたペプチドは、SDS-PAGE電気泳動により純度を常に標準分子量マーカーにより該分子の大きさから判断された。図5の電気泳動図に示された分子量を参
照。
【0083】
得られたヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCのDNA配列、アミノ酸配列およびSDS−PAGE電気泳動法による分子量をそれぞれ次に示す。
ペプチドB
DNA配列;594塩基(1891番Aから2484番Aまで)
アミノ酸配列;198個アミノ酸(681番Fから828番Eまで)
SDS−PAGE電気泳動法による分子量;28kDa
ペプチドC
DNA配列;408塩基(798番Aから1200番Tまで)
アミノ酸配列;136個アミノ酸(264番Kから400番Nまで)
SDS−PAGE電気泳動法による分子量;21kDa
【0084】
本発明に係るヒトコラーゲン(以下、「バイオスコラーゲン」ということがある。)、ヒトコラーゲンペプチドB、ヒトコラーゲンペプチドC、シグマ社製ヒトコラーゲン、ネオシルク社製ヒトコラーゲンのSDS−PAGE電気泳動法による分子量は、まとめると下表の通りである。
【0085】
SDS−PAGE電気泳動法による分子量
バイオスヒトコラーゲン 139
ペプチドB 28
ペプチドC 21
シグマ社ヒトコラーゲン 111
ネオシルク社ヒトコラーゲン 96
【0086】
[実施例1]
下記の(A)の各成分を混合した後、加熱し70℃とする。
下記の(B)の各成分を混合し、70℃に加熱、混合し、(A)成分に(B)成分を加えて乳化し、35℃まで冷却、下記の(C)成分を加えた。
質量%
(A)ワセリン 5.0
スクワラン 10.0
セタノール 8.0
ポリオキシエチレン(20)オレイルエーテル 1.4
モノステアリン酸ソルビタン 0.3
(B)エチルパラペン
プロピレングリコール
製造例2により調製したヒトコラーゲンペプチドB 0.5
精製水 75.4
(C)香料 0.2
【0087】
[実施例2]
(A)の各成分を混合し、80℃に加熱する。
(B)の各成分を混合し、80℃に加熱する。
(A)の成分に(B)の成分を加えて撹拌乳化し、その後35℃まで冷却した。
【0088】
質量%
(A)ポリオキシエチレン(30)セチルエーテル 2.0
グリセリンモノステアレート 10.0
流動パラフィン 10.0
ワセリン 4.0
セタノール 5.0
BHT 0.01
ユーヒドロキシ−4−メトキシベンゾフェノン 0.5
プチルパラベン 0.2
(B)製造例2により得られたヒトコラーゲンペプチドB 0.5
グリセリン 5.0
精製水 62.79
化粧用クリームの品質性能については、前記の方法により評価し、評価結果を下記に示す。
【0089】
[実施例3]
ヒトコラーゲンペプチドBを用いたこと以外、すべて実施例2と同一の成分・組織および同一の条件・操作により化粧クリームを調製した。化粧クリームの品質性能は、前記1〜5の方法に従い評価した。評価結果は下記に示す通りであった。
【0090】
[実施例4]
ヒトコラーゲンペプチドCを用いたこと以外、すべて実施例2と同一の成分・組織および同一の条件・操作により化粧クリームを調製した。品質性能の評価結果は下記に示す通りであった。
【0091】
[実施例5]
実施例3で調製したヒトコラーゲンペプチドB含有化粧クリーム(以下、「HUMANY(登録商標)と称することがある。」)にカプサイシン*を4質量%添加して化粧クリームを調製し、前記アンチエージング試験に供したところ、下表に示す結果を得た。
*和光純薬社製 品番084−11351
【0092】
[実施例6]
実施例3で調製した化粧クリーム「HUMANY」にペパーミント**を0.5質量%添加した化粧用クリームを調製し、前記アンチエージング試験に供したところ、下表に示す結果を得た。
**コネクト社製 製品番号 003−03
【0093】
[実施例7]
実施例3で調製した化粧クリーム「HUMANY」にカプサイシンを4質量%と、ペパーミント0.5質量%を添加した化粧用クリームを調製し、前記アンチエージング試験に供したところ、下表に示す結果を得た。
組 成 アンチエージング効果
HUMANY(実施例3) 20.0%(SD6.0)
HUMANYにカプサイシンを添加(実施例3) 28.3%(SD9.0)
HUMANYにペパーミントを添加(実施例6) 24.7%(SD8.8)
HUMANYにカプサイシンおよび
ペパーミントを添加(実施例7) 30.5%(SD9.4)
実施例2に示す組成のクリームからヒトコラーゲン
ペプチドBを除いたベースクリームにカプサイシン
およびペパーミントを添加(比較例6) 14.1%−15.9%
(SD5.2)
【0094】
[比較例1] ブタコラーゲン
製造例1により得られたヒトコラーゲンの代わりに市販(株式会社ニッピ社製 PS-1 NP20749)のブタコラーゲンを用いたこと以外、すべて実施例1と同一の方法で化粧用クリームを調製し、前記保湿性、粘弾性等の評価に供した。評価結果を図1〜4に示す。
【0095】
[比較例2] ウシコラーゲン
製造例1により得られたヒトコラーゲンの代わりに市販(株式会社ニッピ社製)のウシコラーゲンを用いたこと以外、すべて実施例2と同一の方法により化粧用クリームを調製し、前記保湿性、粘弾性等の評価に供した。評価結果を図1〜4に示す。
【0096】
[比較例3] サケコラーゲン
製造例1により得られるヒトコラーゲンの代わりに(株式会社ニッピ社製)サケコラーゲンを用いたこと以外すべて実施例1と同一の方法により化粧用クリームを調製し、前記アンチエージング試験に供した。評価結果を図4に示す。
【0097】
[比較例4]
製造例2で得られたヒトコラーゲンペプチドBの代わりに、シグマ社製コラーゲン製品(カタログ番号C5488 Human Skin,AcidSolible Powder(純度95%以上))を10mMK・リン酸緩衝液(pH7.4)に0.5質量%溶解したものを用いたこと以外、すべて実施例2と同一の組成による化粧用クリームを調製し、前記の品質性能の評価に供した。評価結果を下記に示す。
【0098】
[比較例5]
製造例2で得られたヒトコラーゲンペプチドBの代わりに、ネオシルク社製コラーゲン製品(「ヒト組換えゼラチン」ロット番号09−RI)10mMK・リン酸緩衝液(pH7.4)に0.5質量%溶解したものを用いたこと以外、すべて実施例2と同一の組成による化粧用クリームを調製し、前記の品質性能の評価に供した。評価結果を品質性能評価の欄[0089]に示す。
【0099】
[比較例6]
実施例2に記載のクリーム組成からヒトコラーゲンペプチドBを除いたベースクリームにカプサイシンを4質量%およびペパーミント0.5質量%添加し化粧用クリームを調製し、前記アンチエージング試験に供したところ、下表に示す結果を得た。
【0100】
実施例1〜4、比較例1〜5により調製した化粧用クリームを前記の皮膚の保湿性試験、皮膚の粘弾性試験、ヒト繊維芽細胞増殖試験、アンチエージング試験にそれぞれ供したところそれぞれ下記の結果を得た。
保湿性 粘弾性 ヒト繊維芽細胞増殖 アンチエーシ゛ンク゛
実施例1 160 155 135 195
比較例1 100 100 100 120
比較例2 105 85 90 105
比較例3 ― ― ― 110
【0101】
次に、本発明に係るヒトコラーゲンペプチドBを含有する化粧用クリーム(実施例3)、ヒトコラーゲンペプチドCを含有する化粧用クリーム(実施例4)、シグマ社製ヒトコラーゲン製品を含有する化粧用クリーム(比較例4)、ネオシルク社製ヒトコラーゲン製品を含有する化粧用クリーム(比較例5)について、前記の品質性能の評価に供した結果を下記の通り示す。
【0102】
1.皮膚の保湿性効果
1)本発明に係るヒトコラーゲンペプチドB含有クリーム 36.0%(SD5.0)
2)本発明に係るヒトコラーゲンペプチドC含有クリーム 34.6%(SD5.3)
3)シグマ社製ヒトコラーゲン含有クリーム 32.0%(SD5.2)
4)ネオシルク社製ヒトコラーゲン含有クリーム 28.6%(SD4.2)
【0103】
2.皮膚の粘弾性効果
1)本発明に係るヒトコラーゲンペプチドB含有クリーム 1.292%(SD0.6)
2)本発明に係るヒトコラーゲンペプチドC含有クリーム 1.112%(SD0.06)
3)シグマ社製ヒトコラーゲン含有クリーム 0.832%(SD0.04)
4)ネオシルク社製ヒトコラーゲン含有クリーム 0.790%(SD0.08)
【0104】
3.繊維芽細胞の増殖効果
1)本発明に係るヒトコラーゲンペプチドB含有クリーム 3.68×104個
2)シグマ社製ヒトコラーゲン含有クリーム 2.20×104個
3)ネオシルク社製ヒトコラーゲン含有クリーム 2.20×104個
【0105】
4.皮膚の形状効果
1)本発明に係るヒトコラーゲンペプチドB含有クリーム 19.5%(SD6.0)
2)本発明に係るヒトコラーゲンペプチドC含有クリーム 15.3%(SD8.1)
3)シグマ社製ヒトコラーゲン含有クリーム 12.0%(SD8.0)
4)ネオシルク社製ヒトコラーゲン含有クリーム 16.7%(SD6.5)
【0106】
以上の製造例、実施例および比較例から、本発明に係るヒトコラーゲン含有化粧料およびその構成成分であるバイオスヒトコラーゲンの特異性は、次の点にあることが明らかになった。
【0107】
1.バイオスヒトコラーゲンについて
1)分子量が制御された範囲にある点
バイオスヒトコラーゲンのペプチドBおよびCは、それぞれ前記の通りのアミノ酸配列およびDNA配列を有するもので、前者は28kDa、後者は21kDaであるのに対し、他社コラーゲンに比較して特定されたものである。これにより、下記の化粧料の品質性能に顕著な効果を与えている。
2)水溶性である点
化粧料の皮膚への浸透性、親和性には、水溶性であることが要求されるが、バイオスコラーゲンは、139kDaの大きさであるにも拘らず、配列の特異性から水溶性であるのに対し、他社製品においては油溶性であるか、または、水溶性については開示されていない。
【0108】
2.化粧料について
本発明に係るバイオスコラーゲンのペプチドB、ペプチドCを成分とするクリームは、前記の通り、1)皮膚の保湿性効果、2)皮膚の粘弾性効果、3)繊維芽細胞の増殖効果、4)皮膚の形状効果、5)アンチエージング効果のすべてにおいて、前記の比較対象製品に対して優れており、著しく顕著な効果を奏するものであることが示されている。
【図面の簡単な説明】
【0109】
【図1】皮膚の保湿性の効果を示す図である。
【図2】皮膚の粘弾性の効果を示す図である。
【図3】ヒト繊維芽細胞の増殖効果を示す図である。
【図4】アンチエージング効果を示す図である。
【図5】本発明に係るヒトコラーゲンペプチドとシグマ社およびネオシルク社の各ヒトコラーゲン製品とのSDS−ポリアクリルアミド電気泳動法による分析結果を示す図である。
【技術分野】
【0001】
本発明は、ヒト型コラーゲン(以下、「ヒトコラーゲン」という。)を含有する化粧料に関するものであり、さらに詳しくは、カイコを用いた組換え遺伝子技法により産生したヒトコラーゲンおよびヒトコラーゲンペプチドを含有する化粧料に関するものである。
【背景技術】
【0002】
コラーゲンは、動物の結合組織を構成する主要タンパク質成分であり、肌の弾力を支配する物質である。従来より、皮膚の細胞及び組織を保護し、活性化するため、近年、コラーゲンが化粧用クリーム、化粧水、乳液等の化粧品、美容品、及び健康食品等の配合成分として使用されている。
【0003】
しかし、従来使用されている化粧料等の配合成分としてのコラーゲンは、主としてブタ、ウシ、ウマ等の哺乳動物のコラーゲン及びフグ、ヒラメ、タラ、マグロのほか、特に寒流魚類のサメ、サケ等から抽出した魚類のコラーゲンを原料とするものである。
【0004】
従って、かかる動物および魚類のコラーゲンを用いた化粧料は、ヒトの皮膚とのアレルギー性反応による発疹が生ずるケースがあること、また、ヒトコラーゲンとは、アミノ酸組成が一部異なるため、ヒトの肌との親和性が低いことが指摘されており、例えば、ブタのコラーゲンおよびサケのコラーゲンは、コラーゲンI型の構造からも10%〜20%の相違があり、ヒトの皮膚に適合するものでないことは明らかといえる。
【0005】
しかし、ヒト由来のコラーゲンはその分子の大きさ(約10万ダルトン)とサブユニット構造が、2つのαペプチド鎖と1つのβペプチド鎖からなるヘテロトリマーであるという複雑なものであることから近年にいたるまで工業的生産には至らなかった。
【0006】
ヒトコラーゲンは、長年にわたり、その生産が切望されてきたが、カイコを利用した遺伝子組換えによる生産が報告されるようになり、例えば、特開2006−109722号公報(以下、「特許文献1」という。)には、カイコが有する絹タンパク質の合成能力に着目し、絹タンパク質と共に大量の組換えタンパク質を繭中に分泌する形質転換カイコを開発したことが記載されている。外来遺伝子の導入により、絹タンパク質遺伝子プロモーターの下流に連結したヒトコラーゲンcDNAをカイコに組み込み、組換えヒトコラーゲンを繭または絹糸腺内のタンパク質の一部とし産生する軽質転換カイコの開発をしたことが記載されている。
【0007】
また、特開2008−125366号公報(以下、「特許文献2」という。)にもトランスジェニックカイコの後部絹糸腺細胞または中部絹糸腺において組換えタンパク質を発現させるための融合ポリヌクレオチドが記載されている。
【0008】
さらに、特開2003−277399号公報(以下、「特許文献3」という。)によれば、ヒトコラーゲンI型のC−末端から誘導されたペプチドにTatペプチドが結合された融合ペプチドおよび該ペプチドを含有する皮膚シワ改善化粧品組成物が記載されている。
【0009】
しかしながら、前記の如きいずれの提案においても、ヒトコラーゲンの生産量は依然として少なく、また、生産プロセスにおいても複雑であるなどの問題があるばかりでなく、ヒトコラーゲンを含有成分とする化粧料については、開示もなく、示唆もされていなかった。
【0010】
また、ヒト繊維芽細胞がコラーゲンを生産することから、かかる繊維芽細胞を培養し、これを顔面のシワおよびラインの部分に移植し、ヒトコラーゲンを生産する方法も実用化されたが、かかる方法は細胞を移植することが前提であり、大量に生産することができないし、繊維芽細胞を化粧品成分化する技術は開発されていないという状況にある。
かかる観点から、水溶性のヒト型コラーゲンの提供が切望されてきた。
【0011】
さらに、従来開発されてきたヒトコラーゲンは、分子量が大きく、化粧料の成分として皮膚への親和性および浸透性が十分ではなかったので、分子量の大きさが制御され、皮膚への親和性・浸透性に優れたペプチド分画の開発が切望されてきた。
【0012】
【特許文献1】特開2006−109722号公報
【特許文献1】特開2008−125366号公報
【特許文献1】特開2003−277399号公報
【非特許文献1】田村 他 ネイチャーバイオテクノロジー(Nature Biotechnology 18,81-84 (2000))
【発明の概要】
【発明が解決しようとする課題】
【0013】
従って、本発明の課題は、ヒトの皮膚成分と同一の構造を有し、ヒトの皮膚との親和性が優れた化粧料を提供することにある。
【0014】
さらに、本発明の課題は、皮膚への浸透性をさらに増加させることが可能であり、ヒトの繊維芽細胞を刺激することが可能な化粧料を提供することにある。
【課題を解決するための手段】
【0015】
そこで、本発明者らは、前記の本発明の課題を解決するために、鋭意検討を重ねた結果、従来の動物由来のコラーゲンまたは魚類由来のコラーゲンに代えて、ヒトコラーゲンを用いることにより、前記の問題点を解決できることに着目し、かかる知見に基いて本発明に想到するに至った。
【0016】
なお、本発明に関する明細書において、「ヒトコラーゲン」とは、ヒトのコラーゲンと同一の遺伝子構造を有するものであって、カイコを用いた組換え遺伝子技法等、その他の合成方法により製造されるものを包含する。
【0017】
かくして、本発明によれば、
ヒトコラーゲンまたは該ヒトコラーゲンの低分子化生成物ゼラチンおよびこれらの混合物を化粧料材料に配合してなる化粧料
が提供される。
【0018】
本発明は、前記の通り、ヒトコラーゲンを含有する化粧料を提供するものであるが、さらに、に好ましい実施の形態として次の1)〜10)に掲げるものを包含する。
【0019】
1)前記ヒトコラーゲンのアミノ酸全長配列が、配列表1に記載のヒトコラーゲンI型の配列である前記化粧料。
2)前記ヒトコラーゲンが、ヒトコラーゲンI型(α鎖)のアミノ酸全長配列のうち681番Fから828番Eまでの198個のアミノ酸を含有するヒトコラーゲンヘプチドBである前記化粧料。
3)前記ヒトコラーゲンが、ヒトコラーゲンI型(α鎖)のアミノ酸全長配列のうち264番Kから400番Nまでの136個のアミノ酸を含有するヒトコラーゲンヘプチドCである前記化粧料。
4)前記ヒトコラーゲンが、カイコを利用した組換え遺伝子技法による産生物質に特定されたものである前記化粧料。
5)前記化粧料が、皮膚および頭髪に用いられる化粧品である前記化粧料。
6)前記皮膚および頭髪に用いられる化粧品が化粧用クリーム、化粧水、乳液を含むものである前記化粧料。
7)前記ヒトコラーゲンとヒアルロン酸その他の保湿成分とを含有してなる前記化粧料。
8)前記ヒトコラーゲンと抗酸化物質を含有してなる前記化粧料。
9)前記ヒトコラーゲンとカプサイシン、ミントその他の抗肥満物質を含有してなる前記化粧料。
10)前記ヒトコラーゲンとオレンジ、レモングラス、クラリセージ、ネロリその他の精油を含有してなる前記化粧料。
【発明の効果】
【0020】
本発明に係るヒトコラーゲン含有化粧料は、ヒトコラーゲンと、該ヒトコラーゲンを配合した化粧料材料とからなるものである。本発明に係る化粧料によれば、配合成分であるヒトコラーゲンの効能が生かされ、ヒトの皮膚を構成する繊維芽細胞の増殖を、他の異種(魚類等)のコラーゲンには有しない親和性および構造の類似性により推進し、前記繊維芽細胞を効果的に保護し、皮膚の保湿性を高く維持することができる。
【0021】
また、ヒトコラーゲンの低分子化生成物ゼラチンは、皮膚の一部構造に浸透しやすいことから前記の如き保湿性が高く、皮膚の弾力性が増加し、皮膚の滑らかさが増強される。
【0022】
さらに、本発明に係るヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCは、後述のように、それぞれ特定のアミノ酸配列およびDNA配列を有し、保湿性、繊維芽細胞の増殖において著しく顕著な効果を奏する。
【0023】
また、ヒトの皮膚上でヒアルロン酸等の保湿剤との共存により、保湿性をさらに増加させることができる。
【0024】
ヒトコラーゲンは、抗酸化物質との共存により、皮膚の抗加齢的な効果を奏する。カプサイシン、ミント等の皮膚からの刺戟により脂肪細胞を燃焼させる抗肥満物質とヒトコラーゲンは、その優れた浸透性から著しい相乗効果を奏する。
【0025】
また、抗ストレス物質との相乗効果が認められるので前記精油との共存作用により効果的に心身の疲労および精神的ストレスを軽減することができる。
【発明を実施するための最良の形態】
【0026】
次に本発明に係るヒトコラーゲン含有化粧料の配合成分について詳細に説明する。
1.ヒトコラーゲン
構造および構造上の特異点
本発明に係る化粧料の必須配合成分であるヒトコラーゲンの構造は、下記記載の通りである。
【0027】
ヒトコラーゲン遺伝子は、Homo sapiens Collagen Type I alpha I (COL1 A 1 ,NM000088)OriGene社、Rockville, MD,USA)を使用した。
【0028】
すなわち、本発明に係るヒトコラーゲン含有化粧料の配合成分としてのヒトコラーゲンのDNA配列は、ヒトコラーゲンI型遺伝子のスタートコドンから801番目までの終止コドンまでが発現可能なベクターに組み込まれている。この配列は、原型として、ベクターからベクターへ、細胞から細胞へ、またある生物から他の生物に受け継がれるものである。また、この配列は、修飾されていない作用をもつサブユニットまたは発現された生産物を構成する。すなわち、原型から修飾されていない細胞株や動物種のサブクローン、またDNAやRNAで発現する新規のプラスミドやベクター類、たんぱく質、ハイブリッド細胞から分泌された抗体を指す。
【0029】
さらに、前記の外、この配列の原型から生産された物質であれば、たんぱく質のいかなる形態または明らかに性質を変えた派生物質でも、この配列の生産物と見なされる。
前記ヒトコラーゲンI型(α鎖)のアミノ酸配列全長およびDNA配列全長を下記の通りに示す。
【0030】
配列表1
A.ヒト型コラーゲンI型(α鎖)のアミノ酸配列全長
MFSFVDLRLLLLLAATALLTHGQEEGQVEGQDEDIPPITCVQNGLRYHDRDVWKPEPCRICVCDNGKVLCDDVICDETKNCPGAEVPEGECCPVCPDGSESPTDQETTGVEGPKGDTGPRGPRGPAGPPGRDGIPGQPGLPGPPGPPGPPGPPGLGGNFAPQLSYGYDEKSTGGISVPGPMGPSGPRGLPGPPGAPGPQGFQGPPGEPGEPGASGPMGPRGPPGPPGKNGDDGEAGKPGRPGERGPPGPQGARGLPGTAGLPGMKGHRGFSGLDGAKGDAGPAGPKGEPGSPGENGAPGQMGPRGLPGERGRPGAPGPAGARGNDGATGAAGPPGPTGPAGPPGFPGAVGAKGEAGPQGPRGSEGPQGVRGEPGPPGPAGAAGPAGNPGADGQPGAKGANGAPGIAGAPGFPGARGPSGPQGPGGPPGPKGNSGEPGAPGSKGDTGAKGEPGPVGVQGPPGPAGEEGKRGARGEPGPTGLPGPPGERGGPGSRGFPGADGVAGPKGPAGERGSPGPAGPKGSPGEAGRPGEAGLPGAKGLTGSPGSPGPDGKTGPPGPAGQDGRPGPPGPPGARGQAGVMGFPGPKGAAGEPGKAGERGVPGPPGAVGPAGKDGEAGAQGPPGPAGPAGERGEQGPAGSPGFQGLPGPAGPPGEAGKPGEQGVPGDLGAPGPSGARGERGFPGERGVQGPPGPAGPRGANGAPGNDGAKGDAGAPGAPGSQGAPGLQGMPGERGAAGLPGPKGDRGDAGPKGADGSPGKDGVRGLTGPIGPPGPAGAPGDKGESGPSGPAGPTGARGAPGDRGEPGPPGPAGFAGPPGADGQPGAKGEPGDAGAKGDAGPPGPAGPAGPPGPIGNVGAPGAKGARGSAGPPGATGFPGAAGRVGPPGPSGNAGPPGPPGPAGKEGGKGPRGETGPAGRPGEVGPPGPPGPAGEKGSPGADGPAGAPGTPGPQGIAGQRGVVGLPGQRGERGFPGLPGPSGEPGKQGPSGASGERGPPGPMGPPGLAGPPGESGREGAPGAEGSPGRDGSPGAKGDRGETGPAGPPGAPGAPGAPGPVGPAGKSGDRGETGPAGPAGPVGPVGARGPAGPQGPRGDKGETGEQGDRGIKGHRGFSGLQGPPGPPGSPGEQGPSGASGPAGPRGPPGSAGAPGKDGLNGLPGPIGPPGPRGRTGDAGPVGPPGPPGPPGPPGPPSAGFDFSFLPQPPQEKAHDGGRYYRADDANVVRDRDLEVDTTLKSLSQQIENIRSPEGSRKNPARTCRDLKMCHSDWKSGEYWIDPNQGCNLDAIKVFCNMETGETCVYPTQPSVAQKNWYISKNPKDKRHVWFGESMTDGFQFEYGGQGSDPADVAIQLTFLRLMSTEASQNITYHCKNSVAYMDQQTGNLKKALLLQGSNEIEIRAEGNSRFTYSVTVDGCTSHTGAWGKTVIEYKTTKTSRLRIIDVAPLDVGAPDQEFGFDVGHVCFL*
【0031】
B.ヒト型コラーゲンI型(α鎖)のDNA酸配列全長
ATGTTCAGCTTTGTGGACCTCCGGCTCCTGCTCCTCTTAGCGGCCACCGCCCTCCTGACG
CACGGCCAAGAGGAAGGCCAAGTCGAGGGCCAAGACGAAGACATCCCACCAATCACCTGC
GTACAGAACGGCCTCAGGTACCATGACCGAGACGTGTGGAAACCCGAGCCCTGCCGGATC
TGCGTCTGCGACAACGGCAAGGTGTTGTGCGATGACGTGATCTGTGACGAGACCAAGAAC
TGCCCCGGCGCCGAAGTCCCCGAGGGCGAGTGCTGTCCCGTCTGCCCCGACGGCTCAGAG
TCACCCACCGACCAAGAAACCACCGGCGTCGAGGGACCCAAGGGAGACACTGGCCCCCGA
GGCCCAAGGGGACCCGCAGGCCCCCCTGGCCGAGATGGCATCCCTGGACAGCCTGGACTT
CCCGGACCCCCCGGACCCCCCGGACCTCCCGGACCCCCTGGCCTCGGAGGAAACTTTGCT
CCCCAGCTGTCTTATGGCTATGATGAGAAATCAACCGGAGGAATTTCCGTGCCTGGCCCC
ATGGGTCCCTCTGGTCCTCGTGGTCTCCCTGGCCCCCCTGGTGCACCTGGTCCCCAAGGC
TTCCAAGGTCCCCCTGGTGAGCCTGGCGAGCCTGGAGCTTCAGGTCCCATGGGTCCCCGA
GGTCCCCCAGGTCCCCCTGGAAAGAATGGAGATGATGGGGAAGCTGGAAAACCTGGTCGT
CCTGGTGAGCGTGGGCCTCCTGGGCCTCAGGGTGCTCGAGGATTGCCCGGAACAGCTGGC
CTCCCTGGAATGAAGGGACACAGAGGTTTCAGTGGTTTGGATGGTGCCAAGGGAGATGCT
GGTCCTGCTGGTCCTAAGGGTGAGCCTGGCAGCCCTGGTGAAAATGGAGCTCCTGGTCAG
ATGGGCCCCCGTGGCCTGCCTGGTGAGAGAGGTCGCCCTGGAGCCCCTGGCCCTGCTGGT
GCTCGTGGAAATGATGGTGCTACTGGTGCTGCCGGGCCCCCTGGTCCCACCGGCCCCGCT
GGTCCTCCTGGCTTCCCTGGTGCTGTTGGTGCTAAGGGTGAAGCTGGTCCCCAAGGGCCC
CGAGGCTCTGAAGGTCCCCAGGGTGTGCGTGGTGAGCCTGGCCCCCCTGGCCCTGCTGGT
GCTGCTGGCCCTGCTGGAAACCCTGGTGCTGATGGACAGCCTGGTGCTAAAGGTGCCAAT
GGTGCTCCTGGTATTGCTGGTGCTCCTGGCTTCCCTGGTGCCCGAGGCCCCTCTGGACCC
CAGGGCCCCGGCGGCCCTCCTGGTCCCAAGGGTAACAGCGGTGAACCTGGTGCTCCTGGC
AGCAAAGGAGACACTGGTGCTAAGGGAGAGCCTGGCCCTGTTGGTGTTCAAGGACCCCCT
GGCCCTGCTGGAGAGGAAGGAAAGCGAGGAGCTCGAGGTGAACCCGGACCCACTGGCCTG
CCCGGACCCCCTGGCGAGCGTGGTGGACCTGGTAGCCGTGGTTTCCCTGGCGCAGATGGT
GTTGCTGGTCCCAAGGGTCCCGCTGGTGAACGTGGTTCTCCTGGCCCTGCTGGCCCCAAA
GGATCTCCTGGTGAAGCTGGTCGTCCCGGTGAAGCTGGTCTGCCTGGTGCCAAGGGTCTG
ACTGGAAGCCCTGGCAGCCCTGGTCCTGATGGCAAAACTGGCCCCCCTGGTCCCGCCGGT
CAAGATGGTCGCCCCGGACCCCCAGGCCCACCTGGTGCCCGTGGTCAGGCTGGTGTGATG
GGATTCCCTGGACCTAAAGGTGCTGCTGGAGAGCCCGGCAAGGCTGGAGAGCGAGGTGTT
CCCGGACCCCCTGGCGCTGTCGGTCCTGCTGGCAAAGATGGAGAGGCTGGAGCTCAGGGA
CCCCCTGGCCCTGCTGGTCCCGCTGGCGAGAGAGGTGAACAAGGCCCTGCTGGCTCCCCC
GGATTCCAGGGTCTCCCTGGTCCTGCTGGTCCTCCAGGTGAAGCAGGCAAACCTGGTGAA
CAGGGTGTTCCTGGAGACCTTGGCGCCCCTGGCCCCTCTGGAGCAAGAGGCGAGAGAGGT
TTCCCTGGCGAGCGTGGTGTGCAAGGTCCCCCTGGTCCTGCTGGTCCCCGAGGGGCCAAC
GGTGCTCCCGGCAACGATGGTGCTAAGGGTGATGCTGGTGCCCCTGGAGCTCCCGGTAGC
CAGGGCGCCCCTGGCCTTCAGGGAATGCCTGGTGAACGTGGTGCAGCTGGTCTTCCAGGG
CCTAAGGGTGACAGAGGTGATGCTGGTCCCAAAGGTGCTGATGGCTCTCCTGGCAAAGAT
GGCGTCCGTGGTCTGACCGGCCCCATTGGTCCTCCTGGCCCTGCTGGTGCCCCTGGTGAC
AAGGGTGAAAGTGGTCCCAGCGGCCCTGCTGGTCCCACTGGAGCTCGTGGTGCCCCCGGA
GACCGTGGTGAGCCTGGTCCCCCCGGCCCTGCTGGCTTTGCTGGCCCCCCTGGTGCTGAC
GGCCAACCTGGTGCTAAAGGCGAACCTGGTGATGCTGGTGCTAAAGGCGATGCTGGTCCC
CCTGGCCCTGCCGGACCCGCTGGACCCCCTGGCCCCATTGGTAATGTTGGTGCTCCTGGA
GCCAAAGGTGCTCGCGGCAGCGCTGGTCCCCCTGGTGCTACTGGTTTCCCTGGTGCTGCT
GGCCGAGTCGGTCCTCCTGGCCCCTCTGGAAATGCTGGACCCCCTGGCCCTCCTGGTCCT
GCTGGCAAAGAAGGCGGCAAAGGTCCCCGTGGTGAGACTGGCCCTGCTGGACGTCCTGGT
GAAGTTGGTCCCCCTGGTCCCCCTGGCCCTGCTGGCGAGAAAGGATCCCCTGGTGCTGAT
GGTCCTGCTGGTGCTCCTGGTACTCCCGGGCCTCAAGGTATTGCTGGACAGCGTGGTGTG
GTCGGCCTGCCTGGTCAGAGAGGAGAGAGAGGCTTCCCTGGTCTTCCTGGCCCCTCTGGT
GAACCTGGCAAACAAGGTCCCTCTGGAGCAAGTGGTGAACGTGGTCCCCCTGGTCCCATG
GGCCCCCCTGGATTGGCTGGACCCCCTGGTGAATCTGGACGTGAGGGGGCTCCTGGTGCC
GAAGGTTCCCCTGGACGAGACGGTTCTCCTGGCGCCAAGGGTGACCGTGGTGAGACCGGC
CCCGCTGGACCCCCTGGTGCTCCTGGTGCTCCTGGTGCCCCTGGCCCCGTTGGCCCTGCT
GGCAAGAGTGGTGATCGTGGTGAGACTGGTCCTGCTGGTCCCGCCGGTCCTGTCGGCCCT
GTTGGCGCCCGTGGCCCCGCCGGACCCCAAGGCCCACGTGGTGACAAGGGTGAGACAGGC
GAACAGGGCGACAGAGGCATAAAGGGTCACCGTGGCTTCTCTGGCCTCCAGGGTCCCCCT
GGCCCTCCTGGCTCTCCTGGTGAACAAGGTCCCTCTGGAGCCTCTGGTCCTGCTGGTCCC
CGAGGTCCCCCTGGCTCTGCTGGTGCTCCTGGCAAAGATGGACTCAACGGTCTCCCTGGC
CCCATTGGGCCCCCTGGTCCTCGCGGTCGCACTGGTGATGCTGGTCCTGTTGGTCCCCCC
GGCCCTCCTGGACCTCCTGGTCCCCCTGGTCCTCCCAGCGCTGGTTTCGACTTCAGCTTC
CTGCCCCAGCCACCTCAAGAGAAGGCTCACGATGGTGGCCGCTACTACCGGGCTGATGAT
GCCAATGTGGTTCGTGACCGTGACCTCGAGGTGGACACCACCCTCAAGAGCCTGAGCCAG
CAGATCGAGAACATCCGGAGCCCAGAGGGCAGCCGCAAGAACCCCGCCCGCACCTGCCGT
GACCTCAAGATGTGCCACTCTGACTGGAAGAGTGGAGAGTACTGGATTGACCCCAACCAA
GGCTGCAACCTGGATGCCATCAAAGTCTTCTGCAACATGGAGACTGGTGAGACCTGCGTG
TACCCCACTCAGCCCAGTGTGGCCCAGAAGAACTGGTACATCAGCAAGAACCCCAAGGAC
AAGAGGCATGTCTGGTTCGGCGAGAGCATGACCGATGGATTCCAGTTCGAGTATGGCGGC
CAGGGCTCCGACCCTGCCGATGTGGCCATCCAGCTGACCTTCCTGCGCCTGATGTCCACC
GAGGCCTCCCAGAACATCACCTACCACTGCAAGAACAGCGTGGCCTACATGGACCAGCAG
ACTGGCAACCTCAAGAAGGCCCTGCTCCTCCAGGGCTCCAACGAGATCGAGATCCGCGCC
GAGGGCAACAGCCGCTTCACCTACAGCGTCACTGTCGATGGCTGCACGAGTCACACCGGA
GCCTGGGGCAAGACAGTGATTGAATACAAAACCACCAAGACCTCCCGCCTGCGCATCATC
GATGTGGCCCCCTTGGACGTTGGTGCCCCAGACCAGGAATTCGGCTTCGACGTTGGCCAT
GTCTGCTTCCTGTAA
【0032】
本発明に係るヒトコラーゲン含有化粧料のヒトコラーゲン成分としては、前記のアミノ酸配列全長およびDNA配列全長を有するヒトコラーゲンおよび該ヒトコラーゲンから分画された少なくとも下記の2種のヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCが、特に、ヒト繊維芽細胞の増殖効果をはじめ、後述の品質性能に優れる点で好適である。かかるヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCのアミノ酸配列とDNA配列は、下記の配列表2に示す通りのものである。
【0033】
すなわち、ヒトコラーゲンペプチドBは、配列表1に示すアミノ酸配列全長を有するヒトコラーゲンI型(α鎖)のアミノ酸配列681番Fから828番Eの198個のアミノ酸からなるアミノ酸配列を分画してなるものであり、また、DNA配列としては、前記ヒトコラーゲンI型(α鎖)のDNA全長配列の1891番Aから2484Aまでの594塩基を分画したものである。また、ヒトコラーゲンペプチドCは、前記ヒトコラーゲンI型(α鎖)のアミノ酸配列全長の264番Kから400番Nまでの136個のアミノ酸からなるアミノ酸配列の分画したものであり、また、DNA配列としては、798番Aから1200番Tまでの408塩基を含有するものである。該当する配列については、下線を付して示す。
【0034】
配列表2
A.ヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCのアミノ酸配列
MFSFVDLRLLLLLAATALLTHGQEEGQVEGQDEDIPPITCVQNGLRYHDRDVWKPEPCRICVCDNGKVLCDDVICDETKNCPGAEVPEGECCPVCPDGSESPTDQETTGVEGPKGDTGPRGPRGPAGPPGRDGIPGQPGLPGPPGPPGPPGPPGLGGNFAPQLSYGYDEKSTGGISVPGPMGPSGPRGLPGPPGAPGPQGFQGPPGEPGEPGASGPMGPRGPPGPPGKNGDDGEAGKPGRPGERGPPGPQGARGLPGTAGLPGMKGHRGFSGLDGAKGDAGPAGPKGEPGSPGENGAPGQMGPRGLPGERGRPGAPGPAGARGNDGATGAAGPPGPTGPAGPPGFPGAVGAKGEAGPQGPRGSEGPQGVRGEPGPPGPAGAAGPAGNPGADGQPGAKGANGAPGIAGAPGFPGARGPSGPQGPGGPPGPKGNSGEPGAPGSKGDTGAKGEPGPVGVQGPPGPAGEEGKRGARGEPGPTGLPGPPGERGGPGSRGFPGADGVAGPKGPAGERGSPGPAGPKGSPGEAGRPGEAGLPGAKGLTGSPGSPGPDGKTGPPGPAGQDGRPGPPGPPGARGQAGVMGFPGPKGAAGEPGKAGERGVPGPPGAVGPAGKDGEAGAQGPPGPAGPAGERGEQGPAGSPGFQGLPGPAGPPGEAGKPGEQGVPGDLGAPGPSGARGERGFPGERGVQGPPGPAGPRGANGAPGNDGAKGDAGAPGAPGSQGAPGLQGMPGERGAAGLPGPKGDRDGAGPKGADGSPGKDGVRGLTGPIGPPGPAGAPGDKGESGPSGPAGPTGARGAPGDRGEPGPPGPAGFAGPPGADGQPGAKGEPGDAGAKGDAGPPGPAGPAGPPGPIGNVGAPGAKGARGSAGPPGATGFPGAAGRVGPPGPSGNAGPPGPPGPAGKEGGKGPRGETGPAGRPGEVGPPGPPGPAGEKGSPGADGPAGAPGTPGPQGIAGQRGVVGLPGQRGERGFPGLPGPSGEPGKQGPSGASGERGPPGPMGPPGLAGPPGESGREGAPGAEGSPGRDGSPGAKGDRGETGPAGPPGAPGAPGAPGPVGPAGKSGDRGETGPAGPAGPVGPVGARGPAGPQGPRDGKGETGEQGDRGIKGHRGFSGLQGPPGPPGSPGEQGPSGASGPAGPRGPPGSAGAPGKDGLNGLPGPIGPPGPRGRTGDAGPVGPPGPPGPPGPPGPPSAGFDFSFLPQPPQEKAHDGGRYYRADDANVVRDRDLEVDTTLKSLSQQIENIRSPEGSRKNPARTCRDLKMCHSDWKSGEYWIDPNQGCNLDAIKVFCNMETGETCVYPTQPSVAQKNWYISKNPKDKRHVWFGESMTDGFQFEYGGQGSDPADVAIQLTFLRLMSTEASQNITYHCKNSVAYMDQQTGNLKKALLLQGSNEIEIRAEGNSRFTYSVTVDGCTSHTGAWGKTVIEYKTTKTSRLRIIDVAPLDVGAPDQEFGFDVGHVCFLTAA
[配列の説明]
ペプチドC(136アミノ酸)の配列:配列上部の下線部文字
ペプチドB(198アミノ酸)の配列:配列下部の下線部文字
【0035】
B.ヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCのDNA配列
ATGTTCAGCTTTGTGGACCTCCGGCTCCTGCTCCTCTTAGCGGCCACCGCCCTCCTGACG
CACGGCCAAGAGGAAGGCCAAGTCGAGGGCCAAGACGAAGACATCCCACCAATCACCTGC
GTACAGAACGGCCTCAGGTACCATGACCGAGACGTGTGGAAACCCGAGCCCTGCCGGATC
TGCGTCTGCGACAACGGCAAGGTGTTGTGCGATGACGTGATCTGTGACGAGACCAAGAAC
TGCCCCGGCGCCGAAGTCCCCGAGGGCGAGTGCTGTCCCGTCTGCCCCGACGGCTCAGAG
TCACCCACCGACCAAGAAACCACCGGCGTCGAGGGACCCAAGGGAGACACTGGCCCCCGA
GGCCCAAGGGGACCCGCAGGCCCCCCTGGCCGAGATGGCATCCCTGGACAGCCTGGACTT
CCCGGACCCCCCGGACCCCCCGGACCTCCCGGACCCCCTGGCCTCGGAGGAAACTTTGCT
CCCCAGCTGTCTTATGGCTATGATGAGAAATCAACCGGAGGAATTTCCGTGCCTGGCCCC
ATGGGTCCCTCTGGTCCTCGTGGTCTCCCTGGCCCCCCTGGTGCACCTGGTCCCCAAGGC
TTCCAAGGTCCCCCTGGTGAGCCTGGCGAGCCTGGAGCTTCAGGTCCCATGGGTCCCCGA
GGTCCCCCAGGTCCCCCTGGAAAGAATGGAGATGATGGGGAAGCTGGAAAACCTGGTCGT
CCTGGTGAGCGTGGGCCTCCTGGGCCTCAGGGTGCTCGAGGATTGCCCGGAACAGCTGGC
CTCCCTGGAATGAAGGGACACAGAGGTTTCAGTGGTTTGGATGGTGCCAAGGGAGATGCT
GGTCCTGCTGGTCCTAAGGGTGAGCCTGGCAGCCCTGGTGAAAATGGAGCTCCTGGTCAG
ATGGGCCCCCGTGGCCTGCCTGGTGAGAGAGGTCGCCCTGGAGCCCCTGGCCCTGCTGGT
GCTCGTGGAAATGATGGTGCTACTGGTGCTGCCGGGCCCCCTGGTCCCACCGGCCCCGCT
GGTCCTCCTGGCTTCCCTGGTGCTGTTGGTGCTAAGGGTGAAGCTGGTCCCCAAGGGCCC
CGAGGCTCTGAAGGTCCCCAGGGTGTGCGTGGTGAGCCTGGCCCCCCTGGCCCTGCTGGT
GCTGCTGGCCCTGCTGGAAACCCTGGTGCTGATGGACAGCCTGGTGCTAAAGGTGCCAAT
GGTGCTCCTGGTATTGCTGGTGCTCCTGGCTTCCCTGGTGCCCGAGGCCCCTCTGGACCC
CAGGGCCCCGGCGGCCCTCCTGGTCCCAAGGGTAACAGCGGTGAACCTGGTGCTCCTGGC
AGCAAAGGAGACACTGGTGCTAAGGGAGAGCCTGGCCCTGTTGGTGTTCAAGGACCCCCT
GGCCCTGCTGGAGAGGAAGGAAAGCGAGGAGCTCGAGGTGAACCCGGACCCACTGGCCTG
CCCGGACCCCCTGGCGAGCGTGGTGGACCTGGTAGCCGTGGTTTCCCTGGCGCAGATGGT
GTTGCTGGTCCCAAGGGTCCCGCTGGTGAACGTGGTTCTCCTGGCCCTGCTGGCCCCAAA
GGATCTCCTGGTGAAGCTGGTCGTCCCGGTGAAGCTGGTCTGCCTGGTGCCAAGGGTCTG
ACTGGAAGCCCTGGCAGCCCTGGTCCTGATGGCAAAACTGGCCCCCCTGGTCCCGCCGGT
CAAGATGGTCGCCCCGGACCCCCAGGCCCACCTGGTGCCCGTGGTCAGGCTGGTGTGATG
GGATTCCCTGGACCTAAAGGTGCTGCTGGAGAGCCCGGCAAGGCTGGAGAGCGAGGTGTT
CCCGGACCCCCTGGCGCTGTCGGTCCTGCTGGCAAAGATGGAGAGGCTGGAGCTCAGGGA
CCCCCTGGCCCTGCTGGTCCCGCTGGCGAGAGAGGTGAACAAGGCCCTGCTGGCTCCCCC
GGATTCCAGGGTCTCCCTGGTCCTGCTGGTCCTCCAGGTGAAGCAGGCAAACCTGGTGAA
CAGGGTGTTCCTGGAGACCTTGGCGCCCCTGGCCCCTCTGGAGCAAGAGGCGAGAGAGGT
TTCCCTGGCGAGCGTGGTGTGCAAGGTCCCCCTGGTCCTGCTGGTCCCCGAGGGGCCAAC
GGTGCTCCCGGCAACGATGGTGCTAAGGGTGATGCTGGTGCCCCTGGAGCTCCCGGTAGC
CAGGGCGCCCCTGGCCTTCAGGGAATGCCTGGTGAACGTGGTGCAGCTGGTCTTCCAGGG
CCTAAGGGTGACAGAGGTGATGCTGGTCCCAAAGGTGCTGATGGCTCTCCTGGCAAAGAT
GGCGTCCGTGGTCTGACCGGCCCCATTGGTCCTCCTGGCCCTGCTGGTGCCCCTGGTGAC
AAGGGTGAAAGTGGTCCCAGCGGCCCTGCTGGTCCCACTGGAGCTCGTGGTGCCCCCGGA
GACCGTGGTGAGCCTGGTCCCCCCGGCCCTGCTGGCTTTGCTGGCCCCCCTGGTGCTGAC
GGCCAACCTGGTGCTAAAGGCGAACCTGGTGATGCTGGTGCTAAAGGCGATGCTGGTCCC
CCTGGCCCTGCCGGACCCGCTGGACCCCCTGGCCCCATTGGTAATGTTGGTGCTCCTGGA
GCCAAAGGTGCTCGCGGCAGCGCTGGTCCCCCTGGTGCTACTGGTTTCCCTGGTGCTGCT
GGCCGAGTCGGTCCTCCTGGCCCCTCTGGAAATGCTGGACCCCCTGGCCCTCCTGGTCCT
GCTGGCAAAGAAGGCGGCAAAGGTCCCCGTGGTGAGACTGGCCCTGCTGGACGTCCTGGT
GAAGTTGGTCCCCCTGGTCCCCCTGGCCCTGCTGGCGAGAAAGGATCCCCTGGTGCTGAT
GGTCCTGCTGGTGCTCCTGGTACTCCCGGGCCTCAAGGTATTGCTGGACAGCGTGGTGTG
GTCGGCCTGCCTGGTCAGAGAGGAGAGAGAGGCTTCCCTGGTCTTCCTGGCCCCTCTGGT
GAACCTGGCAAACAAGGTCCCTCTGGAGCAAGTGGTGAACGTGGTCCCCCTGGTCCCATG
GGCCCCCCTGGATTGGCTGGACCCCCTGGTGAATCTGGACGTGAGGGGGCTCCTGGTGCC
GAAGGTTCCCCTGGACGAGACGGTTCTCCTGGCGCCAAGGGTGACCGTGGTGAGACCGGC
CCCGCTGGACCCCCTGGTGCTCCTGGTGCTCCTGGTGCCCCTGGCCCCGTTGGCCCTGCT
GGCAAGAGTGGTGATCGTGGTGAGACTGGTCCTGCTGGTCCCGCCGGTCCTGTCGGCCCT
GTTGGCGCCCGTGGCCCCGCCGGACCCCAAGGCCCACGTGGTGACAAGGGTGAGACAGGC
GAACAGGGCGACAGAGGCATAAAGGGTCACCGTGGCTTCTCTGGCCTCCAGGGTCCCCCT
GGCCCTCCTGGCTCTCCTGGTGAACAAGGTCCCTCTGGAGCCTCTGGTCCTGCTGGTCCC
CGAGGTCCCCCTGGCTCTGCTGGTGCTCCTGGCAAAGATGGACTCAACGGTCTCCCTGGC
CCCATTGGGCCCCCTGGTCCTCGCGGTCGCACTGGTGATGCTGGTCCTGTTGGTCCCCCC
GGCCCTCCTGGACCTCCTGGTCCCCCTGGTCCTCCCAGCGCTGGTTTCGACTTCAGCTTC
CTGCCCCAGCCACCTCAAGAGAAGGCTCACGATGGTGGCCGCTACTACCGGGCTGATGAT
GCCAATGTGGTTCGTGACCGTGACCTCGAGGTGGACACCACCCTCAAGAGCCTGAGCCAG
CAGATCGAGAACATCCGGAGCCCAGAGGGCAGCCGCAAGAACCCCGCCCGCACCTGCCGT
GACCTCAAGATGTGCCACTCTGACTGGAAGAGTGGAGAGTACTGGATTGACCCCAACCAA
GGCTGCAACCTGGATGCCATCAAAGTCTTCTGCAACATGGAGACTGGTGAGACCTGCGTG
TACCCCACTCAGCCCAGTGTGGCCCAGAAGAACTGGTACATCAGCAAGAACCCCAAGGAC
AAGAGGCATGTCTGGTTCGGCGAGAGCATGACCGATGGATTCCAGTTCGAGTATGGCGGC
CAGGGCTCCGACCCTGCCGATGTGGCCATCCAGCTGACCTTCCTGCGCCTGATGTCCACC
GAGGCCTCCCAGAACATCACCTACCACTGCAAGAACAGCGTGGCCTACATGGACCAGCAG
ACTGGCAACCTCAAGAAGGCCCTGCTCCTCCAGGGCTCCAACGAGATCGAGATCCGCGCC
GAGGGCAACAGCCGCTTCACCTACAGCGTCACTGTCGATGGCTGCACGAGTCACACCGGA
GCCTGGGGCAAGACAGTGATTGAATACAAAACCACCAAGACCTCCCGCCTGCGCATCATC
GATGTGGCCCCCTTGGACGTTGGTGCCCCAGACCAGGAATTCGGCTTCGACGTTGGCCAT
GTCTGCTTCCTGTAA
[配列の説明]
ペプチドCのDNA配列(408bp):配列上部の下線部文字
ペプチドBのDNA配列(594bp):配列下部の下線部文字
【0036】
また、本発明に係るヒトコラーゲン含有化粧料の必須配合成分であるヒトコラーゲンの好ましい成分の第二の特異性は、従来提案されてきたヒトコラーゲンに比較して分子量が特定範囲に制御された点にある。すなわち、具体的には、ヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCのSDS−ポリアクリルアミドゲル電気泳動法により測定した分子量が21〜50kDaであり、好ましくは28kDa〜45kDaである。
【0037】
分子量が21kDaに達しないと、ある特定の構造が存在しないこととなり、一方、50kDaを超えると、構造上の効果が限界になり、特性が向上しないという難点が生ずるおそれがある。
【0038】
かかるヒトコラーゲンの分子量の制御は、その製造方法において、プロモーター遺伝子として、ウィルス系の遺伝子を改造したものを使用したことによるものであるが、これに限定されるものではない。
【0039】
ヒトコラーゲンの製造方法
前記の如き構造の本発明に係るヒトコラーゲンは、下記記載の方法により製造することができる。
【0040】
すなわち、
該ヒトコラーゲン遺伝子のcDNAの5‘末端にフィブロイン鎖との融合したベクターを構築し、これにTTAA特異性トランスポゾンpiggyBac法を用いて、前胚盤葉期の蚕Pnd-w1種(生物資源研究所)の卵に注入した。のち孵化した幼虫を成虫に飼育して、交配し次世代蚕の卵を収穫した。緑色蛍光たんぱく質のマーカーを利用して、該コラーゲン遺伝子を持つトランスジェニック蚕を選別した。
【0041】
本製造方法は、基本的にはT.Tamura等による蚕の後部絹糸腺で合成されるたんぱく質の遺伝子を利用して、目的のたんぱく質を繭のたんぱく質とともに発現させかつ分泌させる方法によっている。本製造方法では、ヒトコラーゲンの効率的な生産を目的として特化し、T.Tamura等による方法を改変したものである。
T.Tamura et al,.Nature Biotechnology 18 (2000)81-84
【0042】
選別されたヒトコラーゲン遺伝子を発現する蚕は、この後部絹糸腺で合成された組換え融合たんぱく質を絹糸腺内腔に分泌される。この分泌されたフィブロインたんぱく質とともに該コラーゲンたんぱく質も繭の中に分泌される。
【0043】
この繭からリチウムチオシアネートによりたんぱく質を抽出し、ウエスターン・ブロンテイング方法と電気永動により、ヒトコラーゲンを検出することができる。
産生されたたんぱく質ないしペプチドは、キモトリプシン酵素処理されたのち、DEAEカラムによる液体クロマトグラフィーを用いてコラーゲンを精製した。精製されたたんぱく質ないしペプチドは、硫安塩析により沈澱させ濃縮した。処理後、水溶性ペプチドを集め、凍結乾燥すればよい。
ヒトコラーゲンの純度は、基準品ヒトコラーゲンとの電気泳動のパターンにより測定することができる。
【0044】
ヒトコラーゲンペプチドBおよびCの製造方法
当該2種のヒトコラーゲンペプチドは、本発明に係るヒトコラーゲン全体(139kDa)よりも4分の1から5分の1の大きさであるが、コラーゲン分子の製造方法と同様に蚕(カイコ)による当該製造方法を用いることが可能である。この場合、ぺプチドB遺伝子およびペプチドC遺伝子は次のような挿入方法によってプラスミドに導入される。
目的遺伝子を市販の発現用プラスミドpPIC9K(インヴィトロゲン社、米 加州)のプロモター遺伝子3‘AOX1(TT)に隣接する制限酵素部位EcoRIおよびNotIを両端として、挿入する。目的遺伝子の挿入の確認は、カナマイシンの存在下の培地中でスクリーニングし、挿入後のプラスミドの大きさをSDS-PAGEの電気泳動によって確認することができる。このペプチドBないしCの遺伝子から構成されるプラスミドの発現は、緑色蛍光たんぱく質遺伝子の導入により、蚕の卵中で確認することができる。繭のたんぱく質として生産されたペプチド分画は、該コラーゲンの抽出方法により分離する。また、DEAEセルロースを担体とする液体クロマトグラフィーによる0.01M-0.85M Naリン酸緩衝液の濃度勾配法により、粗の2つのペプチドの分画を分離し、それぞれの分画を再度DEAEセルロースの液体クロマトグラフィーによるNaリン酸緩衝液により精製される。
【0045】
精製されたペプチドは、SDS-PAGE電気泳動により純度を常に標準分子量マーカーにより該分子の大きさから判断さすることができる。図−5の電気泳動図に示された分子量を参照。
【0046】
2.化粧料材料
本発明に係るヒトコラーゲン含有化粧料は、必須成分のヒトコラーゲンを化粧料材料に配合してなるものであり、配合成分としての化粧料材料について説明する。
化粧料材料は、具体的には下記の通り、通常の化粧料に使用される各種成分および添加剤の群から用途に適したものをヒトコラーゲンの作用を阻害しない範囲または相乗効果が得られる範囲で、任意に選択することができる。
【0047】
各種成分としては、アルコール類、脂肪酸類、エステル類、油脂、水溶性高分子化合物、界面活性剤、無機顔料、紫外線吸収剤、角質溶解剤、酸化防止剤、ビタミン類、収斂剤、美白剤、動植物抽出剤、金属イオン封鎖剤等の一般に知られている下記記載のものを挙げることができる。
【0048】
また、溶剤として精製水を使用することができ、アルコール類、多価アルコール類等については、下記記載のなかから適宜選択することができる。油脂類としては、例えば、ヒマシ油、綿実油、落花生油、タートル油、アーモンド油、エゴマ油、オリブ油、オレンジ油、オレンジラファー油、ゴマ油、カカオ脂、カミツレ油、キャロット油、キューカンバー油、牛脂脂肪酸、ククイナッツ油、サフラワー油、大豆油、ツバキ油、トウモロコシ油、ナタネ油、ミンク油、卵黄油、カカオ脂、パーム油、モクロウ、ヤシ油、牛脂、豚脂またはこれら油脂類の水素化物を挙げることができる。
【0049】
アルコール類としては、エタノール、イソプロパノール、プタノール、セタノール、ラウリルアルコール、ステアリルアルコール、イソステアリルアルコール、オレイルアルコール、ラノリンアルコール、コレステロール、、2−ヘキシルデカノール、イソステアリルアルコール、2−オクチルドデカノール、エチレングリコール、ジエチレングリコール、トリエチレングリコール、エチレングリコールモノエチルエーテル、エチレングリコールモノブチルエーテル、ジエチレングリコールモノメチルエーテル、ジエチレングリコールモノエチルエーテル、ポリオキシエチレンセチルエーテル、ポリオキシエチレンラウリルエーテル、ポリオキシエチレンオレイル、ポリエチレングリコール、プロピレングリコール、ポリプロピレングリコール、1,3−ブチレングリコール、グリセリン、ペンタエリトリトール、ソルビトール、マンニトール等を挙げることができる。
【0050】
ロウ類としては、ミツロウ、カルナバロウ、鯨ロウ、ラノリン、カンデリラロウ、モンタンロウ、セラックロウ等を挙げることができる。
【0051】
鉱物油類として、流動パラフィン、ワセリン、パラフィン、セレシン、マイクロクリスタンワックス、スクワレン、スクワラン、プリスタン等が、また、脂肪酸として、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、ベヘン酸、オレイン酸、12-ヒドロキシステアリン酸、ウンデシレン酸、トール油、ラノリン脂肪酸、イソノナン酸、カプロン酸、2−エチルブタン酸、イソペンタン酸、2−メチルペンタン酸、2−エチルヘキサン酸、イソペンタン酸等を挙げることができる。
【0052】
エステル類としては、ミリスチン酸イソプロピル、パルミチン酸イソプロピル、ステアリン酸ブチル、ラウリン酸ヘキシル、ミリスチン酸ミリスチル、オレイン酸オレイル、オレイン酸デシル、ミリスチン酸オクチルドデシル、ジメチルオクタン酸ヘキシルデシル、乳酸セチル、乳酸ミリスチル、フタル酸ジエチル、フタル酸ジブチル、酢酸ラノリン、モノステアリン酸エチレングリコール、モノステアリン酸プロピレングリコール、モノステアリン酸ソルビタン、グリセリンモノステアレート、ジオレイン酸プロピレングリコールなどのエステル等を挙げることができる。
【0053】
界面活性剤としては、アルキルカルボン酸塩、アルキルスルホン酸塩、アルキル硫酸エステル塩、アルキルリン酸エステル塩等の陰イオン性界面活性剤があり、アルキルアミン塩、アルキル四級アンモニウム塩等のカチオン界面活性剤、カルボン酸型両性界面活性剤、硫酸エステル型両性界面活性剤、スルホン酸型両性界面活性剤、リン酸エステル型両性界面活性剤、エーテル型非イオン界面活性剤、エーテルエステル型非イオン界面活性剤、エステル型非イオン界面活性剤、含窒素型非イオン界面活性剤、その他の界面活性剤等を挙げることができる。
【0054】
さらには、α−ヒドロキシ酸としてはグリコール酸、クエン酸等を、また、無水ケイ酸、ケイ酸マグネシウム、タルク、ベントナイト、マイカ、雲母チタン、等の無機酸化物を挙げることができる。
【0055】
水溶性高分子化合物としては、アラビアゴム、ベンゾインゴム、寒天、カゼイン、乳糖、果糖、ショ糖及びそのエステル、トレハロース及びその誘導体、デキストリン、ゼラチン、ペクチン、デンプン、カラギーナン、キトサン、キトサン塩、ヒアルロン酸及びその塩、コンドロイチン硫酸及びその塩、ヘパリン、エチルセルロース、メチルセルロース、カルボキシメチルセルロース、ポリビニルアルコール、ポリビニルメチルエーテル、ポリビニルピロリドン、ポリビニルメタアクリレート、カルボキシビニルポリマー、ポリエチレンイミン等を挙げることができる。
【0056】
ビタミン類としては、レチノール、レチナール(ビタミンA1)、デヒドロレチナール(ビタミンA2)、カロチン、リコピン(プロビタミンA)、チアミン塩酸塩、チアミン硫酸塩(ビタミンB1)、リボフラビン(ビタミンB2)、ピリドキシン(ビタミンB6)、シアノコバラミン(ビタミンB12)等を挙げることができる。
【0057】
紫外線吸収・遮断剤としては、p-アミノ安息香酸誘導体、サルチル酸誘導体、ベンゾトリアゾール誘導体、ジオキサン誘導体、カンファー誘導体、ビタミンB6誘導体、ベンゾフェノン類、オキシベンゾン、タルク、カオリン等を挙げることができる。
【0058】
収斂剤としては、ハイドロキノンモノベンジルエーテル、ハイドロキノン、乳酸菌エキス、ビタミンA、ビタミンE、酵母エキス等を挙げることができる。
【0059】
酸化防止剤としては、SOD、カタラーゼ、グルタチオンパーオキシダーゼなどの活性酸素消去剤、ブチルヒドロキシトルエン(BHT)、ブチルヒドロキシアニソール(BHA)等を挙げることができる。
【0060】
殺菌・消毒剤として、アクリノール、イオウ、塩化ベンザルコニウム、塩化ベンゼトニウム、塩化メチルロザニリン、クレゾール等を挙げることができる。
【0061】
保湿剤として、さらに必要に応じグリセリン、プロピレングリコール、ポリエチレングリコール、1、3-ブチレングリコール、ヒアルロン酸等を挙げることができる。
【0062】
抗肥満物質として、カプサイシン、ミント等を挙げることができる。
【0063】
末梢血管血流促進剤として、ビタミンE及びその誘導体、センブリエキス、ニンニクエキス、人参エキス、アロエエキス等を挙げることができる。
【0064】
代謝活性剤として、ヒノキチオール、パントテン酸及びその誘導体等を挙げることができる。抗脂漏剤として、ピリドキシン及びその誘導体、イオウ、ビタミンB6等、角質溶解剤としては、レゾルシン、サリチル酸、乳酸等を挙げることができる。
【0065】
酸化剤として、過酸化水素水、過硫酸ナトリウム、過硫酸アンモニウム、過ホウ酸ナトリウム、過酸化尿素等を挙げることができる。
【0066】
防腐剤としては、エチルパラペン、ブチルパラペン等が挙げられる。
【0067】
微生物培養代謝物としては、酵母代謝物、酵母菌抽出エキス、米発酵エキス、米糠発酵エキス、ユーグレナ抽出物やトレハロースまたはその誘導体等を挙げることができる。
【0068】
その他、ホルモン類、金属イオン封鎖剤、pH調整剤、キレート剤、清涼剤、安定化剤、乳化剤、動・植物性蛋白質及びその分解物、動・植物性多糖類及びその分解物、動・植物性糖蛋白質及びその分解物、血流促進剤、消炎剤・抗アレルギー剤、細胞賦活剤等が挙げられる。
【0069】
本発明に係るヒトコラーゲン含有化粧料は、ヒトコラーゲンと化粧料材料および溶剤等からなる組成物であり、前記ヒトコラーゲンは、粉体状、液体状の形態により化粧料材料および溶剤等と混合することによりヒトコラーゲン含有化粧料を調製することができる。
【0070】
前記ヒトコラーゲンの含有量は、化粧料の種類、用途により任意に決定することができるが、通常、0.1〜1質量%、好ましくは0.3〜0.8質量%の範囲で採用することができる。化粧料が化粧用クリームの場合、ヒトコラーゲンの含有量は、特に0.4〜0.5質量%の範囲が好ましい。
【実施例】
【0071】
次に、本発明について実施例および比較例により具体的に説明する。もっとも、本発明は、実施例等により限定されるものではない。
なお、本発明に係るヒトコラーゲン含有化粧料に用いるヒトコラーゲンペプチドおよび対照ヒトコラーゲンの測定に用いるSDS−PAGE電気泳動法、実施例および比較例において得られた化粧料の品質性能の評価方法は下記の通りである。
また、本発明に係るヒトコラーゲン含有化粧料の品質性能を評価するための比較対象材料として用いた他社製品は下記の通りである。
【0072】
A.SDS−PAGE電気泳動法
電気泳動装置として、Bio−Rad社Mini−PROTEAN3CELLを使用し、コラーゲン試料を10μg、それぞれ、25mMTris−Hcl(pH6.8)に溶解し、250V/30mAの電気泳動条件で60分間泳動した。
【0073】
B.化粧料の品質性能の評価方法
次の1〜5の試験法により評価した。
1.皮膚の保湿性効果の試験法
クリーム試料0.5グラムを、腕の皮膚に1日4回10時、12時、14時、16時、女性30歳代1名、40歳代2名、50歳代1名の計4名に塗布し、モリテックス社E−0016型アイセンサー水分計を用いて、皮膚の保湿性の増減を計測した。(n=16)
2.皮膚への粘弾性効果の試験法
クリーム試料0.5グラムを、腕の皮膚に1日4回10時、12時、14時、16時、女性30歳代1名、40歳代2名、50歳代1名の計4名に塗布し、キュートメータ(CK社製)を使用して、皮膚の弾性を増加させる効果を測定した。(n=16)
3.皮膚への形状変化の影響試験法
クリーム試料0.5グラムを、腕の皮膚に1日4回10時、12時、14時、16時、女性30歳代1名、40歳代2名、50歳代1名の計4名に塗布し、CCDカメラ(マイクロスクエア社、MS-40型)を使用して、皮膚表面の弾性を皮丘と皮溝の規則性を解析し、皮膚表面への調整機能を測定した。
4.ヒト繊維芽細胞増殖効果
サンヨー製MCO−17AIC型細胞培養器を用い、96ウエルのプラスチック容器に0.8mlMSDS(FX)培地4×103個の繊維芽細胞を播種し、72時間5%CO2のインキュベータ中、37℃で培養し、それぞれのクリーム試料0.5%(w/v)を添加して培養後細胞数をカウントした。
5.アンチエージング試験
クリーム試料を対象者女性4名の手の甲に塗布し60分後の皮膚の皮丘と皮溝の規則性をCCDカメラにより測定した。
【0074】
C.比較対照ヒトコラーゲン
1)シグマ社製コラーゲン
カタログ番号C5488Type1ヒトコラーゲンHuman Skin,Acid Solube Powder(純度95%以上)、CAS番号2007−34−5
前記SDS−PAGE電気泳動法による分子量; 111kDa
2)ネオシルク社製コラーゲン製品
ネオシルク社「ヒト組換ゼラチン」ロット番号09−RI
前記SDS−PAGE電気泳動法による分子量; 96kDa
【0075】
[製造例1]
ヒトコラーゲンの製造方法
ヒトコラーゲン遺伝子(ヒトコラーゲンI型の鎖の594個のDNA鎖を有する。)のcDNAの5‘末端にフィブロイン鎖との融合したベクターを構築し、これにTTAA特異性トランスポゾンpiggyBac法を用いて、前胚盤葉期の蚕Pnd-w1種(生物資源研究所)の卵に注入した。のち孵化した幼虫を成虫に飼育して、交配し次世代蚕の卵を収穫した。緑色蛍光たんぱく質のマーカーを利用して、該コラーゲン遺伝子を持つトランスジェニック蚕を選別した。
【0076】
選別されたヒトコラーゲン遺伝子を発現する蚕は、この後部絹糸腺で合成された組換え融合たんぱく質を絹糸腺内腔に分泌された。この分泌されたフィブロインたんぱく質とともに該コラーゲンたんぱく質も繭の中に分泌された。
【0077】
この繭からリチウムチオシアネートによりたんぱく質を抽出し、ウエスターン・ブロンテイング方法と電気泳動により、ヒトコラーゲンを検出した。
産生されたたんぱく質ないしペプチドは、キモトリプシン酵素処理されたのち、DEAEカラムによる液体クロマトグラフィーを用いてコラーゲンを精製した。精製されたたんぱく質ないしペプチドは、硫安塩析により沈澱させ濃縮した。処理後、水溶性ペプチドを集め、凍結乾燥すればよい。
【0078】
ヒトコラーゲンの純度は、基準品ヒトコラーゲンとの電気泳動のパターンにより測定もした。
得られたヒトコラーゲンは、配列表に示すDNA配列およびアミノ酸配列を有するものであり、SDS−PAGE電気泳動法による分子量は図5に示すように139kDaであった。
【0079】
図5には、バイオスコラーゲン、シグマ社ヒトコラーゲン、ネオシルク社ヒトコラーゲンを[A]区域に、バイオスコラーゲンペプチドBを[B]区域に、また、バイオスコラーゲンペプチドCを[C]区域に表示した。
【0080】
[製造例2]
ヒトコラーゲンペプチドのBおよびヒトコラーゲンペプチドCの製造方法
当該2種のコラーゲンペプチドは、コラーゲン全体(139kD)よりも4分の1から5分の1の大きさであるが、コラーゲン分子の製造方法と同様に蚕による当該製造方法を用いることが可能である。この場合、〔B〕 ぺプチド遺伝子および〔C〕ペプチド遺伝子は次のような挿入方法によってプラスミドに導入された。
【0081】
目的遺伝子を市販の発現用プラスミドpPIC9K(インヴィトロゲン社、米 加州)のプロモター遺伝子3‘AOX1(TT)に隣接する制限酵素部位EcoRIおよびNotIを両端として、挿入した。目的遺伝子の挿入の確認は、カナマイシンの存在下の培地中でスクリーニングし、挿入後のプラスミドの大きさをSDS-PAGEの電気泳動によって確認した。この〔B〕ないし〔C〕 ペプチドの遺伝子から構成されるプラスミドの発現は、緑色蛍光たんぱく質遺伝子の導入により、蚕の卵中で確認された。繭のたんぱく質として生産されたペプチド分画は、該コラーゲンの抽出方法により分離した。また、DEAEセルロースを担体とする液体クロマトグラフィーによる0.01M-0.85M Naリン酸緩衝液の濃度勾配法により、粗の2つのペプチドの分画を分離し、それぞれの分画を再度DEAEセルロースの液体クロマトグラフィーによるNaリン酸緩衝液により精製した。
【0082】
精製されたペプチドは、SDS-PAGE電気泳動により純度を常に標準分子量マーカーにより該分子の大きさから判断された。図5の電気泳動図に示された分子量を参
照。
【0083】
得られたヒトコラーゲンペプチドBおよびヒトコラーゲンペプチドCのDNA配列、アミノ酸配列およびSDS−PAGE電気泳動法による分子量をそれぞれ次に示す。
ペプチドB
DNA配列;594塩基(1891番Aから2484番Aまで)
アミノ酸配列;198個アミノ酸(681番Fから828番Eまで)
SDS−PAGE電気泳動法による分子量;28kDa
ペプチドC
DNA配列;408塩基(798番Aから1200番Tまで)
アミノ酸配列;136個アミノ酸(264番Kから400番Nまで)
SDS−PAGE電気泳動法による分子量;21kDa
【0084】
本発明に係るヒトコラーゲン(以下、「バイオスコラーゲン」ということがある。)、ヒトコラーゲンペプチドB、ヒトコラーゲンペプチドC、シグマ社製ヒトコラーゲン、ネオシルク社製ヒトコラーゲンのSDS−PAGE電気泳動法による分子量は、まとめると下表の通りである。
【0085】
SDS−PAGE電気泳動法による分子量
バイオスヒトコラーゲン 139
ペプチドB 28
ペプチドC 21
シグマ社ヒトコラーゲン 111
ネオシルク社ヒトコラーゲン 96
【0086】
[実施例1]
下記の(A)の各成分を混合した後、加熱し70℃とする。
下記の(B)の各成分を混合し、70℃に加熱、混合し、(A)成分に(B)成分を加えて乳化し、35℃まで冷却、下記の(C)成分を加えた。
質量%
(A)ワセリン 5.0
スクワラン 10.0
セタノール 8.0
ポリオキシエチレン(20)オレイルエーテル 1.4
モノステアリン酸ソルビタン 0.3
(B)エチルパラペン
プロピレングリコール
製造例2により調製したヒトコラーゲンペプチドB 0.5
精製水 75.4
(C)香料 0.2
【0087】
[実施例2]
(A)の各成分を混合し、80℃に加熱する。
(B)の各成分を混合し、80℃に加熱する。
(A)の成分に(B)の成分を加えて撹拌乳化し、その後35℃まで冷却した。
【0088】
質量%
(A)ポリオキシエチレン(30)セチルエーテル 2.0
グリセリンモノステアレート 10.0
流動パラフィン 10.0
ワセリン 4.0
セタノール 5.0
BHT 0.01
ユーヒドロキシ−4−メトキシベンゾフェノン 0.5
プチルパラベン 0.2
(B)製造例2により得られたヒトコラーゲンペプチドB 0.5
グリセリン 5.0
精製水 62.79
化粧用クリームの品質性能については、前記の方法により評価し、評価結果を下記に示す。
【0089】
[実施例3]
ヒトコラーゲンペプチドBを用いたこと以外、すべて実施例2と同一の成分・組織および同一の条件・操作により化粧クリームを調製した。化粧クリームの品質性能は、前記1〜5の方法に従い評価した。評価結果は下記に示す通りであった。
【0090】
[実施例4]
ヒトコラーゲンペプチドCを用いたこと以外、すべて実施例2と同一の成分・組織および同一の条件・操作により化粧クリームを調製した。品質性能の評価結果は下記に示す通りであった。
【0091】
[実施例5]
実施例3で調製したヒトコラーゲンペプチドB含有化粧クリーム(以下、「HUMANY(登録商標)と称することがある。」)にカプサイシン*を4質量%添加して化粧クリームを調製し、前記アンチエージング試験に供したところ、下表に示す結果を得た。
*和光純薬社製 品番084−11351
【0092】
[実施例6]
実施例3で調製した化粧クリーム「HUMANY」にペパーミント**を0.5質量%添加した化粧用クリームを調製し、前記アンチエージング試験に供したところ、下表に示す結果を得た。
**コネクト社製 製品番号 003−03
【0093】
[実施例7]
実施例3で調製した化粧クリーム「HUMANY」にカプサイシンを4質量%と、ペパーミント0.5質量%を添加した化粧用クリームを調製し、前記アンチエージング試験に供したところ、下表に示す結果を得た。
組 成 アンチエージング効果
HUMANY(実施例3) 20.0%(SD6.0)
HUMANYにカプサイシンを添加(実施例3) 28.3%(SD9.0)
HUMANYにペパーミントを添加(実施例6) 24.7%(SD8.8)
HUMANYにカプサイシンおよび
ペパーミントを添加(実施例7) 30.5%(SD9.4)
実施例2に示す組成のクリームからヒトコラーゲン
ペプチドBを除いたベースクリームにカプサイシン
およびペパーミントを添加(比較例6) 14.1%−15.9%
(SD5.2)
【0094】
[比較例1] ブタコラーゲン
製造例1により得られたヒトコラーゲンの代わりに市販(株式会社ニッピ社製 PS-1 NP20749)のブタコラーゲンを用いたこと以外、すべて実施例1と同一の方法で化粧用クリームを調製し、前記保湿性、粘弾性等の評価に供した。評価結果を図1〜4に示す。
【0095】
[比較例2] ウシコラーゲン
製造例1により得られたヒトコラーゲンの代わりに市販(株式会社ニッピ社製)のウシコラーゲンを用いたこと以外、すべて実施例2と同一の方法により化粧用クリームを調製し、前記保湿性、粘弾性等の評価に供した。評価結果を図1〜4に示す。
【0096】
[比較例3] サケコラーゲン
製造例1により得られるヒトコラーゲンの代わりに(株式会社ニッピ社製)サケコラーゲンを用いたこと以外すべて実施例1と同一の方法により化粧用クリームを調製し、前記アンチエージング試験に供した。評価結果を図4に示す。
【0097】
[比較例4]
製造例2で得られたヒトコラーゲンペプチドBの代わりに、シグマ社製コラーゲン製品(カタログ番号C5488 Human Skin,AcidSolible Powder(純度95%以上))を10mMK・リン酸緩衝液(pH7.4)に0.5質量%溶解したものを用いたこと以外、すべて実施例2と同一の組成による化粧用クリームを調製し、前記の品質性能の評価に供した。評価結果を下記に示す。
【0098】
[比較例5]
製造例2で得られたヒトコラーゲンペプチドBの代わりに、ネオシルク社製コラーゲン製品(「ヒト組換えゼラチン」ロット番号09−RI)10mMK・リン酸緩衝液(pH7.4)に0.5質量%溶解したものを用いたこと以外、すべて実施例2と同一の組成による化粧用クリームを調製し、前記の品質性能の評価に供した。評価結果を品質性能評価の欄[0089]に示す。
【0099】
[比較例6]
実施例2に記載のクリーム組成からヒトコラーゲンペプチドBを除いたベースクリームにカプサイシンを4質量%およびペパーミント0.5質量%添加し化粧用クリームを調製し、前記アンチエージング試験に供したところ、下表に示す結果を得た。
【0100】
実施例1〜4、比較例1〜5により調製した化粧用クリームを前記の皮膚の保湿性試験、皮膚の粘弾性試験、ヒト繊維芽細胞増殖試験、アンチエージング試験にそれぞれ供したところそれぞれ下記の結果を得た。
保湿性 粘弾性 ヒト繊維芽細胞増殖 アンチエーシ゛ンク゛
実施例1 160 155 135 195
比較例1 100 100 100 120
比較例2 105 85 90 105
比較例3 ― ― ― 110
【0101】
次に、本発明に係るヒトコラーゲンペプチドBを含有する化粧用クリーム(実施例3)、ヒトコラーゲンペプチドCを含有する化粧用クリーム(実施例4)、シグマ社製ヒトコラーゲン製品を含有する化粧用クリーム(比較例4)、ネオシルク社製ヒトコラーゲン製品を含有する化粧用クリーム(比較例5)について、前記の品質性能の評価に供した結果を下記の通り示す。
【0102】
1.皮膚の保湿性効果
1)本発明に係るヒトコラーゲンペプチドB含有クリーム 36.0%(SD5.0)
2)本発明に係るヒトコラーゲンペプチドC含有クリーム 34.6%(SD5.3)
3)シグマ社製ヒトコラーゲン含有クリーム 32.0%(SD5.2)
4)ネオシルク社製ヒトコラーゲン含有クリーム 28.6%(SD4.2)
【0103】
2.皮膚の粘弾性効果
1)本発明に係るヒトコラーゲンペプチドB含有クリーム 1.292%(SD0.6)
2)本発明に係るヒトコラーゲンペプチドC含有クリーム 1.112%(SD0.06)
3)シグマ社製ヒトコラーゲン含有クリーム 0.832%(SD0.04)
4)ネオシルク社製ヒトコラーゲン含有クリーム 0.790%(SD0.08)
【0104】
3.繊維芽細胞の増殖効果
1)本発明に係るヒトコラーゲンペプチドB含有クリーム 3.68×104個
2)シグマ社製ヒトコラーゲン含有クリーム 2.20×104個
3)ネオシルク社製ヒトコラーゲン含有クリーム 2.20×104個
【0105】
4.皮膚の形状効果
1)本発明に係るヒトコラーゲンペプチドB含有クリーム 19.5%(SD6.0)
2)本発明に係るヒトコラーゲンペプチドC含有クリーム 15.3%(SD8.1)
3)シグマ社製ヒトコラーゲン含有クリーム 12.0%(SD8.0)
4)ネオシルク社製ヒトコラーゲン含有クリーム 16.7%(SD6.5)
【0106】
以上の製造例、実施例および比較例から、本発明に係るヒトコラーゲン含有化粧料およびその構成成分であるバイオスヒトコラーゲンの特異性は、次の点にあることが明らかになった。
【0107】
1.バイオスヒトコラーゲンについて
1)分子量が制御された範囲にある点
バイオスヒトコラーゲンのペプチドBおよびCは、それぞれ前記の通りのアミノ酸配列およびDNA配列を有するもので、前者は28kDa、後者は21kDaであるのに対し、他社コラーゲンに比較して特定されたものである。これにより、下記の化粧料の品質性能に顕著な効果を与えている。
2)水溶性である点
化粧料の皮膚への浸透性、親和性には、水溶性であることが要求されるが、バイオスコラーゲンは、139kDaの大きさであるにも拘らず、配列の特異性から水溶性であるのに対し、他社製品においては油溶性であるか、または、水溶性については開示されていない。
【0108】
2.化粧料について
本発明に係るバイオスコラーゲンのペプチドB、ペプチドCを成分とするクリームは、前記の通り、1)皮膚の保湿性効果、2)皮膚の粘弾性効果、3)繊維芽細胞の増殖効果、4)皮膚の形状効果、5)アンチエージング効果のすべてにおいて、前記の比較対象製品に対して優れており、著しく顕著な効果を奏するものであることが示されている。
【図面の簡単な説明】
【0109】
【図1】皮膚の保湿性の効果を示す図である。
【図2】皮膚の粘弾性の効果を示す図である。
【図3】ヒト繊維芽細胞の増殖効果を示す図である。
【図4】アンチエージング効果を示す図である。
【図5】本発明に係るヒトコラーゲンペプチドとシグマ社およびネオシルク社の各ヒトコラーゲン製品とのSDS−ポリアクリルアミド電気泳動法による分析結果を示す図である。
【特許請求の範囲】
【請求項1】
ヒトコラーゲンまたは該ヒトコラーゲンの低分子化生成物ゼラチンおよびこれらの混合物を化粧料材料に配合してなることを特徴とするとするヒトコラーゲン含有化粧料。
【請求項2】
前記ヒトコラーゲンのアミノ酸全長配列が、配列表1に記載のヒトコラーゲンI型の配列である請求項1に記載のヒトコラーゲン含有化粧料。
【請求項3】
前記ヒトコラーゲンが、ヒトコラーゲンI型(α鎖)のアミノ酸全長配列のうち681番Fから828番Eまでの198個のアミノ酸を含有するヒトコラーゲンヘプチドBである請求項1に記載のヒトコラーゲン含有化粧料。
【請求項4】
前記ヒトコラーゲンが、ヒトコラーゲンI型(α鎖)のアミノ酸全長配列のうち264番Kから400番Nまでの136個のアミノ酸を含有するヒトコラーゲンヘプチドCである請求項1に記載のヒトコラーゲン含有化粧料。
【請求項5】
前記ヒトコラーゲンが、カイコを利用した組換え遺伝子技法による産生物質である請求項1に記載のヒトコラーゲン含有化粧料。
【請求項6】
前記化粧料が皮膚および頭髪に用いられる化粧品である請求項1に項に記載のヒトコラーゲン含有化粧料。
【請求項7】
前記皮膚および頭髪に用いる化粧品が、化粧用クリーム、化粧水、乳液、ファンデーション、ヘアクリーム、ヘアフォームを含む皮膚用および頭髪用化粧品である請求項3に記載のヒトコラーゲン含有化粧料。
【請求項8】
さらに、ヒアルロン酸その他の保湿成分を含有してなる請求項1ないし3のいずれかの1項に記載のヒトコラーゲン含有化粧料。
【請求項9】
さらに、抗酸化物質を配合してなる請求項1に記載のヒトコラーゲン含有化粧料。
【請求項10】
さらに、カプサイシン、ミントその他の抗肥満物質を配合してなる請求項1に記載のヒトコラーゲン含有化粧料。
【請求項11】
さらに、オレンジ、レモングラス、クラリセージ、ネロリその他の精油からなる抗ストレス物質を配合してなる請求項1に記載のヒトコラーゲン含有化粧料。
【請求項1】
ヒトコラーゲンまたは該ヒトコラーゲンの低分子化生成物ゼラチンおよびこれらの混合物を化粧料材料に配合してなることを特徴とするとするヒトコラーゲン含有化粧料。
【請求項2】
前記ヒトコラーゲンのアミノ酸全長配列が、配列表1に記載のヒトコラーゲンI型の配列である請求項1に記載のヒトコラーゲン含有化粧料。
【請求項3】
前記ヒトコラーゲンが、ヒトコラーゲンI型(α鎖)のアミノ酸全長配列のうち681番Fから828番Eまでの198個のアミノ酸を含有するヒトコラーゲンヘプチドBである請求項1に記載のヒトコラーゲン含有化粧料。
【請求項4】
前記ヒトコラーゲンが、ヒトコラーゲンI型(α鎖)のアミノ酸全長配列のうち264番Kから400番Nまでの136個のアミノ酸を含有するヒトコラーゲンヘプチドCである請求項1に記載のヒトコラーゲン含有化粧料。
【請求項5】
前記ヒトコラーゲンが、カイコを利用した組換え遺伝子技法による産生物質である請求項1に記載のヒトコラーゲン含有化粧料。
【請求項6】
前記化粧料が皮膚および頭髪に用いられる化粧品である請求項1に項に記載のヒトコラーゲン含有化粧料。
【請求項7】
前記皮膚および頭髪に用いる化粧品が、化粧用クリーム、化粧水、乳液、ファンデーション、ヘアクリーム、ヘアフォームを含む皮膚用および頭髪用化粧品である請求項3に記載のヒトコラーゲン含有化粧料。
【請求項8】
さらに、ヒアルロン酸その他の保湿成分を含有してなる請求項1ないし3のいずれかの1項に記載のヒトコラーゲン含有化粧料。
【請求項9】
さらに、抗酸化物質を配合してなる請求項1に記載のヒトコラーゲン含有化粧料。
【請求項10】
さらに、カプサイシン、ミントその他の抗肥満物質を配合してなる請求項1に記載のヒトコラーゲン含有化粧料。
【請求項11】
さらに、オレンジ、レモングラス、クラリセージ、ネロリその他の精油からなる抗ストレス物質を配合してなる請求項1に記載のヒトコラーゲン含有化粧料。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−149062(P2012−149062A)
【公開日】平成24年8月9日(2012.8.9)
【国際特許分類】
【出願番号】特願2011−290403(P2011−290403)
【出願日】平成23年12月29日(2011.12.29)
【出願人】(301000505)株式会社バイオス医科学研究所 (10)
【Fターム(参考)】
【公開日】平成24年8月9日(2012.8.9)
【国際特許分類】
【出願日】平成23年12月29日(2011.12.29)
【出願人】(301000505)株式会社バイオス医科学研究所 (10)
【Fターム(参考)】
[ Back to top ]

