リチウムイオン電池用正極活物質及びその製造方法
【課題】非常に純度の高い、リチウムイオン電池用正極活物質として有用なLi2FeSiO4で表されるオリビン型シリケート化合物、リチウムイオン電池用正極活物質及びその製造方法を提供する。
【解決手段】Li2FeSiO4で表され、かつ
X線回折図において、Li2FeSiO4の(002)面のピーク強度に対するFe3O4の(311)面のピーク強度が0.01倍以下であることを特徴とする、オリビン型シリケート化合物。
【解決手段】Li2FeSiO4で表され、かつ
X線回折図において、Li2FeSiO4の(002)面のピーク強度に対するFe3O4の(311)面のピーク強度が0.01倍以下であることを特徴とする、オリビン型シリケート化合物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、オリビン型シリケート化合物、リチウムイオン電池用正極活物質及びその製造方法に関する。
【背景技術】
【0002】
リチウムイオン電池は、非水電解質電池の1種であり、携帯電話、デジタルカメラ、ノートPC、ハイブリッド自動車、電気自動車等広い分野に利用されている。リチウムイオン電池は、正極材料としてリチウム金属酸化物を用い、負極材料としてグラファイトなどの炭素材を用いるものが主流となっている。
【0003】
この正極材料としては、コバルト酸リチウム(LiCoO2)、マンガン酸リチウム(LiMnO2)、リン酸鉄リチウム(LiFePO4)、ケイ酸鉄リチウム(Li2FeSiO4)等が知られている。このうち、LiFePO4やLi2FeSiO4等は、オリビン構造を有し、高容量のリチウムイオン電池用正極材料として有用である。なかでも、LiFePO4等のリン酸リチウム金属系正極材料は、得られる電池物性のさらなる向上のために不純物の低減を図るべく、X線回折において特定のピーク強度比を示すものも知られている(特許文献1)。
【0004】
一方、Li2FeSiO4等のケイ酸リチウム金属系正極材料の製造法としては、Li源、鉄(金属)源及びケイ酸源の混合物を粉砕し、500〜900℃で焼成するという固相法が一般的である(特許文献2、3)。しかし、固相法では、不活性ガス雰囲気での焼成と粉砕を行う必要があり、複雑な操作が必要であるとともに、粒径や結晶度を制御することが困難である。
これに対し、非特許文献1には、Li2Mn1-yFeySiO4(y=0〜1)を水熱合成で得られる旨の記載がある。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許第4388135号公報
【特許文献2】特開2001−266882号公報
【特許文献3】特開2002−198050号公報
【非特許文献】
【0006】
【非特許文献1】GS Yuasa Technical Report 2009年6月、第6巻、第1号、p21−26
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、本発明者らによって、リチウム源、鉄源及びシリケート源の3者を水に混合し、その混合液をそのまま水熱反応に付しても、Li2FeSiO4の単一相は得られず、Fe3Si2O4(OH)4等が副生することが判明した。そのため、Li2FeSiO4のようなケイ酸リチウム金属系正極材料については、不純物が低減されたことによりX線回折において特定のピーク強度比を示すものは未だ知られていないのが実情である。
【0008】
従って、本発明の課題は、非常に純度の高い、リチウムイオン電池用正極活物質として有用なLi2FeSiO4で表されるオリビン型シリケート化合物、リチウムイオン電池用正極活物質及びその製造方法を提供することにある。
【課題を解決するための手段】
【0009】
そこで本発明者らは、X線回折において特定のピーク強度比を示すLi2FeSiO4で表されるオリビン型シリケート化合物は、Feが酸化することにより生成する不純物であるマグネタイト(Fe3O4)が低減された単一相からなるものであり、リチウムイオン電池用正極活物質として用いた際に優れた電池物性を有することを見出し、本発明を完成するに至った。
【0010】
すなわち、本発明は、Li2FeSiO4で表され、かつ
X線回折図において、Li2FeSiO4の(002)面のピーク強度に対するFe3O4の(311)面のピーク強度が0.01倍以下であることを特徴とする、オリビン型シリケート化合物を提供するものである。
また、本発明は、硫酸鉄(FeSO4)又は(R)2Fe(式中、Rは有機酸残基を示す)で表される有機酸鉄を用い、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有する塩基性水分散液を水熱反応させることを特徴とする、上記オリビン型シリケート化合物の製造方法を提供するものである。
さらに、本発明は、上記オリビン型シリケート化合物を含有するリチウムイオン電池用正極活物質を提供するものである。
また、本発明は、上記リチウムイオン電池用正極活物質を含む正極を有するリチウムイオン電池を提供するものである。
【発明の効果】
【0011】
本発明のオリビン型シリケート化合物を正極材料として用いたリチウムイオン電池は、優れた放電容量を有し、リチウムイオン電池用正極材料として非常に有用である。
【図面の簡単な説明】
【0012】
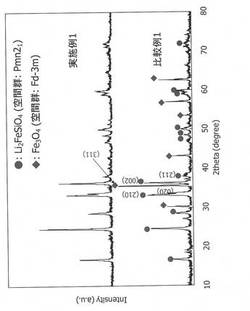
【図1】実施例1及び比較例1で得られた凍結乾燥粉末のX線回析図を示す。
【図2】実施例1で得られた正極活物質を用いた電池の充放電曲線を示す。
【発明を実施するための形態】
【0013】
以下、本発明について詳細に説明する。
本発明のオリビン型シリケート化合物は、Li2FeSiO4で表される。当該オリビン型シリケート化合物のX線回折を測定した場合、得られる回折図において、Li2FeSiO4の(002)面のピーク強度に対するマグネタイト(Fe3O4)の(311)面のピーク強度が、0.01倍以下であり、好ましくは0.005倍以下、より好ましくは0.001倍以下であり、0であるのが最も好ましい。Fe3O4はLi2FeSiO4中におけるFeが酸化することにより生成される不純物であり、電気化学的に不活性なFe3O4の生成により重量当たりのLi2FeSiO4が減少して放電容量の低下を招くことになる。
本発明のオリビン型シリケート化合物は、このFe3O4が極めて効果的に低減されており、これを正極活物質として用いることによって、得られるリチウムイオン電池が優れた放電容量を有することができる。
【0014】
例えば、Li2FeSiO4は、空間群Pmn21で指数付けされる場合において、(011)面のピーク強度が2θ=24.6°に現れ、(010)面のピーク強度は2θ=16.7°に現れる。そのほか、(200)面のピーク強度は2θ=28.6°に、(210)面のピーク強度は2θ=33.2°に、(020)面のピーク強度は2θ=33.6°に、(002)面のピーク強度は2θ=36.3°に、(211)面のピーク強度は2θ=38.0°に現れる。これに対し、Fe3O4は、(311)面のピーク強度が2θ=35.4°に現れる。そのほか、主として、(220)面のピーク強度が2θ=30.0°に、(400)面のピーク強度が2θ=43.0°に、(511)面のピーク強度が2θ=56.9°に現れる。したがって、Li2FeSiO4の(002)面のピーク強度に対するマグネタイト(Fe3O4)の(311)面のピーク強度が、0.01倍以下であると、不純物のFe3O4相がほとんど存在せず、Li2FeSiO4がほぼ単一相であり、非常に純度の高いオリビン型シリケート化合物であることを意味する。
【0015】
本発明のオリビン型シリケート化合物は、硫酸鉄(FeSO4)又は(R)2Fe(式中、Rは有機酸残基を示す)で表される有機酸鉄を用い、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有する塩基性水分散液を水熱反応させることにより製造する。酸化防止剤を用いることにより、極めて効果的にFeの酸化を抑制し、Fe3O4なる不純物の低減を図ることができる。
【0016】
リチウム化合物としては、水酸化リチウム(例えばLiOH・H2O)、炭酸リチウム(Li2CO3)、硫酸リチウム、酢酸リチウムが挙げられるが、水酸化リチウム、炭酸リチウムが特に好ましい。水分散液中のリチウム化合物の濃度は、0.30〜3.00mol/lが好ましく、さらに1.00〜1.50mol/lが好ましい。
【0017】
ケイ酸化合物としては、反応性のあるシリカ化合物であれば特に限定されず、非晶質シリカ、Na4SiO4(例えばNa4SiO4・H2O)が好ましい。このうちNa4SiO4を用いた場合、水分散液が塩基性になるので、より好ましい。水分散液中のケイ酸化合物の濃度は、0.15〜1.50mol/lが好ましく、さらに0.50〜0.75mol/lが好ましい。
【0018】
酸化防止剤としては、アンモニウムイオンを含有する化合物であれば特に限定されず、例えば、アンモニア水、硫酸アンモニウム、塩化アンモニウム、酢酸アンモニウム等が使用できる。アンモニア水として、水に硫酸アンモニウムを溶解させたものを用いてもよい。これらは1種単独で用いてもよく、2種以上組み合わせて用いてもよい。水分散液中の酸化防止剤の含有量は、多量に添加するとオリビン型シリケート化合物の生成を抑制してしまうため、Feに対してモル比で0.001〜2が好ましく、0.1〜1がさらに好ましい。
【0019】
鉄源として硫酸鉄(FeSO4)を用いる場合、副反応を抑制する点から、硫酸鉄とは別に、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有する塩基性水分散液を予め調製しておくのが好ましい。この場合、該水分散液と硫酸鉄とを混合し、水熱反応に付す。該水分散液の調製にあたって、リチウム化合物、ケイ酸化合物及び酸化防止剤の添加順序は特に限定されず、これらの3成分を水に添加してもよい。
【0020】
硫酸鉄の添加量は、反応混合液中0.15〜1.50mol/lとなる量が好ましく、さらに0.50〜0.75mol/lとなる量が好ましい。
なお、この場合における反応混合液中のLiの含有量は、Feに対して2モル以上が好ましい。
【0021】
鉄源として有機酸鉄(R)2Fe(式中、Rは有機酸残基を示す)を用いる場合には、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有し、さらに有機酸鉄を含有する塩基性水分散液を調製する。この場合、リチウム化合物、ケイ酸化合物、酸化防止剤及び有機酸鉄の添加順序は特に限定されない。また、大気条件下でもよい。通常、有機酸鉄は固相法に用いられる原料であるが、水熱反応に用いることにより副反応を抑制することができる。
なお、この場合における反応混合液中のSi及びLiは、Feに対してモル比で2倍以上用いることが好ましく、Li:Feが2.5:1〜3:1程度がより好ましい。
【0022】
有機酸鉄(R)2FeのRで示される有機酸としては、炭素数1〜20の有機酸が好ましく、炭素数2〜12の有機酸がより好ましい。より具体的な有機酸としては、シュウ酸、フマル酸等のジカルボン酸、乳酸等のヒドロキシカルボン酸、酢酸等の脂肪酸が挙げられる。
【0023】
該水分散液は塩基性とするのが、副反応を防止し、ケイ酸化合物を溶解するうえで重要である。具体的には、該水分散液のpHが12.0〜13.5であるのが副反応(Fe3O4の生成)の防止、ケイ酸化合物の溶解性及び反応の進行の点で特に好ましい。該水分散液のpHの調整は、塩基、例えば、水酸化ナトリウムを添加することにより行ってもよいが、ケイ酸化合物としてNa4SiO4を用いるのが特に好ましい。
【0024】
水熱反応は、100℃以上であればよく、130〜180℃が好ましく、さらに140〜160℃が好ましい。水熱反応は耐圧容器中で行うのが好ましく、130〜180℃で反応を行う場合この時の圧力は0.3〜0.9MPaとなり、140〜160℃で反応を行う場合の圧力は0.3〜0.4MPaとなる。水熱反応時間は1〜24時間が好ましく、さらに3〜12時間が好ましい。
【0025】
当該水熱反応により、Li2FeSiO4が高収率で得られる。また、得られたLiFeSiO4の平均粒径は10〜100nmとなり、その結晶度も高い。
【0026】
得られたLi2FeSiO4は、ろ過後、乾燥することにより単離できる。乾燥手段は、凍結乾燥、真空乾燥が用いられる。
【0027】
得られたLi2FeSiO4は、カーボン担持し、次いで焼成することにより、リチウムイオン電池用正極活物質とすることができる。カーボン担持は、Li2FeSiO4に常法により、グルコース、フルクトース、ポリエチレングリコール、ポリビニルアルコール、カルボキシメチルセルロース、サッカロース、デンプン、デキストリン、クエン酸等の炭素源及び水を添加し、次いで焼成すればよい。焼成条件は、不活性ガス雰囲気下又は還元条件下に400℃以上、好ましくは400〜800℃で10分〜3時間、好ましくは0.5〜1.5時間行うのが好ましい。かかる処理によりLi2FeSiO4表面にカーボンが担持された正極活物質とすることができる。炭素源の使用量は、Li2FeSiO4 100質量部に対し、炭素源に含まれる炭素として3〜15質量部が好ましく、炭素源に含まれる炭素として5〜10質量部がさらに好ましい。
【0028】
得られた正極活物質は、放電容量の点で優れており、リチウムイオン電池の正極材料として有用である。本発明の正極活物質を適用できるリチウムイオン電池としては、リチウムイオン二次電池であればよく、正極と負極と電解液とセパレータを必須構成とするものであれば特に限定されない。
【0029】
ここで、負極については、リチウムイオンを充電時には吸蔵し、かつ放電時には放出することができれば、その材料構成で特に限定されるものではなく、公知の材料構成のものを用いることができる。たとえば、リチウム金属、グラファイト又は非晶質炭素等の炭素材料等である。そしてリチウムを電気化学的に吸蔵・放出し得るインターカレート材料で形成された電極、特に炭素材料を用いることが好ましい。
【0030】
電解液は、有機溶媒に支持塩を溶解させたものである。有機溶媒は、通常リチウムイオン電池の電解液の用いられる有機溶媒であれば特に限定されるものではなく、例えば、カーボネート類、ハロゲン化炭化水素、エーテル類、ケトン類、ニトリル類、ラクトン類、オキソラン化合物等を用いることができる。
【0031】
支持塩は、その種類が特に限定されるものではないが、LiPF6、LiBF4、LiClO4及びLiAsF6から選ばれる無機塩、該無機塩の誘導体、LiSO3CF3、LiC(SO3CF3)2及びLiN(SO3CF3)2、LiN(SO2C2F5)2及びLiN(SO2CF3)(SO2C4F9)から選ばれる有機塩、並びに該有機塩の誘導体の少なくとも1種であることが好ましい。
【0032】
セパレータは、正極及び負極を電気的に絶縁し、電解液を保持する役割を果たすものである。たとえば、多孔性合成樹脂膜、特にポリオレフィン系高分子(ポリエチレン、ポリプロピレン)の多孔膜を用いればよい。
【実施例】
【0033】
以下、本発明について、実施例に基づき具体的に説明するが、本発明はこれら実施例に限定されるものではない。
【0034】
[実施例1]
LiOH・H2O 4.20g(0.1mol)、Na4SiO4・nH2O 6.99g(0.025mol)、アンモニア水1.70g(0.025mol)に超純水75cm3を加えて混合した(この時のpHは約13)。この水分散液にFeSO4・7H2O6.95g(0.025mol)を添加し、混合した。得られた混合液をオートクレーブに投入し、150℃で16hr水熱反応を行った。反応液をろ過後、凍結乾燥した。凍結乾燥(約12時間)して得られた粉末8.4gにグルコース(炭素濃度として10%)及び超純水10cm3を加え、還元雰囲気下で600℃で1hr焼成した。
【0035】
[比較例1]
アンモニア水を添加しなかった以外、実施例1と同様にして、凍結乾燥粉末を得た。
【0036】
[試験例1]
実施例1及び比較例1で得られた凍結乾燥粉末のX線回折を行った。このときのX線回折の測定はRINT−UltimaII(リガク社製)で行い、測定条件は、ターゲットCuKα、管電圧40 kV、管電流40 mA、走査範囲10〜80°(2θ)、ステップ幅0.02°、およびスキャンスピード2.00°/minとした。得られたX線回折図を図1に示す。図1から明らかなように、比較例1で得られた粉末は、Li2FeSiO4の(002)面のピーク強度に対するFe3O4の(311)面のピーク強度が1.5倍であってFe3O4を副生していた。これに対し、実施例1で得られた粉末は、Fe3O4の(311)面のピーク強度が確認されず、すなわちLi2FeSiO4の(002)面のピーク強度に対するFe3O4の(311)面のピーク強度が0である、Li2FeSiO4の単一相であり、極めて高純度であることが判明した。
【0037】
[試験例2]
実施例1及び比較例1で得られた焼成物を用い、リチウムイオン二次電池の正極を作製した。実施例1及び比較例1で得られた焼成物、ケッチェンブラック(導電剤)、ポリフッ化ビニリデン(粘結剤)を重量比75:15:10の配合割合で混合し、これにN−メチル−2−ピロリドンを加えて充分混練し、正極スラリーを調製した。正極スラリーを厚さ20μmのアルミニウム箔からなる集電体に塗工機を用いて塗布し、80℃で12時間の真空乾燥を行った。その後、φ14mmの円盤状に打ち抜いてハンドプレスを用いて16MPaで2分間プレスし、正極とした。
【0038】
次いで、上記の正極を用いてコイン型リチウムイオン二次電池を構築した。負極には、φ15mmに打ち抜いたリチウム箔を用いた。電解液には、エチレンカーボネート及びエチルメチルカーボネートを体積比1:1の割合で混合した混合溶媒に、LIPF6を1mol/lの濃度で溶解したものを用いた。セパレータには、ポリプロピレンなどの高分子多孔フィルムなど、公知のものを用いた。これらの電池部品を露点が−50℃以下の雰囲気で常法により組み込み収容し、コイン型リチウム二次電池(CR−2032)を製造した。
【0039】
製造したリチウムイオン二次電池を用いて定電流密度での充放電を4サイクル行った。このときの充電条件は電流0.1CA(33mA/g)、電圧4.5Vの定電流定電圧充電とし、放電条件は電流0.1CA、終止電圧1.5Vの定電流放電とした。温度は全て30℃とした。実施例1の正極材で構築した電池の充放電曲線を図2に示す。
【0040】
図2より、本発明の正極材料を用いたリチウムイオン二次電池は優れた電池物性を有することがわかる。
【技術分野】
【0001】
本発明は、オリビン型シリケート化合物、リチウムイオン電池用正極活物質及びその製造方法に関する。
【背景技術】
【0002】
リチウムイオン電池は、非水電解質電池の1種であり、携帯電話、デジタルカメラ、ノートPC、ハイブリッド自動車、電気自動車等広い分野に利用されている。リチウムイオン電池は、正極材料としてリチウム金属酸化物を用い、負極材料としてグラファイトなどの炭素材を用いるものが主流となっている。
【0003】
この正極材料としては、コバルト酸リチウム(LiCoO2)、マンガン酸リチウム(LiMnO2)、リン酸鉄リチウム(LiFePO4)、ケイ酸鉄リチウム(Li2FeSiO4)等が知られている。このうち、LiFePO4やLi2FeSiO4等は、オリビン構造を有し、高容量のリチウムイオン電池用正極材料として有用である。なかでも、LiFePO4等のリン酸リチウム金属系正極材料は、得られる電池物性のさらなる向上のために不純物の低減を図るべく、X線回折において特定のピーク強度比を示すものも知られている(特許文献1)。
【0004】
一方、Li2FeSiO4等のケイ酸リチウム金属系正極材料の製造法としては、Li源、鉄(金属)源及びケイ酸源の混合物を粉砕し、500〜900℃で焼成するという固相法が一般的である(特許文献2、3)。しかし、固相法では、不活性ガス雰囲気での焼成と粉砕を行う必要があり、複雑な操作が必要であるとともに、粒径や結晶度を制御することが困難である。
これに対し、非特許文献1には、Li2Mn1-yFeySiO4(y=0〜1)を水熱合成で得られる旨の記載がある。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許第4388135号公報
【特許文献2】特開2001−266882号公報
【特許文献3】特開2002−198050号公報
【非特許文献】
【0006】
【非特許文献1】GS Yuasa Technical Report 2009年6月、第6巻、第1号、p21−26
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、本発明者らによって、リチウム源、鉄源及びシリケート源の3者を水に混合し、その混合液をそのまま水熱反応に付しても、Li2FeSiO4の単一相は得られず、Fe3Si2O4(OH)4等が副生することが判明した。そのため、Li2FeSiO4のようなケイ酸リチウム金属系正極材料については、不純物が低減されたことによりX線回折において特定のピーク強度比を示すものは未だ知られていないのが実情である。
【0008】
従って、本発明の課題は、非常に純度の高い、リチウムイオン電池用正極活物質として有用なLi2FeSiO4で表されるオリビン型シリケート化合物、リチウムイオン電池用正極活物質及びその製造方法を提供することにある。
【課題を解決するための手段】
【0009】
そこで本発明者らは、X線回折において特定のピーク強度比を示すLi2FeSiO4で表されるオリビン型シリケート化合物は、Feが酸化することにより生成する不純物であるマグネタイト(Fe3O4)が低減された単一相からなるものであり、リチウムイオン電池用正極活物質として用いた際に優れた電池物性を有することを見出し、本発明を完成するに至った。
【0010】
すなわち、本発明は、Li2FeSiO4で表され、かつ
X線回折図において、Li2FeSiO4の(002)面のピーク強度に対するFe3O4の(311)面のピーク強度が0.01倍以下であることを特徴とする、オリビン型シリケート化合物を提供するものである。
また、本発明は、硫酸鉄(FeSO4)又は(R)2Fe(式中、Rは有機酸残基を示す)で表される有機酸鉄を用い、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有する塩基性水分散液を水熱反応させることを特徴とする、上記オリビン型シリケート化合物の製造方法を提供するものである。
さらに、本発明は、上記オリビン型シリケート化合物を含有するリチウムイオン電池用正極活物質を提供するものである。
また、本発明は、上記リチウムイオン電池用正極活物質を含む正極を有するリチウムイオン電池を提供するものである。
【発明の効果】
【0011】
本発明のオリビン型シリケート化合物を正極材料として用いたリチウムイオン電池は、優れた放電容量を有し、リチウムイオン電池用正極材料として非常に有用である。
【図面の簡単な説明】
【0012】
【図1】実施例1及び比較例1で得られた凍結乾燥粉末のX線回析図を示す。
【図2】実施例1で得られた正極活物質を用いた電池の充放電曲線を示す。
【発明を実施するための形態】
【0013】
以下、本発明について詳細に説明する。
本発明のオリビン型シリケート化合物は、Li2FeSiO4で表される。当該オリビン型シリケート化合物のX線回折を測定した場合、得られる回折図において、Li2FeSiO4の(002)面のピーク強度に対するマグネタイト(Fe3O4)の(311)面のピーク強度が、0.01倍以下であり、好ましくは0.005倍以下、より好ましくは0.001倍以下であり、0であるのが最も好ましい。Fe3O4はLi2FeSiO4中におけるFeが酸化することにより生成される不純物であり、電気化学的に不活性なFe3O4の生成により重量当たりのLi2FeSiO4が減少して放電容量の低下を招くことになる。
本発明のオリビン型シリケート化合物は、このFe3O4が極めて効果的に低減されており、これを正極活物質として用いることによって、得られるリチウムイオン電池が優れた放電容量を有することができる。
【0014】
例えば、Li2FeSiO4は、空間群Pmn21で指数付けされる場合において、(011)面のピーク強度が2θ=24.6°に現れ、(010)面のピーク強度は2θ=16.7°に現れる。そのほか、(200)面のピーク強度は2θ=28.6°に、(210)面のピーク強度は2θ=33.2°に、(020)面のピーク強度は2θ=33.6°に、(002)面のピーク強度は2θ=36.3°に、(211)面のピーク強度は2θ=38.0°に現れる。これに対し、Fe3O4は、(311)面のピーク強度が2θ=35.4°に現れる。そのほか、主として、(220)面のピーク強度が2θ=30.0°に、(400)面のピーク強度が2θ=43.0°に、(511)面のピーク強度が2θ=56.9°に現れる。したがって、Li2FeSiO4の(002)面のピーク強度に対するマグネタイト(Fe3O4)の(311)面のピーク強度が、0.01倍以下であると、不純物のFe3O4相がほとんど存在せず、Li2FeSiO4がほぼ単一相であり、非常に純度の高いオリビン型シリケート化合物であることを意味する。
【0015】
本発明のオリビン型シリケート化合物は、硫酸鉄(FeSO4)又は(R)2Fe(式中、Rは有機酸残基を示す)で表される有機酸鉄を用い、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有する塩基性水分散液を水熱反応させることにより製造する。酸化防止剤を用いることにより、極めて効果的にFeの酸化を抑制し、Fe3O4なる不純物の低減を図ることができる。
【0016】
リチウム化合物としては、水酸化リチウム(例えばLiOH・H2O)、炭酸リチウム(Li2CO3)、硫酸リチウム、酢酸リチウムが挙げられるが、水酸化リチウム、炭酸リチウムが特に好ましい。水分散液中のリチウム化合物の濃度は、0.30〜3.00mol/lが好ましく、さらに1.00〜1.50mol/lが好ましい。
【0017】
ケイ酸化合物としては、反応性のあるシリカ化合物であれば特に限定されず、非晶質シリカ、Na4SiO4(例えばNa4SiO4・H2O)が好ましい。このうちNa4SiO4を用いた場合、水分散液が塩基性になるので、より好ましい。水分散液中のケイ酸化合物の濃度は、0.15〜1.50mol/lが好ましく、さらに0.50〜0.75mol/lが好ましい。
【0018】
酸化防止剤としては、アンモニウムイオンを含有する化合物であれば特に限定されず、例えば、アンモニア水、硫酸アンモニウム、塩化アンモニウム、酢酸アンモニウム等が使用できる。アンモニア水として、水に硫酸アンモニウムを溶解させたものを用いてもよい。これらは1種単独で用いてもよく、2種以上組み合わせて用いてもよい。水分散液中の酸化防止剤の含有量は、多量に添加するとオリビン型シリケート化合物の生成を抑制してしまうため、Feに対してモル比で0.001〜2が好ましく、0.1〜1がさらに好ましい。
【0019】
鉄源として硫酸鉄(FeSO4)を用いる場合、副反応を抑制する点から、硫酸鉄とは別に、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有する塩基性水分散液を予め調製しておくのが好ましい。この場合、該水分散液と硫酸鉄とを混合し、水熱反応に付す。該水分散液の調製にあたって、リチウム化合物、ケイ酸化合物及び酸化防止剤の添加順序は特に限定されず、これらの3成分を水に添加してもよい。
【0020】
硫酸鉄の添加量は、反応混合液中0.15〜1.50mol/lとなる量が好ましく、さらに0.50〜0.75mol/lとなる量が好ましい。
なお、この場合における反応混合液中のLiの含有量は、Feに対して2モル以上が好ましい。
【0021】
鉄源として有機酸鉄(R)2Fe(式中、Rは有機酸残基を示す)を用いる場合には、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有し、さらに有機酸鉄を含有する塩基性水分散液を調製する。この場合、リチウム化合物、ケイ酸化合物、酸化防止剤及び有機酸鉄の添加順序は特に限定されない。また、大気条件下でもよい。通常、有機酸鉄は固相法に用いられる原料であるが、水熱反応に用いることにより副反応を抑制することができる。
なお、この場合における反応混合液中のSi及びLiは、Feに対してモル比で2倍以上用いることが好ましく、Li:Feが2.5:1〜3:1程度がより好ましい。
【0022】
有機酸鉄(R)2FeのRで示される有機酸としては、炭素数1〜20の有機酸が好ましく、炭素数2〜12の有機酸がより好ましい。より具体的な有機酸としては、シュウ酸、フマル酸等のジカルボン酸、乳酸等のヒドロキシカルボン酸、酢酸等の脂肪酸が挙げられる。
【0023】
該水分散液は塩基性とするのが、副反応を防止し、ケイ酸化合物を溶解するうえで重要である。具体的には、該水分散液のpHが12.0〜13.5であるのが副反応(Fe3O4の生成)の防止、ケイ酸化合物の溶解性及び反応の進行の点で特に好ましい。該水分散液のpHの調整は、塩基、例えば、水酸化ナトリウムを添加することにより行ってもよいが、ケイ酸化合物としてNa4SiO4を用いるのが特に好ましい。
【0024】
水熱反応は、100℃以上であればよく、130〜180℃が好ましく、さらに140〜160℃が好ましい。水熱反応は耐圧容器中で行うのが好ましく、130〜180℃で反応を行う場合この時の圧力は0.3〜0.9MPaとなり、140〜160℃で反応を行う場合の圧力は0.3〜0.4MPaとなる。水熱反応時間は1〜24時間が好ましく、さらに3〜12時間が好ましい。
【0025】
当該水熱反応により、Li2FeSiO4が高収率で得られる。また、得られたLiFeSiO4の平均粒径は10〜100nmとなり、その結晶度も高い。
【0026】
得られたLi2FeSiO4は、ろ過後、乾燥することにより単離できる。乾燥手段は、凍結乾燥、真空乾燥が用いられる。
【0027】
得られたLi2FeSiO4は、カーボン担持し、次いで焼成することにより、リチウムイオン電池用正極活物質とすることができる。カーボン担持は、Li2FeSiO4に常法により、グルコース、フルクトース、ポリエチレングリコール、ポリビニルアルコール、カルボキシメチルセルロース、サッカロース、デンプン、デキストリン、クエン酸等の炭素源及び水を添加し、次いで焼成すればよい。焼成条件は、不活性ガス雰囲気下又は還元条件下に400℃以上、好ましくは400〜800℃で10分〜3時間、好ましくは0.5〜1.5時間行うのが好ましい。かかる処理によりLi2FeSiO4表面にカーボンが担持された正極活物質とすることができる。炭素源の使用量は、Li2FeSiO4 100質量部に対し、炭素源に含まれる炭素として3〜15質量部が好ましく、炭素源に含まれる炭素として5〜10質量部がさらに好ましい。
【0028】
得られた正極活物質は、放電容量の点で優れており、リチウムイオン電池の正極材料として有用である。本発明の正極活物質を適用できるリチウムイオン電池としては、リチウムイオン二次電池であればよく、正極と負極と電解液とセパレータを必須構成とするものであれば特に限定されない。
【0029】
ここで、負極については、リチウムイオンを充電時には吸蔵し、かつ放電時には放出することができれば、その材料構成で特に限定されるものではなく、公知の材料構成のものを用いることができる。たとえば、リチウム金属、グラファイト又は非晶質炭素等の炭素材料等である。そしてリチウムを電気化学的に吸蔵・放出し得るインターカレート材料で形成された電極、特に炭素材料を用いることが好ましい。
【0030】
電解液は、有機溶媒に支持塩を溶解させたものである。有機溶媒は、通常リチウムイオン電池の電解液の用いられる有機溶媒であれば特に限定されるものではなく、例えば、カーボネート類、ハロゲン化炭化水素、エーテル類、ケトン類、ニトリル類、ラクトン類、オキソラン化合物等を用いることができる。
【0031】
支持塩は、その種類が特に限定されるものではないが、LiPF6、LiBF4、LiClO4及びLiAsF6から選ばれる無機塩、該無機塩の誘導体、LiSO3CF3、LiC(SO3CF3)2及びLiN(SO3CF3)2、LiN(SO2C2F5)2及びLiN(SO2CF3)(SO2C4F9)から選ばれる有機塩、並びに該有機塩の誘導体の少なくとも1種であることが好ましい。
【0032】
セパレータは、正極及び負極を電気的に絶縁し、電解液を保持する役割を果たすものである。たとえば、多孔性合成樹脂膜、特にポリオレフィン系高分子(ポリエチレン、ポリプロピレン)の多孔膜を用いればよい。
【実施例】
【0033】
以下、本発明について、実施例に基づき具体的に説明するが、本発明はこれら実施例に限定されるものではない。
【0034】
[実施例1]
LiOH・H2O 4.20g(0.1mol)、Na4SiO4・nH2O 6.99g(0.025mol)、アンモニア水1.70g(0.025mol)に超純水75cm3を加えて混合した(この時のpHは約13)。この水分散液にFeSO4・7H2O6.95g(0.025mol)を添加し、混合した。得られた混合液をオートクレーブに投入し、150℃で16hr水熱反応を行った。反応液をろ過後、凍結乾燥した。凍結乾燥(約12時間)して得られた粉末8.4gにグルコース(炭素濃度として10%)及び超純水10cm3を加え、還元雰囲気下で600℃で1hr焼成した。
【0035】
[比較例1]
アンモニア水を添加しなかった以外、実施例1と同様にして、凍結乾燥粉末を得た。
【0036】
[試験例1]
実施例1及び比較例1で得られた凍結乾燥粉末のX線回折を行った。このときのX線回折の測定はRINT−UltimaII(リガク社製)で行い、測定条件は、ターゲットCuKα、管電圧40 kV、管電流40 mA、走査範囲10〜80°(2θ)、ステップ幅0.02°、およびスキャンスピード2.00°/minとした。得られたX線回折図を図1に示す。図1から明らかなように、比較例1で得られた粉末は、Li2FeSiO4の(002)面のピーク強度に対するFe3O4の(311)面のピーク強度が1.5倍であってFe3O4を副生していた。これに対し、実施例1で得られた粉末は、Fe3O4の(311)面のピーク強度が確認されず、すなわちLi2FeSiO4の(002)面のピーク強度に対するFe3O4の(311)面のピーク強度が0である、Li2FeSiO4の単一相であり、極めて高純度であることが判明した。
【0037】
[試験例2]
実施例1及び比較例1で得られた焼成物を用い、リチウムイオン二次電池の正極を作製した。実施例1及び比較例1で得られた焼成物、ケッチェンブラック(導電剤)、ポリフッ化ビニリデン(粘結剤)を重量比75:15:10の配合割合で混合し、これにN−メチル−2−ピロリドンを加えて充分混練し、正極スラリーを調製した。正極スラリーを厚さ20μmのアルミニウム箔からなる集電体に塗工機を用いて塗布し、80℃で12時間の真空乾燥を行った。その後、φ14mmの円盤状に打ち抜いてハンドプレスを用いて16MPaで2分間プレスし、正極とした。
【0038】
次いで、上記の正極を用いてコイン型リチウムイオン二次電池を構築した。負極には、φ15mmに打ち抜いたリチウム箔を用いた。電解液には、エチレンカーボネート及びエチルメチルカーボネートを体積比1:1の割合で混合した混合溶媒に、LIPF6を1mol/lの濃度で溶解したものを用いた。セパレータには、ポリプロピレンなどの高分子多孔フィルムなど、公知のものを用いた。これらの電池部品を露点が−50℃以下の雰囲気で常法により組み込み収容し、コイン型リチウム二次電池(CR−2032)を製造した。
【0039】
製造したリチウムイオン二次電池を用いて定電流密度での充放電を4サイクル行った。このときの充電条件は電流0.1CA(33mA/g)、電圧4.5Vの定電流定電圧充電とし、放電条件は電流0.1CA、終止電圧1.5Vの定電流放電とした。温度は全て30℃とした。実施例1の正極材で構築した電池の充放電曲線を図2に示す。
【0040】
図2より、本発明の正極材料を用いたリチウムイオン二次電池は優れた電池物性を有することがわかる。
【特許請求の範囲】
【請求項1】
Li2FeSiO4で表され、かつ
X線回折図において、Li2FeSiO4の(002)面のピーク強度に対するFe3O4の(311)面のピーク強度が0.01倍以下であることを特徴とする、オリビン型シリケート化合物。
【請求項2】
請求項1に記載のオリビン型シリケート化合物を含有するリチウムイオン電池用正極活物質。
【請求項3】
請求項2に記載のリチウムイオン電池用正極活物質を含む正極を有するリチウムイオン電池。
【請求項4】
硫酸鉄(FeSO4)又は(R)2Fe(式中、Rは有機酸残基を示す)で表される有機酸鉄を用い、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有する塩基性水分散液を水熱反応させることを特徴とする、請求項1に記載のオリビン型シリケート化合物の製造方法。
【請求項5】
酸化防止剤が、アンモニウムイオンを含有する化合物である請求項4に記載のオリビン型シリケート化合物の製造方法。
【請求項6】
塩基性水分散液中の酸化防止剤の含有量が、Feに対してモル比で0.001〜2である請求項4又は5に記載のオリビン型シリケート化合物の製造方法。
【請求項7】
塩基性水分散液と硫酸鉄(FeSO4)とを混合し、得られた混合物を水熱反応させる請求項4〜6のいずれか1項に記載のオリビン型シリケート化合物の製造方法。
【請求項8】
塩基性水分散液が、さらに(R)2Fe(式中、Rは有機酸残基を示す)で表される有機酸鉄を含有する請求項4〜6のいずれか1項に記載のオリビン型シリケート化合物の製造方法。
【請求項9】
リチウム化合物が、水酸化リチウム、炭酸リチウム、硝酸リチウム、酢酸リチウム、硫酸リチウムから選ばれるものである請求項4〜8のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項10】
ケイ酸化合物が、非晶質シリカ及びNa4SiO4から選ばれるものである請求項4〜9のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項11】
塩基性水分散液のpHが、12.0〜13.5である請求項4〜10のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項12】
硫酸鉄(FeSO4)又は(R)2Fe(式中、Rは有機酸残基を示す)で表される有機酸鉄を用い、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有する塩基性水分散液を水熱反応させ、水熱反応後、得られたオリビン型シリケート化合物にカーボン担持し、次いで焼成することを特徴とする、請求項2に記載のリチウムイオン電池用正極活物質の製造方法。
【請求項1】
Li2FeSiO4で表され、かつ
X線回折図において、Li2FeSiO4の(002)面のピーク強度に対するFe3O4の(311)面のピーク強度が0.01倍以下であることを特徴とする、オリビン型シリケート化合物。
【請求項2】
請求項1に記載のオリビン型シリケート化合物を含有するリチウムイオン電池用正極活物質。
【請求項3】
請求項2に記載のリチウムイオン電池用正極活物質を含む正極を有するリチウムイオン電池。
【請求項4】
硫酸鉄(FeSO4)又は(R)2Fe(式中、Rは有機酸残基を示す)で表される有機酸鉄を用い、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有する塩基性水分散液を水熱反応させることを特徴とする、請求項1に記載のオリビン型シリケート化合物の製造方法。
【請求項5】
酸化防止剤が、アンモニウムイオンを含有する化合物である請求項4に記載のオリビン型シリケート化合物の製造方法。
【請求項6】
塩基性水分散液中の酸化防止剤の含有量が、Feに対してモル比で0.001〜2である請求項4又は5に記載のオリビン型シリケート化合物の製造方法。
【請求項7】
塩基性水分散液と硫酸鉄(FeSO4)とを混合し、得られた混合物を水熱反応させる請求項4〜6のいずれか1項に記載のオリビン型シリケート化合物の製造方法。
【請求項8】
塩基性水分散液が、さらに(R)2Fe(式中、Rは有機酸残基を示す)で表される有機酸鉄を含有する請求項4〜6のいずれか1項に記載のオリビン型シリケート化合物の製造方法。
【請求項9】
リチウム化合物が、水酸化リチウム、炭酸リチウム、硝酸リチウム、酢酸リチウム、硫酸リチウムから選ばれるものである請求項4〜8のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項10】
ケイ酸化合物が、非晶質シリカ及びNa4SiO4から選ばれるものである請求項4〜9のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項11】
塩基性水分散液のpHが、12.0〜13.5である請求項4〜10のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項12】
硫酸鉄(FeSO4)又は(R)2Fe(式中、Rは有機酸残基を示す)で表される有機酸鉄を用い、リチウム化合物、ケイ酸化合物及び酸化防止剤を含有する塩基性水分散液を水熱反応させ、水熱反応後、得られたオリビン型シリケート化合物にカーボン担持し、次いで焼成することを特徴とする、請求項2に記載のリチウムイオン電池用正極活物質の製造方法。
【図1】


【図2】




【図2】


【公開番号】特開2013−86977(P2013−86977A)
【公開日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願番号】特願2011−225706(P2011−225706)
【出願日】平成23年10月13日(2011.10.13)
【出願人】(000000240)太平洋セメント株式会社 (1,449)
【Fターム(参考)】
【公開日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願日】平成23年10月13日(2011.10.13)
【出願人】(000000240)太平洋セメント株式会社 (1,449)
【Fターム(参考)】
[ Back to top ]

