二次電池用正極活物質及びその製造方法
【課題】非常に均一性の高い結晶配向性を示し、二次電池用正極活物質として有用なLi2FeSiO4等のオリビン型シリケート化合物、二次電池用正極活物質及びその製造方法を提供する。
【解決手段】Li2MSiO4(式中、MはFe、Ni、Co又はMnから選ばれる1種又は2種以上を示す)で表され、かつ
X線回折図において、(011)面のピーク強度に対する(010)面のピーク強度が0.6倍以上であることを特徴とする、オリビン型シリケート化合物。
【解決手段】Li2MSiO4(式中、MはFe、Ni、Co又はMnから選ばれる1種又は2種以上を示す)で表され、かつ
X線回折図において、(011)面のピーク強度に対する(010)面のピーク強度が0.6倍以上であることを特徴とする、オリビン型シリケート化合物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、オリビン型シリケート化合物、二次電池用正極活物質及びその製造方法に関する。
【背景技術】
【0002】
リチウムイオン電池等の二次電池は、非水電解質電池の1種であり、携帯電話、デジタルカメラ、ノートPC、ハイブリッド自動車、電気自動車等広い分野に利用されている。リチウムイオン電池は、正極材料としてリチウム金属酸化物を用い、負極材料としてグラファイトなどの炭素材を用いるものが主流となっている。
【0003】
この正極材料としては、コバルト酸リチウム(LiCoO2)、マンガン酸リチウム(LiMnO2)、リン酸鉄リチウム(LiFePO4)、ケイ酸鉄リチウム(Li2FeSiO4)等が知られている。このうち、LiFePO4やLi2FeSiO4等は、オリビン構造を有し、高容量のリチウムイオン電池用正極材料として有用である。なかでも、LiFePO4等のリン酸リチウム金属系正極材料は、得られる電池物性のさらなる向上を図るべく、X線回折において特定のピーク強度比を示す、均一な結晶配向性を有するものも知られている(特許文献1、2)。
【0004】
一方、Li2FeSiO4等のケイ酸リチウム金属系正極材料の製造法としては、Li源、鉄(金属)源及びケイ酸源の混合物を粉砕し、500〜900℃で焼成するという固相法が一般的である(特許文献3、4)。しかし、固相法では、不活性ガス雰囲気での焼成と粉砕を行う必要があり、複雑な操作が必要であるとともに、粒径や結晶度を制御することが困難である。
これに対し、非特許文献1には、Li2Mn1-yFeySiO4(y=0〜1)を水熱合成で得られる旨の記載がある。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2007−207637号公報
【特許文献2】特表2008−541364号公報
【特許文献3】特開2001−266882号公報
【特許文献4】特開2002−198050号公報
【非特許文献】
【0006】
【非特許文献1】GS Yuasa Technical Report 2009年6月、第6巻、第1号、p21−26
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、本発明者らによって、リチウム源、鉄源及びシリケート源の3者を水に混合し、その混合液をそのまま水熱反応に付しても、得られるLi2FeSiO4の結晶配向性を充分に制御することができず、二次電池用正極活物質として用いた際に電池物性の低下を招くおそれがあることが判明した。そのため、Li2FeSiO4等のケイ酸リチウム金属系正極材料については、制御された均一性の高い結晶配合性を有するものは未だ知られていないのが実情である。
【0008】
従って、本発明の課題は、非常に均一性の高い結晶配向性を示し、二次電池用正極活物質として有用なLi2FeSiO4等のオリビン型シリケート化合物、二次電池用正極活物質及びその製造方法を提供することにある。
【課題を解決するための手段】
【0009】
そこで本発明者らは、X線回折図において特定のピーク強度比を示すオリビン型シリケート化合物が極めて均一性の高い結晶配合性を有し、二次電池用正極活物質として用いた際に優れた電池物性を有することを見出し、本発明を完成するに至った。
【0010】
すなわち、本発明は、Li2MSiO4(式中、MはFe、Ni、Co又はMnから選ばれる1種又は2種以上を示す)で表され、かつ
X線回折図において、(011)面のピーク強度に対する(010)面のピーク強度が0.6倍以上であることを特徴とする、オリビン型シリケート化合物を提供するものである。
【0011】
また、本発明は、MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩又は(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を用い、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を水熱反応させることを特徴とする、上記オリビン型シリケート化合物の製造方法を提供するものである。
さらに、本発明は、上記オリビン型シリケート化合物を含有する二次電池用正極活物質を提供するものである。
【0012】
また、本発明は、MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩又は(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を用い、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を水熱反応させ、水熱反応後、得られたオリビン型シリケート化合物にカーボン担持し、次いで焼成することを特徴とする、二次電池用正極活物質の製造方法を提供するものである。
【発明の効果】
【0013】
本発明のオリビン型シリケート化合物を正極材料として用いた二次電池は、優れた放電容量を有し、二次電池用正極材料として非常に有用である。
【図面の簡単な説明】
【0014】
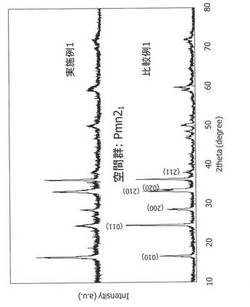
【図1】実施例1及び比較例1で得られた凍結乾燥粉末のX線回析図を示す。
【図2】実施例1で得られた正極活物質を用いた電池の充放電曲線を示す。
【図3】比較例1で得られた正極活物質を用いた電池の充放電曲線を示す。
【発明を実施するための形態】
【0015】
以下、本発明について詳細に説明する。
本発明のオリビン型シリケート化合物は、Li2MSiO4(式中、MはFe、Ni、Co又はMnから選ばれる1種又は2種以上を示す)で表される。当該オリビン型シリケート化合物の具体例としては、Li2FeSiO4、Li2NiSiO4、Li2CoSiO4、Li2MnSiO4、Li2(Fe)m(Mn)1-mSiO4(0<m<1である)等が挙げられる。このうち、原料コストの点からLi2FeSiO4、Li2MnSiO4が好ましく、Li2FeSiO4がより好ましい。
【0016】
本発明のLi2MSiO4で表されるオリビン型シリケート化合物のX線回折を測定した場合、得られる回折図において、(011)面のピーク強度に対する(010)面のピーク強度は0.6倍以上であり、好ましくは0.7〜5.0倍、より好ましくは1.0〜2.5倍である。なお、ピーク強度とは、特定のミラー指数の面に起因するピークが示す最高値を意味する。
【0017】
このように、(011)面のピーク強度に対して、(010)面のピーク強度が0.6倍以上であると、結晶内部においてリチウムイオンが拡散しやすいオリビン型シリケート化合物の配向性が制御されるものと推定される。そして、リチウムイオン電池の充放電において、異方性のあるこうした特定の方向性をもったリチウムイオンの出入りが一段と容易になるため、極めて均一性の高い結晶配向性を有する正極活物質として該オリビン型シリケート化合物を用いることにより、優れた放電容量を有する二次電池が得られると考えられる。
【0018】
例えば、Li2MSiO4がLi2FeSiO4であり、空間群Pmn21で指数付けされる場合において、(011)面のピーク強度は2θ=24.6°に現れ、(010)面のピーク強度は2θ=16.7°に現れる。そのほか、(200)面のピーク強度は2θ=28.6°に、(210)面のピーク強度は2θ=33.2°に、(020)面のピーク強度は2θ=33.6°に、(002)面のピーク強度は2θ=36.3°に、(211)面のピーク強度は2θ=38.0°に現れる。結晶配向性の均一性をより高める点から、さらに(200)面のピーク強度に対する(011)面のピーク強度が、1.0〜2.5倍であるのが好ましく、1.1〜2.0倍であるのがより好ましい。
【0019】
本発明のオリビン型シリケート化合物は、遷移金属(M)源として、MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩又は(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を用い、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を水熱反応させることにより製造する。配向制御剤を用いることにより、極めて効果的にLi2MSiO4における結晶配向性の均一化を図ることができる。
【0020】
リチウム化合物としては、水酸化リチウム(例えばLiOH・H2O)、炭酸リチウム(Li2CO3)、硫酸リチウム、酢酸リチウムが挙げられるが、水酸化リチウム、炭酸リチウムが特に好ましい。水分散液中のリチウム化合物の濃度は、0.30〜3.00mol/lが好ましく、さらに1.00〜1.50mol/lが好ましい。
【0021】
ケイ酸化合物としては、反応性のあるシリカ化合物であれば特に限定されず、非晶質シリカ、Na4SiO4(例えばNa4SiO4・H2O)が好ましい。このうちNa4SiO4を用いた場合、水分散液が塩基性になるので、より好ましい。水分散液中のケイ酸化合物の濃度は、0.15〜1.50mol/lが好ましく、さらに0.50〜0.75mol/lが好ましい。
【0022】
配向制御剤としては、亜ジチオン酸イオン(S2O42-)を含有する化合物であれば特に限定されず、例えば、亜ジチオン酸ナトリウム(Na2S2O4)、亜ジチオン酸カリウム、亜ジチオン酸アンモニウム等が使用できる。これらは1種単独で用いてもよく、2種以上組み合わせて用いてもよい。水分散液中の配向制御剤の含有量は、多量に添加するとオリビン型シリケート化合物の生成を抑制してしまうため、遷移金属に対してモル比で0.001〜1が好ましく、0.1〜0.8がさらに好ましい。
【0023】
遷移金属源として遷移金属硫酸塩MSO4(式中、MはFe、Ni、Co又はMnを示す)を用いる場合、副反応を抑制する点から、遷移金属硫酸塩とは別に、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を予め調製しておくのが好ましい。この場合、該水分散液と遷移金属硫酸塩とを混合し、水熱反応に付す。該水分散液の調製にあたって、リチウム化合物、ケイ酸化合物及び配向制御剤の添加順序は特に限定されず、これらの3成分を水に添加してもよい。
【0024】
遷移金属硫酸塩MSO4の具体例としては、FeSO4、NiSO4、CoSO4又はMnSO4が挙げられ、これらは1種でも2種以上を混合して用いてもよい。これらのうち、FeSO4、MnSO4がより好ましく、FeSO4がさらに好ましい。遷移金属硫酸塩の添加量は、反応混合液中0.15〜1.50mol/lとなる量が好ましく、さらに0.50〜0.75mol/lとなる量が好ましい。
なお、この場合における反応混合液中のLiの含有量は、Mに対して2モル以上が好ましい。
【0025】
遷移金属源として有機酸遷移金属塩(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)を用いる場合には、リチウム化合物、ケイ酸化合物及び配向制御剤を含有し、さらに有機酸遷移金属塩を含有する塩基性水分散液を調製する。この場合、リチウム化合物、ケイ酸化合物、配向制御剤及び有機酸遷移金属塩の添加順序は特に限定されない。また、大気条件下でもよい。通常、有機酸塩は固相法に用いられる原料であるが、水熱反応に用いることにより副反応を抑制することができる。
なお、この場合における反応混合液中のLiは、遷移金属に対してモル比で2倍以上用いることが好ましく、Li:Mが2.5:1〜3:1程度がより好ましい。
【0026】
有機酸遷移金属塩(R)2MのRで示される有機酸としては、炭素数1〜20の有機酸が好ましく、炭素数2〜12の有機酸がより好ましい。より具体的な有機酸としては、シュウ酸、フマル酸等のジカルボン酸、乳酸等のヒドロキシカルボン酸、酢酸等の脂肪酸が挙げられる。
【0027】
該水分散液は塩基性とするのが、副反応を防止し、ケイ酸化合物を溶解するうえで重要である。具体的には、該水分散液のpHが12.0〜13.5であるのが副反応(Fe3O4の生成)の防止、ケイ酸化合物の溶解性及び反応の進行の点で特に好ましい。該水分散液のpHの調整は、塩基、例えば、水酸化ナトリウムを添加することにより行ってもよいが、ケイ酸化合物としてNa4SiO4を用いるのが特に好ましい。
【0028】
水熱反応は、100℃以上であればよく、130〜180℃が好ましく、さらに140〜160℃が好ましい。水熱反応は耐圧容器中で行うのが好ましく、130〜180℃で反応を行う場合この時の圧力は0.3〜0.9MPaとなり、140〜160℃で反応を行う場合の圧力は0.3〜0.4MPaとなる。水熱反応時間は1〜24時間が好ましく、さらに3〜12時間が好ましい。
【0029】
当該水熱反応により、Li2MSiO4(Mは前記と同じ)が高収率で得られる。また、得られたLiMSiO4の平均粒径は10〜100nmとなり、その結晶度も高い。
【0030】
得られたLi2MSiO4は、ろ過後、乾燥することにより単離できる。乾燥手段は、凍結乾燥、真空乾燥が用いられる。
【0031】
得られたLi2MSiO4は、カーボン担持し、次いで焼成することにより、リチウムイオン二次電池用正極活物質とすることができる。カーボン担持は、Li2MSiO4に常法により、グルコース、フルクトース、ポリエチレングリコール、ポリビニルアルコール、カルボキシメチルセルロース、サッカロース、デンプン、デキストリン、クエン酸等の炭素源及び水を添加し、次いで焼成すればよい。焼成条件は、不活性ガス雰囲気下又は還元条件下に400℃以上、好ましくは400〜800℃で10分〜3時間、好ましくは0.5〜1.5時間行うのが好ましい。かかる処理によりLi2MSiO4表面にカーボンが担持された正極活物質とすることができる。炭素源の使用量は、Li2MSiO4 100質量部に対し、炭素源に含まれる炭素として3〜15質量部が好ましく、炭素源に含まれる炭素として5〜10質量部がさらに好ましい。
【0032】
得られた正極活物質は、放電容量の点で優れており、二次電池の正極材料として有用である。本発明の正極活物質を適用できる二次電池としては、リチウムイオン二次電池であればよく、正極と負極と電解液とセパレータを必須構成とするものであれば特に限定されない。
【0033】
ここで、負極については、リチウムイオンを充電時には吸蔵し、かつ放電時には放出することができれば、その材料構成で特に限定されるものではなく、公知の材料構成のものを用いることができる。たとえば、リチウム金属、グラファイト又は非晶質炭素等の炭素材料等である。そしてリチウムを電気化学的に吸蔵・放出し得るインターカレート材料で形成された電極、特に炭素材料を用いることが好ましい。
【0034】
電解液は、有機溶媒に支持塩を溶解させたものである。有機溶媒は、通常リチウムイオン二次電池の電解液の用いられる有機溶媒であれば特に限定されるものではなく、例えば、カーボネート類、ハロゲン化炭化水素、エーテル類、ケトン類、ニトリル類、ラクトン類、オキソラン化合物等を用いることができる。
【0035】
支持塩は、その種類が特に限定されるものではないが、LiPF6、LiBF4、LiClO4及びLiAsF6から選ばれる無機塩、該無機塩の誘導体、LiSO3CF3、LiC(SO3CF3)2及びLiN(SO3CF3)2、LiN(SO2C2F5)2及びLiN(SO2CF3)(SO2C4F9)から選ばれる有機塩、並びに該有機塩の誘導体の少なくとも1種であることが好ましい。
【0036】
セパレータは、正極及び負極を電気的に絶縁し、電解液を保持する役割を果たすものである。たとえば、多孔性合成樹脂膜、特にポリオレフィン系高分子(ポリエチレン、ポリプロピレン)の多孔膜を用いればよい。
【実施例】
【0037】
以下、本発明について、実施例に基づき具体的に説明するが、本発明はこれら実施例に限定されるものではない。
【0038】
[実施例1]
LiOH・H2O 4.20g(0.1mol)、Na4SiO4・nH2O 6.99g(0.025mol)、Na2S2O4 4.35g(0.025mol)に超純水75cm3を加えて混合した(この時のpHは約12.5)。この水分散液にFeSO4・7H2O6.95g(0.025mol)を添加し、混合した。得られた混合液をオートクレーブに投入し、150℃で16hr水熱反応を行った。反応液をろ過後、凍結乾燥した。凍結乾燥(約12時間)して得られた粉末8.4gにグルコース(炭素濃度として10%)及び超純水10cm3を加え、還元雰囲気下で600℃で1hr焼成した。
【0039】
[比較例1]
Na2S2O4を加えなかった以外、実施例1と同様にして、凍結乾燥粉末を得た。
【0040】
[試験例1]
実施例1及び比較例1で得られた凍結乾燥粉末のX線回折を行った。このときのX線回折の測定はRINT−UltimaII(リガク社製)で行い、測定条件は、ターゲットCuKα、管電圧40 kV、管電流40 mA、走査範囲10〜80°(2θ)、ステップ幅0.02°、およびスキャンスピード2.00°/minとした。得られたX線回折図を図1に示す。図1から明らかなように、(011)面のピーク強度に対する(010)面のピーク強度は、比較例1で得られた粉末は0.5倍であったのに対し、実施例1で得られた粉末は1.3倍であり、ある特定の方向への結晶配向性を有するよう制御されているであろうことがわかる。なお、(200)面のピーク強度に対する(010)面のピーク強度は、比較例1では1.2倍であり、実施例1では3.4倍であった。
【0041】
[試験例2]
実施例1及び比較例1で得られた焼成物を用い、リチウムイオン二次電池の正極を作製した。実施例1及び比較例1で得られた焼成物、ケッチェンブラック(導電剤)、ポリフッ化ビニリデン(粘結剤)を重量比75:15:10の配合割合で混合し、これにN−メチル−2−ピロリドンを加えて充分混練し、正極スラリーを調製した。正極スラリーを厚さ20μmのアルミニウム箔からなる集電体に塗工機を用いて塗布し、80℃で12時間の真空乾燥を行った。その後、φ14mmの円盤状に打ち抜いてハンドプレスを用いて16MPaで2分間プレスし、正極とした。
【0042】
次いで、上記の正極を用いてコイン型リチウムイオン二次電池を構築した。負極には、φ15mmに打ち抜いたリチウム箔を用いた。電解液には、エチレンカーボネート及びエチルメチルカーボネートを体積比1:1の割合で混合した混合溶媒に、LIPF6を1mol/lの濃度で溶解したものを用いた。セパレータには、ポリプロピレンなどの高分子多孔フィルムなど、公知のものを用いた。これらの電池部品を露点が−50℃以下の雰囲気で常法により組み込み収容し、コイン型リチウム二次電池(CR−2032)を製造した。
【0043】
製造したリチウムイオン二次電池を用いて定電流密度での充放電を4サイクル行った。このときの充電条件は電流0.1CA(33mA/g)、電圧4.5Vの定電流定電圧充電とし、放電条件は電流0.1CA、終止電圧1.5Vの定電流放電とした。温度は全て30℃とした。実施例1の正極材で構築した電池の充放電曲線を図2に、比較例1の正極材で構築した電池の充放電曲線を図3に示す。
【0044】
図2〜3より、制御された均一性の高い本発明の正極材料を用いたリチウムイオン二次電池は、優れた電池物性を有することがわかる。
【技術分野】
【0001】
本発明は、オリビン型シリケート化合物、二次電池用正極活物質及びその製造方法に関する。
【背景技術】
【0002】
リチウムイオン電池等の二次電池は、非水電解質電池の1種であり、携帯電話、デジタルカメラ、ノートPC、ハイブリッド自動車、電気自動車等広い分野に利用されている。リチウムイオン電池は、正極材料としてリチウム金属酸化物を用い、負極材料としてグラファイトなどの炭素材を用いるものが主流となっている。
【0003】
この正極材料としては、コバルト酸リチウム(LiCoO2)、マンガン酸リチウム(LiMnO2)、リン酸鉄リチウム(LiFePO4)、ケイ酸鉄リチウム(Li2FeSiO4)等が知られている。このうち、LiFePO4やLi2FeSiO4等は、オリビン構造を有し、高容量のリチウムイオン電池用正極材料として有用である。なかでも、LiFePO4等のリン酸リチウム金属系正極材料は、得られる電池物性のさらなる向上を図るべく、X線回折において特定のピーク強度比を示す、均一な結晶配向性を有するものも知られている(特許文献1、2)。
【0004】
一方、Li2FeSiO4等のケイ酸リチウム金属系正極材料の製造法としては、Li源、鉄(金属)源及びケイ酸源の混合物を粉砕し、500〜900℃で焼成するという固相法が一般的である(特許文献3、4)。しかし、固相法では、不活性ガス雰囲気での焼成と粉砕を行う必要があり、複雑な操作が必要であるとともに、粒径や結晶度を制御することが困難である。
これに対し、非特許文献1には、Li2Mn1-yFeySiO4(y=0〜1)を水熱合成で得られる旨の記載がある。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2007−207637号公報
【特許文献2】特表2008−541364号公報
【特許文献3】特開2001−266882号公報
【特許文献4】特開2002−198050号公報
【非特許文献】
【0006】
【非特許文献1】GS Yuasa Technical Report 2009年6月、第6巻、第1号、p21−26
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、本発明者らによって、リチウム源、鉄源及びシリケート源の3者を水に混合し、その混合液をそのまま水熱反応に付しても、得られるLi2FeSiO4の結晶配向性を充分に制御することができず、二次電池用正極活物質として用いた際に電池物性の低下を招くおそれがあることが判明した。そのため、Li2FeSiO4等のケイ酸リチウム金属系正極材料については、制御された均一性の高い結晶配合性を有するものは未だ知られていないのが実情である。
【0008】
従って、本発明の課題は、非常に均一性の高い結晶配向性を示し、二次電池用正極活物質として有用なLi2FeSiO4等のオリビン型シリケート化合物、二次電池用正極活物質及びその製造方法を提供することにある。
【課題を解決するための手段】
【0009】
そこで本発明者らは、X線回折図において特定のピーク強度比を示すオリビン型シリケート化合物が極めて均一性の高い結晶配合性を有し、二次電池用正極活物質として用いた際に優れた電池物性を有することを見出し、本発明を完成するに至った。
【0010】
すなわち、本発明は、Li2MSiO4(式中、MはFe、Ni、Co又はMnから選ばれる1種又は2種以上を示す)で表され、かつ
X線回折図において、(011)面のピーク強度に対する(010)面のピーク強度が0.6倍以上であることを特徴とする、オリビン型シリケート化合物を提供するものである。
【0011】
また、本発明は、MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩又は(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を用い、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を水熱反応させることを特徴とする、上記オリビン型シリケート化合物の製造方法を提供するものである。
さらに、本発明は、上記オリビン型シリケート化合物を含有する二次電池用正極活物質を提供するものである。
【0012】
また、本発明は、MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩又は(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を用い、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を水熱反応させ、水熱反応後、得られたオリビン型シリケート化合物にカーボン担持し、次いで焼成することを特徴とする、二次電池用正極活物質の製造方法を提供するものである。
【発明の効果】
【0013】
本発明のオリビン型シリケート化合物を正極材料として用いた二次電池は、優れた放電容量を有し、二次電池用正極材料として非常に有用である。
【図面の簡単な説明】
【0014】
【図1】実施例1及び比較例1で得られた凍結乾燥粉末のX線回析図を示す。
【図2】実施例1で得られた正極活物質を用いた電池の充放電曲線を示す。
【図3】比較例1で得られた正極活物質を用いた電池の充放電曲線を示す。
【発明を実施するための形態】
【0015】
以下、本発明について詳細に説明する。
本発明のオリビン型シリケート化合物は、Li2MSiO4(式中、MはFe、Ni、Co又はMnから選ばれる1種又は2種以上を示す)で表される。当該オリビン型シリケート化合物の具体例としては、Li2FeSiO4、Li2NiSiO4、Li2CoSiO4、Li2MnSiO4、Li2(Fe)m(Mn)1-mSiO4(0<m<1である)等が挙げられる。このうち、原料コストの点からLi2FeSiO4、Li2MnSiO4が好ましく、Li2FeSiO4がより好ましい。
【0016】
本発明のLi2MSiO4で表されるオリビン型シリケート化合物のX線回折を測定した場合、得られる回折図において、(011)面のピーク強度に対する(010)面のピーク強度は0.6倍以上であり、好ましくは0.7〜5.0倍、より好ましくは1.0〜2.5倍である。なお、ピーク強度とは、特定のミラー指数の面に起因するピークが示す最高値を意味する。
【0017】
このように、(011)面のピーク強度に対して、(010)面のピーク強度が0.6倍以上であると、結晶内部においてリチウムイオンが拡散しやすいオリビン型シリケート化合物の配向性が制御されるものと推定される。そして、リチウムイオン電池の充放電において、異方性のあるこうした特定の方向性をもったリチウムイオンの出入りが一段と容易になるため、極めて均一性の高い結晶配向性を有する正極活物質として該オリビン型シリケート化合物を用いることにより、優れた放電容量を有する二次電池が得られると考えられる。
【0018】
例えば、Li2MSiO4がLi2FeSiO4であり、空間群Pmn21で指数付けされる場合において、(011)面のピーク強度は2θ=24.6°に現れ、(010)面のピーク強度は2θ=16.7°に現れる。そのほか、(200)面のピーク強度は2θ=28.6°に、(210)面のピーク強度は2θ=33.2°に、(020)面のピーク強度は2θ=33.6°に、(002)面のピーク強度は2θ=36.3°に、(211)面のピーク強度は2θ=38.0°に現れる。結晶配向性の均一性をより高める点から、さらに(200)面のピーク強度に対する(011)面のピーク強度が、1.0〜2.5倍であるのが好ましく、1.1〜2.0倍であるのがより好ましい。
【0019】
本発明のオリビン型シリケート化合物は、遷移金属(M)源として、MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩又は(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を用い、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を水熱反応させることにより製造する。配向制御剤を用いることにより、極めて効果的にLi2MSiO4における結晶配向性の均一化を図ることができる。
【0020】
リチウム化合物としては、水酸化リチウム(例えばLiOH・H2O)、炭酸リチウム(Li2CO3)、硫酸リチウム、酢酸リチウムが挙げられるが、水酸化リチウム、炭酸リチウムが特に好ましい。水分散液中のリチウム化合物の濃度は、0.30〜3.00mol/lが好ましく、さらに1.00〜1.50mol/lが好ましい。
【0021】
ケイ酸化合物としては、反応性のあるシリカ化合物であれば特に限定されず、非晶質シリカ、Na4SiO4(例えばNa4SiO4・H2O)が好ましい。このうちNa4SiO4を用いた場合、水分散液が塩基性になるので、より好ましい。水分散液中のケイ酸化合物の濃度は、0.15〜1.50mol/lが好ましく、さらに0.50〜0.75mol/lが好ましい。
【0022】
配向制御剤としては、亜ジチオン酸イオン(S2O42-)を含有する化合物であれば特に限定されず、例えば、亜ジチオン酸ナトリウム(Na2S2O4)、亜ジチオン酸カリウム、亜ジチオン酸アンモニウム等が使用できる。これらは1種単独で用いてもよく、2種以上組み合わせて用いてもよい。水分散液中の配向制御剤の含有量は、多量に添加するとオリビン型シリケート化合物の生成を抑制してしまうため、遷移金属に対してモル比で0.001〜1が好ましく、0.1〜0.8がさらに好ましい。
【0023】
遷移金属源として遷移金属硫酸塩MSO4(式中、MはFe、Ni、Co又はMnを示す)を用いる場合、副反応を抑制する点から、遷移金属硫酸塩とは別に、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を予め調製しておくのが好ましい。この場合、該水分散液と遷移金属硫酸塩とを混合し、水熱反応に付す。該水分散液の調製にあたって、リチウム化合物、ケイ酸化合物及び配向制御剤の添加順序は特に限定されず、これらの3成分を水に添加してもよい。
【0024】
遷移金属硫酸塩MSO4の具体例としては、FeSO4、NiSO4、CoSO4又はMnSO4が挙げられ、これらは1種でも2種以上を混合して用いてもよい。これらのうち、FeSO4、MnSO4がより好ましく、FeSO4がさらに好ましい。遷移金属硫酸塩の添加量は、反応混合液中0.15〜1.50mol/lとなる量が好ましく、さらに0.50〜0.75mol/lとなる量が好ましい。
なお、この場合における反応混合液中のLiの含有量は、Mに対して2モル以上が好ましい。
【0025】
遷移金属源として有機酸遷移金属塩(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)を用いる場合には、リチウム化合物、ケイ酸化合物及び配向制御剤を含有し、さらに有機酸遷移金属塩を含有する塩基性水分散液を調製する。この場合、リチウム化合物、ケイ酸化合物、配向制御剤及び有機酸遷移金属塩の添加順序は特に限定されない。また、大気条件下でもよい。通常、有機酸塩は固相法に用いられる原料であるが、水熱反応に用いることにより副反応を抑制することができる。
なお、この場合における反応混合液中のLiは、遷移金属に対してモル比で2倍以上用いることが好ましく、Li:Mが2.5:1〜3:1程度がより好ましい。
【0026】
有機酸遷移金属塩(R)2MのRで示される有機酸としては、炭素数1〜20の有機酸が好ましく、炭素数2〜12の有機酸がより好ましい。より具体的な有機酸としては、シュウ酸、フマル酸等のジカルボン酸、乳酸等のヒドロキシカルボン酸、酢酸等の脂肪酸が挙げられる。
【0027】
該水分散液は塩基性とするのが、副反応を防止し、ケイ酸化合物を溶解するうえで重要である。具体的には、該水分散液のpHが12.0〜13.5であるのが副反応(Fe3O4の生成)の防止、ケイ酸化合物の溶解性及び反応の進行の点で特に好ましい。該水分散液のpHの調整は、塩基、例えば、水酸化ナトリウムを添加することにより行ってもよいが、ケイ酸化合物としてNa4SiO4を用いるのが特に好ましい。
【0028】
水熱反応は、100℃以上であればよく、130〜180℃が好ましく、さらに140〜160℃が好ましい。水熱反応は耐圧容器中で行うのが好ましく、130〜180℃で反応を行う場合この時の圧力は0.3〜0.9MPaとなり、140〜160℃で反応を行う場合の圧力は0.3〜0.4MPaとなる。水熱反応時間は1〜24時間が好ましく、さらに3〜12時間が好ましい。
【0029】
当該水熱反応により、Li2MSiO4(Mは前記と同じ)が高収率で得られる。また、得られたLiMSiO4の平均粒径は10〜100nmとなり、その結晶度も高い。
【0030】
得られたLi2MSiO4は、ろ過後、乾燥することにより単離できる。乾燥手段は、凍結乾燥、真空乾燥が用いられる。
【0031】
得られたLi2MSiO4は、カーボン担持し、次いで焼成することにより、リチウムイオン二次電池用正極活物質とすることができる。カーボン担持は、Li2MSiO4に常法により、グルコース、フルクトース、ポリエチレングリコール、ポリビニルアルコール、カルボキシメチルセルロース、サッカロース、デンプン、デキストリン、クエン酸等の炭素源及び水を添加し、次いで焼成すればよい。焼成条件は、不活性ガス雰囲気下又は還元条件下に400℃以上、好ましくは400〜800℃で10分〜3時間、好ましくは0.5〜1.5時間行うのが好ましい。かかる処理によりLi2MSiO4表面にカーボンが担持された正極活物質とすることができる。炭素源の使用量は、Li2MSiO4 100質量部に対し、炭素源に含まれる炭素として3〜15質量部が好ましく、炭素源に含まれる炭素として5〜10質量部がさらに好ましい。
【0032】
得られた正極活物質は、放電容量の点で優れており、二次電池の正極材料として有用である。本発明の正極活物質を適用できる二次電池としては、リチウムイオン二次電池であればよく、正極と負極と電解液とセパレータを必須構成とするものであれば特に限定されない。
【0033】
ここで、負極については、リチウムイオンを充電時には吸蔵し、かつ放電時には放出することができれば、その材料構成で特に限定されるものではなく、公知の材料構成のものを用いることができる。たとえば、リチウム金属、グラファイト又は非晶質炭素等の炭素材料等である。そしてリチウムを電気化学的に吸蔵・放出し得るインターカレート材料で形成された電極、特に炭素材料を用いることが好ましい。
【0034】
電解液は、有機溶媒に支持塩を溶解させたものである。有機溶媒は、通常リチウムイオン二次電池の電解液の用いられる有機溶媒であれば特に限定されるものではなく、例えば、カーボネート類、ハロゲン化炭化水素、エーテル類、ケトン類、ニトリル類、ラクトン類、オキソラン化合物等を用いることができる。
【0035】
支持塩は、その種類が特に限定されるものではないが、LiPF6、LiBF4、LiClO4及びLiAsF6から選ばれる無機塩、該無機塩の誘導体、LiSO3CF3、LiC(SO3CF3)2及びLiN(SO3CF3)2、LiN(SO2C2F5)2及びLiN(SO2CF3)(SO2C4F9)から選ばれる有機塩、並びに該有機塩の誘導体の少なくとも1種であることが好ましい。
【0036】
セパレータは、正極及び負極を電気的に絶縁し、電解液を保持する役割を果たすものである。たとえば、多孔性合成樹脂膜、特にポリオレフィン系高分子(ポリエチレン、ポリプロピレン)の多孔膜を用いればよい。
【実施例】
【0037】
以下、本発明について、実施例に基づき具体的に説明するが、本発明はこれら実施例に限定されるものではない。
【0038】
[実施例1]
LiOH・H2O 4.20g(0.1mol)、Na4SiO4・nH2O 6.99g(0.025mol)、Na2S2O4 4.35g(0.025mol)に超純水75cm3を加えて混合した(この時のpHは約12.5)。この水分散液にFeSO4・7H2O6.95g(0.025mol)を添加し、混合した。得られた混合液をオートクレーブに投入し、150℃で16hr水熱反応を行った。反応液をろ過後、凍結乾燥した。凍結乾燥(約12時間)して得られた粉末8.4gにグルコース(炭素濃度として10%)及び超純水10cm3を加え、還元雰囲気下で600℃で1hr焼成した。
【0039】
[比較例1]
Na2S2O4を加えなかった以外、実施例1と同様にして、凍結乾燥粉末を得た。
【0040】
[試験例1]
実施例1及び比較例1で得られた凍結乾燥粉末のX線回折を行った。このときのX線回折の測定はRINT−UltimaII(リガク社製)で行い、測定条件は、ターゲットCuKα、管電圧40 kV、管電流40 mA、走査範囲10〜80°(2θ)、ステップ幅0.02°、およびスキャンスピード2.00°/minとした。得られたX線回折図を図1に示す。図1から明らかなように、(011)面のピーク強度に対する(010)面のピーク強度は、比較例1で得られた粉末は0.5倍であったのに対し、実施例1で得られた粉末は1.3倍であり、ある特定の方向への結晶配向性を有するよう制御されているであろうことがわかる。なお、(200)面のピーク強度に対する(010)面のピーク強度は、比較例1では1.2倍であり、実施例1では3.4倍であった。
【0041】
[試験例2]
実施例1及び比較例1で得られた焼成物を用い、リチウムイオン二次電池の正極を作製した。実施例1及び比較例1で得られた焼成物、ケッチェンブラック(導電剤)、ポリフッ化ビニリデン(粘結剤)を重量比75:15:10の配合割合で混合し、これにN−メチル−2−ピロリドンを加えて充分混練し、正極スラリーを調製した。正極スラリーを厚さ20μmのアルミニウム箔からなる集電体に塗工機を用いて塗布し、80℃で12時間の真空乾燥を行った。その後、φ14mmの円盤状に打ち抜いてハンドプレスを用いて16MPaで2分間プレスし、正極とした。
【0042】
次いで、上記の正極を用いてコイン型リチウムイオン二次電池を構築した。負極には、φ15mmに打ち抜いたリチウム箔を用いた。電解液には、エチレンカーボネート及びエチルメチルカーボネートを体積比1:1の割合で混合した混合溶媒に、LIPF6を1mol/lの濃度で溶解したものを用いた。セパレータには、ポリプロピレンなどの高分子多孔フィルムなど、公知のものを用いた。これらの電池部品を露点が−50℃以下の雰囲気で常法により組み込み収容し、コイン型リチウム二次電池(CR−2032)を製造した。
【0043】
製造したリチウムイオン二次電池を用いて定電流密度での充放電を4サイクル行った。このときの充電条件は電流0.1CA(33mA/g)、電圧4.5Vの定電流定電圧充電とし、放電条件は電流0.1CA、終止電圧1.5Vの定電流放電とした。温度は全て30℃とした。実施例1の正極材で構築した電池の充放電曲線を図2に、比較例1の正極材で構築した電池の充放電曲線を図3に示す。
【0044】
図2〜3より、制御された均一性の高い本発明の正極材料を用いたリチウムイオン二次電池は、優れた電池物性を有することがわかる。
【特許請求の範囲】
【請求項1】
Li2MSiO4(式中、MはFe、Ni、Co又はMnから選ばれる1種又は2種以上を示す)で表され、かつ
X線回折図において、(011)面のピーク強度に対する(010)面のピーク強度が0.6倍以上であることを特徴とする、オリビン型シリケート化合物。
【請求項2】
Li2MSiO4が、Li2FeSiO4である請求項1に記載のオリビン型シリケート化合物。
【請求項3】
請求項1又は2に記載のオリビン型シリケート化合物を含有する二次電池用正極活物質。
【請求項4】
請求項3に記載の二次電池用正極活物質を含む正極を有する二次電池。
【請求項5】
MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩又は(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を用い、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を水熱反応させることを特徴とする、請求項1又は2に記載のオリビン型シリケート化合物の製造方法。
【請求項6】
配向制御剤が、亜ジチオン酸イオンを含有する化合物である請求項5に記載のオリビン型シリケート化合物の製造方法。
【請求項7】
塩基性水分散液中の配向制御剤の含有量が、遷移金属に対してモル比で0.001〜1である請求項5又は6に記載のオリビン型シリケート化合物の製造方法。
【請求項8】
塩基性水分散液と、MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩の1種又は2種以上とを混合し、得られた混合物を水熱反応させる請求項5〜7のいずれか1項に記載のオリビン型シリケート化合物の製造方法。
【請求項9】
塩基性水分散液が、さらに(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を含有する請求項5〜7のいずれか1項に記載のオリビン型シリケート化合物の製造方法。
【請求項10】
リチウム化合物が、水酸化リチウム、炭酸リチウム、硝酸リチウム、酢酸リチウム、硫酸リチウムから選ばれるものである請求項5〜9のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項11】
ケイ酸化合物が、非晶質シリカ及びNa4SiO4から選ばれるものである請求項5〜10のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項12】
塩基性水分散液のpHが、12.0〜13.5である請求項5〜11のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項13】
MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩又は(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を用い、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を水熱反応させ、水熱反応後、得られたオリビン型シリケート化合物にカーボン担持し、次いで焼成することを特徴とする、請求項3に記載の二次電池用正極活物質の製造方法。
【請求項1】
Li2MSiO4(式中、MはFe、Ni、Co又はMnから選ばれる1種又は2種以上を示す)で表され、かつ
X線回折図において、(011)面のピーク強度に対する(010)面のピーク強度が0.6倍以上であることを特徴とする、オリビン型シリケート化合物。
【請求項2】
Li2MSiO4が、Li2FeSiO4である請求項1に記載のオリビン型シリケート化合物。
【請求項3】
請求項1又は2に記載のオリビン型シリケート化合物を含有する二次電池用正極活物質。
【請求項4】
請求項3に記載の二次電池用正極活物質を含む正極を有する二次電池。
【請求項5】
MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩又は(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を用い、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を水熱反応させることを特徴とする、請求項1又は2に記載のオリビン型シリケート化合物の製造方法。
【請求項6】
配向制御剤が、亜ジチオン酸イオンを含有する化合物である請求項5に記載のオリビン型シリケート化合物の製造方法。
【請求項7】
塩基性水分散液中の配向制御剤の含有量が、遷移金属に対してモル比で0.001〜1である請求項5又は6に記載のオリビン型シリケート化合物の製造方法。
【請求項8】
塩基性水分散液と、MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩の1種又は2種以上とを混合し、得られた混合物を水熱反応させる請求項5〜7のいずれか1項に記載のオリビン型シリケート化合物の製造方法。
【請求項9】
塩基性水分散液が、さらに(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を含有する請求項5〜7のいずれか1項に記載のオリビン型シリケート化合物の製造方法。
【請求項10】
リチウム化合物が、水酸化リチウム、炭酸リチウム、硝酸リチウム、酢酸リチウム、硫酸リチウムから選ばれるものである請求項5〜9のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項11】
ケイ酸化合物が、非晶質シリカ及びNa4SiO4から選ばれるものである請求項5〜10のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項12】
塩基性水分散液のpHが、12.0〜13.5である請求項5〜11のいずれか1項に記載のオリビン型シリケート化合物の製造法。
【請求項13】
MSO4(式中、MはFe、Ni、Co又はMnを示す)で表される遷移金属硫酸塩又は(R)2M(式中、Rは有機酸残基を示し、MはFe、Ni、Co又はMnを示す)で表される有機酸遷移金属塩を用い、リチウム化合物、ケイ酸化合物及び配向制御剤を含有する塩基性水分散液を水熱反応させ、水熱反応後、得られたオリビン型シリケート化合物にカーボン担持し、次いで焼成することを特徴とする、請求項3に記載の二次電池用正極活物質の製造方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−89298(P2013−89298A)
【公開日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願番号】特願2011−225705(P2011−225705)
【出願日】平成23年10月13日(2011.10.13)
【出願人】(000000240)太平洋セメント株式会社 (1,449)
【出願人】(305027401)公立大学法人首都大学東京 (385)
【Fターム(参考)】
【公開日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願日】平成23年10月13日(2011.10.13)
【出願人】(000000240)太平洋セメント株式会社 (1,449)
【出願人】(305027401)公立大学法人首都大学東京 (385)
【Fターム(参考)】
[ Back to top ]

