低温殺菌処理ホエータンパク濃縮物を含む腸管炎症抑制剤
【課題】低温殺菌処理することで得られたホエータンパク濃縮物の新たな用途を提供すること。
【解決手段】低温殺菌処理することで得られたホエータンパク濃縮物を含む腸管炎症抑制剤。前記ホエータンパク濃縮物は、一元免疫拡散法で測定した抗体含有量が20mg/g以上である。本発明の炎症抑制剤は、潰瘍性大腸炎の治療に用いられる。
【解決手段】低温殺菌処理することで得られたホエータンパク濃縮物を含む腸管炎症抑制剤。前記ホエータンパク濃縮物は、一元免疫拡散法で測定した抗体含有量が20mg/g以上である。本発明の炎症抑制剤は、潰瘍性大腸炎の治療に用いられる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、低温殺菌処理ホエータンパク濃縮物を含む腸管炎症抑制剤に関する。
【背景技術】
【0002】
近年、日本人において慢性消化管疾患が増加している。特に過敏性腸炎や潰瘍性大腸炎の増加は深刻になりつつある。これらの疾患は慢性的に継続する下痢や腹痛によって、罹患者の社会活動が大幅に制限される。また、これら慢性的な腸管炎症の継続は、致死的疾患になりうる大腸ガンの発症リスクが高まるといる報告(非特許文献1)もある。
【0003】
腸管炎症の一つである潰瘍性大腸炎は、症状としては、下血を伴うまたは伴わない下痢とよく起こる腹痛で、病変は直腸から連続的に、そして上行性(口側)に広がり、最大で直腸から結腸全体に拡がる(非特許文献2)。直接的な原因は未だ不明であるが、食生活の変化やストレスこれらによって生じる、腸内細菌の変化ならびに自己免疫反応の異常(アレルギー)、の関与などが考えられている。また原因が確定していないこともあり治療法は主に抗炎症を志向した、副腎皮質ホルモンや免疫抑制剤等を用いており、根治はなかなか難しいとされている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2006-151914号公報
【特許文献2】特開2006-136259号公報
【非特許文献】
【0005】
【非特許文献1】Bernstein, C. N., Blanchard, J. F., Kliewer, E., and Wajda, A. (2001) Cancer 91(4), 854-862
【非特許文献2】Bouma, G., and Strober, W. (2003) Nat Rev Immunol 3(7), 521-533
【非特許文献3】片山耕他、第52回(中)日本リウマチ学会総会・学術集会(2008.4.21)「ミルク抗体の関節リウマチ治療効果」
【非特許文献4】岩附聡他、月刊フードケミカル2007-3「乳清タンパクの新たな応用」
【非特許文献5】Cooper, H. S., Murthy, S. N., Shah, R. S., and Sedergran, D. J. (1993) Lab Invest 69(2), 238-249
【非特許文献6】Bieri, J. G. (1979) J Nutr 109(5), 925-926
【非特許文献7】Takano, Y., Matsuura, T., Yoshikawa, Y., Satsu, H., Sato, R., and Shimizu, M. (2007) Biosci Biotechnol Biochem 71(6), 1487-1493
【発明の概要】
【発明が解決しようとする課題】
【0006】
ところで、北海道内では多くのチーズ工房で盛んにチーズが生産されており、地域資源としても認定されるようになってきた。チーズ生産過程で排出されるチーズホエーは様々な有用成分を含むが殺菌方法によって生乳由来の機能タンパク質の量ならびに質が変化することがわかっている。大規模なチーズ生産工場などでは高温による殺菌・乾燥処理を行っており、市販のホエーパウダー等では機能性タンパク質等が変性してしまっている可能性が高い。
【0007】
一方、近年の研究で、ミルク抗体を多く含有するホエータンパク濃縮物であるアサマ乳清たんぱくが関節リウマチに対する治療効果を有することが報告されている(非特許文献3、4)。
【0008】
非特許文献3および4には、ミルク抗体が関節リウマチの発症原因と考えられている腸内の毒素産生細菌が産生した毒素を中和することで、上記治療効果が得られていると推察している。また、抗細菌内毒素抗体を用いることで関節リウマチに対する予防、治療および再発防止ができることも報告されている(特許文献1)
【0009】
しかし、低温殺菌処理することで得られたホエータンパク濃縮物の関節リウマチに対する治療効果が得られる作用機構等については、正確には分かっていない。さらに、低温殺菌処理することで得られたホエータンパク濃縮物の関節リウマチ以外の疾患に対する治療効果についても、十分に解明されていないのが現状である。
【0010】
そこで、本発明の目的は、低温殺菌処理することで得られたホエータンパク濃縮物の新たな用途を提供することにある。
【0011】
本発明者らは、低温殺菌処理することで得られたホエータンパク濃縮物の新たな用途を拓くべく種々検討を行った。その結果、低温殺菌処理することで得られたホエータンパク濃縮物が潰瘍性大腸炎に対する治療効果を有することを見出して、本発明を完成させた。
【課題を解決するための手段】
【0012】
本発明は、低温殺菌処理することで得られたホエータンパク濃縮物を含む腸管炎症抑制剤に関するものであり、特に、本発明は、潰瘍性大腸炎の治療に用いられる炎症抑制剤に関するものである。
【発明の効果】
【0013】
本発明によれば、潰瘍性大腸炎の治療に用いられる炎症抑制剤を提供することができる。
【図面の簡単な説明】
【0014】
【図1】殺菌処理の違いによる、ホエータンパク濃縮物のSDS-PAGEパターンの違いを示す。
【図2】試験飼育期間中のマウスの全身状態を示す。
【図3】動物実験1における体重の変化を示す。
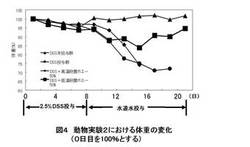
【図4】動物実験2における体重の変化を示す。
【図5】大腸絨毛の形態を示す。
【図6】低温処理ホエーのプロテアーゼ分解物のSDS-PAGEパターンを示す。
【発明を実施するための形態】
【0015】
本発明は、低温殺菌処理することで得られたホエータンパク濃縮物を含む腸管炎症抑制剤に関する。本発明で用いられる低温殺菌処理することで得られたホエータンパク濃縮物は以下の方法で製造することができる。
【0016】
生乳からクリーム成分を除去して得られた脱脂乳を低温殺菌処理する。低温殺菌処理は、脱脂乳に含まれる抗体が変性により失活しない条件、または極力失活が抑制できる条件で実施することが好ましい。そのような条件としては、例えば、65℃、30分を挙げることができる。但し、加熱時間が長くなると生産効率を低下させることから、温度を高めて時間を短く設定することもできる。例えば、70〜75℃の温度で、60〜10秒の範囲とすることもできる。その際、加熱による抗体の変性を抑制する目的で、加熱の前に脱脂乳に糖質を添加することもできる(特許文献2)。尚、加熱時間は長くなるが、65℃よりさらに低温での殺菌や静菌をすることも可能である。
【0017】
低温殺菌処理した脱脂乳は、次いで、常法によりカゼインを除去してホエーを得る。
【0018】
また、チーズ生産過程で排出されるチーズホエーを用いることもできる。
【0019】
これらのホエーは、通常、固形分として、タンパク質を約10〜20質量%、糖類を約60〜80質量%を含み、残部が灰分である(固形分濃度は約10質量%)。そこで、糖類を除去してホエータンパク質を濃縮して、ホエータンパク質に富んだ、即ち、抗体含有量の高いホエータンパク濃縮物を得る。糖類除去により、例えば、固形分として、タンパク質を約60〜80質量%、糖類が約20〜40質量%を含むホエータンパク濃縮物が得られる。ホエーの濃縮方法には特に制限はないが、例えば、膜分離法等を利用できる。また、膜分離法後のホエータンパク濃縮物(固形分濃度は約10質量%)を乾燥して、粉体等とすることもできる。乾燥方法には特に制限はないが、ホエータンパク質の変性を抑制するという観点から、フリーズドライを用いることが適当である。
【0020】
原料として用いる生乳は、例えば、牛乳を挙げられるが、牛乳以外に、山羊乳、羊乳、馬乳、らくだ乳、水牛乳等を用いることもできる。
【0021】
上記方法で得られたホエータンパク濃縮物は、高い抗体含有量を有し、例えば、一元免疫拡散法で測定された抗体含有量は、20mg/g以上である。本発明の炎症抑制剤においては、より高い炎症抑制作用を得るという観点からは、ホエータンパク濃縮物は、35mg/g以上の抗体含有量であることが好ましい。上記方法で得られたホエータンパク濃縮物の抗体含有量の上限は、原料として用いる生乳の種類や殺菌処理条件等により異なるが、通常は80mg/g程度である。
【0022】
(抗体量の測定法)
本発明における抗体含有量の測定はThe Binding Site社(Birmingham,U.K.)の測定キットBovine IgG - NL RIDを用いた一元免疫拡散法(SRID)で行った。
【0023】
本発明の腸管炎症抑制剤が用いられる腸管は大腸であることができ、本発明の炎症抑制剤は、潰瘍性大腸炎の治療に用いられる。
【0024】
本発明の腸管炎症抑制剤は、ホエータンパク濃縮物が有する抗体含有量によっても異なるが、例えば、抗体含有量が35mg/gのホエータンパク濃縮物の場合、ホエータンパク濃縮物を体重1kg当たり0.005〜0.5g、1日1回または2〜3回に分けて経口投与することができる。有効成分であるホエータンパク濃縮物は、粉末、錠剤またはカプセル剤等とすることができる他、加工食品の原料として添加し、該加工食品とすることもできる。また投与形態は、主に経口である。
【実施例】
【0025】
以下に本発明を実施例によりさらに詳細に説明する。但し、本発明は実施例により限定される意図ではない。
【0026】
参考例1(低温処理ホエータンパク濃縮物の調製方法)
生乳(乳脂肪分3.4%、抗体含量0.21mg/ml)を65℃、30分間加熱殺菌し、常法通りにカゼインカードを製造し、副産物として酸ホエー(タンパク含量0.9%)を得た。この酸ホエーから限外濾過法にて乳清タンパク溶液を得た。この乳清タンパク溶液を噴霧乾燥して乳清タンパク(WPC)を得た。この乳清タンパク濃縮物の抗体含有量は60mg/gであった。
【0027】
参考例2(高温処理ホエータンパク濃縮物の調製方法)
生乳(乳脂肪分3.4%、抗体含量0.21mg/ml)を75℃、30分間加熱して殺菌した。その後、通常の方法で、遠心分離し脱脂乳を得、乳酸を添加して酸性化したのち、圧搾してカゼインカードを分離して酸ホエーを得、限外ろ過にて乳糖を分離し、噴霧乾燥して乳清タンパク(WPC)を得た。この乳清タンパクの抗体含有量は10mg/gであった。
【0028】
1.ホエータンパクの確認
実験に用いるに当たり、参考例1および2で得た、高温処理ならびに低温処理ホエータンパク濃縮物特徴を確認するためにドデシル硫酸ナトリウム電気泳動(SDS-PAGEを行った。方法は常法に則って行い、ゲルは5-20%のグラジエントゲルを用い、染色はCBBを用いた。
【0029】
図1に動物実験に用いたホエータンパク質のSDS-PAGEのパターンを示す。その結果低温処理と高温処理では、パターンが大きく異なり、低温処理では高温処理で主要なバンドとして認められなかった、75K、60Kならびに30K付近に主要なバンドが確認された。
【0030】
2.動物実験
低温殺菌処理することで得られたホエータンパク濃縮物の、潰瘍性大腸炎の実験動物モデル系(非特許文献5)に与える影響について調査した。
【0031】
4週齢のBALB/cマウス(♀)を5匹ずつ8群に分け6日間順化飼育した後、2群ずつ標準飼料(AIN-76(非特許文献6))に高温殺菌処理ホエータンパク濃縮物(高温処理ホエー)ならびに低温殺菌ホエータンパク濃縮物(低温処理ホエー)を配合した飼料を給餌した。ホエータンパク質の配合量は、飼料添加タンパク質(通常はカゼイン)の25%〜50%とし、飼料中のタンパク質量を統一するために、ホエー添加量に合わせてカゼインを減量した。なお、腸管への炎症は2.5%デキストラン硫酸ナトリウム(DSS)を飲水させることにより発症させた(非特許文献5)。
【0032】
飼育方法は以下の2種類を行った。実験1)、発症の遅延ならびに、症状への効果を見る実験:1週間の試験飼育の後、2週間試験食とともにDSSを飲水投与。2)回復能を見る実験:1週間の試験飼育の後、8日間試験食とともにDSSを飲水投与、8日以降はDSS水を水道水に切り替え回復能を見る。両者とも、2週間の試験飼育の後、大腸を摘出し、一部はホルマリン固定した後、ミクロトームを用いて切片を調製した後、ヘマトキシリンーエオシン染色(H-E染色)を行い、大腸絨毛の形態を観察した。また腸管粘膜の主要成分であるMucin(Mucin1)の量をMucin1の抗体を用いたウエスタンブロッティング法によって調べた。
【0033】
3.ホエータンパク質のプロテアーゼ処置
プロテアーゼA(天野製薬、日本)を用いてホエータンパク質を分解した(非特許文献7)。分解物はSDS−PAGEに供した。
【0034】
図2にDSS投与8日目のマウスの写真を示す。投与8日目において、DSS投与群では、体毛の状態が、不均一になり、毛並みが乱れていることが見て取れる。一方、DSSとともに、食餌に低温処理ホエーを添加したマウスは、通常飼育と比較する、毛並みは乱れているものの、DSS投与群と比較すると、通常飼育に近く全身状態が緩和されていることが見て取れた。なお、下痢ならびに血便は、DSS投与4日目より生じた。
【0035】
続いて、飼育期間中の、体重の変化を図2に示す。DSS投与群すべてにおいて、体重の減少が認められた。ホエー投与群においては、低温殺菌処理ホエータンパク濃縮物添加群では、有意な体重減少緩和傾向が見られた。一方高温殺菌処理ホエータンパク群においてはコントロール群と有意な差は認められなかった。
【0036】
また動物実験2において、回復能を調べた場合、コントロール群ならびに高温処理ホエー投与群は、症状が回復せず、水道水投与中に、死亡してしまったにもかかわらず、低温処理群では、順調に回復した。
【0037】
試験終了後、マウスの解剖大腸を摘出し、顕微鏡用切片を調製し、大腸絨毛の形態を観察した(図5)。その結界、DSS非投与群では、大腸絨毛の形態的特徴を示す、上皮細胞、大腸腺等が明瞭に観察されたが、DSS投与群では、大腸絨毛の形態は崩壊していた。
【0038】
また高温処理ホエー投与群においては、傷害の軽減は認められなかった。一方、低温処理ホエーを投与した群においては、大腸絨毛の傷害は認められるものの、傷害のレベルは、DSS投与群や高温処理投与群と比較して軽微であった。
【0039】
また、低温殺菌処理ホエータンパク濃縮物添加群は、粘膜の特徴を示すタンパク質であるMucin量の減少も抑えられていた。
【0040】
以上の結果より、低温処理ホエータンパク濃縮物は、潰瘍性大腸炎の発症モデル系であるDSS投与マウスへの、緩和効果が観察された。しかしながら、経口摂取したタンパク質は、胃ならびに小腸でプロテアーゼによって分解されるはずである。そこで、消化管モデル実験で用いられるプロテアーゼを用いて、低抗体ホエーを処理した。その結果、酵素処理数分で、低分子(ペプチド)へホエータンパク質は分解された(図6)
【0041】
以上の結果から、低温処理ホエーには、潰瘍性大腸炎モデル実験動物系において、腸管炎症緩和効果が見いだされた。この機能は低温処理ホエーにおいてのみ有意に認められ、高温処理ホエーでは認められなかった。すなわち食餌性低温処理ホエーには、腸管炎症を抑制する可能性が示唆された。
【0042】
低温処理ホエーと高温処理ホエーの質的違いは、図1で示したように、免疫グロブリンに相当するバンド(75K付近)が残存しており、これらのタンパク質の機能性によって上記の効果が生じる可能性が示唆された。一方、低温処理ホエーをプロテアーゼ処理するとそのほとんどが分解されたことから、消化管で作用する物質は、上記の残存タンパク(免疫グロブリン)が消化管で分解されたペプチド断片等である可能性も示唆された。
【産業上の利用可能性】
【0043】
本発明は、ホエータンパク濃縮物および腸管炎症抑制剤に関連する分野において有用である。
【技術分野】
【0001】
本発明は、低温殺菌処理ホエータンパク濃縮物を含む腸管炎症抑制剤に関する。
【背景技術】
【0002】
近年、日本人において慢性消化管疾患が増加している。特に過敏性腸炎や潰瘍性大腸炎の増加は深刻になりつつある。これらの疾患は慢性的に継続する下痢や腹痛によって、罹患者の社会活動が大幅に制限される。また、これら慢性的な腸管炎症の継続は、致死的疾患になりうる大腸ガンの発症リスクが高まるといる報告(非特許文献1)もある。
【0003】
腸管炎症の一つである潰瘍性大腸炎は、症状としては、下血を伴うまたは伴わない下痢とよく起こる腹痛で、病変は直腸から連続的に、そして上行性(口側)に広がり、最大で直腸から結腸全体に拡がる(非特許文献2)。直接的な原因は未だ不明であるが、食生活の変化やストレスこれらによって生じる、腸内細菌の変化ならびに自己免疫反応の異常(アレルギー)、の関与などが考えられている。また原因が確定していないこともあり治療法は主に抗炎症を志向した、副腎皮質ホルモンや免疫抑制剤等を用いており、根治はなかなか難しいとされている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2006-151914号公報
【特許文献2】特開2006-136259号公報
【非特許文献】
【0005】
【非特許文献1】Bernstein, C. N., Blanchard, J. F., Kliewer, E., and Wajda, A. (2001) Cancer 91(4), 854-862
【非特許文献2】Bouma, G., and Strober, W. (2003) Nat Rev Immunol 3(7), 521-533
【非特許文献3】片山耕他、第52回(中)日本リウマチ学会総会・学術集会(2008.4.21)「ミルク抗体の関節リウマチ治療効果」
【非特許文献4】岩附聡他、月刊フードケミカル2007-3「乳清タンパクの新たな応用」
【非特許文献5】Cooper, H. S., Murthy, S. N., Shah, R. S., and Sedergran, D. J. (1993) Lab Invest 69(2), 238-249
【非特許文献6】Bieri, J. G. (1979) J Nutr 109(5), 925-926
【非特許文献7】Takano, Y., Matsuura, T., Yoshikawa, Y., Satsu, H., Sato, R., and Shimizu, M. (2007) Biosci Biotechnol Biochem 71(6), 1487-1493
【発明の概要】
【発明が解決しようとする課題】
【0006】
ところで、北海道内では多くのチーズ工房で盛んにチーズが生産されており、地域資源としても認定されるようになってきた。チーズ生産過程で排出されるチーズホエーは様々な有用成分を含むが殺菌方法によって生乳由来の機能タンパク質の量ならびに質が変化することがわかっている。大規模なチーズ生産工場などでは高温による殺菌・乾燥処理を行っており、市販のホエーパウダー等では機能性タンパク質等が変性してしまっている可能性が高い。
【0007】
一方、近年の研究で、ミルク抗体を多く含有するホエータンパク濃縮物であるアサマ乳清たんぱくが関節リウマチに対する治療効果を有することが報告されている(非特許文献3、4)。
【0008】
非特許文献3および4には、ミルク抗体が関節リウマチの発症原因と考えられている腸内の毒素産生細菌が産生した毒素を中和することで、上記治療効果が得られていると推察している。また、抗細菌内毒素抗体を用いることで関節リウマチに対する予防、治療および再発防止ができることも報告されている(特許文献1)
【0009】
しかし、低温殺菌処理することで得られたホエータンパク濃縮物の関節リウマチに対する治療効果が得られる作用機構等については、正確には分かっていない。さらに、低温殺菌処理することで得られたホエータンパク濃縮物の関節リウマチ以外の疾患に対する治療効果についても、十分に解明されていないのが現状である。
【0010】
そこで、本発明の目的は、低温殺菌処理することで得られたホエータンパク濃縮物の新たな用途を提供することにある。
【0011】
本発明者らは、低温殺菌処理することで得られたホエータンパク濃縮物の新たな用途を拓くべく種々検討を行った。その結果、低温殺菌処理することで得られたホエータンパク濃縮物が潰瘍性大腸炎に対する治療効果を有することを見出して、本発明を完成させた。
【課題を解決するための手段】
【0012】
本発明は、低温殺菌処理することで得られたホエータンパク濃縮物を含む腸管炎症抑制剤に関するものであり、特に、本発明は、潰瘍性大腸炎の治療に用いられる炎症抑制剤に関するものである。
【発明の効果】
【0013】
本発明によれば、潰瘍性大腸炎の治療に用いられる炎症抑制剤を提供することができる。
【図面の簡単な説明】
【0014】
【図1】殺菌処理の違いによる、ホエータンパク濃縮物のSDS-PAGEパターンの違いを示す。
【図2】試験飼育期間中のマウスの全身状態を示す。
【図3】動物実験1における体重の変化を示す。
【図4】動物実験2における体重の変化を示す。
【図5】大腸絨毛の形態を示す。
【図6】低温処理ホエーのプロテアーゼ分解物のSDS-PAGEパターンを示す。
【発明を実施するための形態】
【0015】
本発明は、低温殺菌処理することで得られたホエータンパク濃縮物を含む腸管炎症抑制剤に関する。本発明で用いられる低温殺菌処理することで得られたホエータンパク濃縮物は以下の方法で製造することができる。
【0016】
生乳からクリーム成分を除去して得られた脱脂乳を低温殺菌処理する。低温殺菌処理は、脱脂乳に含まれる抗体が変性により失活しない条件、または極力失活が抑制できる条件で実施することが好ましい。そのような条件としては、例えば、65℃、30分を挙げることができる。但し、加熱時間が長くなると生産効率を低下させることから、温度を高めて時間を短く設定することもできる。例えば、70〜75℃の温度で、60〜10秒の範囲とすることもできる。その際、加熱による抗体の変性を抑制する目的で、加熱の前に脱脂乳に糖質を添加することもできる(特許文献2)。尚、加熱時間は長くなるが、65℃よりさらに低温での殺菌や静菌をすることも可能である。
【0017】
低温殺菌処理した脱脂乳は、次いで、常法によりカゼインを除去してホエーを得る。
【0018】
また、チーズ生産過程で排出されるチーズホエーを用いることもできる。
【0019】
これらのホエーは、通常、固形分として、タンパク質を約10〜20質量%、糖類を約60〜80質量%を含み、残部が灰分である(固形分濃度は約10質量%)。そこで、糖類を除去してホエータンパク質を濃縮して、ホエータンパク質に富んだ、即ち、抗体含有量の高いホエータンパク濃縮物を得る。糖類除去により、例えば、固形分として、タンパク質を約60〜80質量%、糖類が約20〜40質量%を含むホエータンパク濃縮物が得られる。ホエーの濃縮方法には特に制限はないが、例えば、膜分離法等を利用できる。また、膜分離法後のホエータンパク濃縮物(固形分濃度は約10質量%)を乾燥して、粉体等とすることもできる。乾燥方法には特に制限はないが、ホエータンパク質の変性を抑制するという観点から、フリーズドライを用いることが適当である。
【0020】
原料として用いる生乳は、例えば、牛乳を挙げられるが、牛乳以外に、山羊乳、羊乳、馬乳、らくだ乳、水牛乳等を用いることもできる。
【0021】
上記方法で得られたホエータンパク濃縮物は、高い抗体含有量を有し、例えば、一元免疫拡散法で測定された抗体含有量は、20mg/g以上である。本発明の炎症抑制剤においては、より高い炎症抑制作用を得るという観点からは、ホエータンパク濃縮物は、35mg/g以上の抗体含有量であることが好ましい。上記方法で得られたホエータンパク濃縮物の抗体含有量の上限は、原料として用いる生乳の種類や殺菌処理条件等により異なるが、通常は80mg/g程度である。
【0022】
(抗体量の測定法)
本発明における抗体含有量の測定はThe Binding Site社(Birmingham,U.K.)の測定キットBovine IgG - NL RIDを用いた一元免疫拡散法(SRID)で行った。
【0023】
本発明の腸管炎症抑制剤が用いられる腸管は大腸であることができ、本発明の炎症抑制剤は、潰瘍性大腸炎の治療に用いられる。
【0024】
本発明の腸管炎症抑制剤は、ホエータンパク濃縮物が有する抗体含有量によっても異なるが、例えば、抗体含有量が35mg/gのホエータンパク濃縮物の場合、ホエータンパク濃縮物を体重1kg当たり0.005〜0.5g、1日1回または2〜3回に分けて経口投与することができる。有効成分であるホエータンパク濃縮物は、粉末、錠剤またはカプセル剤等とすることができる他、加工食品の原料として添加し、該加工食品とすることもできる。また投与形態は、主に経口である。
【実施例】
【0025】
以下に本発明を実施例によりさらに詳細に説明する。但し、本発明は実施例により限定される意図ではない。
【0026】
参考例1(低温処理ホエータンパク濃縮物の調製方法)
生乳(乳脂肪分3.4%、抗体含量0.21mg/ml)を65℃、30分間加熱殺菌し、常法通りにカゼインカードを製造し、副産物として酸ホエー(タンパク含量0.9%)を得た。この酸ホエーから限外濾過法にて乳清タンパク溶液を得た。この乳清タンパク溶液を噴霧乾燥して乳清タンパク(WPC)を得た。この乳清タンパク濃縮物の抗体含有量は60mg/gであった。
【0027】
参考例2(高温処理ホエータンパク濃縮物の調製方法)
生乳(乳脂肪分3.4%、抗体含量0.21mg/ml)を75℃、30分間加熱して殺菌した。その後、通常の方法で、遠心分離し脱脂乳を得、乳酸を添加して酸性化したのち、圧搾してカゼインカードを分離して酸ホエーを得、限外ろ過にて乳糖を分離し、噴霧乾燥して乳清タンパク(WPC)を得た。この乳清タンパクの抗体含有量は10mg/gであった。
【0028】
1.ホエータンパクの確認
実験に用いるに当たり、参考例1および2で得た、高温処理ならびに低温処理ホエータンパク濃縮物特徴を確認するためにドデシル硫酸ナトリウム電気泳動(SDS-PAGEを行った。方法は常法に則って行い、ゲルは5-20%のグラジエントゲルを用い、染色はCBBを用いた。
【0029】
図1に動物実験に用いたホエータンパク質のSDS-PAGEのパターンを示す。その結果低温処理と高温処理では、パターンが大きく異なり、低温処理では高温処理で主要なバンドとして認められなかった、75K、60Kならびに30K付近に主要なバンドが確認された。
【0030】
2.動物実験
低温殺菌処理することで得られたホエータンパク濃縮物の、潰瘍性大腸炎の実験動物モデル系(非特許文献5)に与える影響について調査した。
【0031】
4週齢のBALB/cマウス(♀)を5匹ずつ8群に分け6日間順化飼育した後、2群ずつ標準飼料(AIN-76(非特許文献6))に高温殺菌処理ホエータンパク濃縮物(高温処理ホエー)ならびに低温殺菌ホエータンパク濃縮物(低温処理ホエー)を配合した飼料を給餌した。ホエータンパク質の配合量は、飼料添加タンパク質(通常はカゼイン)の25%〜50%とし、飼料中のタンパク質量を統一するために、ホエー添加量に合わせてカゼインを減量した。なお、腸管への炎症は2.5%デキストラン硫酸ナトリウム(DSS)を飲水させることにより発症させた(非特許文献5)。
【0032】
飼育方法は以下の2種類を行った。実験1)、発症の遅延ならびに、症状への効果を見る実験:1週間の試験飼育の後、2週間試験食とともにDSSを飲水投与。2)回復能を見る実験:1週間の試験飼育の後、8日間試験食とともにDSSを飲水投与、8日以降はDSS水を水道水に切り替え回復能を見る。両者とも、2週間の試験飼育の後、大腸を摘出し、一部はホルマリン固定した後、ミクロトームを用いて切片を調製した後、ヘマトキシリンーエオシン染色(H-E染色)を行い、大腸絨毛の形態を観察した。また腸管粘膜の主要成分であるMucin(Mucin1)の量をMucin1の抗体を用いたウエスタンブロッティング法によって調べた。
【0033】
3.ホエータンパク質のプロテアーゼ処置
プロテアーゼA(天野製薬、日本)を用いてホエータンパク質を分解した(非特許文献7)。分解物はSDS−PAGEに供した。
【0034】
図2にDSS投与8日目のマウスの写真を示す。投与8日目において、DSS投与群では、体毛の状態が、不均一になり、毛並みが乱れていることが見て取れる。一方、DSSとともに、食餌に低温処理ホエーを添加したマウスは、通常飼育と比較する、毛並みは乱れているものの、DSS投与群と比較すると、通常飼育に近く全身状態が緩和されていることが見て取れた。なお、下痢ならびに血便は、DSS投与4日目より生じた。
【0035】
続いて、飼育期間中の、体重の変化を図2に示す。DSS投与群すべてにおいて、体重の減少が認められた。ホエー投与群においては、低温殺菌処理ホエータンパク濃縮物添加群では、有意な体重減少緩和傾向が見られた。一方高温殺菌処理ホエータンパク群においてはコントロール群と有意な差は認められなかった。
【0036】
また動物実験2において、回復能を調べた場合、コントロール群ならびに高温処理ホエー投与群は、症状が回復せず、水道水投与中に、死亡してしまったにもかかわらず、低温処理群では、順調に回復した。
【0037】
試験終了後、マウスの解剖大腸を摘出し、顕微鏡用切片を調製し、大腸絨毛の形態を観察した(図5)。その結界、DSS非投与群では、大腸絨毛の形態的特徴を示す、上皮細胞、大腸腺等が明瞭に観察されたが、DSS投与群では、大腸絨毛の形態は崩壊していた。
【0038】
また高温処理ホエー投与群においては、傷害の軽減は認められなかった。一方、低温処理ホエーを投与した群においては、大腸絨毛の傷害は認められるものの、傷害のレベルは、DSS投与群や高温処理投与群と比較して軽微であった。
【0039】
また、低温殺菌処理ホエータンパク濃縮物添加群は、粘膜の特徴を示すタンパク質であるMucin量の減少も抑えられていた。
【0040】
以上の結果より、低温処理ホエータンパク濃縮物は、潰瘍性大腸炎の発症モデル系であるDSS投与マウスへの、緩和効果が観察された。しかしながら、経口摂取したタンパク質は、胃ならびに小腸でプロテアーゼによって分解されるはずである。そこで、消化管モデル実験で用いられるプロテアーゼを用いて、低抗体ホエーを処理した。その結果、酵素処理数分で、低分子(ペプチド)へホエータンパク質は分解された(図6)
【0041】
以上の結果から、低温処理ホエーには、潰瘍性大腸炎モデル実験動物系において、腸管炎症緩和効果が見いだされた。この機能は低温処理ホエーにおいてのみ有意に認められ、高温処理ホエーでは認められなかった。すなわち食餌性低温処理ホエーには、腸管炎症を抑制する可能性が示唆された。
【0042】
低温処理ホエーと高温処理ホエーの質的違いは、図1で示したように、免疫グロブリンに相当するバンド(75K付近)が残存しており、これらのタンパク質の機能性によって上記の効果が生じる可能性が示唆された。一方、低温処理ホエーをプロテアーゼ処理するとそのほとんどが分解されたことから、消化管で作用する物質は、上記の残存タンパク(免疫グロブリン)が消化管で分解されたペプチド断片等である可能性も示唆された。
【産業上の利用可能性】
【0043】
本発明は、ホエータンパク濃縮物および腸管炎症抑制剤に関連する分野において有用である。
【特許請求の範囲】
【請求項1】
低温殺菌処理することで得られたホエータンパク濃縮物を含む腸管炎症抑制剤。
【請求項2】
前記ホエータンパク濃縮物は、一元免疫拡散法で測定した抗体含有量が20mg/g以上である請求項1に記載の炎症抑制剤。
【請求項3】
腸管が大腸である請求項1または2に記載の炎症抑制剤。
【請求項4】
潰瘍性大腸炎の治療に用いられる請求項1〜3のいずれかに記載の炎症抑制剤。
【請求項1】
低温殺菌処理することで得られたホエータンパク濃縮物を含む腸管炎症抑制剤。
【請求項2】
前記ホエータンパク濃縮物は、一元免疫拡散法で測定した抗体含有量が20mg/g以上である請求項1に記載の炎症抑制剤。
【請求項3】
腸管が大腸である請求項1または2に記載の炎症抑制剤。
【請求項4】
潰瘍性大腸炎の治療に用いられる請求項1〜3のいずれかに記載の炎症抑制剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−51914(P2011−51914A)
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願番号】特願2009−200642(P2009−200642)
【出願日】平成21年8月31日(2009.8.31)
【出願人】(504300088)国立大学法人帯広畜産大学 (96)
【出願人】(506206133)ニュテックス株式会社 (4)
【出願人】(000101215)アサマ化成株式会社 (37)
【Fターム(参考)】
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願日】平成21年8月31日(2009.8.31)
【出願人】(504300088)国立大学法人帯広畜産大学 (96)
【出願人】(506206133)ニュテックス株式会社 (4)
【出願人】(000101215)アサマ化成株式会社 (37)
【Fターム(参考)】
[ Back to top ]

