分子のアレイから複製又は派生物を作製するための装置及び方法とその応用
分子のアレイの複製又は派生物を生成する方法であって、前記アレイは、分子の分離したサンプルの空間配置を含む方法は、サンプルごとに、他のサンプルの有効領域と分離している少なくとも一つの空間的に制限された有効領域をつくることを含み、キャリアの、結合アダプタ又は結合特性を供給された表面は、有効領域と接していることを含む。分子は、サンプルの複製又は派生物を生成するために有効領域の増幅薬によって増幅される。サンプルの複製又は派生物は、結合アダプタまたは結合特性によってキャリアに拘束される。その結果、キャリア上のサンプルの複製又は派生物の空間配置は、アレイのサンプルの空間配置に対応する。サンプルの複製を含んでいるキャリアは、アレイから取り除かれる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体分子又は化学的に生成された分子などの、分子のアレイから複製又は派生物を作製するための方法及び装置に関する。そして、特に、例えばDNAマイクロアレイ、RNAマイクロアレイ又はタンパク質マイクロアレイなどの、前記分子および/またはそれから派生した分子のマイクロアレイの複製又は派生物を作製するのに適するような方法及び装置に関する。そして、一次配列、その複製またはその派生物に関する反応と関連したDNA配列を特定するためのアレイの応用に関する。
【背景技術】
【0002】
マイクロアレイは、個々の位置の表面上の又はその中の多くの異なる生体分子の配置を指すものと理解される。前記位置は、スポットとも呼ばれて、一般的に、10μmから約1000μmにわたる直径を有する。生体分子の一つまたはいくつかの同一の個体群が、スポット内に存在する。しかしながら、ある意図的な重複を除いて、さまざまなスポットは、異なる生体分子を示す。生体分子は、表面に析出しうるか、表面の層の中に存在しうるか、キャビティ内に存在しうるか、または、粒子上又はその中に固定された方法で存在しうる。そして、粒子がアレイとして配置されることは可能である。
【0003】
従来は、マイクロアレイを作製するさまざまな技術があった。ある技術によれば、生体分子は、例えば光合成、化学的合成、スポット合成、プリント処理などを使用して、表面に直接合成される(その場合成(in−situ synthesis))。この種の光合成は、例えば、アフィメトリクス社(Affymetrix)によって使用され、スポット合成は、アジレント社(Agilent)によって実行される。コンビメートリックス社(Combimatrix)は、仮想の、電子的にアドレス可能な反応区画によって、DNAマイクロアレイを作製する。更なる技術によれば、(生体)分子は、最初に合成されて、その後、配列されたアレイとして表面に析出される。そして、この種の技術は、例えば、アジレント社(Agilent)、Gesim社およびバイオフルイディクス社(Biofluidix)によって、使用される。両技術は、高水準の技術費用を必要とする。異なる生体分子の数が増加するにつれて、そして、析出スポットの直径が小さくなるにつれて、前記技術費用は線形以上に増加する。さらに、この種のマイクロアレイが例えば2倍の物質を包含することになるとき、又は、被覆構造、すなわちスポットのサイズが低減されることになる場合、費用だけでなく、関係する時間量は、有意に増加する。マイクロアレイを作製するためのスタンピング技術は、[1]において説明される。
【0004】
アレイ上のその場合成(on−site synthesis)によって、何百万もの異なるDNA配列を生成することは可能である。しかし、新規なレイアウトまたは異なるパターンサイズを得るために、全体の製造工程を再編成することが必要である。これは、新しい機器設定を必要とし、光補助の合成の場合には、さらに新規なフォトリソグラフィー・マスク、デジタルミラーシステムの再プログラムを必要とし、マイクロアレイを製造するためのデジタルミラーの利用について説明した[2]を参照されたい。コストを抑えるために、これは、できるだけ回避される。
【0005】
ただ時間不足というだけのために、研究所での合成によって、および、マイクロアレイへの後のトランスミッションによって、例えばナノプロッターによって、物質の数万以上を移すことは不可能である。100万の異なる生体分子を有するマイクロアレイ上に相当数の点をつくるのには、何週も何ヶ月もかかる。その時間の間、表面化学は変化し、全部のマイクロアレイはもはや機能しない。
【0006】
従って、単純で安価な方法で、現存のマイクロアレイ、すなわち、作製するのが複雑で高価である周知の生体分子の規則的な配置を複製することが可能である手段による方法が望まれる。
【0007】
この問題に関するいくつかの基本概念は、すでに提示されている([3]及び[4])。[3]及び[4]は、一つ以上のビオチン化オリゴヌクレオチドが一つ以上のオリゴヌクレオチドにハイブリダイズして、第1の基板で増幅されることを特徴とする、オリゴヌクレオチドアレイを複製する方法を明示する。ビオチン化され、増幅されたオリゴヌクレオチドは、それからストレプトアビジンを有する第2の基板に固定させられる。ビオチン化されたオリゴヌクレオチドは、複製されたアレイを作製するために、機械的な力によってオリゴヌクレオチドから分離されうる。しかし、この種の複製処理は、高コストであり、追加の生化学的アンカーシステムを必要として、多くの場合、元のDNAマイクロアレイのネガティブコピーしか生成しないだろう。
【0008】
[5]はまた、ストレプトアビジン/ビオチン・システムを使用することによるDNAアレイの複製を説明する。[6]は、DNAがRNAにどのように複製されるかを説明する。
【0009】
約30年間、DNAは、研究所において増幅されてきた。特に、ポリメラーゼ連鎖反応(PCR)は標準技術としてほとんどすべての研究所へ到着した。そして、それは大部分の遺伝子の研究の基礎である。しかし、DNAを増やすことを可能にする他の技術、例えばNASBA、リコンビナーゼ・ポリメラーゼ増幅、ローリングサークル型増幅およびさまざまな他の等温増幅技術もある。
【0010】
前記技術は、一般的にDNAを増幅することを可能にするだけでなく、個々のDNA領域又はそのDNAのサブセットのターゲットとされた増幅を可能にする。特に開始点(プライマー)を選択することによって、特にDNAの個々の領域を増大させることもまた、可能である。大部分のDNA増幅処理が溶液中で生じ、これは、液相反応と呼ばれる。しかし、過去2、3年で、DNA増幅のための付加的な固相を利用し、その処理において前記固相で同上を増やすいくつかの方法が出てきている。例えば、スライドまたは固相上のプライマー伸長反応などである[9、10]。以下に、最も一般の方法のうちの2つである、DNAのブリッジ増幅と油中水型エマルジョンPCRの基本について説明する。
【0011】
DNAのブリッジ増幅:ブリッジ増幅のために、周知の、いわゆるアダプタ配列によって、両端で、(部分的には未知の)DNAは、まず伸長される。前記伸長は、表面上で相補的配列のための結合部位として機能する。表面へ結合が起こった後でしか、後に、増幅が起こらない。複製されて、こうして新しく作られたDNA鎖は、ここで、固定して(共有結合して)表面に拘束される。そして、固定していない端に、更なる結合部位を有する。前記更なる結合部位は、ここでまた、表面の適切な相当物に結合し、更なる増幅を始めうる。そして、それは次々に、一端で拘束され、自由端である他端では元の結合配列を有する新しいDNA鎖を作る。このように、一端で固定して拘束され、その他端が、表面に一時的に結合することを可能にする指数的な方法で、ますます多くの新規な鎖は、生成される。増幅の間、最初の鎖は、一端では固定して(共有結合して)拘束され、他端ではゆるく(非共有結合的に)拘束され、こうして分子ブリッジを生成する。これに関して、[11]は、ブリッジ増幅を一般的に説明し、[12]は、シークエンシングのためのブリッジ増幅の利用を説明する。
【0012】
油中水型エマルジョンPCRのために、一種のブリッジ増幅は、使用される。これは、ブリッジ増幅と同様、最初にアダプタ配列によって両サイドでDNA鎖を伸長することを必要とする。その後、伸長したDNAは、水性PCR混合および固相粒子(ビーズとも呼ばれる)と共に混合されて、油中で乳化される。その結果、油中水型エマルジョンが生じる。この油中水型エマルジョンのために、濃度は、理想的には、正確に1つのDNA鎖および正確に1つの粒子が各水滴内に捕捉されるように選択される。ブリッジ増幅によって、粒子の表面は、DNA複製がそれに共有結合して拘束されることを可能にする配列を含む。このように、粒子全体は、増幅によって元のDNAの複製で覆われうる。この技術は、シークエンサにおいて主に使用される。この技術において、ただ一つの定められた鎖しか、常に、固相または液相で増幅されない。
【0013】
タンパク質増幅、またはタンパク質合成において、適切な生化学システムによって、基本的にはまずRNAに転写され、それからタンパク質に翻訳されうるDNA鎖がある。RNAが十分に安定である場合、あるいは、充分な数のDNAテンプレートがある場合、多数のタンパク質は生成されうる。この技術は、RNAを経てDNAからタンパク質をつくることに関与する細胞内で起こっているナチュラルプロセスに対応し、そして、それは生化学の基礎および中心規範である。最近では、単純化された生化学システムが利用でき、それはタスクのこの複合体をマスターすることができて、こうして、少なくとも原理上は、実験室においてタンパク質をDNA鎖から作り出すことを可能にする。この点において、[7]はタンパク質マイクロアレイをDNAマイクロアレイから直接作り出す方法を説明し、[8]は、cDNAアンカーを有するタンパク質マイクロアレイを作製する方法を説明する。あるいは、タンパク質増幅はまた、それらに導入されるタンパク質コーディングDNAを有する、原核生物又は真核生物の細胞を使用して実行されうる。
【0014】
DNA配列をデコードするために、いわゆるシークエンシング法が使用される。そして、比較的最近のシークエンシング法の概要が[13]において提供される。加えて、DNAが粒子に結びつくシークエンシング法は、[14]において説明される。
【0015】
シークエンシングのために使用される非常に複雑な機械は、初めに分離されたDNAを捕捉するための、それを増幅するための、および、その後構成要素ごとにそれを読み出すための多数の反応ステップおよび技術を使用する。選択された反応化学およびシークエンシング法によって、高価なバイオインフォーマティックス方法で、全体としてDNA配列を再計算することは可能であり、こうして調べられた種のゲノムを得ることは可能である。
【0016】
以前のシークエンシング技術は、ゲル内でDNAを分離することを含んだ。これは、固相に基づかないアプローチであり、サンガーシークエンス(Sanger Sequencing)と呼ばれる。ごく最近の生成のシークエンサによって、1つが油中水型エマルジョンPCRによって働いて、こうして何百万もの粒子、例えば、異なるDNA断片の多くの同一の複製をそれぞれ運ぶビーズなどを生成する。配列を読み出すために、粒子は、130万から340万の異なるマイクロキャビティを有する、いわゆるPicoTiterPlate(商標)で配置され、そして、固定される。これは、すでにそれ自体マイクロアレイを示す。この点においては、シークエンシングのためのブリッジ増幅の利用が説明される[15]を参照されたい。
【0017】
生体分子の規則的な配置がこの方法ですでにつくられた場合であっても、それにもかかわらず周知の配列を有する従来のマイクロアレイのように使用されえない。というのも、粒子に拘束される生体分子の個々の配列はそれ自体でまだわかっていないからである。しかしながら、シークエンシング後、特定の粒子に拘束されたDNA断片の配列は、それ自体は知られる。
【0018】
例えばベルリンのマックスプランク分子遺伝学研究所(Max−Planck−Society for Molecular Genetics)と共にScineonの一部で、個々の粒子を取り出して、アレイとしてそれらを再利用することがなされた。しかし、この方法は、高コストで、この種のアレイの1つの標本しか生成することを可能にしない。
【0019】
ソフトリソグラフィまたはマイクロコンタクトプリンティングは、表面上に分子の析出を可能にし、そして、後に他の表面に同上を移すことを可能にするスタンピング技術である。それはまた、微細な空洞キャビティまたは微小流体を統合することを可能にし、こうして液体のための複雑な循環路を供給することを可能にする。前記循環路は、特定の方法で表面を処理し、こうして極めて微小な構造をコーティングする又は修飾することを可能にする。この目的のために使用された材料は、シリコーン(PDMS)である。PDMSの適切な表面の修飾によって、さまざまな生体分子は、表面に加えられることができて、こうして後に移されうる。生体分子だけでなくDNAおよびRNAも、移されうる。
【0020】
これらの移送プロパティは、特に、複製するステップのために、実施されうる。そして、[16]は、生体分子がソフトリソグラフィを使用して移されうる方法を説明する最初のものである。
【0021】
DNAアレイ又はDNAマイクロアレイは、主にいわゆる発現解析、シークエンシングおよび遺伝子又はSNP量の解析のために使用される。
【0022】
発現解析において、特定の遺伝子の活動のレベルを調べることが望まれる。伝令RNA(mRNA)は、これに関して標識とみなされる。この目的のために、例えば、薬を投与すること、環境要因を変化させること、圧迫することなどによって、細胞又は生物は刺激される。生物学的材料から、最初にmRNAを集めて、いわゆる相補的DNA(cDNA)にそれを転写して、それに色素を供給する。標準試料は、異なる色素を供給される。主に、緑及び赤の色素が使用される。等しい比率のサンプルが、混ぜ合わせられて、それからマイクロアレイに適用される。等しい濃度で、両方の元のサンプルにおいて、特定のDNA配列が含まれる場合、マイクロアレイの各スポットに、等しい濃度で、両方のサンプルからの相補的分子は拘束される。従って、このスポットを読み出すことにより、結果として二次的な色となる。緑及び赤の場合、黄色となる。それらの遺伝子配列の比率が等しくない場合、マイクロアレイの対応するスポットは、呈色が支配的な遺伝子産物を示す二次的色を含む。完全にオン又はオフに切替えられた遺伝子は、1つの色相又はその他だけを有する。色パターンはmRNAの量を割り出すことを可能にし、そして、検査された影響により特定の遺伝子がどれくらい強く活性化又は非活性化されたかについての手掛かりを供給する。[17]は、高度に並列なシークエンシングによるゲノム全体の研究のための発現プロファイリングの応用を明示する。
【0023】
SNP解析において、遺伝子配列が個々のミューテーション、すなわち、1つの塩基対を除いて同一である配列を含む(各塩基対の置換=一塩基多型)かどうかが調べられる。置換された塩基対の正確な位置は、置換が有機体に影響を及ぼさない又は軽微な影響しか与えないかどうか、又は、これが致命的な遺伝子欠陥であるかどうかを特定する。いくつかの深刻な遺伝病(例えばハンチントン舞踏病、パーキンソン病またはアルツハイマー病など)の場合において、この種の高度のSNPが知られている。多くの他のSNPによって、例えば糖尿病又はくる病などの特異的疾患に対する増加したリスクまたは感染のしやすさを推定されうる。SNP解析のために、DNAは、生物学的材料から直接集められて、色素で標識される。SNPごとに、マイクロアレイに4つのスポットがあり、各場合に同じ位置において、1つの塩基対が異なる。結合している位置のベースから、どの基部が未知サンプルの関連した位置にあるかについて特定することができ、それは[17]を参照されたい。
【0024】
タンパク質アレイについては、単独での製造はかなり困難である。というのも、DNAとは異なり、タンパク質は非常に広い範囲の溶解度、反応度および特異性を有するからである。従って、同じケミカルアンカを使用して、表面にさまざまなタンパク質を結合することは、些細なことではない。一般的に、タンパク質アレイは、数百から一千の異なるタンパク質を含む。タンパク質アレイは、結合研究のために主に使用される。これは、タンパク質アレイ上の標識分子を位置付けることを含む。従って、色づけを含むマイクロアレイ上のこの種のスポットは、検査された分子のための潜在的結合パートナーである。この技術は、特に、結合部位を見つけるために、エピトープ・マッピング(epitope mapping)に使用される。
【0025】
マイクロアレイのアーキテクチャそれ自体は、[18]において説明される。
【0026】
従って、マイクロアレイのアプリケーションは、広範囲であり、多種多様である。しかしながら、必要な財源の不足のため、または、それらの費用便益比率のため、それらは、使用において、かなり制限される。
【0027】
DNA配列は、生化学情報を含み、生化学的複製システムによって増幅されうる。DNA配列を複製するためのさまざまなアプローチは、個々の塩基対を表面に複製することから始まり、DNAが原理上、1つの表面から他方へどのように複製されうるかを示す、[4]、[5]及び[6]に記載されたアプローチに至るまで、すでに追求され続けてきた。
【0028】
また、タンパク質の複製がDNAアレイからどのように作られうるかについての論文[7]は、最近公表された。
【0029】
上記の引例は、既知の発明が、マイクロアレイを作製する2つの基礎技術、すなわち、一方では、部位に直接物質を生成すること、および、他方では、顕微鏡的な投与又はプリント工程によって、合成後に物質を移すことが可能であることを示す。これらの技術の各々は、技術的に複雑で、時間およびコストに関して高い消費を伴う。そして、物質の数が2倍になると、必要な時間およびコストも少なくとも2倍になるというのが普通である。さらに、DNAアレイ、その配列の場合、合成前に生化学情報についての正確な知識を有することは、必須である 。DNAの場合において前記情報を得るために、上で説明したように、いわゆるシークエンサは使用される。シークエンシングおよびマイクロアレイの製造間の直接的な製造チェーンは、これまで知られていなかった又は確立されていなかった。これは、未知の有機体が最初に配列を決められなければならないことを意味する。そして、その配列がシークエンサのデータから計算され、その後、アレイは作製される。このアレイによって、すぐに、発現パターンは検査されうる。加えて、知られた配列からタンパク質アレイを作り出すことが知られている。この製造チェーンは、非常に長期化し、高コストである。
【0030】
簡単な方法でDNAアレイの派生物として直接タンパク質アレイを作製することが可能である場合、表現型および遺伝子型間のカップリングは保持されるだろう。そして、空間的に分離された方法で、派生物上で反応を実行して(抗原抗体、酵素反応)、それらを基礎となっているDNA配列と関連させることは可能であろう。
【先行技術文献】
【特許文献】
【0031】
【特許文献1】国際公開第2008/022332(WO 2008/022332 A2)
【特許文献2】米国特許第6017738号明細書(US 6017738)
【特許文献3】米国特許第6274351号明細書(US 6274351 B1)
【特許文献4】米国特許第6300070号明細書(US 6300070 B1)
【特許文献5】欧州特許第1203945号明細書(EP 1203945 B1)
【非特許文献】
【0032】
【非特許文献1】ユ A.A.ら著、「表面粗さを克服するコンタクトプリント法:液体超分子ナノスタンプ法」、Advanced materials 2007、19巻、p.4338−4342(Yu A.A. et al,“Contact Printing Beyond Surface Roughness: Liquid Supramolecular Nanostamping”,Adv.Mater.2007,19,pages 4338 to 4342)
【非特許文献2】ブランチャード A.P.、フレンド. S.H.著、Nature Biotechnology(1999)17、p.953以下参照(Blanchard A.P., Friend. S.H., Nature Biotech (1999) 17, Page 953 et seq.)
【非特許文献3】<URL: http://www.techno−preneur.net/technology/New−technologies/life−sciences/novel.htm>
【非特許文献4】キム J.、クルックス R.著、米国化学会誌、128、p.12076−12077、2006年(Kim J., Crooks R., JACS, 128, pages 12076 to 12077 (2006))
【非特許文献5】キム J.、クルックス R.著、Analytical Chemistry(2007)1,79、p.8994−8999(Kim J., Crooks R., Anal Chem(2007)1,79: pages 8994 − 8999)
【非特許文献6】ホー Mら著、Nature Methods(2008)、5、p.175−177(He M. et.al, Nat Methodes (2008), 5: pages 175 − 177)
【非特許文献7】ラマチャンドラン Nら著、Methods in Molecular Biology(2006)328、p.1−14(Ramachandran N, et.al; Methodes Mol Biol (2006); 328: pages 1 to 14)
【非特許文献8】エイブラムズ E.S.ら著、Diagnostic Gene Detection、1.9、p.171−189、1997年(Abrams E.S. et al, Diagnostic and Gene Detection Ch.1.9, pages 171−189 (1997))
【非特許文献9】Laborwelt誌、第3版、8巻、2007年(Laborwelt, edition 3,vol.8 (2007))
【非特許文献10】シェンジャー J.ら著、「次世代DNAシークエンシング」、Nature Biotechnology、26巻、10号、p.1135−1145、2008年10月(Shendure J. et al., “Next−generation DNA sequencing”,Nature Biotechnology, vol. 26, No. 10, October 2008, pages 1135 to 1145)
【非特許文献11】ゲノム分析のためのイルミナ・ハンドブック、2007年(Illumina Handbook for the Genome Analyzer (2007))
【非特許文献12】ケイン R.S.ら著、Biomaterials(1999)20、p.2363−2376(Kane R.S. et.al, Biomaterials (1999) 20, pages 2363 to 2376)
【非特許文献13】トーレス T.T.ら著、ゲノム研究、<URL: http://genome.cshlp.org/cgi/content/abstract/gr.6984908v1#otherarticles>(Torres T.T. et. al., Genome Research)
【発明の概要】
【発明が解決しようとする課題】
【0033】
本発明の目的は、時間及び費用の消費がほとんどなく分子のアレイから複製又は派生物を作製することを可能にする方法及び装置と、対応する複製又は派生物とこの種の複製又は派生物のための応用を提供することである。
【課題を解決するための手段】
【0034】
この目的は、本発明による、請求項1に記載の方法、請求項23に記載の複製、請求項34に記載の装置、および、請求項24、28、30、および32に記載の利用によって達成される。
【0035】
本発明の実施形態は、分子のアレイの複製又は派生物を作製する方法であって、そのアレイが分子の分離したサンプルの空間配置を含んでいる方法を供給する。その方法は、
サンプルごとに、その他のサンプルの有効領域と分離している、少なくとも一つの空間的に制限された有効領域をつくるステップであって、キャリアの、結合アダプタ又は結合特性を供給された、表面は、前記有効領域で接するステップ、
サンプルの複製又は派生物をつくるための有効領域に増幅薬によって生化学分子を増幅するステップ、
キャリア上のサンプルの複製又は派生物の空間配置が、そのアレイにおけるサンプルの空間配置に対応するように、結合アダプタ又は結合特性によって、サンプルの複製又は派生物をキャリアに結合するステップ、および、
そのアレイからサンプルの複製を含んでいるそのキャリアを取り除くステップ、を含む。
【0036】
本発明の実施形態は、対応する方法を使用することにより作製された分子のアレイの複製又は派生物を供給する。
【0037】
本発明の実施形態は、分子のアレイの複製又は派生物を作製するための装置を供給する。そして、そのアレイが分子の分離したサンプルの空間配置を含んでおり、そのデバイスは、
サンプルごとに、その他のサンプルの有効領域と分離している、少なくとも一つの空間的に制限された有効領域をつくる手段であって、キャリアの、結合アダプタ又は結合特性を供給された、表面が有効領域上で接している手段、
サンプルの複製又は派生物を作製するための有効領域において増幅薬によって生化学分子を増幅するための、そして、キャリア上のサンプルの複製又は派生物の空間配置がそのアレイにおけるサンプルの空間配置に対応するように、結合アダプタ又は結合特性によって、サンプルの複製又は派生物をキャリアに結合するための手段、および、
そのアレイからサンプルの複製を含んでいるそのキャリアを取り除くための手段、を含む。
【0038】
本発明によって、本発明が、その空間配置によって与えられる位置情報を保持すると共に、早くシンプルで安価な方法で、対応するアレイの複製又は派生物を作製することを可能にするように、他のサンプルの有効領域と分離している空間的に制限された有効領域は、分子のアレイ、例えば、DNAマイクロアレイの各サンプルに都合のいい形に作られる。
【0039】
特に、本発明の実施形態は、分子が生体分子または合成的に生成された化学分子であることを特徴とする、対応する方法及び装置に関する。本発明によれば、複製は、元の分子の1:1複製を意味するものと理解され、一方、派生物は、元の分子における変更、例えば、元の分子のディセンダントまたはサブセットを意味するものと理解されうる。本発明によれば、分子のサンプルは、アレイの異なる部位で配置された異なる分子、又は、そこに配置された分子の異なる混合物を意味するものと理解されうる。
【0040】
本発明の実施形態は、生化学情報についてのいかなる情報も有せずにマイクロアレイを複製することを可能にする。それは、特に、非合成のマイクロアレイを複製することも意味する。これは、すでにシークエンサから、そこにあるDNAの配置の複製を完全にコピーすることを可能にし、こうして、その配列の情報なしでDNAアレイを供給することを可能にする。
【0041】
このように、本発明の実施形態は、個々のサンプルの配列についてのいかなる情報も有せずにさえ、シークエンシング工程の前、後又はその間に、対応するマイクロアレイを作製することを可能にする。このように、アレイを合成的に生成する時間およびコストのかかる工程段階は、回避され、そして、アレイはそのシークエンシングから直接作製されうる。本発明の実施形態は、このように、早い方法で、および、そのマイクロアレイの生化学的配列又は情報が知られているかどうかとは独立して、所定のマイクロアレイの増幅またはパターンのコーティングを可能にする。本発明の実施形態はまた、異なるタスクセットに必要とされうるように、全く同じ原物から異なるバリエーションを作製することを可能にする。というのも、異なる生体分子(例えばDNA、RNAまたはタンパク質)が異なる生化学の問題のために使用されるからである。これまで、シークエンシング工程の前、間、後の適したDNA又はさらにはタンパク質マイクロアレイを作製することは可能ではなかった。
【0042】
本発明の実施形態は、生化学的複製工程の手段によって、シークエンシング工程の前、間又は後に、一次材料、例えば、分子の一次アレイから直接に二次マイクロアレイを作製することが可能であり、そして、必要であれば、更なるアレイの形で再び前記二次マイクロアレイをDNA、RNA、またはタンパク質に生化学的にマッピングすることを可能にする。加えて、異なる複製ステップの間、アレイのバリエーションは、例えば、ピクチャーの黄色部分しか複製されえないカラーコピーに相当する、特定の標識または配列を含む化学的形態で作製されうる。
【0043】
本発明の実施形態は、シークエンシング工程からのDNA配列の配置からのマイクロアレイの複製の作製に関する(例えばABIまたはロシュ454によるシークエンサのパーティクル・アレイ)。そして、それは今までに説明も実行もされなかった。DNAからDNAへの、または、DNAからタンパク質への生化学的に複製することなどの、個々のサブステップが、既知の発明において説明されたことがあったとしても、シークエンシング工程からマイクロアレイを作製するための個々のサブステップを組み合わせることは知られていない。特に、後にシークエンサから1つのDNAアレイからの複製を製造することによるDNAアレイの作製が続き、その後にそのDNAアレイからRNAアレイ又はDNAアレイの作製が続く、シークエンシングの製造ラインはこれまでに知られていなかった。
【0044】
すでに説明されたように、進行中のシークエンシング工程から早くもDNAアレイを作製することは先行技術からは公知ではない。また、直接前記DNAアレイを複製して、それから選択的修飾によって、DNAまたはRNAマイクロアレイのサブセットからタンパク質マイクロアレイに至るまで、それを改質することは、これまでに説明されなかった。本発明の実施形態は、初めて、シークエンシング工程の間のDNAアレイを作製、および、それにより一般的なマイクロアレイの研究を可能にするために要求されたアレイ表面にそれをすぐ変形させることを可能にする。本発明の実施形態では、マイクロアレイの骨の折れる合成製造は、このようにして完全に回避されうる。
【0045】
しかし、本発明の実施形態は、マイクロアレイをシークエンシング工程から複製することに限らない。むしろ、本発明の実施形態は、例えば、市販のマイクロアレイなどの平面的なマイクロアレイを、単純な方法かつ低コストで、直接複製することを可能にする。本発明の実施形態は、選択的にアレイの態様を完全にコピーし、RNA、DNAサブセット、cDNAまたはタンパク質アレイを作製するためにそれらを転写することを可能にする。
【0046】
例えば適切な増幅手段(例えばPCR、等温増幅、NASBA)や表面との結合アダプタまたは結合特性のマッチング(例えば、プライマー、ストレプトアビジン/ビオチン、抗原抗体、ポリヒスチジン/ニッケル複合体、静電気/力または磁気特性)などの適切な複製方法は、当業者にとって明らかであり、本願明細書においてされる更なる説明は必要ではない。この点において、また、この事項の教示が参照によりここに援用される序文において説明された文書を参照されたい。
【0047】
本発明の実施形態によれば、例えばDNAの遺伝情報の少なくとも一つの複製は、こうして、一次アレイと呼ばれうる遺伝的情報から作られる。そして、複製は、二次アレイと呼ばれうる。更なるアレイの複製(三次アレイとも呼ばれうる)は、さらにまた複製から作製されうる。三次および/または二次アレイは、同一の複製、相補的複製、サブセットまたはRNAまたはタンパク質アレイでありうる。そして、それは、一次および/または二次アレイに関して生化学の複製システムの選択次第である。
【0048】
本発明の実施形態では、一次アレイは、DNAシークエンサから生じる。基本的に、いかなる市販の粒子ベースのシークエンサも、これに関して考慮されうる。しかし、別の実施形態において、いかなる平面的なDNAマイクロアレイも、複製されることになる一次アレイとして使用されうる。本発明の実施形態は、一つの表面からもう一方への「複製工程」にも関する。ただし、アレイの各サンプルは、他の有効領域と分離しているそれに都合がいいように作られた空間的に制限された有効領域を有する。これは、生化学情報を含み、例えば、シークエンサにおいて、または、平面的なマイクロアレイに加えて、化学物質ライブラリにおいて作られるような、非平面的な表面または粒子アレイも含む、空間的に分離された方法で順序付けられた物質ライブラリを含む。
【0049】
本発明の実施形態では、使用される増幅薬は、いかなる周知の増幅薬でありうる。以前の増幅は、特定のDNA断片または配列を増幅することに照準を定めたものであった。この種の周知の増幅については、特定の鎖がどこで一般的に生じたかについての位置情報は保持されない。というのも、前記増幅が溶液中で起こるからである。本発明の実施形態では、対照的に、各サンプルが、都合がいいように他のサンプルの増幅薬領域と分離している空間的に制限された増幅薬領域を有するということにおける複製の作製において、ソース、すなわち、一次アレイから、その複製、すなわち二次アレイへの位置情報は、全体的に又は部分的に保持される。この位置情報は、レジストレーション(registration)ともしばしば呼ばれる。これは、例えば規則的なグリッド内のその配置(行と列、xとy位置)により定義されたような特定のDNA断片の位置を意味するものと理解される。この位置情報の少なくとも部分的な保持によって、本発明は、高品質の複製の作製を可能にする。位置情報がより多く保持されるほど、複製はより良いであろう。多数の複製が作られるとき、低い空間分解能は、ますます低い品質の複製を作り、結果的にある点で役に立たないだろう。
【0050】
本発明によれば、いかなる周知の増幅方法も、通常、使用され、実施形態によっては、PCRまたはブリッジ増幅は、使用されうる。ブリッジ増幅は、表面に使用されうる。従って、本発明の実施形態において、複製工程は、1つの表面から別のものへと生じるが、位置情報または複製された種類のレジストレーションは保持されるある種のブリッジ増幅を示す。別の実施形態において、付加的な結合システムはまた、複製をキャリアと結合すること、例えば[4]に記載されているようなストレプトアビジン/ビオチン・システムに使用されうる。しかし、結果として増加した複雑性をもたらす。
【0051】
本発明の実施形態において、結合アダプタは、アレイが複製されることになっているキャリアの全域にわたって配置されうる。
【0052】
本発明の実施形態では、結合アダプタは、複製される分子の配列に対して相補的であるプライマーである。
【0053】
本発明の実施形態において、位置情報の保持は、空間的に分離すること又は各サンプルと関連した増幅薬領域を区分することによって成し遂げられる。このように、個々の分子は、「マイクロコンパートメント」から逃げるのを防止されうる。その結果、空間分解能またはレジストレーションは保持される。すでに説明されたように、本発明の実施形態において、いかなる増幅技術も、PCRまたは等温増幅などの複製工程としてみなされうる。複製工程の間、複製は、ターゲット面上へ析出され、固定される。遺伝情報が全体的に又は部分的に保持されるという事実に加えて、位置情報もまた保持される。本発明の実施形態は、その表面の「単純な」複製を意味すると一般に理解される1:1複製を供給する。この工程において、原物の複製は作製される。そして、それは可能な限りの類似性の最高水準を有する。マイクロアレイの場合、複製工程の後に、DNAアレイから更なるDNAアレイを得ることになるだろう。
【0054】
本発明の実施形態は、アレイの一部分の複製、すなわち派生物を作製することを可能にする。一部分の複製または一部分のコピーは、コピーされる情報の特定の選択を意味すると理解される。例えば、DNAアレイを複製する工程の間、特定の種類のDNAのみが、キャリアが結合アダプタとして含むプライマーを選択することによって、増幅されうる。このように、例えば特定の配列又は特定のプロモータを含むあらゆるDNA鎖などの、要求された情報を含むサブセットは、得られる。
【0055】
同様に、派生物は、RNA又はcDNAへのDNAの、DNA、cDNA、又は、タンパク質へのRNAの複製の「コンバージョン(conversion)」と呼ばれる。これに関して、生化学情報は、一つの種類の分子から別のものに変換され、かつ、位置情報は依然として保持される。
【0056】
本発明の実施形態において、空間的に制限された増幅薬領域の形で制限された有効領域は、固体構造物によってつくられるが、本発明の別の実施形態において、粘性の異なるレベルの液体間の界面は、空間的に制限された有効領域をつくることに貢献する。
【0057】
加えて、本発明の実施形態は、他の分子または粒子との反応または相互作用についての、および、反応触媒作用についての解析目的のための複製および派生物の応用に関する。
【0058】
本発明の実施形態は、添付図を参照に、より詳細に以下で説明される。
【図面の簡単な説明】
【0059】
【図1】図1a〜図1dは、本発明の方法の実施形態を示すための模式的な断面表現を示す。
【図2】図2は、図式的に、PicoTiterPlate(商標)の断面の平面図を示す。
【図3】図3は、図式的に、DNA粒子を含んでいるシークエンサチップの断面表現を示す。
【図4】図4a〜図4cは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図5】図5a〜図5dは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図6a】図6aは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図6b】図6bは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図6c】図6cは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図6d】図6dは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図7】図7は、本発明の別の実施形態を示すための略図を示す。
【発明を実施するための形態】
【0060】
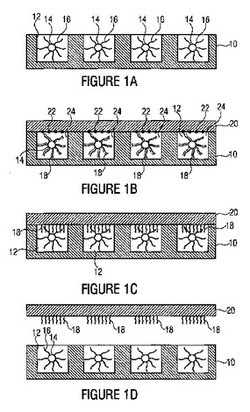
図1aから図1dに関して、発明の方法の実施形態について、以下に述べる。ここで、一次アレイは、シークエンサチップ10の形で存在する。シークエンサチップ10は、複数のマイクロキャビティ12を含む。マイクロキャビティ12を含んでいるシークエンサチップ10の断面の模式的な平面図は、図2に示される。マイクロキャビティは、例えば、図2に示されているように、44μmまたは29μmの直径を有しうる。シークエンサチップは、例えば、ロシュ(Roche)による454シークエンサのシークエンサチップ(GS FLX 2005および/またはGS FLX Titanium 2008)でありえる。
【0061】
キャビティ12の各々は、そこに配置された粒子14を有する。そして、前記粒子14の各々は、個々のDNA鎖16の何百万もの複製を運ぶ。それらに取り入れられたDNA鎖16を含んでいる粒子14を有するキャビティ12を含んでいるシークエンサチップ10の模式的な断面表現は、図3に示される。これまで、シークエンサチップは、シークエンシング工程後、廃棄されており、従って、シークエンシング工程の「老廃物」であった。
【0062】
図1から図3において表された実施形態において、このチップは、複製を作製するための一次アレイとして使用される。そのDNAは、キャビティ12からすっかりコピーされることになる。この目的のために、キャビティは、最初に増幅薬、例えばPCR混合物で満たされる。その後、図1bに示されているように、キャビティ12をシールし、図式的に図1bのスポット22として示され、増幅薬にマッチする結合アダプタを運ぶキャリア20は置かれる。一旦キャビティ12が蓋20によって塞がれると、空間的に制限された増幅薬領域24がこうして各サンプル、すなわち、それに拘束されたDNA鎖16を有する粒子14ごとに作られ、そして増幅薬領域24は、他のサンプルの増幅薬領域24から分離される。結合アダプタ22は、これらの増幅薬領域24に接する。例えば、結合アダプタ22は、PCR混合物とマッチングするプライマーである。前記プライマーは、DNAポリメラーゼのための結合部位である。図1bは、生化学的複製が粒子のDNAでできているポリメラーゼ・ステップの後の状態を示す。これらの複製は、図1bの破線18として描写される。例えば、プライマーの選択によって、増幅薬として使用される酵素の混合物が、このステップで、相補的DNA、すなわち、ネガティブコピーを生成する。
【0063】
その後、作られたDNAの複製18は、粒子14から解放される。そして、それは、例えば、シークエンサチップを加熱し、こうしてそこに配置されたキャビティを加熱することによって実行されうる。その後で、解放された複製18は、結合アダプタ22に加わる。そして、それは、例えば、シークエンサチップを冷やすことによって促進されうる。結合アダプタ22に加わり、そして、こうしてキャリア20に加わる複製18の結果物は、図1cにおいて表される。キャリア20に複製を複製するこのステップにおいて、位置情報またはレジストレーションは保持される。というのも、空間的に制限された増幅薬領域24が、サンプルごとに供給されるからであり、そして、増幅薬24が互いに分離しているからである。
【0064】
その後、それに拘束されたDNA複製18を有するキャリア20は、シークエンサチップ10から取り除かれて、シークエンサチップ10のキャビティ12の範囲内に配置されたDNA粒子14、16の複製を表す。DNA鎖16を含んでいる粒子14は、キャビティ12の範囲内に残っており、その結果、前記キャビティは、再び新しいキャリアを用いた新しい複製工程のための一次アレイとして役立ちうる。この方法で、基本的に多くの複製が作られうる。それに拘束したDNA複製18を有するキャリア20は、例えば、DNAへのタンパク質の、DNAへのRNAの、さらにはRNAのRNAへの結合の検出において、トランスクリプトーム(transcriptome)解析のバイオチップとして使用されうる。
【0065】
複製工程後に、更なる複製サイクルのための一次アレイ(シークエンサチップ10)を再度準備するために、キャビティ内の増幅薬、例えばPCR混合物は、交換されうる又は取り除かれうる。コンタミネーションを回避するために、(特別なDNA生成物を消化するウラシルDNAグリコシラーゼ(uracil−N−glycosylase)のような)酵素も含みうる洗浄ステップは、PCR生成物を取り除いて、従って、オリジナルマスタを汚染することなく多くの複製を可能にする。
【0066】
図4aから図4cは、発明の方法の更なる実施形態を表す。ここで、従来の平面マイクロアレイは一次アレイとして役立つ。平面マイクロアレイは、アレイ基板30上に配置されて、所望のDNAサンプルを含む。DNAサンプルは、二次元の空間配置を有する。DNAサンプルを複製する工程のために、キャビティ36を含んでいるマイクロストラクチャ34は、供給される。少なくとも一つのキャビティ36は、DNAサンプル32ごとに供給される。比較的高い分離度を得るために、別の実施形態において、DNAサンプル32ごとに、複数の、いずれの場合においても、比較的小さいキャビティ36は、供給されうる。
【0067】
キャビティ36は、そこに配置された結合アダプタ38を有する。キャビティまたはマイクロキャビティ36は、増幅薬、例えばポリメラーゼ混合物で充填される。キャビティ36がアレイ基板30で塞がれるように(小距離が有効であるが、キャビティ間のコンタミネーションを強める)、マイクロストラクチャ34はマイクロアレイ30上に置かれ、そして、そうすると、DNAサンプルが、それぞれ、それらと関連したキャビティ36内に配置される。この方法で、他のサンプルの増幅薬領域35と分離している空間的に制限された増幅薬領域35は、DNAサンプルごとに再び作られる。結合アダプタ38は、ポリメラーゼ混合物とマッチングするプライマーによって再度形成されうる。
【0068】
このように塞がれた増幅薬領域35を作った後に、ポリメラーゼ・ステップのような増幅は再度起こる。ここで、DNAサンプル32はキャビティ36の中に増幅され、複製される。図式的に図4bのDNA42によって示されているように、複製されたDNAは、結合アダプタ38で固定される。このために、再度、そこに配置されたDNAサンプルを有するキャビティの温度は、それに応じて制御されうる。最後に、そこに位置付けされたDNAサンプル32を有するDNA基板30は、マイクロストラクチャ34から取り除かれる。その結果、複製されたDNA42を有するマイクロストラクチャ34は元のマイクロアレイの複製を表す。このように複製されたDNA42を供給されるマイクロストラクチャ34は、ここで、例えば、図1aから図1dに関して上で説明されたような方法と類似して実行されうる更なる複製ステップのためのテンプレートとして使用されうる。これに関連して、複製工程の後、シークエンサチップ、例えばロシュ(Roche)による454シークエンサのシークエンサチップと同じ特性を有するように、マイクロストラクチャ34は構成されうる。
【0069】
実施形態は、上記の実施形態による方法の組み合わせを含みうる。最初に、シークエンサチップは、上の図1aから図1dによる複製工程により、全てのDNAのマイクロアレイを含んでいる平面キャリアを作るのに使用されうる。その後、このキャリアは、図4aから図4dに関して説明された実施形態によって再度複製される。DNAによって占められたマイクロキャビティ(図4aから図4dのマイクロキャビティ36)は、ここで、例えば図1aから図1dの方法によって、DNAの更なる複製を作るために使用されうる。あるいは、DNAによって占められたマイクロキャビティは、相補的DNA、DNAのサブグループ、短くされた、伸長された又は修飾されたDNA、さらにはRNA、タンパク質の形で、修飾された複製をつくるために使用されうる。このように、DNA、RNAまたはタンパク質またはペプチドを含んでいるいかなる領域も作られうる。
【0070】
発明の方法の更なる実施形態は、ここで、図5aから図5dに関して説明される。この実施形態において、DNAは、油中水型エマルジョンPCRによって、個々の粒子50中に増幅される。一つの種類のDNAは、(454シークエンシングのためのビーズの製法において、または、ABI SOLIDシークエンサにおいてと同じように)粒子ごとに固定される。前記粒子は、キャリア52の表面に位置付けられる。より詳しくは、粒子50は、液体54の各液滴(例えば水の液滴)に位置する。水の液滴は、油膜56と互いに分離される。水の液滴は、こうして、空間的に制限され、相互に分離された増幅薬領域54’を定めることに貢献する(図5c)。水の液滴54は、親水性被覆によってキャリア52の表面の各位置にくっつかれうる。その結果、それらは定められた空間配置のキャリア52に配置される。例えば、キャリア52は、生化学分子のサンプルの配置に対応する親水性のドットの規則的なパターンを含みうる。水の液滴54は、いずれの場合においても、そこに取り入れられた増幅薬を有する。このように、そこに拘束されたDNAを含んでいる粒子50の形でサンプルごとに、液体、例えば水および油間の界面によって他のサンプルの増幅薬領域とは分離される空間的に制限された増幅薬領域は、供給される。図5bに示されているように、結合アダプタ62を含んでいるキャリア60は供給される。水より細いかたまりの(thinner−bodied)油が動かされるように、および、キャリア60が結合アダプタ62を含むその表面により水の液滴54と接触しないように、結合アダプタ62を含んでいるキャリア60は、油膜56上へ押圧される。図5cにおいて表されているように、水の前記液滴54はその過程で容易に圧縮されうる。
【0071】
その後、液滴54の範囲内で粒子に拘束されるDNAは、DNA複製をつくるために、増幅薬によって増幅される。前記DNA複製64は、結合アダプタ62に拘束されて、キャリア60と共に基板52から取り除かれる。このように、それに拘束された複製されたDNAサンプル64を有するキャリア60は、元のアレイの複製を表す。
【0072】
他の実施形態において、結合アダプタはキャリア60というよりむしろ基板52に供給されうる。その結果、DNAは基板52へ複製されるが、キャリア60は単に反対のサポートとして機能するだけである。従って、この実施形態は、また、油中水型エマルジョンPCRを使用すると共に、粒子アレイの複製として平面マイクロアレイを作製することを可能にする。このように、DNAアレイの早い製造は可能である。また、RNA複製、タンパク質複製または修飾DNA複製は、つくられうる。
【0073】
本発明によれば、空間的に制限された有効領域が、複製されるアレイのサンプルごとに、すなわち、複製又は派生物がつくられることになっている。有効領域の空間的作製は、さまざまな方法で実行されうる。本発明の実施形態において、空間的に塞がれたキャビティは、サンプルごとに供給される。実施形態において、特定の方向への拡散を容易にする空間区分は、供給され、例えば柱又は溝の配置など、他の方向への拡散を防ぐ。実施形態において、ヒドロゲル、エーロゲルまたはポリマー面のような、特定の方向への拡散を好む又は抑止する多孔材、拡散を定めている材料または分子構造は、使用されうる。実施形態において、例えばポリマー分岐、デンドリマー、粒子アレイ、フィルタ膜、脂質膜(球形又は平面)などの、秩序ある又は無秩序な、ナノ又は分子構造は、空間的に制限された有効領域を実施するために使用されうる。
【0074】
実施形態において、拡散(電気泳動、光学ピンセット、磁気泳動、弾性表面波、熱泳動、…)の優先方向または拡散隔膜も作り、それにより空間的分離を構築する電場又は磁場などの物理場は、空間的に制限された有効領域をつくるために使用されうる。例えば、磁性流体および「硬化」磁場は、使用されうる、または個々の領域を分離するレーザー光グリッドは使用されうる。
【0075】
実施形態において、例えば電場、チャージ、pHの変化、光による非活性化/活性化、圧力などによって、空間的に制限された有効領域をつくるために、活性化および/または非活性化が、有効領域の中で、または、外側で生じうる。例えば、ポリメラーゼの光活性化または光による活性ヌクレオチドの生成は、制限された領域の中で実行されうる。そして、反応は暗い領域においては起こらない。
【0076】
更なる実施形態において、空間的に制限された有効領域に特定の物理効果を供給する表面構造は使用されうる。例えば、疎水性/親水性の領域(例えば油および水)またはポリマーは、電場によって特定の領域において増加しうる及び硬化しうる、そして、こうして空間的に制限された有効領域を定めうる状況において言及されうる。
【0077】
空間的に制限された有効領域が三次元構造によって定められる更なる実施形態は、ここで、図6aから図6dに関して説明される。図6aに示されているように、アレイの一部である分子のサンプル100は、アレイ基板104のエレベーション102に配置される。エレベーション102間に、凹部103は、アレイ基板104内に形成される。図6bに示されているように、固相プライマーの形で結合アダプタ108を含んでいるキャリア106は、アレイ基板104の近くに位置付けられる。アレイ基板104の、および、キャリア106の空間的近接のため、エレベーション102の、および、キャリア106の向かい合った表面との間に、エレベーション102の領域において、空間的に制限された有効領域は生ずる。対照的に、凹部102の、そして、キャリア106の向かい合った表面との間の間隔は、ここで有効領域は形成しないように、十分に大きい。
【0078】
有効領域において、固相プライマーとサンプル100間の接点はハイブリッドすることを可能にする。その結果、図6cに示されているように、増幅は開始しうる。矢印112によって図6cに示すように、増幅のための材料は、加えて、凹部から供給されうる。このように、キャリア106に拘束されたサンプル100の複製114は生成され、そして、こうしてサンプル100によって形成されたアレイの複製は作製される。
【0079】
図6cにおいて表された状態から始まり、アレイ基板104およびキャリア106は、ここで分離され、サンプル100がアレイ基板104で残ったままであり、複製114がキャリア106によって除去される。更なる複製は、それから、アレイ基板104に位置づけされたアレイで、または、キャリア106に位置付けされた複製で作られる。
【0080】
図6aから図6dに関して説明された実施形態において、増幅およびキャリアへの転写が、基本的に同時に起こる。転写及び増幅が互いに別々に起こる場合、別の実施形態において、1つのステップが大きい表面領域にわたって実行され、他方が、空間的に定められた方法で実行されうる。
【0081】
図6aから図6dに関して説明された実施形態において、空間的に制限された有効領域は、このように、プライマーがあることによってだけでなく、説明された構造によってつくられる。これに関連して、その反応はブリッジ増幅に対応する。その表面は、互いに物理的接点をもたらされる。空間的近接のため、DNAが他の表面へ複製されることを特徴とする「有効領域」は、エレベーション、すなわち段のピークで形をなす。その後、前記ピークは取り除かれさえしうる。というのも、その増幅は、いわば、それ自身の有効領域を定める典型的ブリッジ増幅だからである。しかし、反応の始まりは、空間有効領域の初期条件によってしか起こらない。この反応は、エッジまたはピークの増幅と呼ばれうる。空間的なエッジまたはピークは、反応のきっかけとなる。エッジの隣の空間は、反応に必要な材料を供給する。
【0082】
別の実施形態において、複製されるアレイは、図6aから図6dまでの偏りにおいて、平面基板に配置されうるが、エレベーションはアレイが複製されるキャリアに形成される。さらにまた、あるいは、エレベーションは、アレイ基板に、そして、キャリアに形成されうる。
【0083】
エネルギー場(例えば磁場又は電場)によってどれくらい空間的に制限された有効領域が作られうるかに関する実施形態が、図7において表される。図7は、単に、図式的に、アレイ基板120およびキャリア122を示すだけである。キャリア122上に結合アダプタだけでなく複製されることになるアレイ基板120上の分子サンプルは、単純化の目的のために表されない。分子の各サンプルの領域において、アレイ基板120とキャリア122の間に配置される増幅薬にエネルギー場126を生成するように構成される場発生手段124は、配置される。このように、空間的に制限された有効領域128は作られ、ここでは増幅薬が活性化されるが、残りの領域ではそうはならない。
【0084】
発明の方法の実施形態が、上で示された。本発明の方法ステップを実施するための対応する装置又は手段の実施形態は、その記載から結果として生じる、又は、当業者にとって明らかである。従って、本発明の装置が、必要に応じて、物理エンティティ、例えばさまざまなアレイ、キャリアまたは基板を位置決めするための適切な処理手段を含みうることを更に示す必要はない。加えて、適切な流体手段が、必要な位置で各液体または作用薬を供給するために提供されうることを更に説明することは必要でない。加えて、対応する制御装置が、本発明の方法を実行するように本装置を制御するために提供されうることは、当業者にとって明らかである。本方法を実行するために必要とされる環境をつくるための手段(例えば温度センサ)はまた、供給されうる。
【0085】
本発明の実施形態は、特に、アレイの複製又は派生物を作るのに適している。ここで、その分子は、一本又は二本鎖のオリゴヌクレオチド、ポリヌクレオチド、DNAまたはDNAに類似している合成分子(PNA)である。本発明の実施形態において、(例えばマイクロアレイなどの)空間的に平面な配置、(例えばシークエンサチップ内の)粒子の空間配置、(例えばPicoTiterPlate(商標)内の)キャビティの空間配置、または、(例えば液体の各溶滴の)異なる層の空間配置は、一次アレイとして働きうる。加えて、イルミナまたはアプライドバイオシステム(SOLID)の企業などによる、粒子ベースの分析法は、例えば、この種のアレイとしてもみなされうる。実施形態において、例えばオリゴヌクレオチドまたはポリヌクレオチドなどの生化学分子は、ゲノムを得るためのシークエンシング工程から、トランスクリプトームを得るためのシークエンシング工程から、RNA(例えばmRNA、tRNA、siRNAまたは一般のRNAなど)をシークエンシングする工程から、または、ミューテーションおよびバリエーションのシークエンシング工程から、複製されうる。本発明の実施形態において、生成された複製は、アレイを作製するための各ケースにおいて、DNA、修飾DNA(伸長した、短くなった、人工的な、挿入物、削除、ミューテーション…)、DNA構造物(発現ベクター、siRNA)、人工分子(PNA、修飾ペプチド)、RNAまたはタンパク質でありうる。
【0086】
本発明の実施形態において、オリゴヌクレオチドまたはポリヌクレオチドは、アレイまたは構造面を生成するためのシークエンシング工程から複製されうる。実施形態において、オリゴヌクレオチドまたはポリヌクレオチドは、アレイを作製するために、または、表面をコーティングするために、粒子の配置から複製されうる。本発明の実施形態において、オリゴヌクレオチドまたはポリヌクレオチドは、複製を生成するために、相補的複製を生成するために、または、物理化学的に表面を修飾するために、表面から複製されうる。
【0087】
本発明の実施形態において、オリゴヌクレオチドまたはポリヌクレオチドは、新規な表面特性に基づいた応用のための、または、化学物質を生成するための生化学工程チェーンのための化学的又は生化学的修飾の目的で、別の表面へ複製されうる。本発明の実施形態において、必要はないが、油中水型エマルジョンPCRによって作製されうる粒子アレイは、DNAライブラリのアレイを作製するために、さまざまなDNA変異体を含んでいるアレイを作製するために、RNA又はタンパク質に前記アレイを更に複製するために、又は、細胞実験において複製を使用するために、シークエンスされる必要なしに、複製されうる。
【0088】
本発明の実施形態は、多数の応用分野において使用されうる。この種の応用分野の例は、シークエンシング、転写解析、DNA、RNAまたはタンパク質活性の測定、発現研究、ファージディスプレイ、リボソームディスプレイまたは細胞ディスプレイを使用する際のディスプレイ技術、および、代謝産物研究である。加えて、本発明は、相互作用研究において適用され、例えば、以下がある。DNA/DNA;DNA/RNA;DNA/タンパク質;RNA/タンパク質;RNA/細胞;タンパク質/タンパク質;キナーゼ活性;プロテアーゼ活性;ホスファターゼ活性;DNA結合タンパク質;エピトープ・マッピング;病原体の測定;物質又は抑制物質の測定。本発明は、アレイ側での多数の相互関係パートナーでは、今日、部分的に可能でないこの解析を可能にしうる。
【0089】
加えて、本発明は、ワクチン開発の分野において、適用されうる。そして、1つの例は以下の通りである。新しいウイルス/バクテリアが現れると仮定する。細胞サンプルまたは血液サンプルは、生存する第1の生物からとられる。その細胞サンプルはウイルスに感染しており、mRNAは分離される。前記mRNAは、配列決定される。そして、得られたDNAはそれから完全にコピーされる。その後、DNAアレイは、タンパク質アレイに転写される。このように、このアレイは、細胞のタンパク質およびウイルス感染により修飾されるタンパク質を含む。血液サンプルはアレイ上へ位置付けられる、そして、そこに含まれる抗体はタンパク質と結びつく。抗体だけがウイルスタンパク質と結びつく。というのも、抗体はそれ自体で同じ集合のタンパク質と結びつかないからである。拘束された抗体は、それから最後のステップによって特定されうる。このように、DNAおよびタンパク質のウイルスの配列は、決定されうる。このように、非常に短い期間内で、抗体のエピトープおよび結合タンパク質についての情報を得た。従って、この情報によって、受動的および能動的ワクチンが、すぐにつくられうる。このように、感染病の場合において、ワクチンを作ることができる前に取られる時間は、劇的に低減されうる。
【0090】
従って、本発明の実施形態は、シークエンシング工程の間生成されるDNA配列のアレイ(一次アレイ)が表面に転写され、したがって、このDNAの複製(二次アレイ)は作られる、完全な作業サイクルを可能にする。加えて、実施形態において、一次又は二次アレイは、さらに、RNAまたはタンパク質(三次アレイ)の形で更なる複製としてモデル化されることになる。実施形態において、生化学分子(例えばDNA)の各アレイは、一次アレイとしてみなされうる。また、最適に複製技術を選択することによって、同一の又は原物の選択的複製は、つくられうる。従って、本発明の実施形態は、その工程において使用されるアレイを(遺伝子シークエンシングの前、間、後に)マッピングすることに関する。そして、更なる複製ステップにおいて、遺伝子、cDNA、RNAまたはタンパク質アレイの中に任意でそれを改良することに関する。
【0091】
本発明の実施形態は、空間的に分離された方法で、シークエンシング工程の間に何回か、分子情報が複製されうるという点で、有効である。ただ1つの原物だけが、この目的のためのマスターとして必要である。原物の性質およびそこに含まれるデータについての情報はなくてもよい。従って、複製工程は、含まれた情報とは独立している。加えて、本発明の実施形態は、その場合成または印刷/調剤装置を使用することなしで、マイクロアレイを作製すること、または、生化学的表面構造化を複製することを可能にする。複製工程は、分子レベルで起こり、確立した生化学システムを使用する。位置情報が保持されるので、複製工程は、生化学情報の高度に並列な処理を可能にする。これは、分子レベルで、異なる種類のマイクロアレイを結合することを可能にし、配列についての情報を得た後のマイクロアレイの時間およびコストがかかる製造を回避する。
【0092】
本発明の実施形態において、空間的に制限された増幅薬領域を定めることに貢献するマイクロ又はナノ構造は、特に、フィルタ膜に、ヒドロゲルに、または、エーロゲルに基づいた無秩序なマトリックスを含む。本発明の実施形態において、マイクロまたはナノ構造は、整然とした三次元基板に基づく。
【0093】
本発明の実施形態において、空間的に制限された増幅薬領域は、少なくとも部分的に、2つの流体、流体および気体間の界面または物理的境界(特に脂質膜)によって分離される。
【0094】
本発明の実施形態において、複製又は派生物をキャリアと結びつけるプロセスはまた、増幅と同時に実行されうる、または、固定された結合アダプタが増幅のためのプライマーとして働くという点で増幅の一部でありうる。加えて、派生物は、固定されたキャプチャ分子を介して、または、それらを作製するために使用されるシステムとそれらが連結したままであるという点で、そして、前記システムがキャリアに固定されるという点で、キャリアに拘束されうる。例えば、このシステムは、酵素、リボソームまたは細胞から成りうる。
【0095】
本発明の実施形態において、有効領域の空間的制限は、規則的又は不規則なスポットの分布を含みうるプライマーアレイの形で、相補的プライマーとして、結合アダプタがキャリア上にあるという点において成り立つ。そして、キャリア上のスポットサイズおよびスポット密度はアレイ上のそれと等しい又は小さい。
【0096】
本発明の実施形態において、増幅薬は、DNA増幅、特に、ポリメラーゼ連鎖反応、等温増幅(例えばNASBA反応)に作用するように構成され、そして、結合アダプタはマッチングプライマーを含む。
【0097】
本発明の実施形態において、一次、二次および/または三次の派生物は、DNAがRNAに転写され、RNAはタンパク質に翻訳されるという点において、または、生成されたタンパク質、生成されたRNAまたは生成されたDNAまたは液相からのそれらの複製を使用するときにバインダーが増やされる点において、または、バインダーが相互に作用するという点において、一次アレイまたは一次アレイの複製から、生成される。
【0098】
本発明の実施形態において、派生物は、ターゲットアレイの固相で生成され、固定された方法でそこに存在する。本発明の実施形態において、サンプルの位置は、サンプルの一部である又は固定され、派生物を生成するのに必要とされ、例えば、複製起点(ori)、プロモーター、リボソーム結合部位、開始コドン、エンドプロテアーゼ切断部位、融合配列、リポーター遺伝子、ターミネーター、抗生物質抵抗性遺伝子、インビトロ(in−vitro)翻訳系または細胞などの、派生物、特に発現ベクター配列を生成するために必要である、更なる分子又はDNA配列又はそこに位置づけられた細胞を有する。
【0099】
本発明の実施形態は、本発明の方法を使用すると共に、作製された分子のアレイの複製又は派生物に関し、そして、この種の複製又は派生物の応用に関する。本発明の実施形態において、この種の複製又は派生物は、特に遺伝子型−表現型カップリング(genotype‐phenotype coupling)のために、バインダー、特にタンパク質、抗体または抗原と、元の分子との間の反応を、元の分子のDNA配列を関連させるのに、使用される。本発明の実施形態において、この種の複製又は派生物は、元の分子、その複製又はその派生物が、特に遺伝子型−表現型カップリングのために、元の分子のDNA配列と、基板の変換を触媒する反応を関連させるために使用される。本発明の実施形態は、この種の利用によって特定されたDNA配列に関し、この種のDNA配列、特に抗体、抗原、ワクチンまたは抗生物質に基づいて生成された生成物又は製法に関する。
【0100】
本発明の実施形態において、本発明の方法によって作製された複製又は派生物は、相互作用分子または粒子を用いてサンプル、複製又はその派生物間の反応を検出するのに使用される。そして、前記検出は、光学的、電気化学的又は磁場的センサによって実行され、そして相互作用している分子または粒子は対応する標識を運んでいる、又は、前記検出が標識なしで、エバネッセント場の変化または変更された共振周波数によって、または、光学ピンセットを使用することによって、または、吸収における変化、特に色の知覚又は変化と、又は、光の発光、特に化学発光と、その反応を対にすることによって、実行される。本発明の実施形態において、その配列を検出するために使用される同一のシークエンシング装置はまた、反応を検出するためにも使用される。
【0101】
本発明の実施形態は、アレイの複製又は派生物上で反応を実行するための対応する複製又は派生物の利用に関する。そして、チャンバ又は流体構造物は、複製又は派生物の表面に適合されている結合端子を含む。複製又は派生物は、対応するチャンバに取り入れられており、特定の温度でチャンバをインキュベートすることは可能であり、そして、チャンバの中に含まれた液体を交換することは可能である。この種の利用はまた、アレイをシークエンシングするために使用されもする装置内で起こりうる。
【0102】
本発明の実施形態は、複製又は派生物上の反応および検出を同時に実行するために、対応する複製又は派生物の利用に関する。本発明の実施形態は、液体粒子アレイをシークエンシングする方法に関する。そして、複製は、粒子に含まれるサンプルから作られ、その複製はシークエンシング装置においてシークエンシングされる。
【0103】
本発明の実施形態において、標準方式を使用することにより、増幅または結合プロセスの間、反応の進行は、読み出されうる。これは、酵素、結合および反応機構の分野における応用を可能にする。例えば、CO2を結合する酵素は、生成されうる。前記酵素は、それからpH値の変化によって、即時特定されうる。同様に、他の酵素又は触媒作用または結合性は、特定されうる。これらは、いわば、分子の単なる存在からその作用モードにいたるまでを評価しているいかなる生化学計測技術も含む。従って、本発明の実施形態は、アプリケーションの間、個々の有効領域内でよく知られた検出方法を使用して物理的又は化学的パラメータにおける変化をモニタすることを含み、そのことは、これまで存在しなかったその派生物だけでなく増幅薬および一次アレイのオペレーティング機構へのある程度の洞察を可能にする。
【0104】
本発明の実施形態は、DNA配列、RNA配列、タンパク質またはDNA、RNAまたはタンパク質の触媒的、信号的(例えば、増強、アロステリック、抑止、…)又は酵素的(例えば、溶解、ホスファターゼ活性、キナーゼ活性、…)機能を特定するための本発明による方法を使用すると共に、作製された分子のアレイの複製又は派生物の利用を提供する。
【0105】
本発明の実施形態は、DNA配列、RNA配列またはペプチド配列を特定するための、およびDNA、RNAまたはペプチドの配列に基づいた、生成物、特に抗体、抗原、ワクチンまたは抗生物質生成物の生成、特定または製法のための本発明による方法を使用すると共に、生成された分子のアレイの複製又は派生物の利用を提供する。
【0106】
「参考文献」
[1]ユ A.A.ら著、「表面粗さを克服するコンタクトプリント法:液体超分子ナノスタンプ法」、Advanced materials 2007、19巻、p.4338−4342
[2]ブランチャード A.P.、フレンド. S.H.著、Nature Biotechnology(1999)17、p.953以下参照
[3]ウェブサイト:http://www.techno−preneur.net/technology/New−technologies/life−sciences/novel.htm
[4]国際公開第2008/022332
[5]キム J.、クルックス R.著、米国化学会誌、128、p.12076−12077、2006年
[6]キム J.、クルックス R.著、Analytical Chemistry(2007)1,79、p.8994−8999
[7]ホー Mら著、Nature Methods(2008)、5、p.175−177
[8]ラマチャンドラン Nら著、Methods in Molecular Biology(2006)328、p.1−14
[9]米国特許第6017738号明細書
[10]米国特許第6274351号明細書
[11]米国特許第6300070号明細書
[12]エイブラムズ E.S.ら著、Diagnostic Gene Detection、1.9、p.171−189、1997年
[13]Laborwelt誌、第3版、8巻、2007年
[14]シェンジャー J.ら著、「次世代DNAシークエンシング」、Nature Biotechnology、26巻、10号、p.1135−1145、2008年10月
[15]ゲノム分析のためのイルミナ・ハンドブック、2007年
[16]ケイン R.S.ら著、Biomaterials(1999)20、p.2363−2376
[17]トーレス T.T.ら著、ゲノム研究、http://genome.cshlp.org/cgi/content/abstract/gr.6984908v1#otherarticles
[18]欧州特許第1203945号明細書
【技術分野】
【0001】
本発明は、生体分子又は化学的に生成された分子などの、分子のアレイから複製又は派生物を作製するための方法及び装置に関する。そして、特に、例えばDNAマイクロアレイ、RNAマイクロアレイ又はタンパク質マイクロアレイなどの、前記分子および/またはそれから派生した分子のマイクロアレイの複製又は派生物を作製するのに適するような方法及び装置に関する。そして、一次配列、その複製またはその派生物に関する反応と関連したDNA配列を特定するためのアレイの応用に関する。
【背景技術】
【0002】
マイクロアレイは、個々の位置の表面上の又はその中の多くの異なる生体分子の配置を指すものと理解される。前記位置は、スポットとも呼ばれて、一般的に、10μmから約1000μmにわたる直径を有する。生体分子の一つまたはいくつかの同一の個体群が、スポット内に存在する。しかしながら、ある意図的な重複を除いて、さまざまなスポットは、異なる生体分子を示す。生体分子は、表面に析出しうるか、表面の層の中に存在しうるか、キャビティ内に存在しうるか、または、粒子上又はその中に固定された方法で存在しうる。そして、粒子がアレイとして配置されることは可能である。
【0003】
従来は、マイクロアレイを作製するさまざまな技術があった。ある技術によれば、生体分子は、例えば光合成、化学的合成、スポット合成、プリント処理などを使用して、表面に直接合成される(その場合成(in−situ synthesis))。この種の光合成は、例えば、アフィメトリクス社(Affymetrix)によって使用され、スポット合成は、アジレント社(Agilent)によって実行される。コンビメートリックス社(Combimatrix)は、仮想の、電子的にアドレス可能な反応区画によって、DNAマイクロアレイを作製する。更なる技術によれば、(生体)分子は、最初に合成されて、その後、配列されたアレイとして表面に析出される。そして、この種の技術は、例えば、アジレント社(Agilent)、Gesim社およびバイオフルイディクス社(Biofluidix)によって、使用される。両技術は、高水準の技術費用を必要とする。異なる生体分子の数が増加するにつれて、そして、析出スポットの直径が小さくなるにつれて、前記技術費用は線形以上に増加する。さらに、この種のマイクロアレイが例えば2倍の物質を包含することになるとき、又は、被覆構造、すなわちスポットのサイズが低減されることになる場合、費用だけでなく、関係する時間量は、有意に増加する。マイクロアレイを作製するためのスタンピング技術は、[1]において説明される。
【0004】
アレイ上のその場合成(on−site synthesis)によって、何百万もの異なるDNA配列を生成することは可能である。しかし、新規なレイアウトまたは異なるパターンサイズを得るために、全体の製造工程を再編成することが必要である。これは、新しい機器設定を必要とし、光補助の合成の場合には、さらに新規なフォトリソグラフィー・マスク、デジタルミラーシステムの再プログラムを必要とし、マイクロアレイを製造するためのデジタルミラーの利用について説明した[2]を参照されたい。コストを抑えるために、これは、できるだけ回避される。
【0005】
ただ時間不足というだけのために、研究所での合成によって、および、マイクロアレイへの後のトランスミッションによって、例えばナノプロッターによって、物質の数万以上を移すことは不可能である。100万の異なる生体分子を有するマイクロアレイ上に相当数の点をつくるのには、何週も何ヶ月もかかる。その時間の間、表面化学は変化し、全部のマイクロアレイはもはや機能しない。
【0006】
従って、単純で安価な方法で、現存のマイクロアレイ、すなわち、作製するのが複雑で高価である周知の生体分子の規則的な配置を複製することが可能である手段による方法が望まれる。
【0007】
この問題に関するいくつかの基本概念は、すでに提示されている([3]及び[4])。[3]及び[4]は、一つ以上のビオチン化オリゴヌクレオチドが一つ以上のオリゴヌクレオチドにハイブリダイズして、第1の基板で増幅されることを特徴とする、オリゴヌクレオチドアレイを複製する方法を明示する。ビオチン化され、増幅されたオリゴヌクレオチドは、それからストレプトアビジンを有する第2の基板に固定させられる。ビオチン化されたオリゴヌクレオチドは、複製されたアレイを作製するために、機械的な力によってオリゴヌクレオチドから分離されうる。しかし、この種の複製処理は、高コストであり、追加の生化学的アンカーシステムを必要として、多くの場合、元のDNAマイクロアレイのネガティブコピーしか生成しないだろう。
【0008】
[5]はまた、ストレプトアビジン/ビオチン・システムを使用することによるDNAアレイの複製を説明する。[6]は、DNAがRNAにどのように複製されるかを説明する。
【0009】
約30年間、DNAは、研究所において増幅されてきた。特に、ポリメラーゼ連鎖反応(PCR)は標準技術としてほとんどすべての研究所へ到着した。そして、それは大部分の遺伝子の研究の基礎である。しかし、DNAを増やすことを可能にする他の技術、例えばNASBA、リコンビナーゼ・ポリメラーゼ増幅、ローリングサークル型増幅およびさまざまな他の等温増幅技術もある。
【0010】
前記技術は、一般的にDNAを増幅することを可能にするだけでなく、個々のDNA領域又はそのDNAのサブセットのターゲットとされた増幅を可能にする。特に開始点(プライマー)を選択することによって、特にDNAの個々の領域を増大させることもまた、可能である。大部分のDNA増幅処理が溶液中で生じ、これは、液相反応と呼ばれる。しかし、過去2、3年で、DNA増幅のための付加的な固相を利用し、その処理において前記固相で同上を増やすいくつかの方法が出てきている。例えば、スライドまたは固相上のプライマー伸長反応などである[9、10]。以下に、最も一般の方法のうちの2つである、DNAのブリッジ増幅と油中水型エマルジョンPCRの基本について説明する。
【0011】
DNAのブリッジ増幅:ブリッジ増幅のために、周知の、いわゆるアダプタ配列によって、両端で、(部分的には未知の)DNAは、まず伸長される。前記伸長は、表面上で相補的配列のための結合部位として機能する。表面へ結合が起こった後でしか、後に、増幅が起こらない。複製されて、こうして新しく作られたDNA鎖は、ここで、固定して(共有結合して)表面に拘束される。そして、固定していない端に、更なる結合部位を有する。前記更なる結合部位は、ここでまた、表面の適切な相当物に結合し、更なる増幅を始めうる。そして、それは次々に、一端で拘束され、自由端である他端では元の結合配列を有する新しいDNA鎖を作る。このように、一端で固定して拘束され、その他端が、表面に一時的に結合することを可能にする指数的な方法で、ますます多くの新規な鎖は、生成される。増幅の間、最初の鎖は、一端では固定して(共有結合して)拘束され、他端ではゆるく(非共有結合的に)拘束され、こうして分子ブリッジを生成する。これに関して、[11]は、ブリッジ増幅を一般的に説明し、[12]は、シークエンシングのためのブリッジ増幅の利用を説明する。
【0012】
油中水型エマルジョンPCRのために、一種のブリッジ増幅は、使用される。これは、ブリッジ増幅と同様、最初にアダプタ配列によって両サイドでDNA鎖を伸長することを必要とする。その後、伸長したDNAは、水性PCR混合および固相粒子(ビーズとも呼ばれる)と共に混合されて、油中で乳化される。その結果、油中水型エマルジョンが生じる。この油中水型エマルジョンのために、濃度は、理想的には、正確に1つのDNA鎖および正確に1つの粒子が各水滴内に捕捉されるように選択される。ブリッジ増幅によって、粒子の表面は、DNA複製がそれに共有結合して拘束されることを可能にする配列を含む。このように、粒子全体は、増幅によって元のDNAの複製で覆われうる。この技術は、シークエンサにおいて主に使用される。この技術において、ただ一つの定められた鎖しか、常に、固相または液相で増幅されない。
【0013】
タンパク質増幅、またはタンパク質合成において、適切な生化学システムによって、基本的にはまずRNAに転写され、それからタンパク質に翻訳されうるDNA鎖がある。RNAが十分に安定である場合、あるいは、充分な数のDNAテンプレートがある場合、多数のタンパク質は生成されうる。この技術は、RNAを経てDNAからタンパク質をつくることに関与する細胞内で起こっているナチュラルプロセスに対応し、そして、それは生化学の基礎および中心規範である。最近では、単純化された生化学システムが利用でき、それはタスクのこの複合体をマスターすることができて、こうして、少なくとも原理上は、実験室においてタンパク質をDNA鎖から作り出すことを可能にする。この点において、[7]はタンパク質マイクロアレイをDNAマイクロアレイから直接作り出す方法を説明し、[8]は、cDNAアンカーを有するタンパク質マイクロアレイを作製する方法を説明する。あるいは、タンパク質増幅はまた、それらに導入されるタンパク質コーディングDNAを有する、原核生物又は真核生物の細胞を使用して実行されうる。
【0014】
DNA配列をデコードするために、いわゆるシークエンシング法が使用される。そして、比較的最近のシークエンシング法の概要が[13]において提供される。加えて、DNAが粒子に結びつくシークエンシング法は、[14]において説明される。
【0015】
シークエンシングのために使用される非常に複雑な機械は、初めに分離されたDNAを捕捉するための、それを増幅するための、および、その後構成要素ごとにそれを読み出すための多数の反応ステップおよび技術を使用する。選択された反応化学およびシークエンシング法によって、高価なバイオインフォーマティックス方法で、全体としてDNA配列を再計算することは可能であり、こうして調べられた種のゲノムを得ることは可能である。
【0016】
以前のシークエンシング技術は、ゲル内でDNAを分離することを含んだ。これは、固相に基づかないアプローチであり、サンガーシークエンス(Sanger Sequencing)と呼ばれる。ごく最近の生成のシークエンサによって、1つが油中水型エマルジョンPCRによって働いて、こうして何百万もの粒子、例えば、異なるDNA断片の多くの同一の複製をそれぞれ運ぶビーズなどを生成する。配列を読み出すために、粒子は、130万から340万の異なるマイクロキャビティを有する、いわゆるPicoTiterPlate(商標)で配置され、そして、固定される。これは、すでにそれ自体マイクロアレイを示す。この点においては、シークエンシングのためのブリッジ増幅の利用が説明される[15]を参照されたい。
【0017】
生体分子の規則的な配置がこの方法ですでにつくられた場合であっても、それにもかかわらず周知の配列を有する従来のマイクロアレイのように使用されえない。というのも、粒子に拘束される生体分子の個々の配列はそれ自体でまだわかっていないからである。しかしながら、シークエンシング後、特定の粒子に拘束されたDNA断片の配列は、それ自体は知られる。
【0018】
例えばベルリンのマックスプランク分子遺伝学研究所(Max−Planck−Society for Molecular Genetics)と共にScineonの一部で、個々の粒子を取り出して、アレイとしてそれらを再利用することがなされた。しかし、この方法は、高コストで、この種のアレイの1つの標本しか生成することを可能にしない。
【0019】
ソフトリソグラフィまたはマイクロコンタクトプリンティングは、表面上に分子の析出を可能にし、そして、後に他の表面に同上を移すことを可能にするスタンピング技術である。それはまた、微細な空洞キャビティまたは微小流体を統合することを可能にし、こうして液体のための複雑な循環路を供給することを可能にする。前記循環路は、特定の方法で表面を処理し、こうして極めて微小な構造をコーティングする又は修飾することを可能にする。この目的のために使用された材料は、シリコーン(PDMS)である。PDMSの適切な表面の修飾によって、さまざまな生体分子は、表面に加えられることができて、こうして後に移されうる。生体分子だけでなくDNAおよびRNAも、移されうる。
【0020】
これらの移送プロパティは、特に、複製するステップのために、実施されうる。そして、[16]は、生体分子がソフトリソグラフィを使用して移されうる方法を説明する最初のものである。
【0021】
DNAアレイ又はDNAマイクロアレイは、主にいわゆる発現解析、シークエンシングおよび遺伝子又はSNP量の解析のために使用される。
【0022】
発現解析において、特定の遺伝子の活動のレベルを調べることが望まれる。伝令RNA(mRNA)は、これに関して標識とみなされる。この目的のために、例えば、薬を投与すること、環境要因を変化させること、圧迫することなどによって、細胞又は生物は刺激される。生物学的材料から、最初にmRNAを集めて、いわゆる相補的DNA(cDNA)にそれを転写して、それに色素を供給する。標準試料は、異なる色素を供給される。主に、緑及び赤の色素が使用される。等しい比率のサンプルが、混ぜ合わせられて、それからマイクロアレイに適用される。等しい濃度で、両方の元のサンプルにおいて、特定のDNA配列が含まれる場合、マイクロアレイの各スポットに、等しい濃度で、両方のサンプルからの相補的分子は拘束される。従って、このスポットを読み出すことにより、結果として二次的な色となる。緑及び赤の場合、黄色となる。それらの遺伝子配列の比率が等しくない場合、マイクロアレイの対応するスポットは、呈色が支配的な遺伝子産物を示す二次的色を含む。完全にオン又はオフに切替えられた遺伝子は、1つの色相又はその他だけを有する。色パターンはmRNAの量を割り出すことを可能にし、そして、検査された影響により特定の遺伝子がどれくらい強く活性化又は非活性化されたかについての手掛かりを供給する。[17]は、高度に並列なシークエンシングによるゲノム全体の研究のための発現プロファイリングの応用を明示する。
【0023】
SNP解析において、遺伝子配列が個々のミューテーション、すなわち、1つの塩基対を除いて同一である配列を含む(各塩基対の置換=一塩基多型)かどうかが調べられる。置換された塩基対の正確な位置は、置換が有機体に影響を及ぼさない又は軽微な影響しか与えないかどうか、又は、これが致命的な遺伝子欠陥であるかどうかを特定する。いくつかの深刻な遺伝病(例えばハンチントン舞踏病、パーキンソン病またはアルツハイマー病など)の場合において、この種の高度のSNPが知られている。多くの他のSNPによって、例えば糖尿病又はくる病などの特異的疾患に対する増加したリスクまたは感染のしやすさを推定されうる。SNP解析のために、DNAは、生物学的材料から直接集められて、色素で標識される。SNPごとに、マイクロアレイに4つのスポットがあり、各場合に同じ位置において、1つの塩基対が異なる。結合している位置のベースから、どの基部が未知サンプルの関連した位置にあるかについて特定することができ、それは[17]を参照されたい。
【0024】
タンパク質アレイについては、単独での製造はかなり困難である。というのも、DNAとは異なり、タンパク質は非常に広い範囲の溶解度、反応度および特異性を有するからである。従って、同じケミカルアンカを使用して、表面にさまざまなタンパク質を結合することは、些細なことではない。一般的に、タンパク質アレイは、数百から一千の異なるタンパク質を含む。タンパク質アレイは、結合研究のために主に使用される。これは、タンパク質アレイ上の標識分子を位置付けることを含む。従って、色づけを含むマイクロアレイ上のこの種のスポットは、検査された分子のための潜在的結合パートナーである。この技術は、特に、結合部位を見つけるために、エピトープ・マッピング(epitope mapping)に使用される。
【0025】
マイクロアレイのアーキテクチャそれ自体は、[18]において説明される。
【0026】
従って、マイクロアレイのアプリケーションは、広範囲であり、多種多様である。しかしながら、必要な財源の不足のため、または、それらの費用便益比率のため、それらは、使用において、かなり制限される。
【0027】
DNA配列は、生化学情報を含み、生化学的複製システムによって増幅されうる。DNA配列を複製するためのさまざまなアプローチは、個々の塩基対を表面に複製することから始まり、DNAが原理上、1つの表面から他方へどのように複製されうるかを示す、[4]、[5]及び[6]に記載されたアプローチに至るまで、すでに追求され続けてきた。
【0028】
また、タンパク質の複製がDNAアレイからどのように作られうるかについての論文[7]は、最近公表された。
【0029】
上記の引例は、既知の発明が、マイクロアレイを作製する2つの基礎技術、すなわち、一方では、部位に直接物質を生成すること、および、他方では、顕微鏡的な投与又はプリント工程によって、合成後に物質を移すことが可能であることを示す。これらの技術の各々は、技術的に複雑で、時間およびコストに関して高い消費を伴う。そして、物質の数が2倍になると、必要な時間およびコストも少なくとも2倍になるというのが普通である。さらに、DNAアレイ、その配列の場合、合成前に生化学情報についての正確な知識を有することは、必須である 。DNAの場合において前記情報を得るために、上で説明したように、いわゆるシークエンサは使用される。シークエンシングおよびマイクロアレイの製造間の直接的な製造チェーンは、これまで知られていなかった又は確立されていなかった。これは、未知の有機体が最初に配列を決められなければならないことを意味する。そして、その配列がシークエンサのデータから計算され、その後、アレイは作製される。このアレイによって、すぐに、発現パターンは検査されうる。加えて、知られた配列からタンパク質アレイを作り出すことが知られている。この製造チェーンは、非常に長期化し、高コストである。
【0030】
簡単な方法でDNAアレイの派生物として直接タンパク質アレイを作製することが可能である場合、表現型および遺伝子型間のカップリングは保持されるだろう。そして、空間的に分離された方法で、派生物上で反応を実行して(抗原抗体、酵素反応)、それらを基礎となっているDNA配列と関連させることは可能であろう。
【先行技術文献】
【特許文献】
【0031】
【特許文献1】国際公開第2008/022332(WO 2008/022332 A2)
【特許文献2】米国特許第6017738号明細書(US 6017738)
【特許文献3】米国特許第6274351号明細書(US 6274351 B1)
【特許文献4】米国特許第6300070号明細書(US 6300070 B1)
【特許文献5】欧州特許第1203945号明細書(EP 1203945 B1)
【非特許文献】
【0032】
【非特許文献1】ユ A.A.ら著、「表面粗さを克服するコンタクトプリント法:液体超分子ナノスタンプ法」、Advanced materials 2007、19巻、p.4338−4342(Yu A.A. et al,“Contact Printing Beyond Surface Roughness: Liquid Supramolecular Nanostamping”,Adv.Mater.2007,19,pages 4338 to 4342)
【非特許文献2】ブランチャード A.P.、フレンド. S.H.著、Nature Biotechnology(1999)17、p.953以下参照(Blanchard A.P., Friend. S.H., Nature Biotech (1999) 17, Page 953 et seq.)
【非特許文献3】<URL: http://www.techno−preneur.net/technology/New−technologies/life−sciences/novel.htm>
【非特許文献4】キム J.、クルックス R.著、米国化学会誌、128、p.12076−12077、2006年(Kim J., Crooks R., JACS, 128, pages 12076 to 12077 (2006))
【非特許文献5】キム J.、クルックス R.著、Analytical Chemistry(2007)1,79、p.8994−8999(Kim J., Crooks R., Anal Chem(2007)1,79: pages 8994 − 8999)
【非特許文献6】ホー Mら著、Nature Methods(2008)、5、p.175−177(He M. et.al, Nat Methodes (2008), 5: pages 175 − 177)
【非特許文献7】ラマチャンドラン Nら著、Methods in Molecular Biology(2006)328、p.1−14(Ramachandran N, et.al; Methodes Mol Biol (2006); 328: pages 1 to 14)
【非特許文献8】エイブラムズ E.S.ら著、Diagnostic Gene Detection、1.9、p.171−189、1997年(Abrams E.S. et al, Diagnostic and Gene Detection Ch.1.9, pages 171−189 (1997))
【非特許文献9】Laborwelt誌、第3版、8巻、2007年(Laborwelt, edition 3,vol.8 (2007))
【非特許文献10】シェンジャー J.ら著、「次世代DNAシークエンシング」、Nature Biotechnology、26巻、10号、p.1135−1145、2008年10月(Shendure J. et al., “Next−generation DNA sequencing”,Nature Biotechnology, vol. 26, No. 10, October 2008, pages 1135 to 1145)
【非特許文献11】ゲノム分析のためのイルミナ・ハンドブック、2007年(Illumina Handbook for the Genome Analyzer (2007))
【非特許文献12】ケイン R.S.ら著、Biomaterials(1999)20、p.2363−2376(Kane R.S. et.al, Biomaterials (1999) 20, pages 2363 to 2376)
【非特許文献13】トーレス T.T.ら著、ゲノム研究、<URL: http://genome.cshlp.org/cgi/content/abstract/gr.6984908v1#otherarticles>(Torres T.T. et. al., Genome Research)
【発明の概要】
【発明が解決しようとする課題】
【0033】
本発明の目的は、時間及び費用の消費がほとんどなく分子のアレイから複製又は派生物を作製することを可能にする方法及び装置と、対応する複製又は派生物とこの種の複製又は派生物のための応用を提供することである。
【課題を解決するための手段】
【0034】
この目的は、本発明による、請求項1に記載の方法、請求項23に記載の複製、請求項34に記載の装置、および、請求項24、28、30、および32に記載の利用によって達成される。
【0035】
本発明の実施形態は、分子のアレイの複製又は派生物を作製する方法であって、そのアレイが分子の分離したサンプルの空間配置を含んでいる方法を供給する。その方法は、
サンプルごとに、その他のサンプルの有効領域と分離している、少なくとも一つの空間的に制限された有効領域をつくるステップであって、キャリアの、結合アダプタ又は結合特性を供給された、表面は、前記有効領域で接するステップ、
サンプルの複製又は派生物をつくるための有効領域に増幅薬によって生化学分子を増幅するステップ、
キャリア上のサンプルの複製又は派生物の空間配置が、そのアレイにおけるサンプルの空間配置に対応するように、結合アダプタ又は結合特性によって、サンプルの複製又は派生物をキャリアに結合するステップ、および、
そのアレイからサンプルの複製を含んでいるそのキャリアを取り除くステップ、を含む。
【0036】
本発明の実施形態は、対応する方法を使用することにより作製された分子のアレイの複製又は派生物を供給する。
【0037】
本発明の実施形態は、分子のアレイの複製又は派生物を作製するための装置を供給する。そして、そのアレイが分子の分離したサンプルの空間配置を含んでおり、そのデバイスは、
サンプルごとに、その他のサンプルの有効領域と分離している、少なくとも一つの空間的に制限された有効領域をつくる手段であって、キャリアの、結合アダプタ又は結合特性を供給された、表面が有効領域上で接している手段、
サンプルの複製又は派生物を作製するための有効領域において増幅薬によって生化学分子を増幅するための、そして、キャリア上のサンプルの複製又は派生物の空間配置がそのアレイにおけるサンプルの空間配置に対応するように、結合アダプタ又は結合特性によって、サンプルの複製又は派生物をキャリアに結合するための手段、および、
そのアレイからサンプルの複製を含んでいるそのキャリアを取り除くための手段、を含む。
【0038】
本発明によって、本発明が、その空間配置によって与えられる位置情報を保持すると共に、早くシンプルで安価な方法で、対応するアレイの複製又は派生物を作製することを可能にするように、他のサンプルの有効領域と分離している空間的に制限された有効領域は、分子のアレイ、例えば、DNAマイクロアレイの各サンプルに都合のいい形に作られる。
【0039】
特に、本発明の実施形態は、分子が生体分子または合成的に生成された化学分子であることを特徴とする、対応する方法及び装置に関する。本発明によれば、複製は、元の分子の1:1複製を意味するものと理解され、一方、派生物は、元の分子における変更、例えば、元の分子のディセンダントまたはサブセットを意味するものと理解されうる。本発明によれば、分子のサンプルは、アレイの異なる部位で配置された異なる分子、又は、そこに配置された分子の異なる混合物を意味するものと理解されうる。
【0040】
本発明の実施形態は、生化学情報についてのいかなる情報も有せずにマイクロアレイを複製することを可能にする。それは、特に、非合成のマイクロアレイを複製することも意味する。これは、すでにシークエンサから、そこにあるDNAの配置の複製を完全にコピーすることを可能にし、こうして、その配列の情報なしでDNAアレイを供給することを可能にする。
【0041】
このように、本発明の実施形態は、個々のサンプルの配列についてのいかなる情報も有せずにさえ、シークエンシング工程の前、後又はその間に、対応するマイクロアレイを作製することを可能にする。このように、アレイを合成的に生成する時間およびコストのかかる工程段階は、回避され、そして、アレイはそのシークエンシングから直接作製されうる。本発明の実施形態は、このように、早い方法で、および、そのマイクロアレイの生化学的配列又は情報が知られているかどうかとは独立して、所定のマイクロアレイの増幅またはパターンのコーティングを可能にする。本発明の実施形態はまた、異なるタスクセットに必要とされうるように、全く同じ原物から異なるバリエーションを作製することを可能にする。というのも、異なる生体分子(例えばDNA、RNAまたはタンパク質)が異なる生化学の問題のために使用されるからである。これまで、シークエンシング工程の前、間、後の適したDNA又はさらにはタンパク質マイクロアレイを作製することは可能ではなかった。
【0042】
本発明の実施形態は、生化学的複製工程の手段によって、シークエンシング工程の前、間又は後に、一次材料、例えば、分子の一次アレイから直接に二次マイクロアレイを作製することが可能であり、そして、必要であれば、更なるアレイの形で再び前記二次マイクロアレイをDNA、RNA、またはタンパク質に生化学的にマッピングすることを可能にする。加えて、異なる複製ステップの間、アレイのバリエーションは、例えば、ピクチャーの黄色部分しか複製されえないカラーコピーに相当する、特定の標識または配列を含む化学的形態で作製されうる。
【0043】
本発明の実施形態は、シークエンシング工程からのDNA配列の配置からのマイクロアレイの複製の作製に関する(例えばABIまたはロシュ454によるシークエンサのパーティクル・アレイ)。そして、それは今までに説明も実行もされなかった。DNAからDNAへの、または、DNAからタンパク質への生化学的に複製することなどの、個々のサブステップが、既知の発明において説明されたことがあったとしても、シークエンシング工程からマイクロアレイを作製するための個々のサブステップを組み合わせることは知られていない。特に、後にシークエンサから1つのDNAアレイからの複製を製造することによるDNAアレイの作製が続き、その後にそのDNAアレイからRNAアレイ又はDNAアレイの作製が続く、シークエンシングの製造ラインはこれまでに知られていなかった。
【0044】
すでに説明されたように、進行中のシークエンシング工程から早くもDNAアレイを作製することは先行技術からは公知ではない。また、直接前記DNAアレイを複製して、それから選択的修飾によって、DNAまたはRNAマイクロアレイのサブセットからタンパク質マイクロアレイに至るまで、それを改質することは、これまでに説明されなかった。本発明の実施形態は、初めて、シークエンシング工程の間のDNAアレイを作製、および、それにより一般的なマイクロアレイの研究を可能にするために要求されたアレイ表面にそれをすぐ変形させることを可能にする。本発明の実施形態では、マイクロアレイの骨の折れる合成製造は、このようにして完全に回避されうる。
【0045】
しかし、本発明の実施形態は、マイクロアレイをシークエンシング工程から複製することに限らない。むしろ、本発明の実施形態は、例えば、市販のマイクロアレイなどの平面的なマイクロアレイを、単純な方法かつ低コストで、直接複製することを可能にする。本発明の実施形態は、選択的にアレイの態様を完全にコピーし、RNA、DNAサブセット、cDNAまたはタンパク質アレイを作製するためにそれらを転写することを可能にする。
【0046】
例えば適切な増幅手段(例えばPCR、等温増幅、NASBA)や表面との結合アダプタまたは結合特性のマッチング(例えば、プライマー、ストレプトアビジン/ビオチン、抗原抗体、ポリヒスチジン/ニッケル複合体、静電気/力または磁気特性)などの適切な複製方法は、当業者にとって明らかであり、本願明細書においてされる更なる説明は必要ではない。この点において、また、この事項の教示が参照によりここに援用される序文において説明された文書を参照されたい。
【0047】
本発明の実施形態によれば、例えばDNAの遺伝情報の少なくとも一つの複製は、こうして、一次アレイと呼ばれうる遺伝的情報から作られる。そして、複製は、二次アレイと呼ばれうる。更なるアレイの複製(三次アレイとも呼ばれうる)は、さらにまた複製から作製されうる。三次および/または二次アレイは、同一の複製、相補的複製、サブセットまたはRNAまたはタンパク質アレイでありうる。そして、それは、一次および/または二次アレイに関して生化学の複製システムの選択次第である。
【0048】
本発明の実施形態では、一次アレイは、DNAシークエンサから生じる。基本的に、いかなる市販の粒子ベースのシークエンサも、これに関して考慮されうる。しかし、別の実施形態において、いかなる平面的なDNAマイクロアレイも、複製されることになる一次アレイとして使用されうる。本発明の実施形態は、一つの表面からもう一方への「複製工程」にも関する。ただし、アレイの各サンプルは、他の有効領域と分離しているそれに都合がいいように作られた空間的に制限された有効領域を有する。これは、生化学情報を含み、例えば、シークエンサにおいて、または、平面的なマイクロアレイに加えて、化学物質ライブラリにおいて作られるような、非平面的な表面または粒子アレイも含む、空間的に分離された方法で順序付けられた物質ライブラリを含む。
【0049】
本発明の実施形態では、使用される増幅薬は、いかなる周知の増幅薬でありうる。以前の増幅は、特定のDNA断片または配列を増幅することに照準を定めたものであった。この種の周知の増幅については、特定の鎖がどこで一般的に生じたかについての位置情報は保持されない。というのも、前記増幅が溶液中で起こるからである。本発明の実施形態では、対照的に、各サンプルが、都合がいいように他のサンプルの増幅薬領域と分離している空間的に制限された増幅薬領域を有するということにおける複製の作製において、ソース、すなわち、一次アレイから、その複製、すなわち二次アレイへの位置情報は、全体的に又は部分的に保持される。この位置情報は、レジストレーション(registration)ともしばしば呼ばれる。これは、例えば規則的なグリッド内のその配置(行と列、xとy位置)により定義されたような特定のDNA断片の位置を意味するものと理解される。この位置情報の少なくとも部分的な保持によって、本発明は、高品質の複製の作製を可能にする。位置情報がより多く保持されるほど、複製はより良いであろう。多数の複製が作られるとき、低い空間分解能は、ますます低い品質の複製を作り、結果的にある点で役に立たないだろう。
【0050】
本発明によれば、いかなる周知の増幅方法も、通常、使用され、実施形態によっては、PCRまたはブリッジ増幅は、使用されうる。ブリッジ増幅は、表面に使用されうる。従って、本発明の実施形態において、複製工程は、1つの表面から別のものへと生じるが、位置情報または複製された種類のレジストレーションは保持されるある種のブリッジ増幅を示す。別の実施形態において、付加的な結合システムはまた、複製をキャリアと結合すること、例えば[4]に記載されているようなストレプトアビジン/ビオチン・システムに使用されうる。しかし、結果として増加した複雑性をもたらす。
【0051】
本発明の実施形態において、結合アダプタは、アレイが複製されることになっているキャリアの全域にわたって配置されうる。
【0052】
本発明の実施形態では、結合アダプタは、複製される分子の配列に対して相補的であるプライマーである。
【0053】
本発明の実施形態において、位置情報の保持は、空間的に分離すること又は各サンプルと関連した増幅薬領域を区分することによって成し遂げられる。このように、個々の分子は、「マイクロコンパートメント」から逃げるのを防止されうる。その結果、空間分解能またはレジストレーションは保持される。すでに説明されたように、本発明の実施形態において、いかなる増幅技術も、PCRまたは等温増幅などの複製工程としてみなされうる。複製工程の間、複製は、ターゲット面上へ析出され、固定される。遺伝情報が全体的に又は部分的に保持されるという事実に加えて、位置情報もまた保持される。本発明の実施形態は、その表面の「単純な」複製を意味すると一般に理解される1:1複製を供給する。この工程において、原物の複製は作製される。そして、それは可能な限りの類似性の最高水準を有する。マイクロアレイの場合、複製工程の後に、DNAアレイから更なるDNAアレイを得ることになるだろう。
【0054】
本発明の実施形態は、アレイの一部分の複製、すなわち派生物を作製することを可能にする。一部分の複製または一部分のコピーは、コピーされる情報の特定の選択を意味すると理解される。例えば、DNAアレイを複製する工程の間、特定の種類のDNAのみが、キャリアが結合アダプタとして含むプライマーを選択することによって、増幅されうる。このように、例えば特定の配列又は特定のプロモータを含むあらゆるDNA鎖などの、要求された情報を含むサブセットは、得られる。
【0055】
同様に、派生物は、RNA又はcDNAへのDNAの、DNA、cDNA、又は、タンパク質へのRNAの複製の「コンバージョン(conversion)」と呼ばれる。これに関して、生化学情報は、一つの種類の分子から別のものに変換され、かつ、位置情報は依然として保持される。
【0056】
本発明の実施形態において、空間的に制限された増幅薬領域の形で制限された有効領域は、固体構造物によってつくられるが、本発明の別の実施形態において、粘性の異なるレベルの液体間の界面は、空間的に制限された有効領域をつくることに貢献する。
【0057】
加えて、本発明の実施形態は、他の分子または粒子との反応または相互作用についての、および、反応触媒作用についての解析目的のための複製および派生物の応用に関する。
【0058】
本発明の実施形態は、添付図を参照に、より詳細に以下で説明される。
【図面の簡単な説明】
【0059】
【図1】図1a〜図1dは、本発明の方法の実施形態を示すための模式的な断面表現を示す。
【図2】図2は、図式的に、PicoTiterPlate(商標)の断面の平面図を示す。
【図3】図3は、図式的に、DNA粒子を含んでいるシークエンサチップの断面表現を示す。
【図4】図4a〜図4cは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図5】図5a〜図5dは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図6a】図6aは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図6b】図6bは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図6c】図6cは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図6d】図6dは、図式的に、本発明の方法の更なる実施形態を示すための断面表現を示す。
【図7】図7は、本発明の別の実施形態を示すための略図を示す。
【発明を実施するための形態】
【0060】
図1aから図1dに関して、発明の方法の実施形態について、以下に述べる。ここで、一次アレイは、シークエンサチップ10の形で存在する。シークエンサチップ10は、複数のマイクロキャビティ12を含む。マイクロキャビティ12を含んでいるシークエンサチップ10の断面の模式的な平面図は、図2に示される。マイクロキャビティは、例えば、図2に示されているように、44μmまたは29μmの直径を有しうる。シークエンサチップは、例えば、ロシュ(Roche)による454シークエンサのシークエンサチップ(GS FLX 2005および/またはGS FLX Titanium 2008)でありえる。
【0061】
キャビティ12の各々は、そこに配置された粒子14を有する。そして、前記粒子14の各々は、個々のDNA鎖16の何百万もの複製を運ぶ。それらに取り入れられたDNA鎖16を含んでいる粒子14を有するキャビティ12を含んでいるシークエンサチップ10の模式的な断面表現は、図3に示される。これまで、シークエンサチップは、シークエンシング工程後、廃棄されており、従って、シークエンシング工程の「老廃物」であった。
【0062】
図1から図3において表された実施形態において、このチップは、複製を作製するための一次アレイとして使用される。そのDNAは、キャビティ12からすっかりコピーされることになる。この目的のために、キャビティは、最初に増幅薬、例えばPCR混合物で満たされる。その後、図1bに示されているように、キャビティ12をシールし、図式的に図1bのスポット22として示され、増幅薬にマッチする結合アダプタを運ぶキャリア20は置かれる。一旦キャビティ12が蓋20によって塞がれると、空間的に制限された増幅薬領域24がこうして各サンプル、すなわち、それに拘束されたDNA鎖16を有する粒子14ごとに作られ、そして増幅薬領域24は、他のサンプルの増幅薬領域24から分離される。結合アダプタ22は、これらの増幅薬領域24に接する。例えば、結合アダプタ22は、PCR混合物とマッチングするプライマーである。前記プライマーは、DNAポリメラーゼのための結合部位である。図1bは、生化学的複製が粒子のDNAでできているポリメラーゼ・ステップの後の状態を示す。これらの複製は、図1bの破線18として描写される。例えば、プライマーの選択によって、増幅薬として使用される酵素の混合物が、このステップで、相補的DNA、すなわち、ネガティブコピーを生成する。
【0063】
その後、作られたDNAの複製18は、粒子14から解放される。そして、それは、例えば、シークエンサチップを加熱し、こうしてそこに配置されたキャビティを加熱することによって実行されうる。その後で、解放された複製18は、結合アダプタ22に加わる。そして、それは、例えば、シークエンサチップを冷やすことによって促進されうる。結合アダプタ22に加わり、そして、こうしてキャリア20に加わる複製18の結果物は、図1cにおいて表される。キャリア20に複製を複製するこのステップにおいて、位置情報またはレジストレーションは保持される。というのも、空間的に制限された増幅薬領域24が、サンプルごとに供給されるからであり、そして、増幅薬24が互いに分離しているからである。
【0064】
その後、それに拘束されたDNA複製18を有するキャリア20は、シークエンサチップ10から取り除かれて、シークエンサチップ10のキャビティ12の範囲内に配置されたDNA粒子14、16の複製を表す。DNA鎖16を含んでいる粒子14は、キャビティ12の範囲内に残っており、その結果、前記キャビティは、再び新しいキャリアを用いた新しい複製工程のための一次アレイとして役立ちうる。この方法で、基本的に多くの複製が作られうる。それに拘束したDNA複製18を有するキャリア20は、例えば、DNAへのタンパク質の、DNAへのRNAの、さらにはRNAのRNAへの結合の検出において、トランスクリプトーム(transcriptome)解析のバイオチップとして使用されうる。
【0065】
複製工程後に、更なる複製サイクルのための一次アレイ(シークエンサチップ10)を再度準備するために、キャビティ内の増幅薬、例えばPCR混合物は、交換されうる又は取り除かれうる。コンタミネーションを回避するために、(特別なDNA生成物を消化するウラシルDNAグリコシラーゼ(uracil−N−glycosylase)のような)酵素も含みうる洗浄ステップは、PCR生成物を取り除いて、従って、オリジナルマスタを汚染することなく多くの複製を可能にする。
【0066】
図4aから図4cは、発明の方法の更なる実施形態を表す。ここで、従来の平面マイクロアレイは一次アレイとして役立つ。平面マイクロアレイは、アレイ基板30上に配置されて、所望のDNAサンプルを含む。DNAサンプルは、二次元の空間配置を有する。DNAサンプルを複製する工程のために、キャビティ36を含んでいるマイクロストラクチャ34は、供給される。少なくとも一つのキャビティ36は、DNAサンプル32ごとに供給される。比較的高い分離度を得るために、別の実施形態において、DNAサンプル32ごとに、複数の、いずれの場合においても、比較的小さいキャビティ36は、供給されうる。
【0067】
キャビティ36は、そこに配置された結合アダプタ38を有する。キャビティまたはマイクロキャビティ36は、増幅薬、例えばポリメラーゼ混合物で充填される。キャビティ36がアレイ基板30で塞がれるように(小距離が有効であるが、キャビティ間のコンタミネーションを強める)、マイクロストラクチャ34はマイクロアレイ30上に置かれ、そして、そうすると、DNAサンプルが、それぞれ、それらと関連したキャビティ36内に配置される。この方法で、他のサンプルの増幅薬領域35と分離している空間的に制限された増幅薬領域35は、DNAサンプルごとに再び作られる。結合アダプタ38は、ポリメラーゼ混合物とマッチングするプライマーによって再度形成されうる。
【0068】
このように塞がれた増幅薬領域35を作った後に、ポリメラーゼ・ステップのような増幅は再度起こる。ここで、DNAサンプル32はキャビティ36の中に増幅され、複製される。図式的に図4bのDNA42によって示されているように、複製されたDNAは、結合アダプタ38で固定される。このために、再度、そこに配置されたDNAサンプルを有するキャビティの温度は、それに応じて制御されうる。最後に、そこに位置付けされたDNAサンプル32を有するDNA基板30は、マイクロストラクチャ34から取り除かれる。その結果、複製されたDNA42を有するマイクロストラクチャ34は元のマイクロアレイの複製を表す。このように複製されたDNA42を供給されるマイクロストラクチャ34は、ここで、例えば、図1aから図1dに関して上で説明されたような方法と類似して実行されうる更なる複製ステップのためのテンプレートとして使用されうる。これに関連して、複製工程の後、シークエンサチップ、例えばロシュ(Roche)による454シークエンサのシークエンサチップと同じ特性を有するように、マイクロストラクチャ34は構成されうる。
【0069】
実施形態は、上記の実施形態による方法の組み合わせを含みうる。最初に、シークエンサチップは、上の図1aから図1dによる複製工程により、全てのDNAのマイクロアレイを含んでいる平面キャリアを作るのに使用されうる。その後、このキャリアは、図4aから図4dに関して説明された実施形態によって再度複製される。DNAによって占められたマイクロキャビティ(図4aから図4dのマイクロキャビティ36)は、ここで、例えば図1aから図1dの方法によって、DNAの更なる複製を作るために使用されうる。あるいは、DNAによって占められたマイクロキャビティは、相補的DNA、DNAのサブグループ、短くされた、伸長された又は修飾されたDNA、さらにはRNA、タンパク質の形で、修飾された複製をつくるために使用されうる。このように、DNA、RNAまたはタンパク質またはペプチドを含んでいるいかなる領域も作られうる。
【0070】
発明の方法の更なる実施形態は、ここで、図5aから図5dに関して説明される。この実施形態において、DNAは、油中水型エマルジョンPCRによって、個々の粒子50中に増幅される。一つの種類のDNAは、(454シークエンシングのためのビーズの製法において、または、ABI SOLIDシークエンサにおいてと同じように)粒子ごとに固定される。前記粒子は、キャリア52の表面に位置付けられる。より詳しくは、粒子50は、液体54の各液滴(例えば水の液滴)に位置する。水の液滴は、油膜56と互いに分離される。水の液滴は、こうして、空間的に制限され、相互に分離された増幅薬領域54’を定めることに貢献する(図5c)。水の液滴54は、親水性被覆によってキャリア52の表面の各位置にくっつかれうる。その結果、それらは定められた空間配置のキャリア52に配置される。例えば、キャリア52は、生化学分子のサンプルの配置に対応する親水性のドットの規則的なパターンを含みうる。水の液滴54は、いずれの場合においても、そこに取り入れられた増幅薬を有する。このように、そこに拘束されたDNAを含んでいる粒子50の形でサンプルごとに、液体、例えば水および油間の界面によって他のサンプルの増幅薬領域とは分離される空間的に制限された増幅薬領域は、供給される。図5bに示されているように、結合アダプタ62を含んでいるキャリア60は供給される。水より細いかたまりの(thinner−bodied)油が動かされるように、および、キャリア60が結合アダプタ62を含むその表面により水の液滴54と接触しないように、結合アダプタ62を含んでいるキャリア60は、油膜56上へ押圧される。図5cにおいて表されているように、水の前記液滴54はその過程で容易に圧縮されうる。
【0071】
その後、液滴54の範囲内で粒子に拘束されるDNAは、DNA複製をつくるために、増幅薬によって増幅される。前記DNA複製64は、結合アダプタ62に拘束されて、キャリア60と共に基板52から取り除かれる。このように、それに拘束された複製されたDNAサンプル64を有するキャリア60は、元のアレイの複製を表す。
【0072】
他の実施形態において、結合アダプタはキャリア60というよりむしろ基板52に供給されうる。その結果、DNAは基板52へ複製されるが、キャリア60は単に反対のサポートとして機能するだけである。従って、この実施形態は、また、油中水型エマルジョンPCRを使用すると共に、粒子アレイの複製として平面マイクロアレイを作製することを可能にする。このように、DNAアレイの早い製造は可能である。また、RNA複製、タンパク質複製または修飾DNA複製は、つくられうる。
【0073】
本発明によれば、空間的に制限された有効領域が、複製されるアレイのサンプルごとに、すなわち、複製又は派生物がつくられることになっている。有効領域の空間的作製は、さまざまな方法で実行されうる。本発明の実施形態において、空間的に塞がれたキャビティは、サンプルごとに供給される。実施形態において、特定の方向への拡散を容易にする空間区分は、供給され、例えば柱又は溝の配置など、他の方向への拡散を防ぐ。実施形態において、ヒドロゲル、エーロゲルまたはポリマー面のような、特定の方向への拡散を好む又は抑止する多孔材、拡散を定めている材料または分子構造は、使用されうる。実施形態において、例えばポリマー分岐、デンドリマー、粒子アレイ、フィルタ膜、脂質膜(球形又は平面)などの、秩序ある又は無秩序な、ナノ又は分子構造は、空間的に制限された有効領域を実施するために使用されうる。
【0074】
実施形態において、拡散(電気泳動、光学ピンセット、磁気泳動、弾性表面波、熱泳動、…)の優先方向または拡散隔膜も作り、それにより空間的分離を構築する電場又は磁場などの物理場は、空間的に制限された有効領域をつくるために使用されうる。例えば、磁性流体および「硬化」磁場は、使用されうる、または個々の領域を分離するレーザー光グリッドは使用されうる。
【0075】
実施形態において、例えば電場、チャージ、pHの変化、光による非活性化/活性化、圧力などによって、空間的に制限された有効領域をつくるために、活性化および/または非活性化が、有効領域の中で、または、外側で生じうる。例えば、ポリメラーゼの光活性化または光による活性ヌクレオチドの生成は、制限された領域の中で実行されうる。そして、反応は暗い領域においては起こらない。
【0076】
更なる実施形態において、空間的に制限された有効領域に特定の物理効果を供給する表面構造は使用されうる。例えば、疎水性/親水性の領域(例えば油および水)またはポリマーは、電場によって特定の領域において増加しうる及び硬化しうる、そして、こうして空間的に制限された有効領域を定めうる状況において言及されうる。
【0077】
空間的に制限された有効領域が三次元構造によって定められる更なる実施形態は、ここで、図6aから図6dに関して説明される。図6aに示されているように、アレイの一部である分子のサンプル100は、アレイ基板104のエレベーション102に配置される。エレベーション102間に、凹部103は、アレイ基板104内に形成される。図6bに示されているように、固相プライマーの形で結合アダプタ108を含んでいるキャリア106は、アレイ基板104の近くに位置付けられる。アレイ基板104の、および、キャリア106の空間的近接のため、エレベーション102の、および、キャリア106の向かい合った表面との間に、エレベーション102の領域において、空間的に制限された有効領域は生ずる。対照的に、凹部102の、そして、キャリア106の向かい合った表面との間の間隔は、ここで有効領域は形成しないように、十分に大きい。
【0078】
有効領域において、固相プライマーとサンプル100間の接点はハイブリッドすることを可能にする。その結果、図6cに示されているように、増幅は開始しうる。矢印112によって図6cに示すように、増幅のための材料は、加えて、凹部から供給されうる。このように、キャリア106に拘束されたサンプル100の複製114は生成され、そして、こうしてサンプル100によって形成されたアレイの複製は作製される。
【0079】
図6cにおいて表された状態から始まり、アレイ基板104およびキャリア106は、ここで分離され、サンプル100がアレイ基板104で残ったままであり、複製114がキャリア106によって除去される。更なる複製は、それから、アレイ基板104に位置づけされたアレイで、または、キャリア106に位置付けされた複製で作られる。
【0080】
図6aから図6dに関して説明された実施形態において、増幅およびキャリアへの転写が、基本的に同時に起こる。転写及び増幅が互いに別々に起こる場合、別の実施形態において、1つのステップが大きい表面領域にわたって実行され、他方が、空間的に定められた方法で実行されうる。
【0081】
図6aから図6dに関して説明された実施形態において、空間的に制限された有効領域は、このように、プライマーがあることによってだけでなく、説明された構造によってつくられる。これに関連して、その反応はブリッジ増幅に対応する。その表面は、互いに物理的接点をもたらされる。空間的近接のため、DNAが他の表面へ複製されることを特徴とする「有効領域」は、エレベーション、すなわち段のピークで形をなす。その後、前記ピークは取り除かれさえしうる。というのも、その増幅は、いわば、それ自身の有効領域を定める典型的ブリッジ増幅だからである。しかし、反応の始まりは、空間有効領域の初期条件によってしか起こらない。この反応は、エッジまたはピークの増幅と呼ばれうる。空間的なエッジまたはピークは、反応のきっかけとなる。エッジの隣の空間は、反応に必要な材料を供給する。
【0082】
別の実施形態において、複製されるアレイは、図6aから図6dまでの偏りにおいて、平面基板に配置されうるが、エレベーションはアレイが複製されるキャリアに形成される。さらにまた、あるいは、エレベーションは、アレイ基板に、そして、キャリアに形成されうる。
【0083】
エネルギー場(例えば磁場又は電場)によってどれくらい空間的に制限された有効領域が作られうるかに関する実施形態が、図7において表される。図7は、単に、図式的に、アレイ基板120およびキャリア122を示すだけである。キャリア122上に結合アダプタだけでなく複製されることになるアレイ基板120上の分子サンプルは、単純化の目的のために表されない。分子の各サンプルの領域において、アレイ基板120とキャリア122の間に配置される増幅薬にエネルギー場126を生成するように構成される場発生手段124は、配置される。このように、空間的に制限された有効領域128は作られ、ここでは増幅薬が活性化されるが、残りの領域ではそうはならない。
【0084】
発明の方法の実施形態が、上で示された。本発明の方法ステップを実施するための対応する装置又は手段の実施形態は、その記載から結果として生じる、又は、当業者にとって明らかである。従って、本発明の装置が、必要に応じて、物理エンティティ、例えばさまざまなアレイ、キャリアまたは基板を位置決めするための適切な処理手段を含みうることを更に示す必要はない。加えて、適切な流体手段が、必要な位置で各液体または作用薬を供給するために提供されうることを更に説明することは必要でない。加えて、対応する制御装置が、本発明の方法を実行するように本装置を制御するために提供されうることは、当業者にとって明らかである。本方法を実行するために必要とされる環境をつくるための手段(例えば温度センサ)はまた、供給されうる。
【0085】
本発明の実施形態は、特に、アレイの複製又は派生物を作るのに適している。ここで、その分子は、一本又は二本鎖のオリゴヌクレオチド、ポリヌクレオチド、DNAまたはDNAに類似している合成分子(PNA)である。本発明の実施形態において、(例えばマイクロアレイなどの)空間的に平面な配置、(例えばシークエンサチップ内の)粒子の空間配置、(例えばPicoTiterPlate(商標)内の)キャビティの空間配置、または、(例えば液体の各溶滴の)異なる層の空間配置は、一次アレイとして働きうる。加えて、イルミナまたはアプライドバイオシステム(SOLID)の企業などによる、粒子ベースの分析法は、例えば、この種のアレイとしてもみなされうる。実施形態において、例えばオリゴヌクレオチドまたはポリヌクレオチドなどの生化学分子は、ゲノムを得るためのシークエンシング工程から、トランスクリプトームを得るためのシークエンシング工程から、RNA(例えばmRNA、tRNA、siRNAまたは一般のRNAなど)をシークエンシングする工程から、または、ミューテーションおよびバリエーションのシークエンシング工程から、複製されうる。本発明の実施形態において、生成された複製は、アレイを作製するための各ケースにおいて、DNA、修飾DNA(伸長した、短くなった、人工的な、挿入物、削除、ミューテーション…)、DNA構造物(発現ベクター、siRNA)、人工分子(PNA、修飾ペプチド)、RNAまたはタンパク質でありうる。
【0086】
本発明の実施形態において、オリゴヌクレオチドまたはポリヌクレオチドは、アレイまたは構造面を生成するためのシークエンシング工程から複製されうる。実施形態において、オリゴヌクレオチドまたはポリヌクレオチドは、アレイを作製するために、または、表面をコーティングするために、粒子の配置から複製されうる。本発明の実施形態において、オリゴヌクレオチドまたはポリヌクレオチドは、複製を生成するために、相補的複製を生成するために、または、物理化学的に表面を修飾するために、表面から複製されうる。
【0087】
本発明の実施形態において、オリゴヌクレオチドまたはポリヌクレオチドは、新規な表面特性に基づいた応用のための、または、化学物質を生成するための生化学工程チェーンのための化学的又は生化学的修飾の目的で、別の表面へ複製されうる。本発明の実施形態において、必要はないが、油中水型エマルジョンPCRによって作製されうる粒子アレイは、DNAライブラリのアレイを作製するために、さまざまなDNA変異体を含んでいるアレイを作製するために、RNA又はタンパク質に前記アレイを更に複製するために、又は、細胞実験において複製を使用するために、シークエンスされる必要なしに、複製されうる。
【0088】
本発明の実施形態は、多数の応用分野において使用されうる。この種の応用分野の例は、シークエンシング、転写解析、DNA、RNAまたはタンパク質活性の測定、発現研究、ファージディスプレイ、リボソームディスプレイまたは細胞ディスプレイを使用する際のディスプレイ技術、および、代謝産物研究である。加えて、本発明は、相互作用研究において適用され、例えば、以下がある。DNA/DNA;DNA/RNA;DNA/タンパク質;RNA/タンパク質;RNA/細胞;タンパク質/タンパク質;キナーゼ活性;プロテアーゼ活性;ホスファターゼ活性;DNA結合タンパク質;エピトープ・マッピング;病原体の測定;物質又は抑制物質の測定。本発明は、アレイ側での多数の相互関係パートナーでは、今日、部分的に可能でないこの解析を可能にしうる。
【0089】
加えて、本発明は、ワクチン開発の分野において、適用されうる。そして、1つの例は以下の通りである。新しいウイルス/バクテリアが現れると仮定する。細胞サンプルまたは血液サンプルは、生存する第1の生物からとられる。その細胞サンプルはウイルスに感染しており、mRNAは分離される。前記mRNAは、配列決定される。そして、得られたDNAはそれから完全にコピーされる。その後、DNAアレイは、タンパク質アレイに転写される。このように、このアレイは、細胞のタンパク質およびウイルス感染により修飾されるタンパク質を含む。血液サンプルはアレイ上へ位置付けられる、そして、そこに含まれる抗体はタンパク質と結びつく。抗体だけがウイルスタンパク質と結びつく。というのも、抗体はそれ自体で同じ集合のタンパク質と結びつかないからである。拘束された抗体は、それから最後のステップによって特定されうる。このように、DNAおよびタンパク質のウイルスの配列は、決定されうる。このように、非常に短い期間内で、抗体のエピトープおよび結合タンパク質についての情報を得た。従って、この情報によって、受動的および能動的ワクチンが、すぐにつくられうる。このように、感染病の場合において、ワクチンを作ることができる前に取られる時間は、劇的に低減されうる。
【0090】
従って、本発明の実施形態は、シークエンシング工程の間生成されるDNA配列のアレイ(一次アレイ)が表面に転写され、したがって、このDNAの複製(二次アレイ)は作られる、完全な作業サイクルを可能にする。加えて、実施形態において、一次又は二次アレイは、さらに、RNAまたはタンパク質(三次アレイ)の形で更なる複製としてモデル化されることになる。実施形態において、生化学分子(例えばDNA)の各アレイは、一次アレイとしてみなされうる。また、最適に複製技術を選択することによって、同一の又は原物の選択的複製は、つくられうる。従って、本発明の実施形態は、その工程において使用されるアレイを(遺伝子シークエンシングの前、間、後に)マッピングすることに関する。そして、更なる複製ステップにおいて、遺伝子、cDNA、RNAまたはタンパク質アレイの中に任意でそれを改良することに関する。
【0091】
本発明の実施形態は、空間的に分離された方法で、シークエンシング工程の間に何回か、分子情報が複製されうるという点で、有効である。ただ1つの原物だけが、この目的のためのマスターとして必要である。原物の性質およびそこに含まれるデータについての情報はなくてもよい。従って、複製工程は、含まれた情報とは独立している。加えて、本発明の実施形態は、その場合成または印刷/調剤装置を使用することなしで、マイクロアレイを作製すること、または、生化学的表面構造化を複製することを可能にする。複製工程は、分子レベルで起こり、確立した生化学システムを使用する。位置情報が保持されるので、複製工程は、生化学情報の高度に並列な処理を可能にする。これは、分子レベルで、異なる種類のマイクロアレイを結合することを可能にし、配列についての情報を得た後のマイクロアレイの時間およびコストがかかる製造を回避する。
【0092】
本発明の実施形態において、空間的に制限された増幅薬領域を定めることに貢献するマイクロ又はナノ構造は、特に、フィルタ膜に、ヒドロゲルに、または、エーロゲルに基づいた無秩序なマトリックスを含む。本発明の実施形態において、マイクロまたはナノ構造は、整然とした三次元基板に基づく。
【0093】
本発明の実施形態において、空間的に制限された増幅薬領域は、少なくとも部分的に、2つの流体、流体および気体間の界面または物理的境界(特に脂質膜)によって分離される。
【0094】
本発明の実施形態において、複製又は派生物をキャリアと結びつけるプロセスはまた、増幅と同時に実行されうる、または、固定された結合アダプタが増幅のためのプライマーとして働くという点で増幅の一部でありうる。加えて、派生物は、固定されたキャプチャ分子を介して、または、それらを作製するために使用されるシステムとそれらが連結したままであるという点で、そして、前記システムがキャリアに固定されるという点で、キャリアに拘束されうる。例えば、このシステムは、酵素、リボソームまたは細胞から成りうる。
【0095】
本発明の実施形態において、有効領域の空間的制限は、規則的又は不規則なスポットの分布を含みうるプライマーアレイの形で、相補的プライマーとして、結合アダプタがキャリア上にあるという点において成り立つ。そして、キャリア上のスポットサイズおよびスポット密度はアレイ上のそれと等しい又は小さい。
【0096】
本発明の実施形態において、増幅薬は、DNA増幅、特に、ポリメラーゼ連鎖反応、等温増幅(例えばNASBA反応)に作用するように構成され、そして、結合アダプタはマッチングプライマーを含む。
【0097】
本発明の実施形態において、一次、二次および/または三次の派生物は、DNAがRNAに転写され、RNAはタンパク質に翻訳されるという点において、または、生成されたタンパク質、生成されたRNAまたは生成されたDNAまたは液相からのそれらの複製を使用するときにバインダーが増やされる点において、または、バインダーが相互に作用するという点において、一次アレイまたは一次アレイの複製から、生成される。
【0098】
本発明の実施形態において、派生物は、ターゲットアレイの固相で生成され、固定された方法でそこに存在する。本発明の実施形態において、サンプルの位置は、サンプルの一部である又は固定され、派生物を生成するのに必要とされ、例えば、複製起点(ori)、プロモーター、リボソーム結合部位、開始コドン、エンドプロテアーゼ切断部位、融合配列、リポーター遺伝子、ターミネーター、抗生物質抵抗性遺伝子、インビトロ(in−vitro)翻訳系または細胞などの、派生物、特に発現ベクター配列を生成するために必要である、更なる分子又はDNA配列又はそこに位置づけられた細胞を有する。
【0099】
本発明の実施形態は、本発明の方法を使用すると共に、作製された分子のアレイの複製又は派生物に関し、そして、この種の複製又は派生物の応用に関する。本発明の実施形態において、この種の複製又は派生物は、特に遺伝子型−表現型カップリング(genotype‐phenotype coupling)のために、バインダー、特にタンパク質、抗体または抗原と、元の分子との間の反応を、元の分子のDNA配列を関連させるのに、使用される。本発明の実施形態において、この種の複製又は派生物は、元の分子、その複製又はその派生物が、特に遺伝子型−表現型カップリングのために、元の分子のDNA配列と、基板の変換を触媒する反応を関連させるために使用される。本発明の実施形態は、この種の利用によって特定されたDNA配列に関し、この種のDNA配列、特に抗体、抗原、ワクチンまたは抗生物質に基づいて生成された生成物又は製法に関する。
【0100】
本発明の実施形態において、本発明の方法によって作製された複製又は派生物は、相互作用分子または粒子を用いてサンプル、複製又はその派生物間の反応を検出するのに使用される。そして、前記検出は、光学的、電気化学的又は磁場的センサによって実行され、そして相互作用している分子または粒子は対応する標識を運んでいる、又は、前記検出が標識なしで、エバネッセント場の変化または変更された共振周波数によって、または、光学ピンセットを使用することによって、または、吸収における変化、特に色の知覚又は変化と、又は、光の発光、特に化学発光と、その反応を対にすることによって、実行される。本発明の実施形態において、その配列を検出するために使用される同一のシークエンシング装置はまた、反応を検出するためにも使用される。
【0101】
本発明の実施形態は、アレイの複製又は派生物上で反応を実行するための対応する複製又は派生物の利用に関する。そして、チャンバ又は流体構造物は、複製又は派生物の表面に適合されている結合端子を含む。複製又は派生物は、対応するチャンバに取り入れられており、特定の温度でチャンバをインキュベートすることは可能であり、そして、チャンバの中に含まれた液体を交換することは可能である。この種の利用はまた、アレイをシークエンシングするために使用されもする装置内で起こりうる。
【0102】
本発明の実施形態は、複製又は派生物上の反応および検出を同時に実行するために、対応する複製又は派生物の利用に関する。本発明の実施形態は、液体粒子アレイをシークエンシングする方法に関する。そして、複製は、粒子に含まれるサンプルから作られ、その複製はシークエンシング装置においてシークエンシングされる。
【0103】
本発明の実施形態において、標準方式を使用することにより、増幅または結合プロセスの間、反応の進行は、読み出されうる。これは、酵素、結合および反応機構の分野における応用を可能にする。例えば、CO2を結合する酵素は、生成されうる。前記酵素は、それからpH値の変化によって、即時特定されうる。同様に、他の酵素又は触媒作用または結合性は、特定されうる。これらは、いわば、分子の単なる存在からその作用モードにいたるまでを評価しているいかなる生化学計測技術も含む。従って、本発明の実施形態は、アプリケーションの間、個々の有効領域内でよく知られた検出方法を使用して物理的又は化学的パラメータにおける変化をモニタすることを含み、そのことは、これまで存在しなかったその派生物だけでなく増幅薬および一次アレイのオペレーティング機構へのある程度の洞察を可能にする。
【0104】
本発明の実施形態は、DNA配列、RNA配列、タンパク質またはDNA、RNAまたはタンパク質の触媒的、信号的(例えば、増強、アロステリック、抑止、…)又は酵素的(例えば、溶解、ホスファターゼ活性、キナーゼ活性、…)機能を特定するための本発明による方法を使用すると共に、作製された分子のアレイの複製又は派生物の利用を提供する。
【0105】
本発明の実施形態は、DNA配列、RNA配列またはペプチド配列を特定するための、およびDNA、RNAまたはペプチドの配列に基づいた、生成物、特に抗体、抗原、ワクチンまたは抗生物質生成物の生成、特定または製法のための本発明による方法を使用すると共に、生成された分子のアレイの複製又は派生物の利用を提供する。
【0106】
「参考文献」
[1]ユ A.A.ら著、「表面粗さを克服するコンタクトプリント法:液体超分子ナノスタンプ法」、Advanced materials 2007、19巻、p.4338−4342
[2]ブランチャード A.P.、フレンド. S.H.著、Nature Biotechnology(1999)17、p.953以下参照
[3]ウェブサイト:http://www.techno−preneur.net/technology/New−technologies/life−sciences/novel.htm
[4]国際公開第2008/022332
[5]キム J.、クルックス R.著、米国化学会誌、128、p.12076−12077、2006年
[6]キム J.、クルックス R.著、Analytical Chemistry(2007)1,79、p.8994−8999
[7]ホー Mら著、Nature Methods(2008)、5、p.175−177
[8]ラマチャンドラン Nら著、Methods in Molecular Biology(2006)328、p.1−14
[9]米国特許第6017738号明細書
[10]米国特許第6274351号明細書
[11]米国特許第6300070号明細書
[12]エイブラムズ E.S.ら著、Diagnostic Gene Detection、1.9、p.171−189、1997年
[13]Laborwelt誌、第3版、8巻、2007年
[14]シェンジャー J.ら著、「次世代DNAシークエンシング」、Nature Biotechnology、26巻、10号、p.1135−1145、2008年10月
[15]ゲノム分析のためのイルミナ・ハンドブック、2007年
[16]ケイン R.S.ら著、Biomaterials(1999)20、p.2363−2376
[17]トーレス T.T.ら著、ゲノム研究、http://genome.cshlp.org/cgi/content/abstract/gr.6984908v1#otherarticles
[18]欧州特許第1203945号明細書
【特許請求の範囲】
【請求項1】
分子(16;32;50)のアレイの複製又は派生物を作製する方法であって、前記アレイは、分子(16;32;50)の分離したサンプルの空間配置を含み、前記方法は、
サンプルごとに、他のサンプルの有効領域(24;35;54)と分離している、少なくとも一つの空間的に制限された前記有効領域(24;35;54’)をつくるステップであって、キャリア(20;34;60)の、結合アダプタ(22;38;62)又は結合特性を供給された、表面は、前記有効領域(24;35;54’)で接するステップ、
前記サンプルの複製(18;32;64)又は派生物をつくるために、前記有効領域(24;35;54’)において、増幅薬によって、前記分子(16;32;50)を増幅するステップ、
前記キャリア上の前記サンプルの前記複製又は派生物の空間配置が、前記アレイの前記サンプルの前記空間配置に対応するように、前記結合アダプタ又は前記結合特性(22;38;62)によって、前記キャリア(20;34;60)と、前記サンプルの前記複製又は派生物(18;32;64)を結合するステップ、および、
前記アレイから前記サンプルの前記複製又は派生物(18;32;64)を含んでいる前記キャリア(20;34;60)を取り除くステップ、を含むこと、を特徴とする、方法。
【請求項2】
空間的に制限された有効領域をつくることは、空間的に制限された増幅薬領域(24;35)をつくることを含むこと、を特徴とする、請求項1に記載の方法。
【請求項3】
前記空間的に制限された増幅薬領域(24;35)は、少なくとも部分的に、前記アレイのアレイ基板(10)の範囲内で、または、前記キャリア(34)の範囲内で、マイクロ又はナノ構造(12;36)によって定められること、を特徴とする、請求項2に記載の方法。
【請求項4】
前記マイクロ又はナノ構造は、特に、フィルタ膜、ヒドロゲル、または、エーロゲルに基づいた無秩序なマトリックスを含むこと、請求項3に記載の方法。
【請求項5】
前記マイクロ又はナノ構造は、秩序ある三次元基板に基づくこと、を特徴とする、請求項3に記載の方法。
【請求項6】
サンプルごとに少なくとも一つの空間的に制限された増幅薬領域(24)をつくることは、前記アレイ基板(10)の範囲内に、相互に、別々に、関連した凹所(12)に前記サンプルを供給すること、前記増幅薬を前記凹所(12)に注入すること、および、前記キャリア(20)により前記凹所(12)を塞ぐこと、を含むこと、を特徴とする、請求項3に記載の方法。
【請求項7】
少なくとも一つの空間的に制限された増幅薬領域(35)をつくることは、前記サンプルが前記増幅薬(35)にさらされるように、各サンプルと関連し、そこに配置された前記結合アダプタ(38)を有する少なくとも一つの凹所(36)を有する前記キャリア(34)を供給すること、前記増幅薬を前記凹所(36)に注入すること、および、前記アレイ基板(30)によって前記凹所(36)を塞ぐこと、を含むこと、を特徴とする、請求項3に記載の方法。
【請求項8】
前記空間的に制限された増幅薬領域(54’)は、少なくとも部分的に、2つの液体(54、56)、液体および気体間の界面によって、または、物理的境界、特に脂質膜によって分離されること、を特徴とする、請求項1に記載の方法。
【請求項9】
サンプルごとに少なくとも一つの空間的に制限された増幅薬領域をつくることは、前記増幅薬を含み、そして、前記アレイのアレイ基板(52)上に、前記空間配置で固定される、相互に分離した液滴(54)に、前記サンプルを供給し、より細いかたまりの液体(56)は、前記液滴(54)間に配置されること、および、前記キャリア(60)の、前記結合アダプタ(62)を供給された前記表面が前記液滴(54)に接するように、前記アレイ基板(52)に関連して前記キャリア(60)を配置すること、を含むこと、を特徴とする、請求項8に記載の方法。
【請求項10】
サンプルごとに空間的に制限された増幅薬領域をつくることは、シークエンサチップ(10)またはナノウェルプレートの範囲内に前記サンプルを供給することを含むこと、を特徴とする、請求項2または請求項3のうちの1つに記載の方法。
【請求項11】
前記複製又は派生物を前記キャリアに結合する工程は、前記増幅と同時に実行されること、を特徴とする、請求項1に記載の方法。
【請求項12】
前記有効領域の前記空間の制限は、前記結合アダプタが、規則的又は不規則なスポットの分布を含みうるプライマーアレイの形で、相補的プライマーとして、前記キャリア上に存在するという点で成り立ち、前記キャリア上の前記スポットサイズ及びスポット密度は前記アレイ上のそれと等しい又はそれより小さいこと、を特徴とする、請求項11に記載の方法。
【請求項13】
前記有効領域の前記空間の制限は、エネルギー場を適用することによって、遂行されること、を特徴とする、請求項1に記載の方法。
【請求項14】
前記サンプルは、粒子(14;50)に拘束された分子の形で供給されること、を特徴とする、請求項1〜請求項13のいずれかに記載の方法。
【請求項15】
前記分子は、一本又は二本鎖オリゴヌクレオチド、ポリヌクレオチド、DNAまたはDNAに類似した合成分子(PNA)であること、を特徴とする、請求項1〜請求項14のいずれかに記載の方法。
【請求項16】
前記アレイは、前記ゲノムを得るためのシークエンシング工程、前記トランスクリプトームを得るためのシークエンシング工程、RNA、mRNA、tRNA、siRNAをシークエンシングする工程、またはミューテーション及びバリエーションをシークエンシングする工程から成ること、を特徴とする、請求項15に記載の方法。
【請求項17】
増幅及び前記キャリアとの結合によって、DNA、修飾DNA、DNAの発現物、RNA、タンパク質、又は、ペプチドに相当する複製は、つくられること、を特徴とする、請求項1〜請求項16のいずれかに記載の方法。
【請求項18】
前記増幅薬は、DNA増幅、特にポリメラーゼ連鎖反応、等温増幅またはNASBA反応に影響を及ぼし、前記結合アダプタはマッチングプライマーを含むこと、を特徴とする、請求項1〜請求項17のいずれかに記載の方法。
【請求項19】
分子の前記アレイは、生体分子の非合成のアレイであること、を特徴とする、請求項1〜請求項18のいずれかに記載の方法。
【請求項20】
前記サンプルの前記位置は、前記サンプルの一部である又は固定される、および、派生物、特に複製起点、プロモーター、リボソーム結合部位、開始コドン、エンドプロテアーゼ切断部位、融合配列、リポーター遺伝子、ターミネーター、抗生物質抵抗性遺伝子、インビトロ翻訳系または細胞などの発現ベクター配列を生成するのに必要である、そこに位置づけられた分子またはDNA配列または細胞を更に有すること、を特徴とする、請求項1〜請求項19のいずれかに記載の方法。
【請求項21】
一次、二次および/または三次派生物は、DNAがRNAに転写され、前記RNAがタンパク質に翻訳されるという点において、又は、バインダーが、生成されたタンパク質、生成されたRNA又は生成されたDNA又は液相からのそれらの前記複製を使用するときに増やされるという点において、または、バインダーが相互に作用するという点において、一次アレイまたは前記一次アレイの複製から生成されること、を特徴とする、請求項1〜請求項20のいずれかに記載の方法。
【請求項22】
派生物は、ターゲットアレイの固相で生成され、固定された方法でそこに存在すること、を特徴とする、請求項21に記載の方法。
【請求項23】
前記有効領域の範囲内で物理又は化学パラメータのいかなる変化もモニタすることを更に含むこと、を特徴とする、請求項1〜請求項22のいずれかに記載の方法。
【請求項24】
請求項1〜請求項23のいずれかに記載の方法を使用するときにつくられた、分子のアレイの複製又は派生物。
【請求項25】
バインダー、特にタンパク質、抗体または抗原と、元の分子、その複製又はその派生物との間の反応を、特に遺伝子型−表現型カップリングのために、前記元の分子の前記DNA配列と関連させるための、請求項24に記載の複製又は派生物の利用。
【請求項26】
前記元の分子、その複製又はその派生物は、基板の前記変換を触媒することを特徴とする反応を、特に遺伝子型−表現型カップリングのために、前記元の分子の前記DNA配列と関連させるための、請求項24に記載の複製又は派生物の前記利用。
【請求項27】
DNA配列、RNA配列、タンパク質、または、DNA、RNAまたはタンパク質の触媒的、信号的(例えば、増強、アロステリック、抑止、…)又は酵素的(例えば、溶解、ホスファターゼ活性、キナーゼ活性、…)機能を特定するための請求項24に記載の複製又は派生物の前記利用。
【請求項28】
DNA配列、RNA配列、または、ペプチド配列を特定するための、および、前記DNA、RNA、又は、ペプチド配列に基づいた、生成物、特に抗体、抗原、ワクチンまたは抗生物質の生成、特定、または、製法のための、請求項24に記載の複製又は派生物の前記利用。
【請求項29】
相互作用する分子または粒子を用いてサンプル、その複製又はその派生物間の反応を検出するための複製又は派生物の利用であって、前記検出は、光学的、電気化学的又は磁場的センサによって実行され、前記相互作用する分子または粒子は、対応する標識を運ぶ、又は、前記検出は、標識なしで、エバネッセント場の変化または変更された共振周波数によって、または、光学ピンセットを使用することによって、または、吸収における変化、特に色の知覚又は変化と、又は、光の発光、特に化学発光と、その反応を対にすることによって、実行される、請求項24に記載の複製又は派生物の前記利用。
【請求項30】
前記シークエンシングを検出するために使用される同一のシークエンシング装置はまた、前記反応を検出するために使用されること、を特徴とする、請求項29に記載の前記利用。
【請求項31】
チャンバ又は流体構造物が、前記複製又は派生物の前記表面上に適合される結合端子を含み、又は、前記複製又は派生物が対応するチャンバに取り入れられ、そして、特定の温度で前記チャンバをインキュベートすることが可能であり、前記チャンバ内に含まれた液体を取りかえることが可能である、前記アレイの前記複製又は派生物での反応を実行するための、請求項24に記載の複製又は派生物の前記利用。
【請求項32】
前記アレイをシークエンシングするためにも使用される装置の範囲内での請求項31に記載の前記利用。
【請求項33】
前記複製又は派生物に関する反応及び検出を同時に実行するための請求項24に記載の複製又は派生物の前記利用。
【請求項34】
液体粒子アレイをシークエンシングする方法であって、複製は、請求項14に記載の前記粒子に含まれる前記サンプルから作られ、前記複製は、シークエンシング装置でシークエンシングされる、方法。
【請求項35】
分子(16;32;50)のアレイの複製又は派生物を作製するための装置であって、前記アレイは、分子(16;32;50)の分離したサンプルの空間配置を含み、前記装置は、
サンプルごとに、他のサンプルの有効領域(24;35;54)と分離している、少なくとも一つの空間的に制限された前記有効領域(24;35;54’)をつくる手段であって、キャリア(20;34;60)の、結合アダプタ又は結合特性(22;38;62)を供給された、表面は、前記有効領域(24;35;54’)に接する手段、
前記サンプルの複製又は派生物(18;32;64)をつくるために、前記有効領域(24;35;54’)の増幅薬によって、前記分子(16;32;50)を増幅するための、および、前記キャリア上の前記サンプルの前記複製又は派生物の空間配置が、前記サンプルの前記空間配置に対応するように、前記結合アダプタ(22;38;62)又は前記結合特性によって、前記キャリア(20;34;60)と、前記サンプルの前記複製又は派生物を結合するための、手段、および、
前記アレイから前記サンプルの前記複製を含んでいる前記キャリア(20;34;60)を取り除くための手段、を含むこと、を特徴とする、装置。
【請求項1】
分子(16;32;50)のアレイの複製又は派生物を作製する方法であって、前記アレイは、分子(16;32;50)の分離したサンプルの空間配置を含み、前記方法は、
サンプルごとに、他のサンプルの有効領域(24;35;54)と分離している、少なくとも一つの空間的に制限された前記有効領域(24;35;54’)をつくるステップであって、キャリア(20;34;60)の、結合アダプタ(22;38;62)又は結合特性を供給された、表面は、前記有効領域(24;35;54’)で接するステップ、
前記サンプルの複製(18;32;64)又は派生物をつくるために、前記有効領域(24;35;54’)において、増幅薬によって、前記分子(16;32;50)を増幅するステップ、
前記キャリア上の前記サンプルの前記複製又は派生物の空間配置が、前記アレイの前記サンプルの前記空間配置に対応するように、前記結合アダプタ又は前記結合特性(22;38;62)によって、前記キャリア(20;34;60)と、前記サンプルの前記複製又は派生物(18;32;64)を結合するステップ、および、
前記アレイから前記サンプルの前記複製又は派生物(18;32;64)を含んでいる前記キャリア(20;34;60)を取り除くステップ、を含むこと、を特徴とする、方法。
【請求項2】
空間的に制限された有効領域をつくることは、空間的に制限された増幅薬領域(24;35)をつくることを含むこと、を特徴とする、請求項1に記載の方法。
【請求項3】
前記空間的に制限された増幅薬領域(24;35)は、少なくとも部分的に、前記アレイのアレイ基板(10)の範囲内で、または、前記キャリア(34)の範囲内で、マイクロ又はナノ構造(12;36)によって定められること、を特徴とする、請求項2に記載の方法。
【請求項4】
前記マイクロ又はナノ構造は、特に、フィルタ膜、ヒドロゲル、または、エーロゲルに基づいた無秩序なマトリックスを含むこと、請求項3に記載の方法。
【請求項5】
前記マイクロ又はナノ構造は、秩序ある三次元基板に基づくこと、を特徴とする、請求項3に記載の方法。
【請求項6】
サンプルごとに少なくとも一つの空間的に制限された増幅薬領域(24)をつくることは、前記アレイ基板(10)の範囲内に、相互に、別々に、関連した凹所(12)に前記サンプルを供給すること、前記増幅薬を前記凹所(12)に注入すること、および、前記キャリア(20)により前記凹所(12)を塞ぐこと、を含むこと、を特徴とする、請求項3に記載の方法。
【請求項7】
少なくとも一つの空間的に制限された増幅薬領域(35)をつくることは、前記サンプルが前記増幅薬(35)にさらされるように、各サンプルと関連し、そこに配置された前記結合アダプタ(38)を有する少なくとも一つの凹所(36)を有する前記キャリア(34)を供給すること、前記増幅薬を前記凹所(36)に注入すること、および、前記アレイ基板(30)によって前記凹所(36)を塞ぐこと、を含むこと、を特徴とする、請求項3に記載の方法。
【請求項8】
前記空間的に制限された増幅薬領域(54’)は、少なくとも部分的に、2つの液体(54、56)、液体および気体間の界面によって、または、物理的境界、特に脂質膜によって分離されること、を特徴とする、請求項1に記載の方法。
【請求項9】
サンプルごとに少なくとも一つの空間的に制限された増幅薬領域をつくることは、前記増幅薬を含み、そして、前記アレイのアレイ基板(52)上に、前記空間配置で固定される、相互に分離した液滴(54)に、前記サンプルを供給し、より細いかたまりの液体(56)は、前記液滴(54)間に配置されること、および、前記キャリア(60)の、前記結合アダプタ(62)を供給された前記表面が前記液滴(54)に接するように、前記アレイ基板(52)に関連して前記キャリア(60)を配置すること、を含むこと、を特徴とする、請求項8に記載の方法。
【請求項10】
サンプルごとに空間的に制限された増幅薬領域をつくることは、シークエンサチップ(10)またはナノウェルプレートの範囲内に前記サンプルを供給することを含むこと、を特徴とする、請求項2または請求項3のうちの1つに記載の方法。
【請求項11】
前記複製又は派生物を前記キャリアに結合する工程は、前記増幅と同時に実行されること、を特徴とする、請求項1に記載の方法。
【請求項12】
前記有効領域の前記空間の制限は、前記結合アダプタが、規則的又は不規則なスポットの分布を含みうるプライマーアレイの形で、相補的プライマーとして、前記キャリア上に存在するという点で成り立ち、前記キャリア上の前記スポットサイズ及びスポット密度は前記アレイ上のそれと等しい又はそれより小さいこと、を特徴とする、請求項11に記載の方法。
【請求項13】
前記有効領域の前記空間の制限は、エネルギー場を適用することによって、遂行されること、を特徴とする、請求項1に記載の方法。
【請求項14】
前記サンプルは、粒子(14;50)に拘束された分子の形で供給されること、を特徴とする、請求項1〜請求項13のいずれかに記載の方法。
【請求項15】
前記分子は、一本又は二本鎖オリゴヌクレオチド、ポリヌクレオチド、DNAまたはDNAに類似した合成分子(PNA)であること、を特徴とする、請求項1〜請求項14のいずれかに記載の方法。
【請求項16】
前記アレイは、前記ゲノムを得るためのシークエンシング工程、前記トランスクリプトームを得るためのシークエンシング工程、RNA、mRNA、tRNA、siRNAをシークエンシングする工程、またはミューテーション及びバリエーションをシークエンシングする工程から成ること、を特徴とする、請求項15に記載の方法。
【請求項17】
増幅及び前記キャリアとの結合によって、DNA、修飾DNA、DNAの発現物、RNA、タンパク質、又は、ペプチドに相当する複製は、つくられること、を特徴とする、請求項1〜請求項16のいずれかに記載の方法。
【請求項18】
前記増幅薬は、DNA増幅、特にポリメラーゼ連鎖反応、等温増幅またはNASBA反応に影響を及ぼし、前記結合アダプタはマッチングプライマーを含むこと、を特徴とする、請求項1〜請求項17のいずれかに記載の方法。
【請求項19】
分子の前記アレイは、生体分子の非合成のアレイであること、を特徴とする、請求項1〜請求項18のいずれかに記載の方法。
【請求項20】
前記サンプルの前記位置は、前記サンプルの一部である又は固定される、および、派生物、特に複製起点、プロモーター、リボソーム結合部位、開始コドン、エンドプロテアーゼ切断部位、融合配列、リポーター遺伝子、ターミネーター、抗生物質抵抗性遺伝子、インビトロ翻訳系または細胞などの発現ベクター配列を生成するのに必要である、そこに位置づけられた分子またはDNA配列または細胞を更に有すること、を特徴とする、請求項1〜請求項19のいずれかに記載の方法。
【請求項21】
一次、二次および/または三次派生物は、DNAがRNAに転写され、前記RNAがタンパク質に翻訳されるという点において、又は、バインダーが、生成されたタンパク質、生成されたRNA又は生成されたDNA又は液相からのそれらの前記複製を使用するときに増やされるという点において、または、バインダーが相互に作用するという点において、一次アレイまたは前記一次アレイの複製から生成されること、を特徴とする、請求項1〜請求項20のいずれかに記載の方法。
【請求項22】
派生物は、ターゲットアレイの固相で生成され、固定された方法でそこに存在すること、を特徴とする、請求項21に記載の方法。
【請求項23】
前記有効領域の範囲内で物理又は化学パラメータのいかなる変化もモニタすることを更に含むこと、を特徴とする、請求項1〜請求項22のいずれかに記載の方法。
【請求項24】
請求項1〜請求項23のいずれかに記載の方法を使用するときにつくられた、分子のアレイの複製又は派生物。
【請求項25】
バインダー、特にタンパク質、抗体または抗原と、元の分子、その複製又はその派生物との間の反応を、特に遺伝子型−表現型カップリングのために、前記元の分子の前記DNA配列と関連させるための、請求項24に記載の複製又は派生物の利用。
【請求項26】
前記元の分子、その複製又はその派生物は、基板の前記変換を触媒することを特徴とする反応を、特に遺伝子型−表現型カップリングのために、前記元の分子の前記DNA配列と関連させるための、請求項24に記載の複製又は派生物の前記利用。
【請求項27】
DNA配列、RNA配列、タンパク質、または、DNA、RNAまたはタンパク質の触媒的、信号的(例えば、増強、アロステリック、抑止、…)又は酵素的(例えば、溶解、ホスファターゼ活性、キナーゼ活性、…)機能を特定するための請求項24に記載の複製又は派生物の前記利用。
【請求項28】
DNA配列、RNA配列、または、ペプチド配列を特定するための、および、前記DNA、RNA、又は、ペプチド配列に基づいた、生成物、特に抗体、抗原、ワクチンまたは抗生物質の生成、特定、または、製法のための、請求項24に記載の複製又は派生物の前記利用。
【請求項29】
相互作用する分子または粒子を用いてサンプル、その複製又はその派生物間の反応を検出するための複製又は派生物の利用であって、前記検出は、光学的、電気化学的又は磁場的センサによって実行され、前記相互作用する分子または粒子は、対応する標識を運ぶ、又は、前記検出は、標識なしで、エバネッセント場の変化または変更された共振周波数によって、または、光学ピンセットを使用することによって、または、吸収における変化、特に色の知覚又は変化と、又は、光の発光、特に化学発光と、その反応を対にすることによって、実行される、請求項24に記載の複製又は派生物の前記利用。
【請求項30】
前記シークエンシングを検出するために使用される同一のシークエンシング装置はまた、前記反応を検出するために使用されること、を特徴とする、請求項29に記載の前記利用。
【請求項31】
チャンバ又は流体構造物が、前記複製又は派生物の前記表面上に適合される結合端子を含み、又は、前記複製又は派生物が対応するチャンバに取り入れられ、そして、特定の温度で前記チャンバをインキュベートすることが可能であり、前記チャンバ内に含まれた液体を取りかえることが可能である、前記アレイの前記複製又は派生物での反応を実行するための、請求項24に記載の複製又は派生物の前記利用。
【請求項32】
前記アレイをシークエンシングするためにも使用される装置の範囲内での請求項31に記載の前記利用。
【請求項33】
前記複製又は派生物に関する反応及び検出を同時に実行するための請求項24に記載の複製又は派生物の前記利用。
【請求項34】
液体粒子アレイをシークエンシングする方法であって、複製は、請求項14に記載の前記粒子に含まれる前記サンプルから作られ、前記複製は、シークエンシング装置でシークエンシングされる、方法。
【請求項35】
分子(16;32;50)のアレイの複製又は派生物を作製するための装置であって、前記アレイは、分子(16;32;50)の分離したサンプルの空間配置を含み、前記装置は、
サンプルごとに、他のサンプルの有効領域(24;35;54)と分離している、少なくとも一つの空間的に制限された前記有効領域(24;35;54’)をつくる手段であって、キャリア(20;34;60)の、結合アダプタ又は結合特性(22;38;62)を供給された、表面は、前記有効領域(24;35;54’)に接する手段、
前記サンプルの複製又は派生物(18;32;64)をつくるために、前記有効領域(24;35;54’)の増幅薬によって、前記分子(16;32;50)を増幅するための、および、前記キャリア上の前記サンプルの前記複製又は派生物の空間配置が、前記サンプルの前記空間配置に対応するように、前記結合アダプタ(22;38;62)又は前記結合特性によって、前記キャリア(20;34;60)と、前記サンプルの前記複製又は派生物を結合するための、手段、および、
前記アレイから前記サンプルの前記複製を含んでいる前記キャリア(20;34;60)を取り除くための手段、を含むこと、を特徴とする、装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6a】


【図6b】


【図6c】


【図6d】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6a】


【図6b】


【図6c】


【図6d】


【図7】


【公表番号】特表2012−519475(P2012−519475A)
【公表日】平成24年8月30日(2012.8.30)
【国際特許分類】
【出願番号】特願2011−552467(P2011−552467)
【出願日】平成22年3月5日(2010.3.5)
【国際出願番号】PCT/EP2010/052849
【国際公開番号】WO2010/100265
【国際公開日】平成22年9月10日(2010.9.10)
【出願人】(500342075)ハーン−シッカート−ゲゼルシャフト フュア アンゲヴァンテ フォルシュンク エー ファウ (3)
【出願人】(509250021)
【Fターム(参考)】
【公表日】平成24年8月30日(2012.8.30)
【国際特許分類】
【出願日】平成22年3月5日(2010.3.5)
【国際出願番号】PCT/EP2010/052849
【国際公開番号】WO2010/100265
【国際公開日】平成22年9月10日(2010.9.10)
【出願人】(500342075)ハーン−シッカート−ゲゼルシャフト フュア アンゲヴァンテ フォルシュンク エー ファウ (3)
【出願人】(509250021)

【Fターム(参考)】
[ Back to top ]

