抗炎症用組成物
【課題】NF−κB活性化の抑制を作用機序とする炎症性サイトカインの発現抑制を通じて様々な症状の改善または予防手段を提供する。
【解決手段】セロトニン誘導体を含有してなるNF−κB活性化抑制用組成物、セロトニン誘導体を含有してなる、NF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物ならびにセロトニン誘導体を含有してなる抗炎症用組成物。本発明の組成物は、医薬または食品として用いられる。
【解決手段】セロトニン誘導体を含有してなるNF−κB活性化抑制用組成物、セロトニン誘導体を含有してなる、NF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物ならびにセロトニン誘導体を含有してなる抗炎症用組成物。本発明の組成物は、医薬または食品として用いられる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、セロトニン誘導体のNF−κBの活性化抑制作用に基づく医薬または食品用途に関する。より具体的には、例えば、セロトニン誘導体の抗炎症用途に関する。
【背景技術】
【0002】
炎症は、種々の外因性または内因性の組織障害刺激に対する生体の応答である。感染などにより生体組織の一部が障害されると、組織からは様々な生体反応修飾物質が産生・放出され、炎症が生じる。初期にはTNF-αやIL-1などの炎症性サイトカインが炎症部位で産生され、それらの作用により、血管内皮上に細胞接着因子(ICAM-1、VCAM-1など)の発現が増強し、炎症性細胞の血管壁接着が亢進する。同時に、炎症部位より産生されるMCP-1やIL-8などの走化因子によって、単球やリンパ球、好中球が炎症組織に浸潤する。内皮下に浸潤した炎症性細胞からは、更に種々のサイトカインや活性酸素、水解酵素などが病原微生物などに対して分泌されるが、それらは同時に宿主組織をも障害する。このような過程を経て、起炎物質が消滅または除去されると、通常は炎症細胞の移入が停止し、炎症は消散に向かうが、組織障害が強かった場合は完全には修復されず、組織の実質細胞が結合組織により置換(線維化)される結果、組織の機能低下を招く場合が生じる。また、結核のような持続感染、自己免疫機序による自己組織障害、酸化LDLの蓄積などは、炎症を遷延化させ、慢性炎症と呼ばれる、活動性炎症反応、組織破壊、組織修復を繰り返し長期に渡って進行するという病態を形成することがある。こうした慢性炎症性疾患にはベーチェット病などのような難治性のものが少なくなく、患者は長期にわたってQOLの低下に苦しめられることになる。
【0003】
これらの炎症プロセスにおいては、多くの遺伝子が活性化されるが、NF−κBはこの遺伝子活性化プロセスに中心的な役割を担う転写因子である。NF−κBは、p50とp65の二つのサブユニットからなるヘテロダイマーであり、通常、抑制性タンパクであるI−κBと複合体を形成して不活性体として細胞質に存在するが、刺激によりI−κBがリン酸化を受けて分解され、複合体から離脱すると、NF−κBヘテロダイマーは核内に移行してDNAと結合し、結合サイト下流の遺伝子発現を調節することが知られている。NF−κBの活性化と核内へのトランスロケーションの過程には酸化ストレスが関与していると言われている。そのメカニズムについては未だ不明な点も多いが、ある種の活性酸素種(ROS)がI−κBリン酸化酵素を活性化し、I−κBの分解を促すと考えられている。複数の抗酸化物質の添加や、グルタチオンペルオキシダーゼなどの抗酸化酵素の過剰発現がNF−κBの活性化を抑制することが知られている。これとは逆に、核内に移行した活性化NF−κBのDNA上への結合は酸化剤によって阻害され、チオール類により促進される。このように、NF−κBの活性化と、それに引き続いて起こる各種遺伝子産物の発現はいずれもレドックス制御下に置かれていると言えるが、その制御様式は異なっているため、細胞内のレドックス状態の変化がNF−κBの制御下にある遺伝子産物の発現に及ぼす影響は一様ではなく、複雑である(非特許文献1)。NF−κBによる発現調節を受ける遺伝子産物としては、TNF-α、IL-1β、IL-6などの炎症性サイトカイン、ICAM-1、VCAM-1、E-セレクチンなどの細胞接着因子、IL-8やMCP-1などの細胞走化因子(ケモカイン)、誘導型一酸化窒素合成酵素(iNOS)、組織因子(TF)や誘導型シクロオキシゲナーゼ(COX-2)などが代表的なものとしてあげられる。多くの疾患にNF−κBの活性化が関与していると言われている。重要なものとしては、アテローム性動脈硬化、心筋梗塞、ウイルス感染(HIV、サイトメガロウイルスなど)、関節炎(慢性関節リウマチ、変形性関節炎など)、乾癬、炎症性腸疾患(IBD)、II型糖尿病、気管支喘息、敗血症、自己免疫疾患などがあげられる。
【0004】
NF−κBの活性化によって発現が上昇するVCAM−1(Vascular Cell Adhesion Molecule-1)は、分子量110kDaの糖タンパクで、主に血管内皮細胞、マクロファージなどに発現が認められる。その主な働きは、リンパ球、単球などに発現しているβ1-インテグリンファミリーの一つであるVLA4と結合することにより、白血球を血管内皮細胞上に強固に接着させることである。VCAM−1と疾患の関連については、動脈硬化、同種移植拒絶反応、悪性腫瘍(メラノーマ等)の転移など、様々な急性/慢性炎症性疾患の病変局所の血管内皮細胞において発現亢進が確認されている。
【0005】
MCP−1(Monocyte Chemotactic Protein-1)は、内皮細胞、平滑筋細胞、およびマクロファージなどから産生され、血管内皮細胞に接着した単球/マクロファージ、Tリンパ球の内皮下への遊走を強力に誘導することから、MCP−1は各種の炎症病変において単球およびT細胞の組織浸潤を促進すると考えられている。MCP−1も多くの疾患との関わりが知られており、気管支喘息やアレルギー性鼻炎、慢性関節リウマチ、肺高血圧、肝線維症、腎硬化症、ウイルス性脳炎、動脈硬化、子宮内膜症、炎症性腸疾患(IBD)などの慢性炎症疾患や、アレルギー疾患/免疫異常において、局所における産生亢進、あるいはMCP-1中和抗体/アンタゴニストによる症状の改善などが報告されている。
【0006】
炎症性疾患の治療には様々な抗炎症剤が用いられるが、種々の炎症性メディエーターの産生、または炎症性細胞接着分子の発現を抑制するものとしては、いまだに決め手となるようなものはない。その理由の一つとしては、上述したように炎症反応には多数の遺伝子産物が関与するため、単一の酵素活性やサイトカイン産生をブロックするだけでは不十分と考えられることである。例えば、NSAID(非ステロイド抗炎症剤)類は、アラキドン酸代謝においてシクロオキシゲナーゼを阻害することにより、炎症性プロスタグランジンの産生を抑制するが、サイトカインの産生を直接阻害することはない。サイトカイン抗体またはサイトカイン受容体ブロッカーなどを用いた抗サイトカイン療法は、特定のサイトカインの機能を抑制できても、複数のサイトカインの活性を直接抑制することはできない。例えば、抗ICAM-1抗体は臓器移植時の拒絶反応抑制などで効果が報告されているが、他の接着分子や炎症性サイトカイン類に対する直接的な作用はない。また、抗サイトカイン療法の場合、初期の投与効果は大きくても効果の持続性が疑問視されており、慢性炎症性疾患への臨床応用は困難と考えられる。一方、従来の、免疫抑制剤を含む抗炎症剤、抗サイトカイン療法には多くの副作用が報告されている。例えば、ステロイド剤は、経口投与が可能で、非特異的に複数のサイトカインの産生を抑制するメリットを持つが、その一方で感染増悪、リバウンドなどの問題を抱えている。抗TNF-α抗体は慢性関節リウマチやクローン病で効果が示されているが、感染症やアレルギー(アナフィラキシーショック)などの重大な問題が指摘されている。
【0007】
これら既存の抗炎症剤に対して、NF−κB抑制剤は、上述した各種起炎性物質の産生に関与する遺伝子の活性化における共通のプロセスを抑制するため、広く抗炎症的に作用する可能性が考えられる。すなわち、複数の炎症性サイトカインの転写を同時に抑制することにより、炎症性サイトカインの異常産生に基づく疾患を治療する医薬品、また、HIVやサイトメガロウイルスなどの、NF−κBの活性化が自己の複製に必要なウイルスに対する抗ウイルス剤、細胞接着分子の発現を抑制することによる抗炎症または癌転移抑制剤、臓器移植の際に用いる免疫抑制剤への応用などが考えられる。
【0008】
食品などに含まれる天然成分にもNF−κB抑制作用を有するものがいくつか知られている(ケルセチン(非特許文献2)、クルクミン(非特許文献3)、イソビテキシン(非特許文献4)、アピゲニン(非特許文献5)、ピクノジェノール(非特許文献6)、など)。これらのポリフェノール類は経口的に摂取されており、安全性は比較的高いと考えられるだけでなく、一部については抗酸化活性や抗動脈硬化作用などが報告されている(非特許文献7、8)ことなどから、慢性炎症病態の日常的な制御や、炎症性疾患の発症予防に有用である可能性がある。しかしながら、これらのNF−κBの抑制作用はin vitroで調べられたものであるのに対し、生体内ではポリフェノール類は代謝されて抗酸化作用が減弱する、あるいは失われる例が報告されている(非特許文献9)ことから、これらの物質が実際に生体内で抗炎症作用を発揮するかどうかについては不明である。
【0009】
ベニバナ種子脱脂粕抽出物は、in vitroで低比重リポタンパク(LDL)の酸化を強力に抑制し、apoE KOマウスにおける動脈硬化病変形成を抑制する作用(特許文献1)、動脈硬化モデルであるKHCウサギや、ヒトボランティアにおける血圧・脈波改善作用(特許文献2)を有することが示されている。この抽出物中に含まれるヒドロキシ桂皮酸セロトニンアミド(セロトニン誘導体)は、apoE KOマウスにおける抗動脈硬化活性本体の少なくとも一つであると考えられる(特許文献1)。ベニバナ種子中のセロトニン誘導体としては、主としてN-(p-Coumaroyl)serotonin(CS)とN-Feruloylserotonin(FS)、およびそれらの配糖体の4種が知られており、これらの化合物の構造は、上記非特許文献2〜6に示されたNF−κB抑制剤とは全く異なるものである。CSとFSは、共にほぼ同レベルの抗酸化活性(DPPHラジカル消去活性、LDL酸化抑制作用など)を有することが示されている。これらのうち、CSについては、細菌のリポ多糖(LPS)で刺激されたヒト末梢血単球におけるTNF-α、IL-1、IL-6などの炎症性サイトカイン産生を抑制することがKawashimaらにより報告されている(非特許文献10)。この報告によれば、CSは50μM以上の濃度でTNF-α、IL-1α、IL-1β、IL-6の産生を転写レベルで阻害し、NF−κB活性化阻害がEMSA(Electrophoretic Mobility Shift Assay)の結果認められたとしている。しかしながら、同じ研究グループの続報(非特許文献11)では、上記のCSの効果は炎症性サイトカインに特異的なものではなく、末梢血由来単球におけるCSの非特異的なタンパク合成阻害作用と抗酸化作用の結果であると考察している。これらの知見を総合すると、末梢血単球以外の細胞におけるセロトニン誘導体の炎症性サイトカイン発現またはNF−κB活性に及ぼす影響は不明である。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】国際公開番号第2003/086437号パンフレット
【特許文献2】国際公開第2007/032551号パンフレット
【非特許文献】
【0011】
【非特許文献1】Halliwell B and Gutteridge JM, Free Radicals in Biology and Medicine Third Edition, Oxford Science Publications (1999)
【非特許文献2】Martinez-Florez Sら、J. Nutr. 135:1359-1365 (2005)
【非特許文献3】Yeh C-Hら、J. Surgical Res.125:109-116 (2005)
【非特許文献4】Lin C-Mら、Planta Medica 71:748-753 (2005)
【非特許文献5】Gerritsen MEら、Am. J. Pathol. 147:278-292 (1995)
【非特許文献6】Packer L, Book of abstracts, 219th ACS National Meeting, SanFrancisco, CA, March 26-30, (2000)
【非特許文献7】Nakamura Yら、Jpn. J. Cancer Res. 89:361-370 (1998)
【非特許文献8】Kamada Cら、Free Rad. Res. 39:185-194 (2005)
【非特許文献9】Williamson Gら, Free Rad Res. 39:457-469 (2005)
【非特許文献10】Kawashima Sら、J. Interferon Cytokine Res. 18:423-428 (1998)
【非特許文献11】Takii Tら、Int. Immunopharmacol. 3:273-277 (2003)
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の目的は、NF−κB活性化の抑制を作用機序とする炎症性サイトカインの発現抑制を通じて様々な症状の改善または予防手段を提供することにある。
【課題を解決するための手段】
【0013】
本発明者らは、上記課題を解決するために鋭意検討し、セロトニン誘導体、とりわけフェルロイルセロトニン、p−クマロイルセロトニンが血管内皮細胞に対して有意なNF−κB活性化の抑制作用があることを見出し、本発明を完成するに至った。即ち、本願発明は、以下に示す通りである。
【0014】
〔1〕セロトニン誘導体を含有してなるNF−κB活性化抑制用組成物。
〔2〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔1〕に記載のNF−κB活性化抑制用組成物。
〔3〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔1〕に記載のNF−κB活性化抑制用組成物。
〔4〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔1〕に記載のNF−κB活性化抑制用組成物。
〔5〕前記セロトニン誘導体が植物から抽出されたものである、前記〔1〕〜〔4〕いずれかに記載のNF−κB活性化抑制用組成物。
〔6〕前記植物が紅花の種子である、前記〔5〕に記載のNF−κB活性化抑制用組成物。
〔7〕医薬である、前記〔1〕〜〔6〕いずれかに記載のNF−κB活性化抑制用組成物。
〔8〕NF−κB活性化に起因する疾患の治療または予防のために用いられる、前記〔7〕に記載のNF−κB活性化抑制用組成物。
〔9〕食品である、前記〔1〕〜〔6〕いずれかに記載のNF−κB活性化抑制用組成物。
〔10〕食品が保健機能食品またはダイエタリーサプリメントである、前記〔9〕に記載のNF−κB活性化抑制用組成物。
〔11〕保健機能食品が特定保健用食品または栄養機能食品である、前記〔10〕に記載のNF−κB活性化抑制用組成物。
〔12〕前記〔7〕または〔8〕に記載のNF−κB活性化抑制用組成物を、それを必要とする対象に投与することを含む、対象におけるNF−κB活性化を抑制する方法。
〔13〕NF−κB活性化抑制用組成物を製造するためのセロトニン誘導体の使用。
〔14〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔13〕に記載の使用。
〔15〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔13に記載の使用。
〔16〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔13〕に記載の使用。
〔17〕前記セロトニン誘導体が植物から抽出されたものである、前記〔13〕〜〔16〕いずれかに記載の使用。
〔18〕前記植物が紅花の種子である、前記〔17〕に記載の使用。
〔19〕前記〔7〕または〔8〕に記載の組成物および当該組成物をNF−κB活性化に起因する疾患の治療または予防のために使用することができること、または使用すべきであることを記載した記載物を含む、商業用パッケージ。
〔20〕NF−κB活性化に起因する状態の治療または改善に用いられるという表示を付した、前記〔10〕または〔11〕に記載のNF−κB活性化抑制用組成物。
〔21〕セロトニン誘導体を含有してなる、NF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物。
〔22〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔21〕に記載の発現抑制用組成物。
〔23〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔21〕に記載の発現抑制用組成物。
〔24〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔21〕に記載の発現抑制用組成物。
〔25〕セロトニン誘導体が植物から抽出されたものである、前記〔21〕〜〔24〕いずれかに記載の発現抑制用組成物。
〔26〕前記植物が紅花の種子である、前記〔25〕に記載の発現抑制用組成物。
〔27〕医薬である、前記〔21〕〜〔26〕いずれかに記載の発現抑制用組成物。
〔28〕NF−κBを介したVCAM−1および/またはMCP−1の発現に起因する疾患の治療または予防のために用いられる、前記〔27〕に記載の発現抑制組成物。
〔29〕食品である、前記〔21〕〜〔26〕いずれかに記載の発現抑制用組成物。
〔30〕食品が保健機能食品またはダイエタリーサプリメントである、前記〔29〕に記載の発現抑制用組成物。
〔31〕保健機能食品が特定保健用食品または栄養機能食品である、前記〔30〕に記載の発現抑制用組成物。
〔32〕前記〔27〕または〔28〕に記載の組成物を、それを必要とする対象に投与することを含む、対象におけるNF−κBを介したVCAM−1および/またはMCP−1の発現を抑制する方法。
〔33〕NF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物を製造するためのセロトニン誘導体の使用。
〔34〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔33〕に記載の使用。
〔35〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔33〕に記載の使用。
〔36〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔33〕に記載の使用。
〔37〕セロトニン誘導体が植物から抽出されたものである、前記〔33〕〜〔36〕いずれかに記載の使用。
〔38〕前記植物が紅花の種子である、前記〔37〕に記載の使用。
〔39〕前記〔27〕または〔28〕に記載の組成物、および当該組成物をNF−κBを介したVCAM−1および/またはMCP−1の発現抑制に使用することができること、または使用すべきであることを記載した記載物を含む、商業用パッケージ。
〔40〕NF−κBを介したVCAM−1および/またはMCP−1の発現に起因する状態の予防または改善に用いられるという表示を付した、前記〔30〕または〔31〕に記載の発現抑制用組成物。
〔41〕セロトニン誘導体を含有してなる抗炎症用組成物。
〔42〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔41〕に記載の抗炎症用組成物。
〔43〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔41〕に記載の抗炎症用組成物。
〔44〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔41〕に記載の抗炎症用組成物。
〔45〕前記セロトニン誘導体が植物から抽出されたものである、前記〔41〕〜〔44〕いずれかに記載の抗炎症用組成物。
〔46〕前記植物が紅花の種子である、前記〔45〕に記載の抗炎症用組成物。
〔47〕医薬である、前記〔41〕〜〔46〕いずれかに記載の抗炎症用組成物。
〔48〕炎症性腸疾患の治療または予防のために用いられる、前記〔47〕に記載の抗炎症用組成物。
〔49〕食品である、前記〔41〕〜〔46〕いずれかに記載の抗炎症用組成物。
〔50〕食品が保健機能食品またはダイエタリーサプリメントである、前記〔49〕に記載の抗炎症用組成物。
〔51〕保健機能食品が特定保健用食品または栄養機能食品である、前記〔50〕に記載の抗炎症用組成物。
〔52〕前記〔47〕または〔48〕に記載の抗炎症用組成物を、それを必要とする対象に投与することを含む、対象における炎症性疾患を治療または予防する方法。
〔53〕抗炎症用組成物を製造するためのセロトニン誘導体の使用。
〔54〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔53〕に記載の使用。
〔55〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔53〕に記載の使用。
〔56〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔53〕に記載の使用。
〔57〕前記セロトニン誘導体が植物から抽出されたものである、前記〔53〕〜〔56〕いずれかに記載の使用。
〔58〕前記植物が紅花の種子である、前記〔57〕に記載の使用。
〔59〕前記〔47〕または〔48〕に記載の組成物、および当該組成物を炎症性疾患の治療または予防に使用することができること、または使用すべきであることを記載した記載物を含む、商業用パッケージ。
〔60〕炎症性疾患の予防または改善に用いられるという表示を付した、前記〔50〕または〔51〕に記載の抗炎症用組成物。
〔61〕セロトニン誘導体を含有してなるNF−κB活性化抑制剤。
〔62〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔61〕に記載のNF−κB活性化抑制剤。
〔63〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔61〕に記載のNF−κB活性化抑制剤。
〔64〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔61〕に記載のNF−κB活性化抑制剤。
〔65〕前記セロトニン誘導体が植物から抽出されたものである、前記〔61〕〜〔64〕いずれかに記載のNF−κB活性化抑制剤。
〔66〕前記植物が紅花の種子である、前記〔65〕に記載のNF−κB活性化抑制剤。
〔67〕セロトニン誘導体を含有してなる、NF−κBを介したVCAM−1および/またはMCP−1の発現抑制剤。
〔68〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔67〕に記載の発現抑制剤。
〔69〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔67〕に記載の発現抑制剤。
〔70〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔67〕に記載の発現抑制剤。
〔71〕セロトニン誘導体が植物から抽出されたものである、前記〔67〕〜〔70〕いずれかに記載の発現抑制剤。
〔72〕前記植物が紅花の種子である、前記〔71〕に記載の発現抑制剤。
〔73〕セロトニン誘導体を含有してなる抗炎症剤。
〔74〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔73〕に記載の抗炎症剤。
〔75〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔73〕に記載の抗炎症剤。
〔76〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔73〕に記載の抗炎症剤。
〔77〕前記セロトニン誘導体が植物から抽出されたものである、前記〔73〕〜〔76〕いずれかに記載の抗炎症剤。
〔78〕前記植物が紅花の種子である、前記〔77〕に記載の抗炎症剤。
【図面の簡単な説明】
【0015】
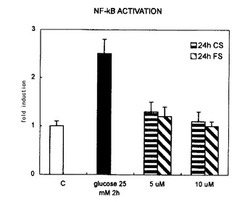
【図1】図1は、ヒト大動脈内皮細胞においてセロトニン誘導体がNF−κBの活性化に及ぼす影響を調べた結果を示すグラフである。
【図2】図2は、ヒト大動脈内皮細胞においてセロトニン誘導体がROS産生の上昇を用量依存的に低下させることを調べた結果を示すグラフである。
【図3】図3は、ヒト大動脈内皮細胞においてセロトニン誘導体がVCAM−1(A)およびMCP−1(B)のmRNA発現に及ぼす影響をリアルタイムPCRで調べた結果を示すグラフである。
【図4】図4は、ヒト大動脈内皮細胞においてセロトニン誘導体がVCAM−1(A)およびMCP−1(B)のタンパク質発現誘導に及ぼす影響を免疫染色で調べた結果を示すグラフである。
【図5】図5は、セロトニン誘導体がヒト大動脈内皮細胞上への単球接着に及ぼす影響を細胞数の計測により調べた結果を示すグラフである。
【図6】図6は、セロトニン誘導体がヒト大動脈内皮細胞上への単球接着に及ぼす影響を蛍光標識により調べた結果を示すグラフである。
【図7】図7は、セロトニン誘導体が単球の遊走能に及ぼす影響を細胞数の計測により調べた結果を示すグラフである。
【図8】図8は、セロトニン誘導体が単球の遊走能に及ぼす影響を蛍光標識により調べた結果を示すグラフである。
【図9】図9は、セロトニン誘導体を摂取したマウスにおける血漿中のsVCAM−1レベルを調べた結果を示すグラフである。
【図10】図10は、セロトニン誘導体を摂取したヒトボランティアにおける血清中のsVCAM−1(A)およびMCP−1(B)レベルを調べた結果を示すグラフである。
【図11】図11は、FS、およびベニバナ種子抽出物(SSE)がIBDモデルマウス(IL-10欠損細胞移入SCIDマウス)の大腸腸管長(A)、大腸重量(B)、単位長あたりの大腸重量(C)に及ぼす影響を示すグラフである。
【図12】図12は、FS、およびベニバナ種子抽出物(SSE)がIBDモデルマウス(IL-10欠損細胞移入SCIDマウス)の白血球数(A)、血小板数(B)、好中球数(C)、単球数(D)に及ぼす影響を示すグラフである。
【図13】図13は、FS、およびベニバナ種子抽出物(SSE)がIBDモデルマウス(IL-10欠損細胞移入SCIDマウス)の血中NOx濃度に及ぼす影響を示すグラフである。
【図14】図14は、FS、およびベニバナ種子抽出物(SSE)がIBDモデルマウス(IL-10欠損細胞移入SCIDマウス)の大腸病理組織における影響を示す写真である。
【図15】図15は、FS、およびベニバナ種子抽出物(SSE)がIBDモデルマウス(IL-10欠損細胞移入SCIDマウス)の大腸組織におけるIL-1β、TNFαの遺伝子発現に及ぼす影響を示すグラフである。
【発明を実施するための形態】
【0016】
本発明は、有効成分としてセロトニン誘導体を含有するNF−κB活性化抑制用組成物に関するものである。既に背景技術の欄でも述べたように、炎症性疾患の発症、増悪の過程には、各種の炎症性メディエーター(炎症性サイトカイン、接着因子、白血球走化因子、プロスタグランジン類など)の産生が関与している。これらの炎症性メディエーターの産生に関わる遺伝子の多くは、その発現過程にNF−κBの活性化というプロセスを共有していることが知られている。また、HIV、HTLV−1やサイトメガロウイルスなどは、自己の複製の過程でNF−κBの活性化を必要とする。また、各種サイトカインの発現誘導にもNF−κBの活性化が関与している。したがって、NF−κBの活性化を抑制する物質は、多くの炎症性疾患、ウイルス感染、腫瘍の転移、免疫疾患などの発症および進展を抑制する可能性がある。
【0017】
炎症性疾患としては、例えば、心筋梗塞、ウイルス性脳炎、関節炎(慢性関節リウマチ、変形性関節炎など)、乾癬、炎症性腸疾患、肺高血圧、敗血症、II型糖尿病、肝線維症、腎硬化症、子宮内膜症などがあげられる。
【0018】
ウイルス感染としては、例えば、エイズ、成人T細胞白血病、ヘルペスウイルス、EBウイルスなどがあげられる。
【0019】
腫瘍の転移としては、例えば、悪性腫瘍(メラノーマ、大腸癌、乳癌等)の転移があげられる。
【0020】
免疫疾患としては、例えば、アレルギー(気管支喘息、アレルギー性鼻炎など)、同種移植拒絶反応などがあげられる。
【0021】
本発明は、NF−κBの活性化が深く関与していると考えられる上記疾患および障害を予防、改善または治療するために、セロトニン誘導体を用いる方法を提供するものである。ただし、NF−κBの活性化に応答する疾患および障害は、ここにあげたものに限定されない。なお、本明細書および請求の範囲にいうセロトニン誘導体は、製品化上許容し得る塩を含有する概念であり、塩としては、酸付加塩、例えば無機酸付加塩(塩酸塩、臭化水素酸塩、硫酸塩、燐酸塩など)、有機酸付加塩(蟻酸塩、酢酸塩、トリフルオロ酢酸塩、マレイン酸塩、酒石酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩、トルエンスルホン酸塩など)、アミノ酸との塩(アスパラギン酸塩、グルタミン酸塩など)、金属塩、例えばアルカリ金属塩(ナトリウム塩、カリウム塩など)およびアルカリ土類金属塩(カルシウム塩、マグネシウム塩など)などがあげられる。
【0022】
本発明における「NF−κB活性化抑制」とは、NF−κBの核内への移行を抑制することをいう。NF−κBの核内への移行の抑制については、実施例1に記載の方法により確認することができる。すなわち、ヒト大動脈内皮細胞の培養液中に被験物質を添加し、所定の時間インキュベートした後、グルコースで刺激した前記細胞から核を抽出し、核内に移行した活性化NF−κB(p65)を検出する。NF−κBが活性化されていないグルコース刺激前の細胞を陰性対照とし、被験物質を添加しないでグルコースで刺激した細胞を陽性対照として、前記p65の検出程度が陽性対照よりも陰性対照に近い場合、NF−κB活性化抑制であると判断する。
【0023】
本発明のNF−κB活性化抑制用組成物に含まれるセロトニン誘導体としては、例えば下記の式で表される化合物(I)が例示される。
【0024】
【化1】

【0025】
(式中、R1、R2、R3、およびR4は、それぞれ独立に水素原子、炭素数1〜3のアルキル基、または糖を表し、n、m、およびlは0または1を表す)本明細書において、炭素数1〜3のアルキル基は、メチル、エチル、n−プロピル、i−プロピルがあげられる。糖としては、グルコース、マンノース、ガラクトース、フコース、ラムノース、アラビノース、キシロース、フルクトース、ルチノース、ガラクツロン酸、グルクロン酸、ネオヘスペリドースなどがあげられる。好ましい化合物としてはヒドロキシ桂皮酸のセロトニンアミドが例示される。
【0026】
ヒドロキシ桂皮酸としては、p-クマル酸、フェルラ酸、カフェ酸が好適なものとしてあげられ、そのセロトニンアミドとしては、N-(p−クマロイル)セロトニン(あるいはp−クマリルセロトニン、またはp−クマロイルセロトニン)、N-フェルロイルセロトニン(あるいはフェルリルセロトニン、またはフェルロイルセロトニン)、カフェオイルセロトニンが例示される。
【0027】
本発明で使用されるセロトニン誘導体は配糖体であってもよい。ここで配糖体とは、式(I)におけるR1にグルコースがβグルコシド結合したO-β-D-グルコピラノシドなどが例示されるが、これに限定されるものではない。
【0028】
セロトニン誘導体は、上記化合物の1種を単独で、あるいは2種以上の化合物を併用して、使用することができる。
【0029】
セロトニン誘導体は、化学的に合成することにより、また天然物から抽出することにより調製可能である。
【0030】
当該化合物は自体既知のものであり、その合成には自体既知の方法を採用すればよい。好適な具体例としては、後述の試験例1に記載の方法があげられる。
【0031】
天然物から抽出する場合には、原料としては様々な植物組織が用いられる。例えば、紅花やヤグルマギクをはじめとするキク科植物、特にその種子、クロヒエやコンニャクイモ等の特にその穀粒、塊茎などがあげられるが、好ましくは紅花の種子、あるいはその脱脂粕である。本発明において植物種子とは、植物種子を構成する全体、あるいはその一部、例えば、種皮、胚乳、胚芽等を取り出したものでもよく、それらの混合物であってもよい。これらのものからの抽出方法としては、例えば、下記の如き方法があげられる。
【0032】
植物組織は、通常脱脂物(ミール)として抽出に供される。脱脂物は自体公知の方法により、例えば植物種子等の植物組織を脱脂して得ることができるが、例えば種子を圧搾抽出するかまたは種子の破砕物にn−ヘキサン等を加えて抽出した後、抽出系から固形分を取り出し、該固形分を乾燥して得ることができる。脱脂程度は通常60重量%以上、好ましくは80重量%以上である。
【0033】
また、抽出方法としては、例えば以下の、原料である脱脂後の植物種子を水で洗浄後、有機溶媒で抽出する方法が例示される。
【0034】
水は、特に限定されず、例えば蒸留水、水道水、工業用水及びこれらの混合水等のいずれも用いることができる。水には、本発明の効果が得られる限り、他の物質、例えば無機塩(例えば塩化ナトリウム、塩化カリウム、塩化カルシウム等)、酸(例えば塩化水素、酢酸、炭酸、過酸化水素、リン酸等)、アルカリ(例えば水酸化ナトリウム、水酸化カリウム、炭酸水素ナトリウム等)等を含んでいてもよい。洗浄の際のpHは通常2〜9であり、好ましくは5〜7である。
【0035】
水の使用量は、総量として、原料である脱脂後の植物種子に対して、通常2〜100倍量(水容量/脱脂後の植物種子重量、以下同様)、好ましくは10〜40倍量である。
【0036】
洗浄は、自体公知の方法で、原料である脱脂後の植物種子と水とを接触させて行うことができる。例えば、脱脂後の植物種子を水に懸濁後、濾過して固形の洗浄処理物を回収する方法等があげられる。洗浄は、上記の量の水を、脱脂後の植物種子に一度にまたは複数回に分けて、または連続的に接触させて行ってもよい。接触させる際の温度は通常5〜45℃、好ましくは25〜35℃である。接触させる時間は通常10〜240分であり、好ましくは15〜60分である。
【0037】
上記のようにして得られた脱脂後の植物種子等の洗浄処理物から有機溶媒で抽出して植物種子等の抽出物を得ることができる。
【0038】
有機溶媒として、例えば、低級アルコール、アセトン、アセトニトリル及びそれらの混合溶媒等があげられるが、それらに限定されない。有機溶媒は、水を含んでいてもよく、含んでいなくてもよい。有機溶媒の濃度は、通常20〜95重量%、好ましくは50〜90重量%である。有機溶媒は抽出後の抽出物の濃縮、乾燥及び食品製造の点からは低級アルコールが好ましい。低級アルコールとして、例えば炭素数1〜4のアルコールがあげられ、具体的には例えば、メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール等があげられるが、これらに限定されない。低級アルコールは、食品製造の点からは、エタノールが好ましい。エタノールは、エタノール分を50重量%以上含む含水エタノールあるいは無水エタノールが好ましい。
【0039】
有機溶媒の使用量は、原料である脱脂後の植物種子の通常2〜40倍量(有機溶媒容量/脱脂後の植物種子重量、以下同様)、好ましくは2〜10倍量である。抽出温度は通常20〜75℃、好ましくは50〜70℃である。抽出時間は通常10〜240分、好ましくは60〜120分である。
【0040】
抽出後、懸濁液より濾過等により固形分を分離して得られた抽出液は、そのまま、または必要により濃縮、乾燥して本発明の植物種子抽出物として用いることができる。濃縮、乾燥は抽出液そのままを濃縮、乾燥してもよく、賦形剤(例えば乳糖、ショ糖、デンプン、サイクロデキストリン等)を添加して実施してもよい。上記の溶媒で抽出された抽出物は、その純度で、本発明に供してもよいが、更に自体公知の方法により精製しても良い。
【0041】
更に純度を上げるための一例を記載するが、これに限定されない。上述の溶媒抽出物の有機溶媒を減圧留去し、水を加え、抽出物を水に懸濁し、水相を非極性溶媒、例えば、n−ヘキサン、n−ヘプタン、n−オクタン等で、好ましくはn−ヘキサンで洗浄し、洗浄後の水層を、二層に分かれて目的の組成物を抽出できる溶媒、例えば、酢酸エステルやn−ブタノールなど、好ましくは、酢酸エチル、酢酸メチル、酢酸プロピル等で抽出する。次いで、抽出液を飽和食塩水等で洗浄し、有機層を得る。酢酸エステルで抽出した場合、該有機層を、例えば、無水硫酸マグネシウム等で、脱水し、次いで減圧濃縮して、固形物(組成物)を得る。以上のどの段階で、精製を止めても良いし、いずれかの工程を省いても良いし、改変を加えても良いし、更に精製を進めても良い。上記溶媒の種類を変えることも含めて多段抽出法や向流分配法なども用いることができる。
【0042】
本発明で使用されるセロトニン誘導体、とりわけN-(p-クマロイル)セロトニン、およびN-フェルロイルセロトニンは、細胞内の酸化ストレスを抑制することにより、NF−κBの活性化を抑制し、その核内移行を抑制する。その結果、NF−κBの制御下にあるVCAM−1やMCP−1遺伝子などの発現が転写レベルで抑制され、それらの遺伝子産物の過剰産生が抑制され、抗炎症的に作用するものと考えられる。N-(p-クマロイル)セロトニン(p-クマロイルセロトニン)、およびN-フェルロイルセロトニン(フェルロイルセロトニン)は、以下の構造式で表される。
【0043】
【化2】

【0044】
別の側面では、本発明は、セロトニン誘導体を含有するNF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物にも関する。当該組成物は、上述した多くの炎症性疾患、ウイルス感染、腫瘍の転移、免疫疾患の中でも、特に、炎症性腸疾患、肺高血圧症、関節リウマチ、肝線維症などの難治性炎症性免疫疾患、臓器移植後の動脈硬化、腎硬化症、子宮内膜症、気管支喘息またはアレルギー性鼻炎の改善または予防が期待される。
【0045】
本発明の組成物は、前記セロトニン誘導体を有効成分とし、賦形剤(例えば、乳糖、ショ糖、デンプン、サイクロデキストリン等)、場合によっては、香料、色素、調味料、安定剤、防腐剤等も含有するものであり、錠剤、丸剤、顆粒、細粒、粉末、ペレット、カプセル、溶液、乳液、懸濁液、シロップおよびトローチ等に製剤化して、食品(食品組成物)や医薬製剤(医薬組成物)として用いることができる。
【0046】
本発明の組成物中に含まれるセロトニン誘導体の量は、本発明の効果を奏する限り特に限定されるものではないが、通常、0.0001〜99.9重量%であり、好ましくは0.001〜99.5重量%であり、より好ましくは0.005〜99重量%である。
【0047】
特に、医薬として使用する場合、医薬として許容できる担体(添加剤も含む)と共に製剤化することができる。医薬として許容できる担体としては、例えば、賦形剤(例えば、乳糖、ショ糖、デキストリン、ヒドロキシプロピルセルロース、ポリビニルピロリドン等)、崩壊剤(例えば、デンプン、カルボキシメチルセルロース等)、滑沢剤(例えば、ステアリン酸マグネシウム等)、界面活性剤(例えば、ラウリル硫酸ナトリウム等)、溶剤(例えば、水、食塩水、大豆油等)、保存剤(例えば、p-ヒドロキシ安息香酸エステル等)などがあげられるが、これらに限定されるものではない。
【0048】
本発明の「食品」は、食品全般を意味するが、いわゆる健康食品を含む一般食品の他、厚生労働省の保健機能食品制度に規定される特定保健用食品や栄養機能食品等の保健機能食品をも含むものであり、さらにダイエタリーサプリメント(サプリメント、栄養補助食品)、飼料、食品添加物等も本発明の食品に包含される。
【0049】
食品用途の場合、セロトニン誘導体を、例えば、ドレッシング、マヨネーズ等の一般食品(いわゆる健康食品を含む)に含有させて用いることもできる。また、セロトニン誘導体を、賦形剤(例えば、乳糖、ショ糖、デンプン等)、場合によっては、香料、色素等と共に、錠剤、丸剤、顆粒、細粒、粉末、ペレット、カプセル、溶液、乳液、懸濁液、シロップ及びトローチ等に製剤化して、特定保健用食品や栄養機能食品等の保健機能食品、サプリメントとして用いることができる。また、本発明の組成物は、飼料用途にも適用することができ、家禽や家畜等には、通常の飼料に添加して摂取または投与することができる。
【0050】
本発明のNF−κB活性化抑制用組成物は、含有するセロトニン誘導体の生物学的作用を有効に発揮させるためには、特定保健用食品または栄養機能食品として用いられることが好ましく、その際、「NF−κB活性化に起因する状態の予防または改善に用いられる」という表示を付すことが推奨される。
【0051】
本発明のVCAM−1および/またはMCP−1の発現抑制用組成物は、含有するセロトニン誘導体の生物学的作用を有効に発揮させるためには、特定保健用食品または栄養機能食品として用いられることが好ましく、その際、「NF−κBを介したVCAM−1および/またはMCP−1の発現に起因する疾患の改善または予防のために用いられる」という表示を付すことが推奨される。
【0052】
本発明の抗炎症用組成物は、含有するセロトニン誘導体の生物学的作用を有効に発揮させるためには、特定保健用食品または栄養機能食品として用いられることが好ましく、その際、「炎症性疾患の改善または予防のために用いられる」という表示を付すことが推奨される。
【0053】
本発明の組成物の対象は、ヒトを含む動物(ヒト、ウシ、ブタ、イヌ、ネコ等の哺乳類、ニワトリ等の鳥類等)である。また、本発明の組成物が標的とする細胞は、単球以外の細胞であれば特に限定されるものではないが、VCAM−1および/またはMCP−1が高発現している細胞、具体的には、血管内皮細胞、血管平滑筋細胞、腎糸球体細胞が好適な例としてあげられる。また、本発明の組成物が対象とするエフェクター細胞は、単球、マクロファージ、好中球、好酸球、好塩基球などの顆粒球、キラーT細胞などのリンパ球、ナチュラルキラー細胞、肥満細胞、樹状細胞などがあげられる。
【0054】
本発明の組成物の摂取または投与方法は、摂取または投与対象の年齢、体重、健康状態によって異なるが、例えば、健康の維持・増進や疾患の予防を目的とする場合は、通常、食品の形態にして経口的に摂取し、一方、疾患の治療や健康回復を目的とする場合には、通常、医薬品、または食品の形態にして、経口的、または注射、外用剤などにより投与する。用量としては、合成したセロトニン誘導体を投与する場合、成人1日当たり0.2mg〜2g、好ましくは20mg〜2gを1日1回から数回に分けて摂取、または服用することが好ましい。また、実施例6または実施例8の紅花種子抽出物を経口的に摂取する場合、成人1日当たり1mg〜10g、好ましくは、100mg〜10gを1日1回から数回に分けて摂取、または服用することが好ましい。この場合、一日あたりの摂取量または1回あたりの摂取量を一単位包装とすることができる。
【0055】
本発明の組成物中に含まれるセロトニン誘導体は、上述のように動物に摂取または投与された後、その血中濃度が一定期間一定のレベルを維持していることが好ましい。血中濃度としては、本発明の効果を奏する限り特に限定されるものではないが、通常50μM未満であり、好ましくは0.1〜10,000nM、より好ましくは1〜5,000nM、さらにより好ましくは100〜1,000nMが推奨される。
【0056】
セロトニン誘導体は、様々な植物の種子や塊茎などに含まれており、とりわけ紅花種子に多く含まれている。韓国では古来、紅花種子は骨折治癒促進、骨粗鬆症予防などの用途で、民間で用いられており、安全性は高いと考えられる。実施例9の結果も、本発明の組成物の毒性が低く、副作用がほとんど認められないことを裏付けている。
【実施例】
【0057】
以下に実施例等をあげて本発明をより具体的に例示するが、本発明はこれらの実施例等に限定されるものではない。
試験例1(セロトニン誘導体の合成)
p−クマロイルセロトニン(CS)、およびフェルロイルセロトニン(FS)を以下の方法で合成した。
【0058】
CS:セロトニン塩酸塩をジメチルホルムアミド(5mL/g vs.セロトニン塩酸塩、以下同様)およびジクロロメタン(20mL/g)で溶解後、trans−4−クマル酸(1.0モル/モル)、1−ヒドロキシベンゾトリアゾール水和物(HOBt)、1−[3−(ジメチルアミノ)プロピル]−エチル−カルボジイミド ヒドロクロリド(EDC)およびトリエチルアミンを各1.1等量加え、室温で終夜攪拌し反応させた。反応液を減圧濃縮後、酢酸エチルと水(各40mL/gセロトニン量)を加え、酢酸エチル抽出を行った。3回の酢酸エチル抽出により得た抽出相を5%クエン酸水溶液、飽和炭酸水素ナトリウム水溶液および飽和食塩水で順次洗浄後、無水硫酸ナトリウムで脱水した。乾燥剤を除去した抽出液を減圧濃縮し、酢酸エチル−エタノール(10:0.6)にて晶析後、得られた結晶を酢酸エチルで洗浄し、乾燥させ、CSを得た(収率=69.8%)。
【0059】
FS:セロトニン塩酸塩とtrans−4−フェルラ酸より上記CSと同様の方法で合成したが、晶析はメタノール−クロロホルム(1:15)にて行った(収率69.2%)。
【0060】
実施例1(セロトニン誘導体(CS、FS)がNF−κBの活性化に及ぼす作用)
ヒト大動脈内皮細胞(HAEC)はクロネティクスより購入し、3〜4代継代培養(37℃、5%炭酸ガス雰囲気下)したものを実験に用いた。培養ディッシュ(100mmφ)中で、CSおよびFS(各5および10μM)と24時間プレインキュベートした後、25mMのグルコースで2時間刺激した。Nuclear Extract Kit (アクティブモチーフ)を用いて細胞より核を抽出し、TransAM NF−κB p65 Kit (アクティブモチーフ)を用いて核内に移行した活性化NF−κB(p65)を検出した。
【0061】
図1に示したように、2時間の高濃度グルコース処理により、p65の核内移行は顕著に増加し、NF−κBの著明な活性化が認められたが、5および10μMのCSまたはFSの前処理により、p65の核内移行は有意に抑制された。このことから、セロトニン誘導体はヒト大動脈内皮細胞におけるNF−κBの活性化を抑制することが示された。
【0062】
NF−κB活性化抑制機序を調べるため、上記と同様にセロトニン誘導体を前処理したHAEC細胞を25mMグルコースで1時間刺激し、細胞内の活性酸素(ROS)産生に基づく蛍光強度を、Takahashi Mら、Free Radic. Biol. Med. 31:164-174 (2001)の方法に従って測定したところ、高濃度グルコース刺激によるROS産生の上昇を、セロトニン誘導体は用量依存的に低下させることが判明した(図2)。このことから、セロトニン誘導体は、細胞内酸化ストレスを抑制することにより、NF−κBの活性化とそれに引き続いて起こるNF−κBの核内移行を抑制することが示された。
【0063】
実施例2(セロトニン誘導体(CS、FS)がVCAM−1およびMCP−1の遺伝子発現に及ぼす作用)
10μMのCSまたはFSで24時間前処理したHAEC細胞を25mMグルコースで3時間刺激した後、トータルRNAをIsogenキット(ニッポンジーン)を用いて抽出した。1μgのRNAから、100U/mLの逆転写酵素(タカラバイオ)と0.1μMのオリゴ(dT)-アダプター(タカラバイオ)(反応液総量50μL)を用いてcDNAを合成した(42℃、40分)。リアルタイムPCRは7300 Real Time PCR system (アプライドバイオシステムス)を用いて行い、SYBER Green Iを用いてPCR産物を検出した。
【0064】
PCR反応組成(RT-PCRキット、タカラバイオ):12.5μL Premix Ex Taq、2.5μL SYBER Green I、合成プライマー、ROX reference dye、cDNA(20ngのトータルRNAに相当)、最終反応容量25μL
プライマーは以下の配列のものを用いた。
VCAM−1遺伝子の検出:
5’-CCCTTGACCGGCTGGAGATT-3’(センス)(配列番号1)
5’-CTGGGGGCAACATTGACATAAAGTG-3’(アンチセンス)(配列番号2)
MCP−1遺伝子の検出:
5’-CGCCTCCAGCATGAAAGTCT-3’(センス)(配列番号3)
5’-GGAATGAAGGTGGCTGCTATG-3’(アンチセンス)(配列番号4)
GAPDH(内部標準)遺伝子の検出:
5’-ACCACAGTCCATGCCATCAC-3’(センス)(配列番号5)
5’-TCCACCACCCTGTTGCTGTA-3’(アンチセンス)(配列番号6)
PCRは以下の条件で実施した。
熱変性:95℃で15秒、伸長反応:40サイクル(95℃で3秒、60℃で31秒)
VCAM−1およびMCP−1 mRNAの発現量は、GAPDHを内部標準として求めた。
【0065】
図3A、Bに示したように、高濃度グルコース刺激により、VCAM−1およびMCP−1 mRNAのHAEC細胞における発現量は共に未処理細胞の約3倍に上昇したが、CS、FSはいずれもその上昇を有意に抑制した。このことから、セロトニン誘導体はヒト大動脈内皮細胞を高グルコースで刺激した際のVCAM−1およびMCP−1の発現を転写レベルで抑制することが示された。実施例1の結果から、セロトニン誘導体は、NF−κBの活性化を抑制することにより、高グルコース刺激によって誘導されるこれらの遺伝子の転写を抑制したものと考えられた。
【0066】
実施例3(セロトニン誘導体(CS、FS)がVCAM−1およびMCP−1タンパク質発現に及ぼす作用)
96穴マイクロプレート上でコンフルエントになるまで増殖させたHAEC細胞を0.1〜10μMのセロトニン誘導体と24時間プレインキュベートした後、25mMグルコースで4時間刺激した。細胞層をHanks液で洗った後、抗VCAM−1モノクローナル抗体(ベクトンディキンソン)を添加して37℃、1時間インキュベートし、洗浄後、二次抗体(ペルオキシダーゼ標識抗マウスIgGヤギF(ab’)2フラグメント;カッペル)と1時間インキュベートした。発色基質(ο−フェニレンジアミン2塩酸塩)を添加して約30分後(室温)、各ウエルの吸光度(492nm)をマイクロプレートリーダーで定量した。一方、培地中のMCP−1濃度は、Human MCP-1 Immunoassay Kit (バイオソースインターナショナル)を用いて定量した。
【0067】
図4A、Bに示したように、高濃度グルコース刺激により細胞膜上のVCAM−1の発現、および培地中へのMCP−1分泌は、未処理時のそれぞれ2倍弱、約3.5倍に上昇したが、CSおよびFSは共に用量依存的にこれらの発現誘導を抑制した。このことから、セロトニン誘導体は、ヒト大動脈内皮細胞を高グルコースで刺激した際のVCAM−1およびMCP−1の発現誘導を抑制することがタンパク質レベルで示された。
【0068】
実施例4(セロトニン誘導体(CS、FS)がHAEC細胞上への単球接着に及ぼす作用)
24穴マルチウエルプレートにてコンフルエントまで増殖させたHAEC細胞をCS、およびFS(各5および10μM)と24時間プレインキュベートした後、25mMグルコースで4時間刺激した。細胞層をHanks液で洗浄後、U−937単球細胞(ATCCより購入)の懸濁液(1×106/mL)を200μL添加して、37℃で30分間インキュベートした。再び洗浄後、1%パラホルムアルデヒドで細胞を固定し、HAEC上に接着したU−937細胞数を顕微鏡下で計測した(20視野)。実験は3回行い、結果はそれらの平均値で表した。蛍光標識したU−937細胞を用いた実験も同様に実施した。具体的には、10μMの2’,7’−ビス(2−カルボキシエチル)−5(6)−カルボキシフルオレセインアセトキシメチルエステル (BCECF−AM、モレキュラープローブス)存在下でU−937細胞をインキュベート(37℃、1時間)後、遠心により細胞を洗浄した。蛍光標識されたU−937細胞(1×106/mL)をHAEC細胞に添加し、37℃、1時間インキュベートした。浮遊しているU−937細胞を除去後、プレートをPBS緩衝液で洗浄し、1% Triton Xで2時間処理した。接着した細胞の蛍光量を蛍光プレートリーダー(バイオラッド・フルオロマーク)を用いて定量した(Ex.503nm、Em.525nm)。
【0069】
図5に示したように、高濃度のグルコース刺激により、HAEC細胞上に接着したU−937細胞数は著明に増加したが、CSおよびFSとのプレインキュベーションにより、接着した細胞数はセロトニン誘導体の用量依存的に減少した。同様の結果は、蛍光標識したU−937細胞を用いた蛍光強度アッセイによっても確認された(図6)。これらのことから、セロトニン誘導体は、高濃度グルコース刺激により誘導される単球の内皮細胞上への接着を抑制することが示された。実施例2、実施例3および高濃度グルコース刺激HAECにおけるU−937細胞の接着は、抗VCAM−1モノクローナル抗体の添加により抑制された(データ示さず)ことから、セロトニン誘導体が内皮細胞上のVCAM−1発現誘導を抑制した結果であると考えられた。
【0070】
実施例5(セロトニン誘導体(CS、FS)が単球の遊走能に及ぼす作用)
単球の遊走能はトランスウエルシステム(ポアサイズ3μm;BDバイオサイエンス)を用いて行った。24マルチウエルプレート中に設置したトランスウエル上で培養したHAECを5、および10μMのセロトニン誘導体と24時間プレインキュベートした後、25mMのグルコースで4時間刺激した。U−937細胞懸濁液(106細胞/mL)200μLをトランスウエル内に添加し、そのまま37℃で2時間インキュベートした。メンブレンを通過してトランスウエル下部に遊走してきた細胞の数を検鏡下でカウントした(20視野)。実験は3回繰り返し、結果はそれらの平均値で表した。蛍光標識したU−937細胞を用いた実験も同様に実施した。上述した方法でBCECF−AM標識したU−937細胞をトランスウエル上部に播種して37℃、2時間インキュベートした。メンブレンを通過してトランスウエル下部に遊走してきた細胞を1mLのPBS緩衝液に回収し、1% Triton Xで2時間処理した。遊走細胞由来の蛍光を蛍光プレートリーダー(バイオラッド フルオロマーク)を用いて定量した(Ex.503nm、Em.525nm)。
【0071】
インキュベート(37℃、1時間)後、遠心操作により細胞を洗浄した。蛍光標識されたU−937細胞(1×106/mL)をHAEC細胞に添加し、37℃、1時間インキュベートした。浮遊しているU−937細胞を除去後、プレートをPBS緩衝液で洗浄し、1% Triton Xで2時間処理した。接着した細胞の蛍光量を蛍光プレートリーダー(バイオラッド フルオロマーク)を用いて定量した(Ex.503nm、Em.525nm)。
【0072】
図7に示したように、HAEC細胞を高濃度グルコースで刺激することにより、内皮下に遊走するU−937細胞数が劇的に上昇したが、HAEC細胞をCSまたはFSとプレインキュベートすることにより、遊走細胞数は有意に減少した。同様の結果は、蛍光標識したU−937細胞を用いた蛍光強度アッセイによっても確認された(図8)。これらのことから、セロトニン誘導体は、高濃度グルコース刺激により誘導される単球の内皮下への遊走を抑制することが示された。実施例2および実施例3の結果から、セロトニン誘導体による単球の遊走抑制は、内皮細胞からのMCP−1産生を抑制した結果であると考えられた。
【0073】
実施例6(動物用ベニバナ種子抽出物の調製)
ベニバナ種子抽出物の調製を以下の方法で実施した。搾油後のベニバナ脱脂種子600gに3,000mLの90容量%エタノール水を加えて、60℃の湯浴中で3時間、加温、攪拌した後、ろ過した。ろ過後の固形分に対して同様の操作を1回行い、得られたろ過液を合一して減圧濃縮にて500mLの濃縮液を得た。濃縮液に水を加えて1,000mLとし、内容物を懸濁した後、500mLのn−ヘキサンにて2回洗浄し、洗浄後の水層を酢酸エチル500mLで2回抽出した。酢酸エチル抽出液を無水硫酸マグネシウムで脱水し、ろ過後減圧濃縮してベニバナ種子抽出物(SSE)10.1gを得た。この方法で得られた抽出物中の総セロトニン誘導体含量(アグリコン+配糖体)は24.1%(アグリコン換算では21.4%)であった。
【0074】
実施例7(セロトニン誘導体およびベニバナ種子抽出物の摂取がapoEノックアウトマウス血漿中のsVCAM−1レベルに及ぼす作用)
6〜7週齢の雄性apoEノックアウトマウス(ジャクソンラボラトリーより購入)を1群7〜10匹として、
1)対照(Control)、
2)セロトニン誘導体0.2%投与区(CS + FS (0.2);試験例1で合成されたCS、FS各0.1重量%含有)、
3)セロトニン誘導体0.4%投与区(CS + FS (0.4);試験例1で合成されたCS、FS各0.2%重量含有)、
4)FS 0.4%投与区(FS;試験例1で合成されたFSのみ0.4重量%含有)、
5)ベニバナ種子抽出物(SSE)1%投与区(SSE;実施例6で得たSSEを1重量%含有)の計5群に分け、表1に示すような組成の餌を15週間自由摂取させた。投与期間終了後、マウスをエーテル麻酔下、腹部大静脈より採血(抗凝固剤:EDTA−2K+ヘパリン)し、3,000rpm、15分の遠心操作を行い、血漿を回収した。血漿中の可溶性VCAM−1(sVCAM−1)濃度は、sVCAM−1測定ELISAキット”Mouse sVCAM-1/CD106 Quantikine ELISA Kit”(R&Dシステムス)を用いて測定した。
得られた値については各群間で分散分析を行い、Dunnett検定で試験食群の平均値を対照群のそれと比較した。
【0075】
図9に示したように、セロトニン誘導体を長期摂取させたapoEノックアウトマウスの血中sVCAM−1レベルは、いずれの群においても低下傾向を示した。SSEを摂取させた動物においては統計学的に有意に血中sVCAM−1レベルを低下させた。これらのことから、セロトニン誘導体、およびセロトニン誘導体を含むベニバナ種子抽出物はVCAM−1レベルを低下させることが動物レベルでも確認された。
【0076】
【表1】

【0077】
実施例8(ヒトボランティア試験用試験食の調製)
ベニバナ種子抽出物の調製を以下に記載した方法で実施した。脱脂ベニバナ種子100kgを2000Lの水にて30℃、30分間攪拌洗浄後固液分離を行い、得られた固形分に60容積%エチルアルコール−水を1500L加え、60℃に昇温後、同温にて60分間攪拌抽出した。同操作を3経路同時に実施して得た固液分離後の抽出液を合一し、ろ過助剤(KCフロック)を用いて圧搾濾過後、ろ過液中の固形分量と等量のγ-サイクロデキストリン(CAVAMAX W8 FOOD、シクロケム)の水溶液を加え、減圧下50〜60℃にて濃縮した。得られた濃縮液を88℃、1時間加熱殺菌及び、60℃、15時間の乾燥後、粉砕、篩分け(60メッシュ篩)し、ベニバナ種子抽出物粉末6kgを得た。一般成分分析結果は表2のとおりであった。このベニバナ種子抽出物粉末中の総ポリフェノール含量をFolin-Ciocalteau法で測定したところ、143mg/g抽出物粉末(p−クマロイルセロトニン当量)であった。HPLCで分析したところ、総セロトニン誘導体含量は138mg/g抽出物粉末(13.8重量%)であった。結果を表3に示す。このことから、セロトニン誘導体は本ベニバナ種子抽出物粉末中に含まれるフェノール類の主要成分であると考えられた。こうして調製したベニバナ種子抽出物粉末をハードカプセル充填機(ウルトラエイト、カプスゲル ジャパン)にてハードカプセルに充填した(1カプセルあたり210mgのベニバナ種子抽出物粉末、セロトニン誘導体として約29mgを含む)。
【0078】
【表2】

【0079】
【表3】

【0080】
実施例9(ベニバナ種子抽出物粉末の摂取がヒト血清中のsVCAM−1およびMCP−1レベルに及ぼす作用)
90名のボランティア男性の加速度脈波検査を事前に行い、加速度脈波加齢指数(血管年齢)が暦年齢よりも高く、かつ血圧、血中コレステロール、血糖制御に関する薬物治療を行っていない20名を被験者として選定した(平均暦年齢37.3±6.8歳、平均血管年齢48.1±8.1歳)。実施例8で調製した試験食カプセル10個(ベニバナ種子抽出物粉末2.1g(セロトニン誘導体として約290g))を1日2回(朝、夕食後30分以内、各5個ずつ)に分けて4週間毎日摂取させ、摂取開始直前(0週)、摂取終了時(4週)、および摂取終了後4週間(8週)の時点で採血を行い(午前中、空腹時採血)、血清を分離した。血清中のsVCAM−1およびMCP−1濃度は、臨床検査の受託機関に委託して分析した。
【0081】
試験食の摂取期間中において、試験食によって起因したと思われる症状の訴えは認められなかった。血液生化学パラメータ(血中脂質(総コレステロール、HDL-コレステロール、LDL-コレステロール、トリグリセリド)、および血糖、肝機能指標(GOT、GPT、LDH、γ-GTP総タンパク、アルブミン)、腎機能指標(尿素窒素、クレアチニン)、電解質(Na+、K+、Ca2+))についても、摂取前後で異常な変化は認められなかった。
【0082】
図10A、Bに示したように、4週間の試験食摂取により、ボランティア血清中のVCAM−1およびMCP−1は試験食摂取開始前に比べて有意に低下し、試験食摂取終了後4週間でほぼ摂取開始時点のレベルに戻ることが示された。これらの結果からベニバナ種子抽出物は安全性に特に問題は認められないこと、また、ヒトにおいてもVCAM−1およびMCP−1レベルを低下させることが明らかとなった。
【0083】
実施例10(FS、およびFSを含有するベニバナ種子抽出物(SSE)の炎症性腸疾患(IBD)モデルマウスに及ぼす作用)
炎症性腸疾患(IBD)モデルマウス(IL−10欠損細胞移入モデル)は、池上らの方法(Ikenoue Y.ら、Int. Immunopharmacol., 5, 993-1006 (2005):非特許文献12)に従い、IBDの発症(下痢、体重減少)が確認されたIL−10欠損マウス(ジャクソンラボラトリーより購入したIL−10-/-マウスをBALB/cマウス(日本チャールズリバー)と7世代バッククロスしたもの)から調製した脾臓、および腸間膜リンパ節細胞懸濁液(1〜3 x 107 cells /200μL)をSCIDマウス(CB-17/Icr SCID;日本クレア)の腹腔内に投与することによって作製した(本モデル動物において、細胞移入後2-3週間以内に腸管における慢性炎症が全例に発生し、臨床的にも効果が確認されている抗IBD剤(抗TNF受容体抗体(TNFR-Ig)やステロイド(プレドニゾロン))によって症状が改善されることが既に明らかにされている(非特許文献12))。
【0084】
IL-10欠損細胞移入4日前に計40匹のSCIDマウス(7週齢、♀)を下記の1)〜4)に示す4群(各群10匹)に分けると同時に対照食への馴化を開始し、細胞移入後直ちに飼料を表4に示す試験食に切り替え、3週間自由摂取させた。ベニバナ種子抽出物粉末は実施例8で示したものと同一であり、γ-サイクロデキストリンを50重量%含む。N-フェルロイルセロトニン(FS)は試験例1の方法で合成したものである。試験食摂取期間中は、週3回体重、摂餌量、飲水量の測定、および発症の有無を観察した。
【0085】
1) Normal群(正常SCIDマウス x 対照食)
2) Control群(IL-10欠損細胞移入SCIDマウス x 対照食)
3) SSE群(IL-10欠損細胞移入SCIDマウス x SSE食*)
4) FS群(IL-10欠損細胞移入SCIDマウス x FS食**)
* FS、およびp-クマロイルセロトニン(CS)を各々0.10、および0.13重量%(アグリコン換算)含有(総セロトニン誘導体含量=0.28重量%)
**FSアグリコン0.4重量%含有
【0086】
試験食摂取期間終了後、麻酔下にて採血し、摘出した大腸(盲腸〜肛門)の長さ、および重量(内容物洗浄後)を計測した。得られたデータについては、まずNormal群とControl群との間でt-検定を行い、試験の成立を確認した後、Control群とSSE、FS各群との間で分散分析を行い、被験物質による影響をDunnett検定にて比較した。
【0087】
表5に示したように、IL-10欠損細胞移入により増体は有意に抑制された。摂餌量、飲水量については、群間に有意差は認められなかった。一方、図11に示したように、IL-10欠損細胞移入によりControl群における大腸腸管長、大腸重量、および単位腸管長当たりの大腸重量はいずれも有意に増加した。また、図12に示したように、血中の白血球数、血小板数、好中球数、単球数がいずれも有意に増加していたことから、大腸炎の発生は明らかであった。SSE、およびFSを摂取させた動物においては、大腸重量、単位腸管長当たりの大腸重量ともにControl群よりも有意に低値を示した。また、いずれの群における血小板数もControl群より有意に低下した(本モデルにおいては、病態の進展と共に血小板数が上昇することが上記文献(非特許文献12)で示されている)。白血球数、好中球数、単球数については統計学的に有意ではなかったが、いずれもSSE群、FS群においてControl群よりも低下する傾向を示した。これらの結果は、SSE、およびFSの摂取が大腸炎を改善することを示している。
【0088】
【表4】

【0089】
【表5】

【0090】
炎症反応における白血球の活性化によって、大量のNOが細胞から産生され、代謝物であるNOxの血中濃度が上昇する。このことより、血中NOx濃度は生体における炎症反応の一つの指標となることが知られている(Yuka Ikenoue ら、International Immunopharmacology 5 (2005)993-1006)。実施例10より得た血液中のNOx濃度を「Nitric Oxide Quantitation Kit(ACTIVE MOTIF社)」にて測定したところ、図13に示すように、Control群はNormal群に比べて著明なNOx濃度の上昇を認めた。これに対し、SSE群では有意なNOx濃度の低下が、またFS群では統計学的な有意差は認めなかったものの、低下する傾向を示した。
【0091】
実施例10にて記載した試験において、終了時に大腸(盲腸〜肛門)の中央部から肛門側に約1cmずつ切り出していき、計3本の切片を得た。そのうち1本は10%ホルマリン溶液にて固定、2本は液体窒素にて凍結した。ホルマリン固定した大腸はパラフィン包埋後、薄切し横断の輪切り標本を作製した。標本はPAS(Periodic acid Schiff)染色法にて染色後、病理組織像の観察を実施した。一方凍結した大腸組織からISOGEN(株式会社ニッポンジーン)を用い、total RNAを抽出した。total RNA 2μgをSYBR ExScriptTM RT-PCR kit (TaKaRa)を用いて逆転写反応を行い、これを鋳型としてIL-1β、TNFαおよびGAPDHに対する定量リアルタイムPCRを行った。解析に用いたプライマーは以下のとおりである。
IL-1β:forward 5’- TCA CAG CAG CAC ATC AAC AA -3’(配列番号7)
reverse 5’- TGT CCT CAT CCT GGA AGG TC -3’(配列番号8)
TNFα:forward 5’- CCA CCA CGC TCT TCT GTC TA-3’(配列番号9)
reverse 5’-AGG GTC TGG GCC ATA GAA CT -3’(配列番号10)
GAPDH:forward 5’- CTG AGG ACC AGG TTG TCT CC -3’(配列番号11)
reverse 5’- ACC ACC CTG TTG CTG TAG CC -3’(配列番号12)
鋳型DNA 2μl、SYBR Premix Ex TaqTM (TaKaRa)10μl、ROX Reference Dye 0.4μl、100μM forward プライマー0.04μl、100μM reverse プライマー 0.04μl、滅菌水7.52μlを氷上で混合し、Applied Biosystems 7900HT Fast リアルタイムPCRシステムを用いて、95℃で10秒加熱後、95℃で5秒、60℃で34秒を40サイクル繰り返し、DNAを増幅した。GAPDHを内部標準として用い、IL-1βおよびTNFα発現量を評価した。
【0092】
図14に示したように、Control群では大腸粘膜上皮層の著明な肥厚、ならびに正常サイズの杯細胞数減少といった炎症性腸疾患特有の病理所見が認められた(Yuka Ikenoue ら、International Immunopharmacology 5 (2005)993-1006)。SSE群およびFS群ではControl群と比較して、大腸粘膜上皮層の肥厚抑制、および正常な杯細胞の増加といった所見が認められ、病理所見上においても改善効果が示された。さらに炎症性サイトカインであるIL-1β、TNFαの大腸組織におけるmRNA発現量に対し、SSE群およびFS群は、IL-1βではいずれもControl群に比べて有意な低下を示し、TNFαについてはSSE群では有意な低下を、FS群では低下の傾向を示した(図15)。
【0093】
血中NOxレベル、病理組織学的所見、および炎症サイトカインのmRNA発現量に対するSSE群およびFS群の効果は、大腸重量、単位腸管長当たりの大腸重量の低下といった作用が、大腸における炎症反応の抑制によるものであることを強く示すものである。
【産業上の利用可能性】
【0094】
本発明品により、NF−κB活性化抑制作用を介して広く炎症性疾患の予防または治療が可能となる。具体的には、慢性関節炎、乾癬、炎症性腸疾患、子宮内膜症などの疾患があげられ、特に、炎症性腸疾患の改善または予防が期待される。また、本発明品により、NF−κB活性化が関与する疾患の予防または治療が可能となる。具体的には、上述した炎症性疾患、ウイルス感染、腫瘍の転移、免疫疾患などの疾患があげられる。また、本発明品により、NF−κBを介したVCAM−1および/またはMCP−1の発現に起因する疾患の予防または治療が可能となる。具体的には、肺高血圧症、関節リウマチ、肝線維症などの難治性炎症性免疫疾患、臓器移植後の動脈硬化などの疾患があげられる。本発明品は、医薬品としての使用のほか、食品への適用も可能である。
【0095】
本出願は、日本で出願された特願2006−131770(出願日:2006年5月10日)を基礎としており、その内容は本明細書に全て包含されるものである。
【技術分野】
【0001】
本発明は、セロトニン誘導体のNF−κBの活性化抑制作用に基づく医薬または食品用途に関する。より具体的には、例えば、セロトニン誘導体の抗炎症用途に関する。
【背景技術】
【0002】
炎症は、種々の外因性または内因性の組織障害刺激に対する生体の応答である。感染などにより生体組織の一部が障害されると、組織からは様々な生体反応修飾物質が産生・放出され、炎症が生じる。初期にはTNF-αやIL-1などの炎症性サイトカインが炎症部位で産生され、それらの作用により、血管内皮上に細胞接着因子(ICAM-1、VCAM-1など)の発現が増強し、炎症性細胞の血管壁接着が亢進する。同時に、炎症部位より産生されるMCP-1やIL-8などの走化因子によって、単球やリンパ球、好中球が炎症組織に浸潤する。内皮下に浸潤した炎症性細胞からは、更に種々のサイトカインや活性酸素、水解酵素などが病原微生物などに対して分泌されるが、それらは同時に宿主組織をも障害する。このような過程を経て、起炎物質が消滅または除去されると、通常は炎症細胞の移入が停止し、炎症は消散に向かうが、組織障害が強かった場合は完全には修復されず、組織の実質細胞が結合組織により置換(線維化)される結果、組織の機能低下を招く場合が生じる。また、結核のような持続感染、自己免疫機序による自己組織障害、酸化LDLの蓄積などは、炎症を遷延化させ、慢性炎症と呼ばれる、活動性炎症反応、組織破壊、組織修復を繰り返し長期に渡って進行するという病態を形成することがある。こうした慢性炎症性疾患にはベーチェット病などのような難治性のものが少なくなく、患者は長期にわたってQOLの低下に苦しめられることになる。
【0003】
これらの炎症プロセスにおいては、多くの遺伝子が活性化されるが、NF−κBはこの遺伝子活性化プロセスに中心的な役割を担う転写因子である。NF−κBは、p50とp65の二つのサブユニットからなるヘテロダイマーであり、通常、抑制性タンパクであるI−κBと複合体を形成して不活性体として細胞質に存在するが、刺激によりI−κBがリン酸化を受けて分解され、複合体から離脱すると、NF−κBヘテロダイマーは核内に移行してDNAと結合し、結合サイト下流の遺伝子発現を調節することが知られている。NF−κBの活性化と核内へのトランスロケーションの過程には酸化ストレスが関与していると言われている。そのメカニズムについては未だ不明な点も多いが、ある種の活性酸素種(ROS)がI−κBリン酸化酵素を活性化し、I−κBの分解を促すと考えられている。複数の抗酸化物質の添加や、グルタチオンペルオキシダーゼなどの抗酸化酵素の過剰発現がNF−κBの活性化を抑制することが知られている。これとは逆に、核内に移行した活性化NF−κBのDNA上への結合は酸化剤によって阻害され、チオール類により促進される。このように、NF−κBの活性化と、それに引き続いて起こる各種遺伝子産物の発現はいずれもレドックス制御下に置かれていると言えるが、その制御様式は異なっているため、細胞内のレドックス状態の変化がNF−κBの制御下にある遺伝子産物の発現に及ぼす影響は一様ではなく、複雑である(非特許文献1)。NF−κBによる発現調節を受ける遺伝子産物としては、TNF-α、IL-1β、IL-6などの炎症性サイトカイン、ICAM-1、VCAM-1、E-セレクチンなどの細胞接着因子、IL-8やMCP-1などの細胞走化因子(ケモカイン)、誘導型一酸化窒素合成酵素(iNOS)、組織因子(TF)や誘導型シクロオキシゲナーゼ(COX-2)などが代表的なものとしてあげられる。多くの疾患にNF−κBの活性化が関与していると言われている。重要なものとしては、アテローム性動脈硬化、心筋梗塞、ウイルス感染(HIV、サイトメガロウイルスなど)、関節炎(慢性関節リウマチ、変形性関節炎など)、乾癬、炎症性腸疾患(IBD)、II型糖尿病、気管支喘息、敗血症、自己免疫疾患などがあげられる。
【0004】
NF−κBの活性化によって発現が上昇するVCAM−1(Vascular Cell Adhesion Molecule-1)は、分子量110kDaの糖タンパクで、主に血管内皮細胞、マクロファージなどに発現が認められる。その主な働きは、リンパ球、単球などに発現しているβ1-インテグリンファミリーの一つであるVLA4と結合することにより、白血球を血管内皮細胞上に強固に接着させることである。VCAM−1と疾患の関連については、動脈硬化、同種移植拒絶反応、悪性腫瘍(メラノーマ等)の転移など、様々な急性/慢性炎症性疾患の病変局所の血管内皮細胞において発現亢進が確認されている。
【0005】
MCP−1(Monocyte Chemotactic Protein-1)は、内皮細胞、平滑筋細胞、およびマクロファージなどから産生され、血管内皮細胞に接着した単球/マクロファージ、Tリンパ球の内皮下への遊走を強力に誘導することから、MCP−1は各種の炎症病変において単球およびT細胞の組織浸潤を促進すると考えられている。MCP−1も多くの疾患との関わりが知られており、気管支喘息やアレルギー性鼻炎、慢性関節リウマチ、肺高血圧、肝線維症、腎硬化症、ウイルス性脳炎、動脈硬化、子宮内膜症、炎症性腸疾患(IBD)などの慢性炎症疾患や、アレルギー疾患/免疫異常において、局所における産生亢進、あるいはMCP-1中和抗体/アンタゴニストによる症状の改善などが報告されている。
【0006】
炎症性疾患の治療には様々な抗炎症剤が用いられるが、種々の炎症性メディエーターの産生、または炎症性細胞接着分子の発現を抑制するものとしては、いまだに決め手となるようなものはない。その理由の一つとしては、上述したように炎症反応には多数の遺伝子産物が関与するため、単一の酵素活性やサイトカイン産生をブロックするだけでは不十分と考えられることである。例えば、NSAID(非ステロイド抗炎症剤)類は、アラキドン酸代謝においてシクロオキシゲナーゼを阻害することにより、炎症性プロスタグランジンの産生を抑制するが、サイトカインの産生を直接阻害することはない。サイトカイン抗体またはサイトカイン受容体ブロッカーなどを用いた抗サイトカイン療法は、特定のサイトカインの機能を抑制できても、複数のサイトカインの活性を直接抑制することはできない。例えば、抗ICAM-1抗体は臓器移植時の拒絶反応抑制などで効果が報告されているが、他の接着分子や炎症性サイトカイン類に対する直接的な作用はない。また、抗サイトカイン療法の場合、初期の投与効果は大きくても効果の持続性が疑問視されており、慢性炎症性疾患への臨床応用は困難と考えられる。一方、従来の、免疫抑制剤を含む抗炎症剤、抗サイトカイン療法には多くの副作用が報告されている。例えば、ステロイド剤は、経口投与が可能で、非特異的に複数のサイトカインの産生を抑制するメリットを持つが、その一方で感染増悪、リバウンドなどの問題を抱えている。抗TNF-α抗体は慢性関節リウマチやクローン病で効果が示されているが、感染症やアレルギー(アナフィラキシーショック)などの重大な問題が指摘されている。
【0007】
これら既存の抗炎症剤に対して、NF−κB抑制剤は、上述した各種起炎性物質の産生に関与する遺伝子の活性化における共通のプロセスを抑制するため、広く抗炎症的に作用する可能性が考えられる。すなわち、複数の炎症性サイトカインの転写を同時に抑制することにより、炎症性サイトカインの異常産生に基づく疾患を治療する医薬品、また、HIVやサイトメガロウイルスなどの、NF−κBの活性化が自己の複製に必要なウイルスに対する抗ウイルス剤、細胞接着分子の発現を抑制することによる抗炎症または癌転移抑制剤、臓器移植の際に用いる免疫抑制剤への応用などが考えられる。
【0008】
食品などに含まれる天然成分にもNF−κB抑制作用を有するものがいくつか知られている(ケルセチン(非特許文献2)、クルクミン(非特許文献3)、イソビテキシン(非特許文献4)、アピゲニン(非特許文献5)、ピクノジェノール(非特許文献6)、など)。これらのポリフェノール類は経口的に摂取されており、安全性は比較的高いと考えられるだけでなく、一部については抗酸化活性や抗動脈硬化作用などが報告されている(非特許文献7、8)ことなどから、慢性炎症病態の日常的な制御や、炎症性疾患の発症予防に有用である可能性がある。しかしながら、これらのNF−κBの抑制作用はin vitroで調べられたものであるのに対し、生体内ではポリフェノール類は代謝されて抗酸化作用が減弱する、あるいは失われる例が報告されている(非特許文献9)ことから、これらの物質が実際に生体内で抗炎症作用を発揮するかどうかについては不明である。
【0009】
ベニバナ種子脱脂粕抽出物は、in vitroで低比重リポタンパク(LDL)の酸化を強力に抑制し、apoE KOマウスにおける動脈硬化病変形成を抑制する作用(特許文献1)、動脈硬化モデルであるKHCウサギや、ヒトボランティアにおける血圧・脈波改善作用(特許文献2)を有することが示されている。この抽出物中に含まれるヒドロキシ桂皮酸セロトニンアミド(セロトニン誘導体)は、apoE KOマウスにおける抗動脈硬化活性本体の少なくとも一つであると考えられる(特許文献1)。ベニバナ種子中のセロトニン誘導体としては、主としてN-(p-Coumaroyl)serotonin(CS)とN-Feruloylserotonin(FS)、およびそれらの配糖体の4種が知られており、これらの化合物の構造は、上記非特許文献2〜6に示されたNF−κB抑制剤とは全く異なるものである。CSとFSは、共にほぼ同レベルの抗酸化活性(DPPHラジカル消去活性、LDL酸化抑制作用など)を有することが示されている。これらのうち、CSについては、細菌のリポ多糖(LPS)で刺激されたヒト末梢血単球におけるTNF-α、IL-1、IL-6などの炎症性サイトカイン産生を抑制することがKawashimaらにより報告されている(非特許文献10)。この報告によれば、CSは50μM以上の濃度でTNF-α、IL-1α、IL-1β、IL-6の産生を転写レベルで阻害し、NF−κB活性化阻害がEMSA(Electrophoretic Mobility Shift Assay)の結果認められたとしている。しかしながら、同じ研究グループの続報(非特許文献11)では、上記のCSの効果は炎症性サイトカインに特異的なものではなく、末梢血由来単球におけるCSの非特異的なタンパク合成阻害作用と抗酸化作用の結果であると考察している。これらの知見を総合すると、末梢血単球以外の細胞におけるセロトニン誘導体の炎症性サイトカイン発現またはNF−κB活性に及ぼす影響は不明である。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】国際公開番号第2003/086437号パンフレット
【特許文献2】国際公開第2007/032551号パンフレット
【非特許文献】
【0011】
【非特許文献1】Halliwell B and Gutteridge JM, Free Radicals in Biology and Medicine Third Edition, Oxford Science Publications (1999)
【非特許文献2】Martinez-Florez Sら、J. Nutr. 135:1359-1365 (2005)
【非特許文献3】Yeh C-Hら、J. Surgical Res.125:109-116 (2005)
【非特許文献4】Lin C-Mら、Planta Medica 71:748-753 (2005)
【非特許文献5】Gerritsen MEら、Am. J. Pathol. 147:278-292 (1995)
【非特許文献6】Packer L, Book of abstracts, 219th ACS National Meeting, SanFrancisco, CA, March 26-30, (2000)
【非特許文献7】Nakamura Yら、Jpn. J. Cancer Res. 89:361-370 (1998)
【非特許文献8】Kamada Cら、Free Rad. Res. 39:185-194 (2005)
【非特許文献9】Williamson Gら, Free Rad Res. 39:457-469 (2005)
【非特許文献10】Kawashima Sら、J. Interferon Cytokine Res. 18:423-428 (1998)
【非特許文献11】Takii Tら、Int. Immunopharmacol. 3:273-277 (2003)
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の目的は、NF−κB活性化の抑制を作用機序とする炎症性サイトカインの発現抑制を通じて様々な症状の改善または予防手段を提供することにある。
【課題を解決するための手段】
【0013】
本発明者らは、上記課題を解決するために鋭意検討し、セロトニン誘導体、とりわけフェルロイルセロトニン、p−クマロイルセロトニンが血管内皮細胞に対して有意なNF−κB活性化の抑制作用があることを見出し、本発明を完成するに至った。即ち、本願発明は、以下に示す通りである。
【0014】
〔1〕セロトニン誘導体を含有してなるNF−κB活性化抑制用組成物。
〔2〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔1〕に記載のNF−κB活性化抑制用組成物。
〔3〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔1〕に記載のNF−κB活性化抑制用組成物。
〔4〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔1〕に記載のNF−κB活性化抑制用組成物。
〔5〕前記セロトニン誘導体が植物から抽出されたものである、前記〔1〕〜〔4〕いずれかに記載のNF−κB活性化抑制用組成物。
〔6〕前記植物が紅花の種子である、前記〔5〕に記載のNF−κB活性化抑制用組成物。
〔7〕医薬である、前記〔1〕〜〔6〕いずれかに記載のNF−κB活性化抑制用組成物。
〔8〕NF−κB活性化に起因する疾患の治療または予防のために用いられる、前記〔7〕に記載のNF−κB活性化抑制用組成物。
〔9〕食品である、前記〔1〕〜〔6〕いずれかに記載のNF−κB活性化抑制用組成物。
〔10〕食品が保健機能食品またはダイエタリーサプリメントである、前記〔9〕に記載のNF−κB活性化抑制用組成物。
〔11〕保健機能食品が特定保健用食品または栄養機能食品である、前記〔10〕に記載のNF−κB活性化抑制用組成物。
〔12〕前記〔7〕または〔8〕に記載のNF−κB活性化抑制用組成物を、それを必要とする対象に投与することを含む、対象におけるNF−κB活性化を抑制する方法。
〔13〕NF−κB活性化抑制用組成物を製造するためのセロトニン誘導体の使用。
〔14〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔13〕に記載の使用。
〔15〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔13に記載の使用。
〔16〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔13〕に記載の使用。
〔17〕前記セロトニン誘導体が植物から抽出されたものである、前記〔13〕〜〔16〕いずれかに記載の使用。
〔18〕前記植物が紅花の種子である、前記〔17〕に記載の使用。
〔19〕前記〔7〕または〔8〕に記載の組成物および当該組成物をNF−κB活性化に起因する疾患の治療または予防のために使用することができること、または使用すべきであることを記載した記載物を含む、商業用パッケージ。
〔20〕NF−κB活性化に起因する状態の治療または改善に用いられるという表示を付した、前記〔10〕または〔11〕に記載のNF−κB活性化抑制用組成物。
〔21〕セロトニン誘導体を含有してなる、NF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物。
〔22〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔21〕に記載の発現抑制用組成物。
〔23〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔21〕に記載の発現抑制用組成物。
〔24〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔21〕に記載の発現抑制用組成物。
〔25〕セロトニン誘導体が植物から抽出されたものである、前記〔21〕〜〔24〕いずれかに記載の発現抑制用組成物。
〔26〕前記植物が紅花の種子である、前記〔25〕に記載の発現抑制用組成物。
〔27〕医薬である、前記〔21〕〜〔26〕いずれかに記載の発現抑制用組成物。
〔28〕NF−κBを介したVCAM−1および/またはMCP−1の発現に起因する疾患の治療または予防のために用いられる、前記〔27〕に記載の発現抑制組成物。
〔29〕食品である、前記〔21〕〜〔26〕いずれかに記載の発現抑制用組成物。
〔30〕食品が保健機能食品またはダイエタリーサプリメントである、前記〔29〕に記載の発現抑制用組成物。
〔31〕保健機能食品が特定保健用食品または栄養機能食品である、前記〔30〕に記載の発現抑制用組成物。
〔32〕前記〔27〕または〔28〕に記載の組成物を、それを必要とする対象に投与することを含む、対象におけるNF−κBを介したVCAM−1および/またはMCP−1の発現を抑制する方法。
〔33〕NF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物を製造するためのセロトニン誘導体の使用。
〔34〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔33〕に記載の使用。
〔35〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔33〕に記載の使用。
〔36〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔33〕に記載の使用。
〔37〕セロトニン誘導体が植物から抽出されたものである、前記〔33〕〜〔36〕いずれかに記載の使用。
〔38〕前記植物が紅花の種子である、前記〔37〕に記載の使用。
〔39〕前記〔27〕または〔28〕に記載の組成物、および当該組成物をNF−κBを介したVCAM−1および/またはMCP−1の発現抑制に使用することができること、または使用すべきであることを記載した記載物を含む、商業用パッケージ。
〔40〕NF−κBを介したVCAM−1および/またはMCP−1の発現に起因する状態の予防または改善に用いられるという表示を付した、前記〔30〕または〔31〕に記載の発現抑制用組成物。
〔41〕セロトニン誘導体を含有してなる抗炎症用組成物。
〔42〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔41〕に記載の抗炎症用組成物。
〔43〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔41〕に記載の抗炎症用組成物。
〔44〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔41〕に記載の抗炎症用組成物。
〔45〕前記セロトニン誘導体が植物から抽出されたものである、前記〔41〕〜〔44〕いずれかに記載の抗炎症用組成物。
〔46〕前記植物が紅花の種子である、前記〔45〕に記載の抗炎症用組成物。
〔47〕医薬である、前記〔41〕〜〔46〕いずれかに記載の抗炎症用組成物。
〔48〕炎症性腸疾患の治療または予防のために用いられる、前記〔47〕に記載の抗炎症用組成物。
〔49〕食品である、前記〔41〕〜〔46〕いずれかに記載の抗炎症用組成物。
〔50〕食品が保健機能食品またはダイエタリーサプリメントである、前記〔49〕に記載の抗炎症用組成物。
〔51〕保健機能食品が特定保健用食品または栄養機能食品である、前記〔50〕に記載の抗炎症用組成物。
〔52〕前記〔47〕または〔48〕に記載の抗炎症用組成物を、それを必要とする対象に投与することを含む、対象における炎症性疾患を治療または予防する方法。
〔53〕抗炎症用組成物を製造するためのセロトニン誘導体の使用。
〔54〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔53〕に記載の使用。
〔55〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔53〕に記載の使用。
〔56〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔53〕に記載の使用。
〔57〕前記セロトニン誘導体が植物から抽出されたものである、前記〔53〕〜〔56〕いずれかに記載の使用。
〔58〕前記植物が紅花の種子である、前記〔57〕に記載の使用。
〔59〕前記〔47〕または〔48〕に記載の組成物、および当該組成物を炎症性疾患の治療または予防に使用することができること、または使用すべきであることを記載した記載物を含む、商業用パッケージ。
〔60〕炎症性疾患の予防または改善に用いられるという表示を付した、前記〔50〕または〔51〕に記載の抗炎症用組成物。
〔61〕セロトニン誘導体を含有してなるNF−κB活性化抑制剤。
〔62〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔61〕に記載のNF−κB活性化抑制剤。
〔63〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔61〕に記載のNF−κB活性化抑制剤。
〔64〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔61〕に記載のNF−κB活性化抑制剤。
〔65〕前記セロトニン誘導体が植物から抽出されたものである、前記〔61〕〜〔64〕いずれかに記載のNF−κB活性化抑制剤。
〔66〕前記植物が紅花の種子である、前記〔65〕に記載のNF−κB活性化抑制剤。
〔67〕セロトニン誘導体を含有してなる、NF−κBを介したVCAM−1および/またはMCP−1の発現抑制剤。
〔68〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔67〕に記載の発現抑制剤。
〔69〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔67〕に記載の発現抑制剤。
〔70〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔67〕に記載の発現抑制剤。
〔71〕セロトニン誘導体が植物から抽出されたものである、前記〔67〕〜〔70〕いずれかに記載の発現抑制剤。
〔72〕前記植物が紅花の種子である、前記〔71〕に記載の発現抑制剤。
〔73〕セロトニン誘導体を含有してなる抗炎症剤。
〔74〕前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、前記〔73〕に記載の抗炎症剤。
〔75〕前記セロトニン誘導体がフェルロイルセロトニンである、前記〔73〕に記載の抗炎症剤。
〔76〕前記セロトニン誘導体がp−クマロイルセロトニンである、前記〔73〕に記載の抗炎症剤。
〔77〕前記セロトニン誘導体が植物から抽出されたものである、前記〔73〕〜〔76〕いずれかに記載の抗炎症剤。
〔78〕前記植物が紅花の種子である、前記〔77〕に記載の抗炎症剤。
【図面の簡単な説明】
【0015】
【図1】図1は、ヒト大動脈内皮細胞においてセロトニン誘導体がNF−κBの活性化に及ぼす影響を調べた結果を示すグラフである。
【図2】図2は、ヒト大動脈内皮細胞においてセロトニン誘導体がROS産生の上昇を用量依存的に低下させることを調べた結果を示すグラフである。
【図3】図3は、ヒト大動脈内皮細胞においてセロトニン誘導体がVCAM−1(A)およびMCP−1(B)のmRNA発現に及ぼす影響をリアルタイムPCRで調べた結果を示すグラフである。
【図4】図4は、ヒト大動脈内皮細胞においてセロトニン誘導体がVCAM−1(A)およびMCP−1(B)のタンパク質発現誘導に及ぼす影響を免疫染色で調べた結果を示すグラフである。
【図5】図5は、セロトニン誘導体がヒト大動脈内皮細胞上への単球接着に及ぼす影響を細胞数の計測により調べた結果を示すグラフである。
【図6】図6は、セロトニン誘導体がヒト大動脈内皮細胞上への単球接着に及ぼす影響を蛍光標識により調べた結果を示すグラフである。
【図7】図7は、セロトニン誘導体が単球の遊走能に及ぼす影響を細胞数の計測により調べた結果を示すグラフである。
【図8】図8は、セロトニン誘導体が単球の遊走能に及ぼす影響を蛍光標識により調べた結果を示すグラフである。
【図9】図9は、セロトニン誘導体を摂取したマウスにおける血漿中のsVCAM−1レベルを調べた結果を示すグラフである。
【図10】図10は、セロトニン誘導体を摂取したヒトボランティアにおける血清中のsVCAM−1(A)およびMCP−1(B)レベルを調べた結果を示すグラフである。
【図11】図11は、FS、およびベニバナ種子抽出物(SSE)がIBDモデルマウス(IL-10欠損細胞移入SCIDマウス)の大腸腸管長(A)、大腸重量(B)、単位長あたりの大腸重量(C)に及ぼす影響を示すグラフである。
【図12】図12は、FS、およびベニバナ種子抽出物(SSE)がIBDモデルマウス(IL-10欠損細胞移入SCIDマウス)の白血球数(A)、血小板数(B)、好中球数(C)、単球数(D)に及ぼす影響を示すグラフである。
【図13】図13は、FS、およびベニバナ種子抽出物(SSE)がIBDモデルマウス(IL-10欠損細胞移入SCIDマウス)の血中NOx濃度に及ぼす影響を示すグラフである。
【図14】図14は、FS、およびベニバナ種子抽出物(SSE)がIBDモデルマウス(IL-10欠損細胞移入SCIDマウス)の大腸病理組織における影響を示す写真である。
【図15】図15は、FS、およびベニバナ種子抽出物(SSE)がIBDモデルマウス(IL-10欠損細胞移入SCIDマウス)の大腸組織におけるIL-1β、TNFαの遺伝子発現に及ぼす影響を示すグラフである。
【発明を実施するための形態】
【0016】
本発明は、有効成分としてセロトニン誘導体を含有するNF−κB活性化抑制用組成物に関するものである。既に背景技術の欄でも述べたように、炎症性疾患の発症、増悪の過程には、各種の炎症性メディエーター(炎症性サイトカイン、接着因子、白血球走化因子、プロスタグランジン類など)の産生が関与している。これらの炎症性メディエーターの産生に関わる遺伝子の多くは、その発現過程にNF−κBの活性化というプロセスを共有していることが知られている。また、HIV、HTLV−1やサイトメガロウイルスなどは、自己の複製の過程でNF−κBの活性化を必要とする。また、各種サイトカインの発現誘導にもNF−κBの活性化が関与している。したがって、NF−κBの活性化を抑制する物質は、多くの炎症性疾患、ウイルス感染、腫瘍の転移、免疫疾患などの発症および進展を抑制する可能性がある。
【0017】
炎症性疾患としては、例えば、心筋梗塞、ウイルス性脳炎、関節炎(慢性関節リウマチ、変形性関節炎など)、乾癬、炎症性腸疾患、肺高血圧、敗血症、II型糖尿病、肝線維症、腎硬化症、子宮内膜症などがあげられる。
【0018】
ウイルス感染としては、例えば、エイズ、成人T細胞白血病、ヘルペスウイルス、EBウイルスなどがあげられる。
【0019】
腫瘍の転移としては、例えば、悪性腫瘍(メラノーマ、大腸癌、乳癌等)の転移があげられる。
【0020】
免疫疾患としては、例えば、アレルギー(気管支喘息、アレルギー性鼻炎など)、同種移植拒絶反応などがあげられる。
【0021】
本発明は、NF−κBの活性化が深く関与していると考えられる上記疾患および障害を予防、改善または治療するために、セロトニン誘導体を用いる方法を提供するものである。ただし、NF−κBの活性化に応答する疾患および障害は、ここにあげたものに限定されない。なお、本明細書および請求の範囲にいうセロトニン誘導体は、製品化上許容し得る塩を含有する概念であり、塩としては、酸付加塩、例えば無機酸付加塩(塩酸塩、臭化水素酸塩、硫酸塩、燐酸塩など)、有機酸付加塩(蟻酸塩、酢酸塩、トリフルオロ酢酸塩、マレイン酸塩、酒石酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩、トルエンスルホン酸塩など)、アミノ酸との塩(アスパラギン酸塩、グルタミン酸塩など)、金属塩、例えばアルカリ金属塩(ナトリウム塩、カリウム塩など)およびアルカリ土類金属塩(カルシウム塩、マグネシウム塩など)などがあげられる。
【0022】
本発明における「NF−κB活性化抑制」とは、NF−κBの核内への移行を抑制することをいう。NF−κBの核内への移行の抑制については、実施例1に記載の方法により確認することができる。すなわち、ヒト大動脈内皮細胞の培養液中に被験物質を添加し、所定の時間インキュベートした後、グルコースで刺激した前記細胞から核を抽出し、核内に移行した活性化NF−κB(p65)を検出する。NF−κBが活性化されていないグルコース刺激前の細胞を陰性対照とし、被験物質を添加しないでグルコースで刺激した細胞を陽性対照として、前記p65の検出程度が陽性対照よりも陰性対照に近い場合、NF−κB活性化抑制であると判断する。
【0023】
本発明のNF−κB活性化抑制用組成物に含まれるセロトニン誘導体としては、例えば下記の式で表される化合物(I)が例示される。
【0024】
【化1】

【0025】
(式中、R1、R2、R3、およびR4は、それぞれ独立に水素原子、炭素数1〜3のアルキル基、または糖を表し、n、m、およびlは0または1を表す)本明細書において、炭素数1〜3のアルキル基は、メチル、エチル、n−プロピル、i−プロピルがあげられる。糖としては、グルコース、マンノース、ガラクトース、フコース、ラムノース、アラビノース、キシロース、フルクトース、ルチノース、ガラクツロン酸、グルクロン酸、ネオヘスペリドースなどがあげられる。好ましい化合物としてはヒドロキシ桂皮酸のセロトニンアミドが例示される。
【0026】
ヒドロキシ桂皮酸としては、p-クマル酸、フェルラ酸、カフェ酸が好適なものとしてあげられ、そのセロトニンアミドとしては、N-(p−クマロイル)セロトニン(あるいはp−クマリルセロトニン、またはp−クマロイルセロトニン)、N-フェルロイルセロトニン(あるいはフェルリルセロトニン、またはフェルロイルセロトニン)、カフェオイルセロトニンが例示される。
【0027】
本発明で使用されるセロトニン誘導体は配糖体であってもよい。ここで配糖体とは、式(I)におけるR1にグルコースがβグルコシド結合したO-β-D-グルコピラノシドなどが例示されるが、これに限定されるものではない。
【0028】
セロトニン誘導体は、上記化合物の1種を単独で、あるいは2種以上の化合物を併用して、使用することができる。
【0029】
セロトニン誘導体は、化学的に合成することにより、また天然物から抽出することにより調製可能である。
【0030】
当該化合物は自体既知のものであり、その合成には自体既知の方法を採用すればよい。好適な具体例としては、後述の試験例1に記載の方法があげられる。
【0031】
天然物から抽出する場合には、原料としては様々な植物組織が用いられる。例えば、紅花やヤグルマギクをはじめとするキク科植物、特にその種子、クロヒエやコンニャクイモ等の特にその穀粒、塊茎などがあげられるが、好ましくは紅花の種子、あるいはその脱脂粕である。本発明において植物種子とは、植物種子を構成する全体、あるいはその一部、例えば、種皮、胚乳、胚芽等を取り出したものでもよく、それらの混合物であってもよい。これらのものからの抽出方法としては、例えば、下記の如き方法があげられる。
【0032】
植物組織は、通常脱脂物(ミール)として抽出に供される。脱脂物は自体公知の方法により、例えば植物種子等の植物組織を脱脂して得ることができるが、例えば種子を圧搾抽出するかまたは種子の破砕物にn−ヘキサン等を加えて抽出した後、抽出系から固形分を取り出し、該固形分を乾燥して得ることができる。脱脂程度は通常60重量%以上、好ましくは80重量%以上である。
【0033】
また、抽出方法としては、例えば以下の、原料である脱脂後の植物種子を水で洗浄後、有機溶媒で抽出する方法が例示される。
【0034】
水は、特に限定されず、例えば蒸留水、水道水、工業用水及びこれらの混合水等のいずれも用いることができる。水には、本発明の効果が得られる限り、他の物質、例えば無機塩(例えば塩化ナトリウム、塩化カリウム、塩化カルシウム等)、酸(例えば塩化水素、酢酸、炭酸、過酸化水素、リン酸等)、アルカリ(例えば水酸化ナトリウム、水酸化カリウム、炭酸水素ナトリウム等)等を含んでいてもよい。洗浄の際のpHは通常2〜9であり、好ましくは5〜7である。
【0035】
水の使用量は、総量として、原料である脱脂後の植物種子に対して、通常2〜100倍量(水容量/脱脂後の植物種子重量、以下同様)、好ましくは10〜40倍量である。
【0036】
洗浄は、自体公知の方法で、原料である脱脂後の植物種子と水とを接触させて行うことができる。例えば、脱脂後の植物種子を水に懸濁後、濾過して固形の洗浄処理物を回収する方法等があげられる。洗浄は、上記の量の水を、脱脂後の植物種子に一度にまたは複数回に分けて、または連続的に接触させて行ってもよい。接触させる際の温度は通常5〜45℃、好ましくは25〜35℃である。接触させる時間は通常10〜240分であり、好ましくは15〜60分である。
【0037】
上記のようにして得られた脱脂後の植物種子等の洗浄処理物から有機溶媒で抽出して植物種子等の抽出物を得ることができる。
【0038】
有機溶媒として、例えば、低級アルコール、アセトン、アセトニトリル及びそれらの混合溶媒等があげられるが、それらに限定されない。有機溶媒は、水を含んでいてもよく、含んでいなくてもよい。有機溶媒の濃度は、通常20〜95重量%、好ましくは50〜90重量%である。有機溶媒は抽出後の抽出物の濃縮、乾燥及び食品製造の点からは低級アルコールが好ましい。低級アルコールとして、例えば炭素数1〜4のアルコールがあげられ、具体的には例えば、メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール等があげられるが、これらに限定されない。低級アルコールは、食品製造の点からは、エタノールが好ましい。エタノールは、エタノール分を50重量%以上含む含水エタノールあるいは無水エタノールが好ましい。
【0039】
有機溶媒の使用量は、原料である脱脂後の植物種子の通常2〜40倍量(有機溶媒容量/脱脂後の植物種子重量、以下同様)、好ましくは2〜10倍量である。抽出温度は通常20〜75℃、好ましくは50〜70℃である。抽出時間は通常10〜240分、好ましくは60〜120分である。
【0040】
抽出後、懸濁液より濾過等により固形分を分離して得られた抽出液は、そのまま、または必要により濃縮、乾燥して本発明の植物種子抽出物として用いることができる。濃縮、乾燥は抽出液そのままを濃縮、乾燥してもよく、賦形剤(例えば乳糖、ショ糖、デンプン、サイクロデキストリン等)を添加して実施してもよい。上記の溶媒で抽出された抽出物は、その純度で、本発明に供してもよいが、更に自体公知の方法により精製しても良い。
【0041】
更に純度を上げるための一例を記載するが、これに限定されない。上述の溶媒抽出物の有機溶媒を減圧留去し、水を加え、抽出物を水に懸濁し、水相を非極性溶媒、例えば、n−ヘキサン、n−ヘプタン、n−オクタン等で、好ましくはn−ヘキサンで洗浄し、洗浄後の水層を、二層に分かれて目的の組成物を抽出できる溶媒、例えば、酢酸エステルやn−ブタノールなど、好ましくは、酢酸エチル、酢酸メチル、酢酸プロピル等で抽出する。次いで、抽出液を飽和食塩水等で洗浄し、有機層を得る。酢酸エステルで抽出した場合、該有機層を、例えば、無水硫酸マグネシウム等で、脱水し、次いで減圧濃縮して、固形物(組成物)を得る。以上のどの段階で、精製を止めても良いし、いずれかの工程を省いても良いし、改変を加えても良いし、更に精製を進めても良い。上記溶媒の種類を変えることも含めて多段抽出法や向流分配法なども用いることができる。
【0042】
本発明で使用されるセロトニン誘導体、とりわけN-(p-クマロイル)セロトニン、およびN-フェルロイルセロトニンは、細胞内の酸化ストレスを抑制することにより、NF−κBの活性化を抑制し、その核内移行を抑制する。その結果、NF−κBの制御下にあるVCAM−1やMCP−1遺伝子などの発現が転写レベルで抑制され、それらの遺伝子産物の過剰産生が抑制され、抗炎症的に作用するものと考えられる。N-(p-クマロイル)セロトニン(p-クマロイルセロトニン)、およびN-フェルロイルセロトニン(フェルロイルセロトニン)は、以下の構造式で表される。
【0043】
【化2】

【0044】
別の側面では、本発明は、セロトニン誘導体を含有するNF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物にも関する。当該組成物は、上述した多くの炎症性疾患、ウイルス感染、腫瘍の転移、免疫疾患の中でも、特に、炎症性腸疾患、肺高血圧症、関節リウマチ、肝線維症などの難治性炎症性免疫疾患、臓器移植後の動脈硬化、腎硬化症、子宮内膜症、気管支喘息またはアレルギー性鼻炎の改善または予防が期待される。
【0045】
本発明の組成物は、前記セロトニン誘導体を有効成分とし、賦形剤(例えば、乳糖、ショ糖、デンプン、サイクロデキストリン等)、場合によっては、香料、色素、調味料、安定剤、防腐剤等も含有するものであり、錠剤、丸剤、顆粒、細粒、粉末、ペレット、カプセル、溶液、乳液、懸濁液、シロップおよびトローチ等に製剤化して、食品(食品組成物)や医薬製剤(医薬組成物)として用いることができる。
【0046】
本発明の組成物中に含まれるセロトニン誘導体の量は、本発明の効果を奏する限り特に限定されるものではないが、通常、0.0001〜99.9重量%であり、好ましくは0.001〜99.5重量%であり、より好ましくは0.005〜99重量%である。
【0047】
特に、医薬として使用する場合、医薬として許容できる担体(添加剤も含む)と共に製剤化することができる。医薬として許容できる担体としては、例えば、賦形剤(例えば、乳糖、ショ糖、デキストリン、ヒドロキシプロピルセルロース、ポリビニルピロリドン等)、崩壊剤(例えば、デンプン、カルボキシメチルセルロース等)、滑沢剤(例えば、ステアリン酸マグネシウム等)、界面活性剤(例えば、ラウリル硫酸ナトリウム等)、溶剤(例えば、水、食塩水、大豆油等)、保存剤(例えば、p-ヒドロキシ安息香酸エステル等)などがあげられるが、これらに限定されるものではない。
【0048】
本発明の「食品」は、食品全般を意味するが、いわゆる健康食品を含む一般食品の他、厚生労働省の保健機能食品制度に規定される特定保健用食品や栄養機能食品等の保健機能食品をも含むものであり、さらにダイエタリーサプリメント(サプリメント、栄養補助食品)、飼料、食品添加物等も本発明の食品に包含される。
【0049】
食品用途の場合、セロトニン誘導体を、例えば、ドレッシング、マヨネーズ等の一般食品(いわゆる健康食品を含む)に含有させて用いることもできる。また、セロトニン誘導体を、賦形剤(例えば、乳糖、ショ糖、デンプン等)、場合によっては、香料、色素等と共に、錠剤、丸剤、顆粒、細粒、粉末、ペレット、カプセル、溶液、乳液、懸濁液、シロップ及びトローチ等に製剤化して、特定保健用食品や栄養機能食品等の保健機能食品、サプリメントとして用いることができる。また、本発明の組成物は、飼料用途にも適用することができ、家禽や家畜等には、通常の飼料に添加して摂取または投与することができる。
【0050】
本発明のNF−κB活性化抑制用組成物は、含有するセロトニン誘導体の生物学的作用を有効に発揮させるためには、特定保健用食品または栄養機能食品として用いられることが好ましく、その際、「NF−κB活性化に起因する状態の予防または改善に用いられる」という表示を付すことが推奨される。
【0051】
本発明のVCAM−1および/またはMCP−1の発現抑制用組成物は、含有するセロトニン誘導体の生物学的作用を有効に発揮させるためには、特定保健用食品または栄養機能食品として用いられることが好ましく、その際、「NF−κBを介したVCAM−1および/またはMCP−1の発現に起因する疾患の改善または予防のために用いられる」という表示を付すことが推奨される。
【0052】
本発明の抗炎症用組成物は、含有するセロトニン誘導体の生物学的作用を有効に発揮させるためには、特定保健用食品または栄養機能食品として用いられることが好ましく、その際、「炎症性疾患の改善または予防のために用いられる」という表示を付すことが推奨される。
【0053】
本発明の組成物の対象は、ヒトを含む動物(ヒト、ウシ、ブタ、イヌ、ネコ等の哺乳類、ニワトリ等の鳥類等)である。また、本発明の組成物が標的とする細胞は、単球以外の細胞であれば特に限定されるものではないが、VCAM−1および/またはMCP−1が高発現している細胞、具体的には、血管内皮細胞、血管平滑筋細胞、腎糸球体細胞が好適な例としてあげられる。また、本発明の組成物が対象とするエフェクター細胞は、単球、マクロファージ、好中球、好酸球、好塩基球などの顆粒球、キラーT細胞などのリンパ球、ナチュラルキラー細胞、肥満細胞、樹状細胞などがあげられる。
【0054】
本発明の組成物の摂取または投与方法は、摂取または投与対象の年齢、体重、健康状態によって異なるが、例えば、健康の維持・増進や疾患の予防を目的とする場合は、通常、食品の形態にして経口的に摂取し、一方、疾患の治療や健康回復を目的とする場合には、通常、医薬品、または食品の形態にして、経口的、または注射、外用剤などにより投与する。用量としては、合成したセロトニン誘導体を投与する場合、成人1日当たり0.2mg〜2g、好ましくは20mg〜2gを1日1回から数回に分けて摂取、または服用することが好ましい。また、実施例6または実施例8の紅花種子抽出物を経口的に摂取する場合、成人1日当たり1mg〜10g、好ましくは、100mg〜10gを1日1回から数回に分けて摂取、または服用することが好ましい。この場合、一日あたりの摂取量または1回あたりの摂取量を一単位包装とすることができる。
【0055】
本発明の組成物中に含まれるセロトニン誘導体は、上述のように動物に摂取または投与された後、その血中濃度が一定期間一定のレベルを維持していることが好ましい。血中濃度としては、本発明の効果を奏する限り特に限定されるものではないが、通常50μM未満であり、好ましくは0.1〜10,000nM、より好ましくは1〜5,000nM、さらにより好ましくは100〜1,000nMが推奨される。
【0056】
セロトニン誘導体は、様々な植物の種子や塊茎などに含まれており、とりわけ紅花種子に多く含まれている。韓国では古来、紅花種子は骨折治癒促進、骨粗鬆症予防などの用途で、民間で用いられており、安全性は高いと考えられる。実施例9の結果も、本発明の組成物の毒性が低く、副作用がほとんど認められないことを裏付けている。
【実施例】
【0057】
以下に実施例等をあげて本発明をより具体的に例示するが、本発明はこれらの実施例等に限定されるものではない。
試験例1(セロトニン誘導体の合成)
p−クマロイルセロトニン(CS)、およびフェルロイルセロトニン(FS)を以下の方法で合成した。
【0058】
CS:セロトニン塩酸塩をジメチルホルムアミド(5mL/g vs.セロトニン塩酸塩、以下同様)およびジクロロメタン(20mL/g)で溶解後、trans−4−クマル酸(1.0モル/モル)、1−ヒドロキシベンゾトリアゾール水和物(HOBt)、1−[3−(ジメチルアミノ)プロピル]−エチル−カルボジイミド ヒドロクロリド(EDC)およびトリエチルアミンを各1.1等量加え、室温で終夜攪拌し反応させた。反応液を減圧濃縮後、酢酸エチルと水(各40mL/gセロトニン量)を加え、酢酸エチル抽出を行った。3回の酢酸エチル抽出により得た抽出相を5%クエン酸水溶液、飽和炭酸水素ナトリウム水溶液および飽和食塩水で順次洗浄後、無水硫酸ナトリウムで脱水した。乾燥剤を除去した抽出液を減圧濃縮し、酢酸エチル−エタノール(10:0.6)にて晶析後、得られた結晶を酢酸エチルで洗浄し、乾燥させ、CSを得た(収率=69.8%)。
【0059】
FS:セロトニン塩酸塩とtrans−4−フェルラ酸より上記CSと同様の方法で合成したが、晶析はメタノール−クロロホルム(1:15)にて行った(収率69.2%)。
【0060】
実施例1(セロトニン誘導体(CS、FS)がNF−κBの活性化に及ぼす作用)
ヒト大動脈内皮細胞(HAEC)はクロネティクスより購入し、3〜4代継代培養(37℃、5%炭酸ガス雰囲気下)したものを実験に用いた。培養ディッシュ(100mmφ)中で、CSおよびFS(各5および10μM)と24時間プレインキュベートした後、25mMのグルコースで2時間刺激した。Nuclear Extract Kit (アクティブモチーフ)を用いて細胞より核を抽出し、TransAM NF−κB p65 Kit (アクティブモチーフ)を用いて核内に移行した活性化NF−κB(p65)を検出した。
【0061】
図1に示したように、2時間の高濃度グルコース処理により、p65の核内移行は顕著に増加し、NF−κBの著明な活性化が認められたが、5および10μMのCSまたはFSの前処理により、p65の核内移行は有意に抑制された。このことから、セロトニン誘導体はヒト大動脈内皮細胞におけるNF−κBの活性化を抑制することが示された。
【0062】
NF−κB活性化抑制機序を調べるため、上記と同様にセロトニン誘導体を前処理したHAEC細胞を25mMグルコースで1時間刺激し、細胞内の活性酸素(ROS)産生に基づく蛍光強度を、Takahashi Mら、Free Radic. Biol. Med. 31:164-174 (2001)の方法に従って測定したところ、高濃度グルコース刺激によるROS産生の上昇を、セロトニン誘導体は用量依存的に低下させることが判明した(図2)。このことから、セロトニン誘導体は、細胞内酸化ストレスを抑制することにより、NF−κBの活性化とそれに引き続いて起こるNF−κBの核内移行を抑制することが示された。
【0063】
実施例2(セロトニン誘導体(CS、FS)がVCAM−1およびMCP−1の遺伝子発現に及ぼす作用)
10μMのCSまたはFSで24時間前処理したHAEC細胞を25mMグルコースで3時間刺激した後、トータルRNAをIsogenキット(ニッポンジーン)を用いて抽出した。1μgのRNAから、100U/mLの逆転写酵素(タカラバイオ)と0.1μMのオリゴ(dT)-アダプター(タカラバイオ)(反応液総量50μL)を用いてcDNAを合成した(42℃、40分)。リアルタイムPCRは7300 Real Time PCR system (アプライドバイオシステムス)を用いて行い、SYBER Green Iを用いてPCR産物を検出した。
【0064】
PCR反応組成(RT-PCRキット、タカラバイオ):12.5μL Premix Ex Taq、2.5μL SYBER Green I、合成プライマー、ROX reference dye、cDNA(20ngのトータルRNAに相当)、最終反応容量25μL
プライマーは以下の配列のものを用いた。
VCAM−1遺伝子の検出:
5’-CCCTTGACCGGCTGGAGATT-3’(センス)(配列番号1)
5’-CTGGGGGCAACATTGACATAAAGTG-3’(アンチセンス)(配列番号2)
MCP−1遺伝子の検出:
5’-CGCCTCCAGCATGAAAGTCT-3’(センス)(配列番号3)
5’-GGAATGAAGGTGGCTGCTATG-3’(アンチセンス)(配列番号4)
GAPDH(内部標準)遺伝子の検出:
5’-ACCACAGTCCATGCCATCAC-3’(センス)(配列番号5)
5’-TCCACCACCCTGTTGCTGTA-3’(アンチセンス)(配列番号6)
PCRは以下の条件で実施した。
熱変性:95℃で15秒、伸長反応:40サイクル(95℃で3秒、60℃で31秒)
VCAM−1およびMCP−1 mRNAの発現量は、GAPDHを内部標準として求めた。
【0065】
図3A、Bに示したように、高濃度グルコース刺激により、VCAM−1およびMCP−1 mRNAのHAEC細胞における発現量は共に未処理細胞の約3倍に上昇したが、CS、FSはいずれもその上昇を有意に抑制した。このことから、セロトニン誘導体はヒト大動脈内皮細胞を高グルコースで刺激した際のVCAM−1およびMCP−1の発現を転写レベルで抑制することが示された。実施例1の結果から、セロトニン誘導体は、NF−κBの活性化を抑制することにより、高グルコース刺激によって誘導されるこれらの遺伝子の転写を抑制したものと考えられた。
【0066】
実施例3(セロトニン誘導体(CS、FS)がVCAM−1およびMCP−1タンパク質発現に及ぼす作用)
96穴マイクロプレート上でコンフルエントになるまで増殖させたHAEC細胞を0.1〜10μMのセロトニン誘導体と24時間プレインキュベートした後、25mMグルコースで4時間刺激した。細胞層をHanks液で洗った後、抗VCAM−1モノクローナル抗体(ベクトンディキンソン)を添加して37℃、1時間インキュベートし、洗浄後、二次抗体(ペルオキシダーゼ標識抗マウスIgGヤギF(ab’)2フラグメント;カッペル)と1時間インキュベートした。発色基質(ο−フェニレンジアミン2塩酸塩)を添加して約30分後(室温)、各ウエルの吸光度(492nm)をマイクロプレートリーダーで定量した。一方、培地中のMCP−1濃度は、Human MCP-1 Immunoassay Kit (バイオソースインターナショナル)を用いて定量した。
【0067】
図4A、Bに示したように、高濃度グルコース刺激により細胞膜上のVCAM−1の発現、および培地中へのMCP−1分泌は、未処理時のそれぞれ2倍弱、約3.5倍に上昇したが、CSおよびFSは共に用量依存的にこれらの発現誘導を抑制した。このことから、セロトニン誘導体は、ヒト大動脈内皮細胞を高グルコースで刺激した際のVCAM−1およびMCP−1の発現誘導を抑制することがタンパク質レベルで示された。
【0068】
実施例4(セロトニン誘導体(CS、FS)がHAEC細胞上への単球接着に及ぼす作用)
24穴マルチウエルプレートにてコンフルエントまで増殖させたHAEC細胞をCS、およびFS(各5および10μM)と24時間プレインキュベートした後、25mMグルコースで4時間刺激した。細胞層をHanks液で洗浄後、U−937単球細胞(ATCCより購入)の懸濁液(1×106/mL)を200μL添加して、37℃で30分間インキュベートした。再び洗浄後、1%パラホルムアルデヒドで細胞を固定し、HAEC上に接着したU−937細胞数を顕微鏡下で計測した(20視野)。実験は3回行い、結果はそれらの平均値で表した。蛍光標識したU−937細胞を用いた実験も同様に実施した。具体的には、10μMの2’,7’−ビス(2−カルボキシエチル)−5(6)−カルボキシフルオレセインアセトキシメチルエステル (BCECF−AM、モレキュラープローブス)存在下でU−937細胞をインキュベート(37℃、1時間)後、遠心により細胞を洗浄した。蛍光標識されたU−937細胞(1×106/mL)をHAEC細胞に添加し、37℃、1時間インキュベートした。浮遊しているU−937細胞を除去後、プレートをPBS緩衝液で洗浄し、1% Triton Xで2時間処理した。接着した細胞の蛍光量を蛍光プレートリーダー(バイオラッド・フルオロマーク)を用いて定量した(Ex.503nm、Em.525nm)。
【0069】
図5に示したように、高濃度のグルコース刺激により、HAEC細胞上に接着したU−937細胞数は著明に増加したが、CSおよびFSとのプレインキュベーションにより、接着した細胞数はセロトニン誘導体の用量依存的に減少した。同様の結果は、蛍光標識したU−937細胞を用いた蛍光強度アッセイによっても確認された(図6)。これらのことから、セロトニン誘導体は、高濃度グルコース刺激により誘導される単球の内皮細胞上への接着を抑制することが示された。実施例2、実施例3および高濃度グルコース刺激HAECにおけるU−937細胞の接着は、抗VCAM−1モノクローナル抗体の添加により抑制された(データ示さず)ことから、セロトニン誘導体が内皮細胞上のVCAM−1発現誘導を抑制した結果であると考えられた。
【0070】
実施例5(セロトニン誘導体(CS、FS)が単球の遊走能に及ぼす作用)
単球の遊走能はトランスウエルシステム(ポアサイズ3μm;BDバイオサイエンス)を用いて行った。24マルチウエルプレート中に設置したトランスウエル上で培養したHAECを5、および10μMのセロトニン誘導体と24時間プレインキュベートした後、25mMのグルコースで4時間刺激した。U−937細胞懸濁液(106細胞/mL)200μLをトランスウエル内に添加し、そのまま37℃で2時間インキュベートした。メンブレンを通過してトランスウエル下部に遊走してきた細胞の数を検鏡下でカウントした(20視野)。実験は3回繰り返し、結果はそれらの平均値で表した。蛍光標識したU−937細胞を用いた実験も同様に実施した。上述した方法でBCECF−AM標識したU−937細胞をトランスウエル上部に播種して37℃、2時間インキュベートした。メンブレンを通過してトランスウエル下部に遊走してきた細胞を1mLのPBS緩衝液に回収し、1% Triton Xで2時間処理した。遊走細胞由来の蛍光を蛍光プレートリーダー(バイオラッド フルオロマーク)を用いて定量した(Ex.503nm、Em.525nm)。
【0071】
インキュベート(37℃、1時間)後、遠心操作により細胞を洗浄した。蛍光標識されたU−937細胞(1×106/mL)をHAEC細胞に添加し、37℃、1時間インキュベートした。浮遊しているU−937細胞を除去後、プレートをPBS緩衝液で洗浄し、1% Triton Xで2時間処理した。接着した細胞の蛍光量を蛍光プレートリーダー(バイオラッド フルオロマーク)を用いて定量した(Ex.503nm、Em.525nm)。
【0072】
図7に示したように、HAEC細胞を高濃度グルコースで刺激することにより、内皮下に遊走するU−937細胞数が劇的に上昇したが、HAEC細胞をCSまたはFSとプレインキュベートすることにより、遊走細胞数は有意に減少した。同様の結果は、蛍光標識したU−937細胞を用いた蛍光強度アッセイによっても確認された(図8)。これらのことから、セロトニン誘導体は、高濃度グルコース刺激により誘導される単球の内皮下への遊走を抑制することが示された。実施例2および実施例3の結果から、セロトニン誘導体による単球の遊走抑制は、内皮細胞からのMCP−1産生を抑制した結果であると考えられた。
【0073】
実施例6(動物用ベニバナ種子抽出物の調製)
ベニバナ種子抽出物の調製を以下の方法で実施した。搾油後のベニバナ脱脂種子600gに3,000mLの90容量%エタノール水を加えて、60℃の湯浴中で3時間、加温、攪拌した後、ろ過した。ろ過後の固形分に対して同様の操作を1回行い、得られたろ過液を合一して減圧濃縮にて500mLの濃縮液を得た。濃縮液に水を加えて1,000mLとし、内容物を懸濁した後、500mLのn−ヘキサンにて2回洗浄し、洗浄後の水層を酢酸エチル500mLで2回抽出した。酢酸エチル抽出液を無水硫酸マグネシウムで脱水し、ろ過後減圧濃縮してベニバナ種子抽出物(SSE)10.1gを得た。この方法で得られた抽出物中の総セロトニン誘導体含量(アグリコン+配糖体)は24.1%(アグリコン換算では21.4%)であった。
【0074】
実施例7(セロトニン誘導体およびベニバナ種子抽出物の摂取がapoEノックアウトマウス血漿中のsVCAM−1レベルに及ぼす作用)
6〜7週齢の雄性apoEノックアウトマウス(ジャクソンラボラトリーより購入)を1群7〜10匹として、
1)対照(Control)、
2)セロトニン誘導体0.2%投与区(CS + FS (0.2);試験例1で合成されたCS、FS各0.1重量%含有)、
3)セロトニン誘導体0.4%投与区(CS + FS (0.4);試験例1で合成されたCS、FS各0.2%重量含有)、
4)FS 0.4%投与区(FS;試験例1で合成されたFSのみ0.4重量%含有)、
5)ベニバナ種子抽出物(SSE)1%投与区(SSE;実施例6で得たSSEを1重量%含有)の計5群に分け、表1に示すような組成の餌を15週間自由摂取させた。投与期間終了後、マウスをエーテル麻酔下、腹部大静脈より採血(抗凝固剤:EDTA−2K+ヘパリン)し、3,000rpm、15分の遠心操作を行い、血漿を回収した。血漿中の可溶性VCAM−1(sVCAM−1)濃度は、sVCAM−1測定ELISAキット”Mouse sVCAM-1/CD106 Quantikine ELISA Kit”(R&Dシステムス)を用いて測定した。
得られた値については各群間で分散分析を行い、Dunnett検定で試験食群の平均値を対照群のそれと比較した。
【0075】
図9に示したように、セロトニン誘導体を長期摂取させたapoEノックアウトマウスの血中sVCAM−1レベルは、いずれの群においても低下傾向を示した。SSEを摂取させた動物においては統計学的に有意に血中sVCAM−1レベルを低下させた。これらのことから、セロトニン誘導体、およびセロトニン誘導体を含むベニバナ種子抽出物はVCAM−1レベルを低下させることが動物レベルでも確認された。
【0076】
【表1】

【0077】
実施例8(ヒトボランティア試験用試験食の調製)
ベニバナ種子抽出物の調製を以下に記載した方法で実施した。脱脂ベニバナ種子100kgを2000Lの水にて30℃、30分間攪拌洗浄後固液分離を行い、得られた固形分に60容積%エチルアルコール−水を1500L加え、60℃に昇温後、同温にて60分間攪拌抽出した。同操作を3経路同時に実施して得た固液分離後の抽出液を合一し、ろ過助剤(KCフロック)を用いて圧搾濾過後、ろ過液中の固形分量と等量のγ-サイクロデキストリン(CAVAMAX W8 FOOD、シクロケム)の水溶液を加え、減圧下50〜60℃にて濃縮した。得られた濃縮液を88℃、1時間加熱殺菌及び、60℃、15時間の乾燥後、粉砕、篩分け(60メッシュ篩)し、ベニバナ種子抽出物粉末6kgを得た。一般成分分析結果は表2のとおりであった。このベニバナ種子抽出物粉末中の総ポリフェノール含量をFolin-Ciocalteau法で測定したところ、143mg/g抽出物粉末(p−クマロイルセロトニン当量)であった。HPLCで分析したところ、総セロトニン誘導体含量は138mg/g抽出物粉末(13.8重量%)であった。結果を表3に示す。このことから、セロトニン誘導体は本ベニバナ種子抽出物粉末中に含まれるフェノール類の主要成分であると考えられた。こうして調製したベニバナ種子抽出物粉末をハードカプセル充填機(ウルトラエイト、カプスゲル ジャパン)にてハードカプセルに充填した(1カプセルあたり210mgのベニバナ種子抽出物粉末、セロトニン誘導体として約29mgを含む)。
【0078】
【表2】

【0079】
【表3】

【0080】
実施例9(ベニバナ種子抽出物粉末の摂取がヒト血清中のsVCAM−1およびMCP−1レベルに及ぼす作用)
90名のボランティア男性の加速度脈波検査を事前に行い、加速度脈波加齢指数(血管年齢)が暦年齢よりも高く、かつ血圧、血中コレステロール、血糖制御に関する薬物治療を行っていない20名を被験者として選定した(平均暦年齢37.3±6.8歳、平均血管年齢48.1±8.1歳)。実施例8で調製した試験食カプセル10個(ベニバナ種子抽出物粉末2.1g(セロトニン誘導体として約290g))を1日2回(朝、夕食後30分以内、各5個ずつ)に分けて4週間毎日摂取させ、摂取開始直前(0週)、摂取終了時(4週)、および摂取終了後4週間(8週)の時点で採血を行い(午前中、空腹時採血)、血清を分離した。血清中のsVCAM−1およびMCP−1濃度は、臨床検査の受託機関に委託して分析した。
【0081】
試験食の摂取期間中において、試験食によって起因したと思われる症状の訴えは認められなかった。血液生化学パラメータ(血中脂質(総コレステロール、HDL-コレステロール、LDL-コレステロール、トリグリセリド)、および血糖、肝機能指標(GOT、GPT、LDH、γ-GTP総タンパク、アルブミン)、腎機能指標(尿素窒素、クレアチニン)、電解質(Na+、K+、Ca2+))についても、摂取前後で異常な変化は認められなかった。
【0082】
図10A、Bに示したように、4週間の試験食摂取により、ボランティア血清中のVCAM−1およびMCP−1は試験食摂取開始前に比べて有意に低下し、試験食摂取終了後4週間でほぼ摂取開始時点のレベルに戻ることが示された。これらの結果からベニバナ種子抽出物は安全性に特に問題は認められないこと、また、ヒトにおいてもVCAM−1およびMCP−1レベルを低下させることが明らかとなった。
【0083】
実施例10(FS、およびFSを含有するベニバナ種子抽出物(SSE)の炎症性腸疾患(IBD)モデルマウスに及ぼす作用)
炎症性腸疾患(IBD)モデルマウス(IL−10欠損細胞移入モデル)は、池上らの方法(Ikenoue Y.ら、Int. Immunopharmacol., 5, 993-1006 (2005):非特許文献12)に従い、IBDの発症(下痢、体重減少)が確認されたIL−10欠損マウス(ジャクソンラボラトリーより購入したIL−10-/-マウスをBALB/cマウス(日本チャールズリバー)と7世代バッククロスしたもの)から調製した脾臓、および腸間膜リンパ節細胞懸濁液(1〜3 x 107 cells /200μL)をSCIDマウス(CB-17/Icr SCID;日本クレア)の腹腔内に投与することによって作製した(本モデル動物において、細胞移入後2-3週間以内に腸管における慢性炎症が全例に発生し、臨床的にも効果が確認されている抗IBD剤(抗TNF受容体抗体(TNFR-Ig)やステロイド(プレドニゾロン))によって症状が改善されることが既に明らかにされている(非特許文献12))。
【0084】
IL-10欠損細胞移入4日前に計40匹のSCIDマウス(7週齢、♀)を下記の1)〜4)に示す4群(各群10匹)に分けると同時に対照食への馴化を開始し、細胞移入後直ちに飼料を表4に示す試験食に切り替え、3週間自由摂取させた。ベニバナ種子抽出物粉末は実施例8で示したものと同一であり、γ-サイクロデキストリンを50重量%含む。N-フェルロイルセロトニン(FS)は試験例1の方法で合成したものである。試験食摂取期間中は、週3回体重、摂餌量、飲水量の測定、および発症の有無を観察した。
【0085】
1) Normal群(正常SCIDマウス x 対照食)
2) Control群(IL-10欠損細胞移入SCIDマウス x 対照食)
3) SSE群(IL-10欠損細胞移入SCIDマウス x SSE食*)
4) FS群(IL-10欠損細胞移入SCIDマウス x FS食**)
* FS、およびp-クマロイルセロトニン(CS)を各々0.10、および0.13重量%(アグリコン換算)含有(総セロトニン誘導体含量=0.28重量%)
**FSアグリコン0.4重量%含有
【0086】
試験食摂取期間終了後、麻酔下にて採血し、摘出した大腸(盲腸〜肛門)の長さ、および重量(内容物洗浄後)を計測した。得られたデータについては、まずNormal群とControl群との間でt-検定を行い、試験の成立を確認した後、Control群とSSE、FS各群との間で分散分析を行い、被験物質による影響をDunnett検定にて比較した。
【0087】
表5に示したように、IL-10欠損細胞移入により増体は有意に抑制された。摂餌量、飲水量については、群間に有意差は認められなかった。一方、図11に示したように、IL-10欠損細胞移入によりControl群における大腸腸管長、大腸重量、および単位腸管長当たりの大腸重量はいずれも有意に増加した。また、図12に示したように、血中の白血球数、血小板数、好中球数、単球数がいずれも有意に増加していたことから、大腸炎の発生は明らかであった。SSE、およびFSを摂取させた動物においては、大腸重量、単位腸管長当たりの大腸重量ともにControl群よりも有意に低値を示した。また、いずれの群における血小板数もControl群より有意に低下した(本モデルにおいては、病態の進展と共に血小板数が上昇することが上記文献(非特許文献12)で示されている)。白血球数、好中球数、単球数については統計学的に有意ではなかったが、いずれもSSE群、FS群においてControl群よりも低下する傾向を示した。これらの結果は、SSE、およびFSの摂取が大腸炎を改善することを示している。
【0088】
【表4】

【0089】
【表5】

【0090】
炎症反応における白血球の活性化によって、大量のNOが細胞から産生され、代謝物であるNOxの血中濃度が上昇する。このことより、血中NOx濃度は生体における炎症反応の一つの指標となることが知られている(Yuka Ikenoue ら、International Immunopharmacology 5 (2005)993-1006)。実施例10より得た血液中のNOx濃度を「Nitric Oxide Quantitation Kit(ACTIVE MOTIF社)」にて測定したところ、図13に示すように、Control群はNormal群に比べて著明なNOx濃度の上昇を認めた。これに対し、SSE群では有意なNOx濃度の低下が、またFS群では統計学的な有意差は認めなかったものの、低下する傾向を示した。
【0091】
実施例10にて記載した試験において、終了時に大腸(盲腸〜肛門)の中央部から肛門側に約1cmずつ切り出していき、計3本の切片を得た。そのうち1本は10%ホルマリン溶液にて固定、2本は液体窒素にて凍結した。ホルマリン固定した大腸はパラフィン包埋後、薄切し横断の輪切り標本を作製した。標本はPAS(Periodic acid Schiff)染色法にて染色後、病理組織像の観察を実施した。一方凍結した大腸組織からISOGEN(株式会社ニッポンジーン)を用い、total RNAを抽出した。total RNA 2μgをSYBR ExScriptTM RT-PCR kit (TaKaRa)を用いて逆転写反応を行い、これを鋳型としてIL-1β、TNFαおよびGAPDHに対する定量リアルタイムPCRを行った。解析に用いたプライマーは以下のとおりである。
IL-1β:forward 5’- TCA CAG CAG CAC ATC AAC AA -3’(配列番号7)
reverse 5’- TGT CCT CAT CCT GGA AGG TC -3’(配列番号8)
TNFα:forward 5’- CCA CCA CGC TCT TCT GTC TA-3’(配列番号9)
reverse 5’-AGG GTC TGG GCC ATA GAA CT -3’(配列番号10)
GAPDH:forward 5’- CTG AGG ACC AGG TTG TCT CC -3’(配列番号11)
reverse 5’- ACC ACC CTG TTG CTG TAG CC -3’(配列番号12)
鋳型DNA 2μl、SYBR Premix Ex TaqTM (TaKaRa)10μl、ROX Reference Dye 0.4μl、100μM forward プライマー0.04μl、100μM reverse プライマー 0.04μl、滅菌水7.52μlを氷上で混合し、Applied Biosystems 7900HT Fast リアルタイムPCRシステムを用いて、95℃で10秒加熱後、95℃で5秒、60℃で34秒を40サイクル繰り返し、DNAを増幅した。GAPDHを内部標準として用い、IL-1βおよびTNFα発現量を評価した。
【0092】
図14に示したように、Control群では大腸粘膜上皮層の著明な肥厚、ならびに正常サイズの杯細胞数減少といった炎症性腸疾患特有の病理所見が認められた(Yuka Ikenoue ら、International Immunopharmacology 5 (2005)993-1006)。SSE群およびFS群ではControl群と比較して、大腸粘膜上皮層の肥厚抑制、および正常な杯細胞の増加といった所見が認められ、病理所見上においても改善効果が示された。さらに炎症性サイトカインであるIL-1β、TNFαの大腸組織におけるmRNA発現量に対し、SSE群およびFS群は、IL-1βではいずれもControl群に比べて有意な低下を示し、TNFαについてはSSE群では有意な低下を、FS群では低下の傾向を示した(図15)。
【0093】
血中NOxレベル、病理組織学的所見、および炎症サイトカインのmRNA発現量に対するSSE群およびFS群の効果は、大腸重量、単位腸管長当たりの大腸重量の低下といった作用が、大腸における炎症反応の抑制によるものであることを強く示すものである。
【産業上の利用可能性】
【0094】
本発明品により、NF−κB活性化抑制作用を介して広く炎症性疾患の予防または治療が可能となる。具体的には、慢性関節炎、乾癬、炎症性腸疾患、子宮内膜症などの疾患があげられ、特に、炎症性腸疾患の改善または予防が期待される。また、本発明品により、NF−κB活性化が関与する疾患の予防または治療が可能となる。具体的には、上述した炎症性疾患、ウイルス感染、腫瘍の転移、免疫疾患などの疾患があげられる。また、本発明品により、NF−κBを介したVCAM−1および/またはMCP−1の発現に起因する疾患の予防または治療が可能となる。具体的には、肺高血圧症、関節リウマチ、肝線維症などの難治性炎症性免疫疾患、臓器移植後の動脈硬化などの疾患があげられる。本発明品は、医薬品としての使用のほか、食品への適用も可能である。
【0095】
本出願は、日本で出願された特願2006−131770(出願日:2006年5月10日)を基礎としており、その内容は本明細書に全て包含されるものである。
【特許請求の範囲】
【請求項1】
セロトニン誘導体を含有してなるNF−κB活性化抑制用組成物。
【請求項2】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項1に記載のNF−κB活性化抑制用組成物。
【請求項3】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項1に記載のNF−κB活性化抑制用組成物。
【請求項4】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項1に記載のNF−κB活性化抑制用組成物。
【請求項5】
前記セロトニン誘導体が植物から抽出されたものである、請求項1〜4いずれかに記載のNF−κB活性化抑制用組成物。
【請求項6】
前記植物が紅花の種子である、請求項5に記載のNF−κB活性化抑制用組成物。
【請求項7】
医薬である、請求項1〜6いずれかに記載のNF−κB活性化抑制用組成物。
【請求項8】
NF−κB活性化に起因する疾患の治療または予防のために用いられる、請求項7に記載のNF−κB活性化抑制用組成物。
【請求項9】
食品である、請求項1〜6いずれかに記載のNF−κB活性化抑制用組成物。
【請求項10】
食品が保健機能食品またはダイエタリーサプリメントである、請求項9に記載のNF−κB活性化抑制用組成物。
【請求項11】
保健機能食品が特定保健用食品または栄養機能食品である、請求項10に記載のNF−κB活性化抑制用組成物。
【請求項12】
請求項7または8に記載のNF−κB活性化抑制用組成物を、それを必要とする対象に投与することを含む、対象におけるNF−κB活性化を抑制する方法。
【請求項13】
NF−κB活性化抑制用組成物を製造するためのセロトニン誘導体の使用。
【請求項14】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項13に記載の使用。
【請求項15】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項13に記載の使用。
【請求項16】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項13に記載の使用。
【請求項17】
前記セロトニン誘導体が植物から抽出されたものである、請求項13〜16いずれかに記載の使用。
【請求項18】
前記植物が紅花の種子である、請求項17に記載の使用。
【請求項19】
セロトニン誘導体を含有してなる、NF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物。
【請求項20】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項19に記載の発現抑制用組成物。
【請求項21】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項19に記載の発現抑制用組成物。
【請求項22】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項19に記載の発現抑制用組成物。
【請求項23】
セロトニン誘導体が植物から抽出されたものである、請求項19〜22いずれかに記載の発現抑制用組成物。
【請求項24】
前記植物が紅花の種子である、請求項23に記載の発現抑制用組成物。
【請求項25】
医薬である、請求項19〜24いずれかに記載の発現抑制用組成物。
【請求項26】
NF−κBを介したVCAM−1および/またはMCP−1の発現に起因する疾患の治療または予防のために用いられる、請求項25に記載の発現抑制組成物。
【請求項27】
食品である、請求項19〜24いずれかに記載の発現抑制用組成物。
【請求項28】
食品が保健機能食品またはダイエタリーサプリメントである、請求項27に記載の発現抑制用組成物。
【請求項29】
保健機能食品が特定保健用食品または栄養機能食品である、請求項28に記載の発現抑制用組成物。
【請求項30】
請求項25または26に記載の組成物を、それを必要とする対象に投与することを含む、対象におけるNF−κBを介したVCAM−1および/またはMCP−1の発現を抑制する方法。
【請求項31】
NF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物を製造するためのセロトニン誘導体の使用。
【請求項32】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項31に記載の使用。
【請求項33】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項31に記載の使用。
【請求項34】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項31に記載の使用。
【請求項35】
セロトニン誘導体が植物から抽出されたものである、請求項31〜34いずれかに記載の使用。
【請求項36】
前記植物が紅花の種子である、請求項35に記載の使用。
【請求項37】
セロトニン誘導体を含有してなる抗炎症用組成物。
【請求項38】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項37に記載の抗炎症用組成物。
【請求項39】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項37に記載の抗炎症用組成物。
【請求項40】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項37に記載の抗炎症用組成物。
【請求項41】
前記セロトニン誘導体が植物から抽出されたものである、請求項37〜40いずれかに記載の抗炎症用組成物。
【請求項42】
前記植物が紅花の種子である、請求項41に記載の抗炎症用組成物。
【請求項43】
医薬である、請求項37〜42いずれかに記載の抗炎症用組成物。
【請求項44】
炎症性腸疾患の治療または予防のために用いられる、請求項43に記載の抗炎症用組成物。
【請求項45】
食品である、請求項37〜42いずれかに記載の抗炎症用組成物。
【請求項46】
食品が保健機能食品またはダイエタリーサプリメントである、請求項45に記載の抗炎症用組成物。
【請求項47】
保健機能食品が特定保健用食品または栄養機能食品である、請求項46に記載の抗炎症用組成物。
【請求項48】
請求項43または44に記載の抗炎症用組成物を、それを必要とする対象に投与することを含む、対象における炎症性疾患を治療または予防する方法。
【請求項49】
抗炎症用組成物を製造するためのセロトニン誘導体の使用。
【請求項50】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項49に記載の使用。
【請求項51】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項49に記載の使用。
【請求項52】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項49に記載の使用。
【請求項53】
前記セロトニン誘導体が植物から抽出されたものである、請求項49〜52いずれかに記載の使用。
【請求項54】
前記植物が紅花の種子である、請求項53に記載の使用。
【請求項1】
セロトニン誘導体を含有してなるNF−κB活性化抑制用組成物。
【請求項2】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項1に記載のNF−κB活性化抑制用組成物。
【請求項3】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項1に記載のNF−κB活性化抑制用組成物。
【請求項4】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項1に記載のNF−κB活性化抑制用組成物。
【請求項5】
前記セロトニン誘導体が植物から抽出されたものである、請求項1〜4いずれかに記載のNF−κB活性化抑制用組成物。
【請求項6】
前記植物が紅花の種子である、請求項5に記載のNF−κB活性化抑制用組成物。
【請求項7】
医薬である、請求項1〜6いずれかに記載のNF−κB活性化抑制用組成物。
【請求項8】
NF−κB活性化に起因する疾患の治療または予防のために用いられる、請求項7に記載のNF−κB活性化抑制用組成物。
【請求項9】
食品である、請求項1〜6いずれかに記載のNF−κB活性化抑制用組成物。
【請求項10】
食品が保健機能食品またはダイエタリーサプリメントである、請求項9に記載のNF−κB活性化抑制用組成物。
【請求項11】
保健機能食品が特定保健用食品または栄養機能食品である、請求項10に記載のNF−κB活性化抑制用組成物。
【請求項12】
請求項7または8に記載のNF−κB活性化抑制用組成物を、それを必要とする対象に投与することを含む、対象におけるNF−κB活性化を抑制する方法。
【請求項13】
NF−κB活性化抑制用組成物を製造するためのセロトニン誘導体の使用。
【請求項14】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項13に記載の使用。
【請求項15】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項13に記載の使用。
【請求項16】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項13に記載の使用。
【請求項17】
前記セロトニン誘導体が植物から抽出されたものである、請求項13〜16いずれかに記載の使用。
【請求項18】
前記植物が紅花の種子である、請求項17に記載の使用。
【請求項19】
セロトニン誘導体を含有してなる、NF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物。
【請求項20】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項19に記載の発現抑制用組成物。
【請求項21】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項19に記載の発現抑制用組成物。
【請求項22】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項19に記載の発現抑制用組成物。
【請求項23】
セロトニン誘導体が植物から抽出されたものである、請求項19〜22いずれかに記載の発現抑制用組成物。
【請求項24】
前記植物が紅花の種子である、請求項23に記載の発現抑制用組成物。
【請求項25】
医薬である、請求項19〜24いずれかに記載の発現抑制用組成物。
【請求項26】
NF−κBを介したVCAM−1および/またはMCP−1の発現に起因する疾患の治療または予防のために用いられる、請求項25に記載の発現抑制組成物。
【請求項27】
食品である、請求項19〜24いずれかに記載の発現抑制用組成物。
【請求項28】
食品が保健機能食品またはダイエタリーサプリメントである、請求項27に記載の発現抑制用組成物。
【請求項29】
保健機能食品が特定保健用食品または栄養機能食品である、請求項28に記載の発現抑制用組成物。
【請求項30】
請求項25または26に記載の組成物を、それを必要とする対象に投与することを含む、対象におけるNF−κBを介したVCAM−1および/またはMCP−1の発現を抑制する方法。
【請求項31】
NF−κBを介したVCAM−1および/またはMCP−1の発現抑制用組成物を製造するためのセロトニン誘導体の使用。
【請求項32】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項31に記載の使用。
【請求項33】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項31に記載の使用。
【請求項34】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項31に記載の使用。
【請求項35】
セロトニン誘導体が植物から抽出されたものである、請求項31〜34いずれかに記載の使用。
【請求項36】
前記植物が紅花の種子である、請求項35に記載の使用。
【請求項37】
セロトニン誘導体を含有してなる抗炎症用組成物。
【請求項38】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項37に記載の抗炎症用組成物。
【請求項39】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項37に記載の抗炎症用組成物。
【請求項40】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項37に記載の抗炎症用組成物。
【請求項41】
前記セロトニン誘導体が植物から抽出されたものである、請求項37〜40いずれかに記載の抗炎症用組成物。
【請求項42】
前記植物が紅花の種子である、請求項41に記載の抗炎症用組成物。
【請求項43】
医薬である、請求項37〜42いずれかに記載の抗炎症用組成物。
【請求項44】
炎症性腸疾患の治療または予防のために用いられる、請求項43に記載の抗炎症用組成物。
【請求項45】
食品である、請求項37〜42いずれかに記載の抗炎症用組成物。
【請求項46】
食品が保健機能食品またはダイエタリーサプリメントである、請求項45に記載の抗炎症用組成物。
【請求項47】
保健機能食品が特定保健用食品または栄養機能食品である、請求項46に記載の抗炎症用組成物。
【請求項48】
請求項43または44に記載の抗炎症用組成物を、それを必要とする対象に投与することを含む、対象における炎症性疾患を治療または予防する方法。
【請求項49】
抗炎症用組成物を製造するためのセロトニン誘導体の使用。
【請求項50】
前記セロトニン誘導体がフェルロイルセロトニンおよびp−クマロイルセロトニンである、請求項49に記載の使用。
【請求項51】
前記セロトニン誘導体がフェルロイルセロトニンである、請求項49に記載の使用。
【請求項52】
前記セロトニン誘導体がp−クマロイルセロトニンである、請求項49に記載の使用。
【請求項53】
前記セロトニン誘導体が植物から抽出されたものである、請求項49〜52いずれかに記載の使用。
【請求項54】
前記植物が紅花の種子である、請求項53に記載の使用。
【図1】


【図2】


【図5】


【図10】


【図3】


【図4】


【図6】


【図7】


【図8】


【図9】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図5】


【図10】


【図3】


【図4】


【図6】


【図7】


【図8】


【図9】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2013−35858(P2013−35858A)
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願番号】特願2012−211013(P2012−211013)
【出願日】平成24年9月25日(2012.9.25)
【分割の表示】特願2008−514517(P2008−514517)の分割
【原出願日】平成19年5月9日(2007.5.9)
【出願人】(000000066)味の素株式会社 (887)
【Fターム(参考)】
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願日】平成24年9月25日(2012.9.25)
【分割の表示】特願2008−514517(P2008−514517)の分割
【原出願日】平成19年5月9日(2007.5.9)
【出願人】(000000066)味の素株式会社 (887)
【Fターム(参考)】
[ Back to top ]

