新規微生物及び該微生物を用いた 2,6−ナフタレンジカルボン酸の製造法
【構成】 本発明は、スフィンゴモナス属に属し、2,6−ジメチルナフタレンから2,6−ナフタレンジカルボン酸を生成することのできる2,6−ナフタレンジカルボン酸生成菌及びこの生成菌を用い、2,6−ジメチルナフタレンを溶解した有機溶媒と、培地からなる有機溶媒系培地において培養し、2,6−ナフタレンジカルボン酸を生成させることを特徴とする2,6−ナフタレンジカルボン酸あるいはその塩の製造法に関するものである。
【効果】 本発明の使用菌によれば、2,6−ジメチルナフタレンを溶液状で直接2,6−ナフタレンジカルボン酸に交換でき、その収率を著じるしく高めることができたものである。
【効果】 本発明の使用菌によれば、2,6−ジメチルナフタレンを溶液状で直接2,6−ナフタレンジカルボン酸に交換でき、その収率を著じるしく高めることができたものである。
【発明の詳細な説明】
【0001】
【産業上の利用分野】本発明はスフィンゴモナス属に属する新規微生物及び該微生物の休止菌体又は菌体由来の酵素を用いて2,6−ジメチルナフタレンを酸化し、2,6−ナフタレンジカルボン酸を製造する方法に関する。
【0002】
【従来の技術】2,6−ナフタレンジカルボン酸あるいは、そのエステル誘導体は高機能性樹脂原料、液晶原料、ポリアミド系医薬品原料、染料顔料用として有用な化合物であり、現在数種の化学合成法により生産されている。特にポリエチレンナフタレート(PEN)樹脂としての用途は、80〜90%とも言われており、現在のポリエチレンテレフタレート(PET)樹脂に比べ、耐熱温度で約35℃、破断強度も約25%高い他、二次転移点、結晶化速度、軟化点、溶融粘度等に対し、優れた性能を有するものとして大量生産化が期待されている。しかしながら、2,6−ジメチルナフタレンを原料とした化学合成法は、高温反応であるため官能基の転移が起こり易く、純度の高い2,6−ナフタレンジカルボン酸が得られにくい上、高温高圧条件を必要とし、大量のエネルギーを消費することや環境汚染等の問題点もあった。
【0003】これらの問題点を解決する方法として、近年、微生物を用いた微生物酸化法の研究が進められている。微生物を触媒とする酸化法は、常温常圧で反応させることができる上、官能基の転移が起こらないため副産物の生成がほとんど無いという優れた特徴を有している。しかし、これまでの報告では、■フラボバクテリウム属等の微生物を用いて、2,6−ジメチルナフタレンを酸化しても、一方のメチル基しか酸化されず、2,6−ナフタレンジカルボン酸は検出されなかった(E.A.BARNSLEY APPLIED AND ENVIRONMENTAL MICROBIOLOGY 54,428〜433,1988)。
【0004】又、■ノカルディア属細菌により、糖質との共酸化による2,6−ナフタレンジカルボン酸の確認の報告(G.K.SKRYABIN,et al.,DOKL.AKAD.NAUK.USSR 202,973〜974,1972)があるが、収量が低く定性的な研究にとどまっているというものであった。
【0005】更に最近では、■シュードモナス属細菌を用いて発酵法による2,6−ナフタレンジカルボン酸の製造法(特開平3−80091号公報)や、■アルキルナフタレン化合物のアルキル基に対して酸化力を有する微生物を利用した、ナフタレンカルボン酸の製造法(特開平5−15365号公報)が提案されている。
【0006】
【発明が解決しようとする課題】しかし、前記■、■の方法は省エネルギー、環境保全型の生産法としては、好ましいものであるが、生産を行なう培養条件は水系であり、しかも変換基質としての2,6−ジメチルナフタレンは水に不溶性で、いわゆる固−液反応系であるため変換基質の供給量に限界が生じ、かつ供給量の制御も困難で効率的な連続的大量生産化の点において、まだ問題を内包している。
【0007】そこで、2,6−ジメチルナフタレンの両メチル基末端酸化能を有し、かつ有機溶媒系においても、生育もしくは反応可能であり、かつ酸化反応が阻害されることのない微生物を見出し、このような微生物へ2,6−ジメチルナフタレンを溶解した有機溶媒を供給することができれば、液−液反応系により連続的に2,6−ナフタレンジカルボン酸への大量変換も可能となり、石油産業及び石油化学産業にとって有用性も大きいことから、この様な反応系で使用し得る菌と製造法の確立が望まれていた。
【0008】
【課題を解決するための手段】かかる状況において、本発明者らは前記課題を解決すべく、鋭意検討を重ね、有効な菌株のスクリーニング法の開発とそれによる効率的な微生物の探索を実施した結果、有機溶媒に溶解した2,6−ジメチルナフタレンの両側のメチル基を効率良く酸化可能な新規微生物を見出し、液−液反応系による製造法を初めて可能にし本発明をなすに至った。
【0009】すなわち本発明は、スフィンゴモナス属に属し、有機溶媒に溶解した2,6−ジメチルナフタレンからの2,6−ナフタレンジカルボン酸生成菌を、2,6−ジメチルナフタレンを溶解した有機溶媒と培地からなる液−液系、つまりは有機溶媒系で、培養し変換することを特徴とする2,6−ナフタレンジカルボン酸の製造方法、及び2,6−ナフタレンジカルボン酸生成菌の固定化菌体もしくは菌体由来の酵素を有機溶媒に溶解した2,6−ジメチルナフタレンと、有機溶媒系で接触させて変換することを特徴とする2,6−ナフタレンジカルボン酸の製造法を提供するものである。
【0010】本発明の新規微生物は、炭素源として2,6−ジメチルナフタレンのみを添加した培地にて生育し、かつ2,6−ナフタレンジカルボン酸を生産する能力の有無をもって、あるいは有機溶媒に2,6−ジメチルナフタレンのみを溶解したものと、培地からなる有機溶媒系培養により生育し、かつ2,6−ナフタレンジカルボン酸生産能の有無をもってスクリーニングすることにより分離することができる。
【0011】発明者らが全国各地から集めた土壌について、微生物の増殖に必要な成分のうち、炭素源を含まない培地(以下、培地という)を試験管等に分注し、これを滅菌したのち土壌を添加し、さらに2,6−ジメチルナフタレンあるいは2,6−ジメチルナフタレンを溶解した有機溶媒、例えばデカリンを加え、試験管振とう機等により培養を行う。この培養液を、別の試験管等に予め分注しておいた同様の培地に白金耳等を用いて植え継ぎした後、2,6−ジメチルナフタレンを添加し、試験管振とう機等によりさらに培養する。培養後の培養液を、上記培地もしくは滅菌水等で希釈し、炭素源を含まない寒天培地等に塗布した後、2,6−ジメチルナフタレンを供給してさらに培養する。培養によって得られたコロニーを単離し、それぞれの菌株について2,6−ナフタレンジカルボン酸の生産能力を確認することにより、2,6−ナフタレンジカルボン酸生成菌を選抜することができる。
【0012】これらの菌を培養する培地として、炭素源以外は一般的な培地成分を使用することができる。すなわち、窒素源としては、例えば、塩化アンモニウム、燐酸アンモニウム、硫酸アンモニウム、炭酸アンモニウム、酢酸アンモニウム、硝酸アンモニウム、硝酸ナトリウム、尿素等を、無機塩類としては、例えばカリウム、ナトリウム、鉄、マグネシウム、マンガン、銅、カルシウム等の各塩類等を使用できる。又、前記培養条件は、一般に微生物が死滅しない培養条件であれば良く、例えばpH約5〜9、温度約20〜40℃で好気的に行われる。
【0013】得られた菌株の2,6−ナフタレンジカルボン酸の生産能力の確認は、それぞれの菌株を炭素源として2,6−ジメチルナフタレンを添加した培地中で、上記と同様の条件で培養した培養液を遠心分離等で分離した後、上清を適当な分析手法、例えば高速液体クロマトグラフィー(HPLC)、ガスクロマトグラフィー(GC)、核磁気共鳴スペクトル(NMR)、赤外線吸収スペクトル(IR)、紫外線吸収スペクトル(UV)等を用いて分析すれば良い。得られた微生物は、腸内細菌以外の非醗酵菌同定用API20NE(ビオメリュー社)を用いて試験した結果、以下の表1に示す菌学的性質を有するものであった。
【0014】
【表1】

【0015】表1で示された菌学的性質を、BERGEY’S MANUAL OF SYSTEMATIC BACTERIOLOGY,vol.1,P198(1984)、INTERNATIONAL JOURNAL OF SYSTEMATIC BACTERIOLOGY,vol.40,No.3,P320〜321(1990)、API20NEプロファイルインデックスにて分類すると、スフィンゴモナス パウチモビリスに属するものと認められた。
【0016】本菌は2,6−ジメチルナフタレンを単一炭素源として、有機溶媒系でも生育可能であり、かつ培地中に2,6−ナフタレンジカルボン酸を蓄積する。このような特性を有した2,6−ナフタレンジカルボン酸生産菌は、未だ報告されていない。
【0017】以上の菌学的性質より本発明者らは、本菌はスフィンゴモナス パウチモビリスに属する新菌株であると判定し、本菌をスフィンゴモナス パウチモビリスA−7(Sphingomonas paucimobilis A−7)株と命名し、工業技術院生命工学工業技術研究所に寄託した〔FERM P−13632〕。
【0018】本発明の微生物は、スフィンゴモナス パウチモビリスに属する、2,6−位のメチル基の酸化能を有する微生物の他に、当該微生物に例えばX線・紫外線照射、エチルメタンスルホン酸などの変異剤による処理等の、公知の変異処理を施した、いわゆる変異株の使用や、遺伝子操作等による育種株の使用も包含するものである。
【0019】次に、本発明による2,6−ナフタレンジカルボン酸の製造方法を、スフィンゴモナス パウチモビリス A−7株(以下、本菌という)を用いた場合を一例に説明する。
【0020】本菌を培養する場合の培地成分としては、炭素源及び変換基質として2,6−ジメチルナフタレンを含有すること以外は、本菌の生育が良好であれば他の培地成分は特に制限されない。すなわち、生育基質として、窒素源では、例えばアンモニア、塩化アンモニウム、燐酸アンモニウム、硫酸アンモニウム、炭酸アンモニウム、酢酸アンモニウム、硝酸アンモニウム、硝酸ナトリウム、尿素等を、無機塩類としては、例えばカリウム、ナトリウム、鉄、マグネシウム、マンガン、銅、カルシウム、コバルト等の各塩類等が使用できる。又、炭素源としては、2,6−ジメチルナフタレン以外に、サリチル酸、2−メチルナフタレン、アントラセン、グルコース、フラクトース、デンプン等を補助基質として添加することも可能である。
【0021】有機溶媒系培養で用いる2,6−ジメチルナフタレンを溶解する溶媒としては、例えば、ヘプタン、n−オクタン、イソオクタン、シクロオクタン、ノナン、デカン、ドデカン、テトラリン、デカリン、ヘキシルエーテル、等が使用できるが、数日間の培養で揮発減少せず、又、雑菌の繁殖を抑制する意味から微生物毒性が強すぎず、また弱すぎないもので、かつ、2,6−ジメチルナフタレンを溶解し資化されないものであれば、上記以外の溶媒も使用することができる。そして、これらの内のいづれか1種、又は2種以上を任意に混合し使用しても良い。
【0022】本発明のように、溶媒に2,6−ジメチルナフタレンを溶解して供給する方法は、従来の水系培地に直接2,6−ジメチルナフタレンを供給する、固−液反応方法に比べ、変換基質の分散性を極めて良好にするため菌体との接触が容易になり、溶媒中の変換基質は均一状態にし易いことから、その供給量を容易に制御することができ、培地のみならず溶媒中の変換基質を効率良く連続的に、又は間欠的に、自在に供給できるので、連続式反応が可能となり、2,6−ナフタレンジカルボン酸の生産効率をより高めることができる。又、本菌では従来法のように2,6−ジメチルナフタレンを溶剤に溶解せずに、直接供給しても2,6−ナフタレンジカルボン酸を製造することができるが、当然その生産効率は劣るものとなる。
【0023】培養条件は、本菌が死滅せず増殖可能であれば良く、例えば培養温度は約15〜37℃、より好ましくは約25〜35℃、培地のpHは約4.2〜8.9、より好ましくは6.0〜8.0の範囲で、約1〜30日間好気的に培養又は反応させるのが好ましい。
【0024】2,6−ジメチルナフタレンを単一炭素源もしくは変換基質として、本菌を培養し、目的とする2,6−ナフタレンジカルボン酸を効率よく生産するためには、2,6−ジメチルナフタレンを、少なくとも本菌が生育するのに必要な量以上を添加することが必要である。本菌は、2,6−ジメチルナフタレンによって阻害を大きく受け難いため、これを多量に添加することが可能であるが、生成する2,6−ナフタレンジカルボン酸の量が増加してくると培地のpHが低下するので、水酸化ナトリウム、アンモニア水、水酸化カリウム等のアルカリ溶液を供給したり、緩衝能を有する成分を供給するか、あるいは予め培地に用いる等してpHを適性な範囲に調整すれば、より効率良い生産ができる。更に上記の条件で菌体を予め培養増殖して集菌後、これを以下に述べる方法に供しても良い。
【0025】本菌を用いて、2,6−ジメチルナフタレンから2,6−ナフタレンジカルボン酸を生産する工程はバッチ式でも良く、バイオリアクター等を用いても可能である。また、本菌の菌体、その処理物または酵素を、例えばアルギン酸カルシウム、ポリアクリルアミド法、ポリウレタン樹脂法、光架橋性樹脂法等を用いて通常の固定化法に従って固定化することもできる。得られた菌体培養物は、そのまま酵素源として使用することができるが、遠心分離等の操作により固液分離して得た微生物菌体を用いることが好ましい。さらに微生物菌体を燐酸緩衝液等の溶液で洗浄し、該溶液に懸濁して使用することもできる。又、菌体由来の酵素は、常法により精製することができ、これらの休止菌体、菌体処理物あるいは酵素を用いて生産する場合は、前記培養条件下で行なうことができる。培養液又は反応液中の2,6−ナフタレンジカルボン酸は常法に従い精製すれば良い。すなわち、培養液又は反応液をろ過、遠心分離等により処理した後、得られた溶液に塩酸や硫酸等の酸溶液を加えて酸性化することにより、2,6−ナフタレンジカルボン酸を回収することができる。また、溶剤抽出等の方法により回収することも可能であり、クロマトグラフィー等公知の精製方法を適宜併用することができる。
【0026】本発明の製造方法は、有機溶媒に溶解した2,6−ジメチルナフタレンの両側のメチル基を効率良く酸化可能な微生物を、見出したことで初めて可能となったものである。
【0027】
【実施例】以下、実施例及び比較例を挙げ、本発明をさらに詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0028】
【実施例1】2,6−ジメチルナフタレンから2,6−ナフタレンジカルボン酸を生産する菌を分離するために、脱イオン水で溶解した表2に示す成分の培地を用いてスクリーニングを行った。この培地のpHは7となった。
【0029】
【表2】

【0030】この培地を、500mlのバッフル付き三角フラスコに100ml入れ、121℃で20分間滅菌した。室温にて冷却した後、各地にて採集した土壌を薬さじ1〜2杯分添加し、別途滅菌した2,6−ジメチルナフタレンを100mg添加し、30℃、270rpmで振とう培養した。別の同様培地に0.1ml植えつぎした後、再度30℃、270rpmで振とう培養し、一週間後培養液の一部を滅菌した生理的食塩水にて希釈し、前もって調整しておいた表2に示した成分の培地に、寒天を15g/lとなる様に加えた平板培地に塗布し、さらに2,6−ジメチルナフタレンを溶かしたジエチルエーテル溶液を噴霧して平板培地上に供給し、30℃で一週間培養した。
【0031】平板培地上に形成された、2,6−ジメチルナフタレンが資化されたことを示す、透明帯を有したコロニーを単離し、これらすべての微生物を、以下に記す方法で2,6−ナフタレンジカルボン酸生産菌株を選択した。すなわち、上記と同様の培地4mlと、2,6−ジメチルナフタレンを1wt%に溶解したデカリン4mlを、内径21mmの試験管に分注し、120℃で20分間滅菌し室温にて冷却した後、単離した微生物を白金耳を用いて1白金耳植え付けた。試験管振とう機により30℃、300pmで数日間往復振とう培養した。培養後、この培養液の水性部分の上清を、強アルカリで処理した後、中性で高速液体クロマトグラフィー(HPLC)にて分析し、2,6−ナフタレンジカルボン酸生産菌を複数選択し、その中から表1に示した菌学的性質を有するスフィンゴモナス パウチモビリス A−7株を取得した。
【0032】
【実施例2】500mlのバッフル付き三角フラスコに実施例1と同様の培地を50mlと、2,6−ジメチルナフタレンを1wt%に溶解したデカリン50mlを入れ、121℃で20分間滅菌した。室温にて冷却後、実施例1で得た菌株、スフィンゴモナス パウチモビリス A−7株を1白金耳植菌し、30℃、300rpmで4日間振とう培養した。培養後、培養液の水性部分の上清を実施例1と同様の方法で分析し、2,6−ナフタレンジカルボン酸の生産量を測定した。結果を表3に示す。
【0033】
【比較例1】実施例2における、2,6−ジメチルナフタレンの供給方法を、溶媒に溶解せずに直接培地に添加する従来の固−液反応系に変えて、実施例1と同様の培地を50ml用い、以下実施例2と同様な条件で4日間培養、分析し、2,6−ナフタレンジカルボン酸の生産量を測定した。2,6−ジメチルナフタレンは500mg添加した。結果を表3に示す。表3の結果から本発明の有機溶媒系による方法がより優れていることが判る。
【0034】
【表3】

【0035】
【実施例3】2,6−ジメチルナフタレンを溶解する溶媒を、ヘプタン、シクロオクタン、イソオクタン、オクタン、ヘキシルエーテル、ノナン、デカンの各種溶媒に変えて、これらに2,6−ジメチルナフタレンを1wt%溶解し、そして、これら溶媒を、表2に示した成分の培地が4ml入った内径21mmの試験管に、4ml分注し121℃で20分間滅菌した。室温にて冷却後、スフィンゴモナス パウチモビリス A−7株を1白金耳植え付け、試験管振とう機により30℃、300rpmで数日間往復振とう培養した。培養後、この培養液の水性部分の上清を、強アルカリで処理した後、中性で高速液体クロマトグラフィー(HPLC)にて分析した。その結果、本発明の菌株は、種々の有機溶媒を用いても生育可能で、しかも2,6−ジメチルナフタレンに対し十分な変換能を有することが判った。
【0036】
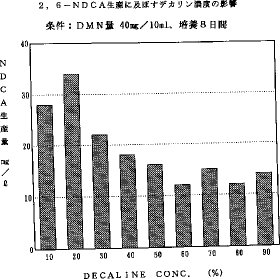
【実施例4】内径21mmの試験管に2,6−ジメチルナフタレンを40mgと、表2に示した培地にデカリン濃度が10〜90%にあるようにしたものとを加え、全量を10mlとし、121℃で20分間滅菌した。室温にて冷却後、スフィンゴモナス パウチモビリス A−7株を1白金耳植え付け、試験管振とう機により30℃、300rpmで数日間往復振とう培養した。培養後、この培養液の水性部分の上清を、強アルカリで処理した後、中性で高速液体クロマトグラフィー(HPLC)にて分析し、図1に示した結果を得た。本発明の菌株は、各種濃度のデカリンを用いても生育可能で、しかも2,6−ジメチルナフタレンに対し十分な変換能を有することが判った。
【0037】
【実施例5】2本の500mlのバッフル付き三角フラスコに、L培地(バクトトリプトン10g/l、酵母エキス5g/l、NaCl・5g/l)をそれぞれ100ml入れ、2,6−ジメチルナフタレンを100mg添加して121℃、20分間滅菌した。室温で冷却後、スフィンゴモナス・パウチモビリス A−7株を、白金耳を用いて1白金耳ずつ植菌し、30℃で5日間振とう培養した。培養後の培養液を遠心分離して集菌後、培地の緩衝能を高めてpHの低下を抑制するため、表2に示した培地成分の内、KH2PO4を(NH4)2HPO4に変えて、20g/lを添加、NH4NO3を無添加に変更した培地(pH7)で洗浄し、同培地4mlに菌体を懸濁させ、これを滅菌済みの内径21mmの試験管に移し、更に1wt%にジメチルナフタレンを溶解したデカリン4mlを加え、30℃で3日間振とうして反応させた。反応生成液をHPLCで分析したところ2,6−ナフタレンジカルボン酸の収量は310mg/lであった。
【0038】
【発明の効果】本発明によれば、2,6−ジメチルナフタレンを単一炭素源もしくは変換基質として溶解した有機溶媒と、炭素源を含まない培地との有機溶媒系において、生育可能で、かつ2,6−ナフタレンジカルボン酸を生産することができる生産菌、もしくはその休止菌体、その処理物又は菌体由来の酵素を用い、2,6−ジメチルナフタレンから2,6−ナフタレンジカルボン酸を効率よく生産することができる。
【図面の簡単な説明】
【図1】実施例4においてデカリン濃度10〜90%とあるようにして2,6−ナフタレンジカルボン酸の生成の影響をみた図である。
【0001】
【産業上の利用分野】本発明はスフィンゴモナス属に属する新規微生物及び該微生物の休止菌体又は菌体由来の酵素を用いて2,6−ジメチルナフタレンを酸化し、2,6−ナフタレンジカルボン酸を製造する方法に関する。
【0002】
【従来の技術】2,6−ナフタレンジカルボン酸あるいは、そのエステル誘導体は高機能性樹脂原料、液晶原料、ポリアミド系医薬品原料、染料顔料用として有用な化合物であり、現在数種の化学合成法により生産されている。特にポリエチレンナフタレート(PEN)樹脂としての用途は、80〜90%とも言われており、現在のポリエチレンテレフタレート(PET)樹脂に比べ、耐熱温度で約35℃、破断強度も約25%高い他、二次転移点、結晶化速度、軟化点、溶融粘度等に対し、優れた性能を有するものとして大量生産化が期待されている。しかしながら、2,6−ジメチルナフタレンを原料とした化学合成法は、高温反応であるため官能基の転移が起こり易く、純度の高い2,6−ナフタレンジカルボン酸が得られにくい上、高温高圧条件を必要とし、大量のエネルギーを消費することや環境汚染等の問題点もあった。
【0003】これらの問題点を解決する方法として、近年、微生物を用いた微生物酸化法の研究が進められている。微生物を触媒とする酸化法は、常温常圧で反応させることができる上、官能基の転移が起こらないため副産物の生成がほとんど無いという優れた特徴を有している。しかし、これまでの報告では、
【0004】又、
【0005】更に最近では、
【0006】
【発明が解決しようとする課題】しかし、前記
【0007】そこで、2,6−ジメチルナフタレンの両メチル基末端酸化能を有し、かつ有機溶媒系においても、生育もしくは反応可能であり、かつ酸化反応が阻害されることのない微生物を見出し、このような微生物へ2,6−ジメチルナフタレンを溶解した有機溶媒を供給することができれば、液−液反応系により連続的に2,6−ナフタレンジカルボン酸への大量変換も可能となり、石油産業及び石油化学産業にとって有用性も大きいことから、この様な反応系で使用し得る菌と製造法の確立が望まれていた。
【0008】
【課題を解決するための手段】かかる状況において、本発明者らは前記課題を解決すべく、鋭意検討を重ね、有効な菌株のスクリーニング法の開発とそれによる効率的な微生物の探索を実施した結果、有機溶媒に溶解した2,6−ジメチルナフタレンの両側のメチル基を効率良く酸化可能な新規微生物を見出し、液−液反応系による製造法を初めて可能にし本発明をなすに至った。
【0009】すなわち本発明は、スフィンゴモナス属に属し、有機溶媒に溶解した2,6−ジメチルナフタレンからの2,6−ナフタレンジカルボン酸生成菌を、2,6−ジメチルナフタレンを溶解した有機溶媒と培地からなる液−液系、つまりは有機溶媒系で、培養し変換することを特徴とする2,6−ナフタレンジカルボン酸の製造方法、及び2,6−ナフタレンジカルボン酸生成菌の固定化菌体もしくは菌体由来の酵素を有機溶媒に溶解した2,6−ジメチルナフタレンと、有機溶媒系で接触させて変換することを特徴とする2,6−ナフタレンジカルボン酸の製造法を提供するものである。
【0010】本発明の新規微生物は、炭素源として2,6−ジメチルナフタレンのみを添加した培地にて生育し、かつ2,6−ナフタレンジカルボン酸を生産する能力の有無をもって、あるいは有機溶媒に2,6−ジメチルナフタレンのみを溶解したものと、培地からなる有機溶媒系培養により生育し、かつ2,6−ナフタレンジカルボン酸生産能の有無をもってスクリーニングすることにより分離することができる。
【0011】発明者らが全国各地から集めた土壌について、微生物の増殖に必要な成分のうち、炭素源を含まない培地(以下、培地という)を試験管等に分注し、これを滅菌したのち土壌を添加し、さらに2,6−ジメチルナフタレンあるいは2,6−ジメチルナフタレンを溶解した有機溶媒、例えばデカリンを加え、試験管振とう機等により培養を行う。この培養液を、別の試験管等に予め分注しておいた同様の培地に白金耳等を用いて植え継ぎした後、2,6−ジメチルナフタレンを添加し、試験管振とう機等によりさらに培養する。培養後の培養液を、上記培地もしくは滅菌水等で希釈し、炭素源を含まない寒天培地等に塗布した後、2,6−ジメチルナフタレンを供給してさらに培養する。培養によって得られたコロニーを単離し、それぞれの菌株について2,6−ナフタレンジカルボン酸の生産能力を確認することにより、2,6−ナフタレンジカルボン酸生成菌を選抜することができる。
【0012】これらの菌を培養する培地として、炭素源以外は一般的な培地成分を使用することができる。すなわち、窒素源としては、例えば、塩化アンモニウム、燐酸アンモニウム、硫酸アンモニウム、炭酸アンモニウム、酢酸アンモニウム、硝酸アンモニウム、硝酸ナトリウム、尿素等を、無機塩類としては、例えばカリウム、ナトリウム、鉄、マグネシウム、マンガン、銅、カルシウム等の各塩類等を使用できる。又、前記培養条件は、一般に微生物が死滅しない培養条件であれば良く、例えばpH約5〜9、温度約20〜40℃で好気的に行われる。
【0013】得られた菌株の2,6−ナフタレンジカルボン酸の生産能力の確認は、それぞれの菌株を炭素源として2,6−ジメチルナフタレンを添加した培地中で、上記と同様の条件で培養した培養液を遠心分離等で分離した後、上清を適当な分析手法、例えば高速液体クロマトグラフィー(HPLC)、ガスクロマトグラフィー(GC)、核磁気共鳴スペクトル(NMR)、赤外線吸収スペクトル(IR)、紫外線吸収スペクトル(UV)等を用いて分析すれば良い。得られた微生物は、腸内細菌以外の非醗酵菌同定用API20NE(ビオメリュー社)を用いて試験した結果、以下の表1に示す菌学的性質を有するものであった。
【0014】
【表1】

【0015】表1で示された菌学的性質を、BERGEY’S MANUAL OF SYSTEMATIC BACTERIOLOGY,vol.1,P198(1984)、INTERNATIONAL JOURNAL OF SYSTEMATIC BACTERIOLOGY,vol.40,No.3,P320〜321(1990)、API20NEプロファイルインデックスにて分類すると、スフィンゴモナス パウチモビリスに属するものと認められた。
【0016】本菌は2,6−ジメチルナフタレンを単一炭素源として、有機溶媒系でも生育可能であり、かつ培地中に2,6−ナフタレンジカルボン酸を蓄積する。このような特性を有した2,6−ナフタレンジカルボン酸生産菌は、未だ報告されていない。
【0017】以上の菌学的性質より本発明者らは、本菌はスフィンゴモナス パウチモビリスに属する新菌株であると判定し、本菌をスフィンゴモナス パウチモビリスA−7(Sphingomonas paucimobilis A−7)株と命名し、工業技術院生命工学工業技術研究所に寄託した〔FERM P−13632〕。
【0018】本発明の微生物は、スフィンゴモナス パウチモビリスに属する、2,6−位のメチル基の酸化能を有する微生物の他に、当該微生物に例えばX線・紫外線照射、エチルメタンスルホン酸などの変異剤による処理等の、公知の変異処理を施した、いわゆる変異株の使用や、遺伝子操作等による育種株の使用も包含するものである。
【0019】次に、本発明による2,6−ナフタレンジカルボン酸の製造方法を、スフィンゴモナス パウチモビリス A−7株(以下、本菌という)を用いた場合を一例に説明する。
【0020】本菌を培養する場合の培地成分としては、炭素源及び変換基質として2,6−ジメチルナフタレンを含有すること以外は、本菌の生育が良好であれば他の培地成分は特に制限されない。すなわち、生育基質として、窒素源では、例えばアンモニア、塩化アンモニウム、燐酸アンモニウム、硫酸アンモニウム、炭酸アンモニウム、酢酸アンモニウム、硝酸アンモニウム、硝酸ナトリウム、尿素等を、無機塩類としては、例えばカリウム、ナトリウム、鉄、マグネシウム、マンガン、銅、カルシウム、コバルト等の各塩類等が使用できる。又、炭素源としては、2,6−ジメチルナフタレン以外に、サリチル酸、2−メチルナフタレン、アントラセン、グルコース、フラクトース、デンプン等を補助基質として添加することも可能である。
【0021】有機溶媒系培養で用いる2,6−ジメチルナフタレンを溶解する溶媒としては、例えば、ヘプタン、n−オクタン、イソオクタン、シクロオクタン、ノナン、デカン、ドデカン、テトラリン、デカリン、ヘキシルエーテル、等が使用できるが、数日間の培養で揮発減少せず、又、雑菌の繁殖を抑制する意味から微生物毒性が強すぎず、また弱すぎないもので、かつ、2,6−ジメチルナフタレンを溶解し資化されないものであれば、上記以外の溶媒も使用することができる。そして、これらの内のいづれか1種、又は2種以上を任意に混合し使用しても良い。
【0022】本発明のように、溶媒に2,6−ジメチルナフタレンを溶解して供給する方法は、従来の水系培地に直接2,6−ジメチルナフタレンを供給する、固−液反応方法に比べ、変換基質の分散性を極めて良好にするため菌体との接触が容易になり、溶媒中の変換基質は均一状態にし易いことから、その供給量を容易に制御することができ、培地のみならず溶媒中の変換基質を効率良く連続的に、又は間欠的に、自在に供給できるので、連続式反応が可能となり、2,6−ナフタレンジカルボン酸の生産効率をより高めることができる。又、本菌では従来法のように2,6−ジメチルナフタレンを溶剤に溶解せずに、直接供給しても2,6−ナフタレンジカルボン酸を製造することができるが、当然その生産効率は劣るものとなる。
【0023】培養条件は、本菌が死滅せず増殖可能であれば良く、例えば培養温度は約15〜37℃、より好ましくは約25〜35℃、培地のpHは約4.2〜8.9、より好ましくは6.0〜8.0の範囲で、約1〜30日間好気的に培養又は反応させるのが好ましい。
【0024】2,6−ジメチルナフタレンを単一炭素源もしくは変換基質として、本菌を培養し、目的とする2,6−ナフタレンジカルボン酸を効率よく生産するためには、2,6−ジメチルナフタレンを、少なくとも本菌が生育するのに必要な量以上を添加することが必要である。本菌は、2,6−ジメチルナフタレンによって阻害を大きく受け難いため、これを多量に添加することが可能であるが、生成する2,6−ナフタレンジカルボン酸の量が増加してくると培地のpHが低下するので、水酸化ナトリウム、アンモニア水、水酸化カリウム等のアルカリ溶液を供給したり、緩衝能を有する成分を供給するか、あるいは予め培地に用いる等してpHを適性な範囲に調整すれば、より効率良い生産ができる。更に上記の条件で菌体を予め培養増殖して集菌後、これを以下に述べる方法に供しても良い。
【0025】本菌を用いて、2,6−ジメチルナフタレンから2,6−ナフタレンジカルボン酸を生産する工程はバッチ式でも良く、バイオリアクター等を用いても可能である。また、本菌の菌体、その処理物または酵素を、例えばアルギン酸カルシウム、ポリアクリルアミド法、ポリウレタン樹脂法、光架橋性樹脂法等を用いて通常の固定化法に従って固定化することもできる。得られた菌体培養物は、そのまま酵素源として使用することができるが、遠心分離等の操作により固液分離して得た微生物菌体を用いることが好ましい。さらに微生物菌体を燐酸緩衝液等の溶液で洗浄し、該溶液に懸濁して使用することもできる。又、菌体由来の酵素は、常法により精製することができ、これらの休止菌体、菌体処理物あるいは酵素を用いて生産する場合は、前記培養条件下で行なうことができる。培養液又は反応液中の2,6−ナフタレンジカルボン酸は常法に従い精製すれば良い。すなわち、培養液又は反応液をろ過、遠心分離等により処理した後、得られた溶液に塩酸や硫酸等の酸溶液を加えて酸性化することにより、2,6−ナフタレンジカルボン酸を回収することができる。また、溶剤抽出等の方法により回収することも可能であり、クロマトグラフィー等公知の精製方法を適宜併用することができる。
【0026】本発明の製造方法は、有機溶媒に溶解した2,6−ジメチルナフタレンの両側のメチル基を効率良く酸化可能な微生物を、見出したことで初めて可能となったものである。
【0027】
【実施例】以下、実施例及び比較例を挙げ、本発明をさらに詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0028】
【実施例1】2,6−ジメチルナフタレンから2,6−ナフタレンジカルボン酸を生産する菌を分離するために、脱イオン水で溶解した表2に示す成分の培地を用いてスクリーニングを行った。この培地のpHは7となった。
【0029】
【表2】

【0030】この培地を、500mlのバッフル付き三角フラスコに100ml入れ、121℃で20分間滅菌した。室温にて冷却した後、各地にて採集した土壌を薬さじ1〜2杯分添加し、別途滅菌した2,6−ジメチルナフタレンを100mg添加し、30℃、270rpmで振とう培養した。別の同様培地に0.1ml植えつぎした後、再度30℃、270rpmで振とう培養し、一週間後培養液の一部を滅菌した生理的食塩水にて希釈し、前もって調整しておいた表2に示した成分の培地に、寒天を15g/lとなる様に加えた平板培地に塗布し、さらに2,6−ジメチルナフタレンを溶かしたジエチルエーテル溶液を噴霧して平板培地上に供給し、30℃で一週間培養した。
【0031】平板培地上に形成された、2,6−ジメチルナフタレンが資化されたことを示す、透明帯を有したコロニーを単離し、これらすべての微生物を、以下に記す方法で2,6−ナフタレンジカルボン酸生産菌株を選択した。すなわち、上記と同様の培地4mlと、2,6−ジメチルナフタレンを1wt%に溶解したデカリン4mlを、内径21mmの試験管に分注し、120℃で20分間滅菌し室温にて冷却した後、単離した微生物を白金耳を用いて1白金耳植え付けた。試験管振とう機により30℃、300pmで数日間往復振とう培養した。培養後、この培養液の水性部分の上清を、強アルカリで処理した後、中性で高速液体クロマトグラフィー(HPLC)にて分析し、2,6−ナフタレンジカルボン酸生産菌を複数選択し、その中から表1に示した菌学的性質を有するスフィンゴモナス パウチモビリス A−7株を取得した。
【0032】
【実施例2】500mlのバッフル付き三角フラスコに実施例1と同様の培地を50mlと、2,6−ジメチルナフタレンを1wt%に溶解したデカリン50mlを入れ、121℃で20分間滅菌した。室温にて冷却後、実施例1で得た菌株、スフィンゴモナス パウチモビリス A−7株を1白金耳植菌し、30℃、300rpmで4日間振とう培養した。培養後、培養液の水性部分の上清を実施例1と同様の方法で分析し、2,6−ナフタレンジカルボン酸の生産量を測定した。結果を表3に示す。
【0033】
【比較例1】実施例2における、2,6−ジメチルナフタレンの供給方法を、溶媒に溶解せずに直接培地に添加する従来の固−液反応系に変えて、実施例1と同様の培地を50ml用い、以下実施例2と同様な条件で4日間培養、分析し、2,6−ナフタレンジカルボン酸の生産量を測定した。2,6−ジメチルナフタレンは500mg添加した。結果を表3に示す。表3の結果から本発明の有機溶媒系による方法がより優れていることが判る。
【0034】
【表3】

【0035】
【実施例3】2,6−ジメチルナフタレンを溶解する溶媒を、ヘプタン、シクロオクタン、イソオクタン、オクタン、ヘキシルエーテル、ノナン、デカンの各種溶媒に変えて、これらに2,6−ジメチルナフタレンを1wt%溶解し、そして、これら溶媒を、表2に示した成分の培地が4ml入った内径21mmの試験管に、4ml分注し121℃で20分間滅菌した。室温にて冷却後、スフィンゴモナス パウチモビリス A−7株を1白金耳植え付け、試験管振とう機により30℃、300rpmで数日間往復振とう培養した。培養後、この培養液の水性部分の上清を、強アルカリで処理した後、中性で高速液体クロマトグラフィー(HPLC)にて分析した。その結果、本発明の菌株は、種々の有機溶媒を用いても生育可能で、しかも2,6−ジメチルナフタレンに対し十分な変換能を有することが判った。
【0036】
【実施例4】内径21mmの試験管に2,6−ジメチルナフタレンを40mgと、表2に示した培地にデカリン濃度が10〜90%にあるようにしたものとを加え、全量を10mlとし、121℃で20分間滅菌した。室温にて冷却後、スフィンゴモナス パウチモビリス A−7株を1白金耳植え付け、試験管振とう機により30℃、300rpmで数日間往復振とう培養した。培養後、この培養液の水性部分の上清を、強アルカリで処理した後、中性で高速液体クロマトグラフィー(HPLC)にて分析し、図1に示した結果を得た。本発明の菌株は、各種濃度のデカリンを用いても生育可能で、しかも2,6−ジメチルナフタレンに対し十分な変換能を有することが判った。
【0037】
【実施例5】2本の500mlのバッフル付き三角フラスコに、L培地(バクトトリプトン10g/l、酵母エキス5g/l、NaCl・5g/l)をそれぞれ100ml入れ、2,6−ジメチルナフタレンを100mg添加して121℃、20分間滅菌した。室温で冷却後、スフィンゴモナス・パウチモビリス A−7株を、白金耳を用いて1白金耳ずつ植菌し、30℃で5日間振とう培養した。培養後の培養液を遠心分離して集菌後、培地の緩衝能を高めてpHの低下を抑制するため、表2に示した培地成分の内、KH2PO4を(NH4)2HPO4に変えて、20g/lを添加、NH4NO3を無添加に変更した培地(pH7)で洗浄し、同培地4mlに菌体を懸濁させ、これを滅菌済みの内径21mmの試験管に移し、更に1wt%にジメチルナフタレンを溶解したデカリン4mlを加え、30℃で3日間振とうして反応させた。反応生成液をHPLCで分析したところ2,6−ナフタレンジカルボン酸の収量は310mg/lであった。
【0038】
【発明の効果】本発明によれば、2,6−ジメチルナフタレンを単一炭素源もしくは変換基質として溶解した有機溶媒と、炭素源を含まない培地との有機溶媒系において、生育可能で、かつ2,6−ナフタレンジカルボン酸を生産することができる生産菌、もしくはその休止菌体、その処理物又は菌体由来の酵素を用い、2,6−ジメチルナフタレンから2,6−ナフタレンジカルボン酸を効率よく生産することができる。
【図面の簡単な説明】
【図1】実施例4においてデカリン濃度10〜90%とあるようにして2,6−ナフタレンジカルボン酸の生成の影響をみた図である。
【特許請求の範囲】
【請求項1】 スフィンゴモナス属に属する2,6−ナフタレンジカルボン酸生成菌。
【請求項2】 スフィンゴモナス属に属し、2,6−ジメチルナフタレンから2,6−ナフタレンジカルボン酸を生成することのできる2,6−ナフタレンジカルボン酸生成菌。
【請求項3】 スフィンゴモナス属に属し、有機溶媒系において2,6−ジメチルナフタレンの両メチル基末端酸化能を有する2,6−ナフタレンジカルボン酸生成菌。
【請求項4】 請求項1〜3に記載の生成菌がスフィンゴモナス パウチモビリス A−7である2,6−ナフタレンジカルボン酸生成菌。
【請求項5】 請求項1〜4に記載の生成菌を、2,6−ジメチルナフタレンを溶解した有機溶媒と、培地からなる有機溶媒系培地において培養し、2,6−ナフタレンジカルボン酸を生成させることを特徴とする2,6−ナフタレンジカルボン酸あるいはその塩の製造法。
【請求項6】 請求項1〜4に記載の生成菌を、2,6−ジメチルナフタレンを含むかもしくは含まない培地あるいは2,6−ジメチルナフタレンを溶解した有機溶媒と、培地からなる有機溶媒系培地で培養し、集菌後、その菌体もしくは休止菌体、又はその処理物もしくは菌体由来の酵素を用いて、有機溶媒系において反応させて2,6−ナフタレンジカルボン酸を生成せしめるか、もしくは2,6−ジメチルナフタレンを2,6−ナフタレンジカルボン酸に変換せしめることを特徴とする2,6−ナフタレンジカルボン酸あるいはその塩の製造法。
【請求項1】 スフィンゴモナス属に属する2,6−ナフタレンジカルボン酸生成菌。
【請求項2】 スフィンゴモナス属に属し、2,6−ジメチルナフタレンから2,6−ナフタレンジカルボン酸を生成することのできる2,6−ナフタレンジカルボン酸生成菌。
【請求項3】 スフィンゴモナス属に属し、有機溶媒系において2,6−ジメチルナフタレンの両メチル基末端酸化能を有する2,6−ナフタレンジカルボン酸生成菌。
【請求項4】 請求項1〜3に記載の生成菌がスフィンゴモナス パウチモビリス A−7である2,6−ナフタレンジカルボン酸生成菌。
【請求項5】 請求項1〜4に記載の生成菌を、2,6−ジメチルナフタレンを溶解した有機溶媒と、培地からなる有機溶媒系培地において培養し、2,6−ナフタレンジカルボン酸を生成させることを特徴とする2,6−ナフタレンジカルボン酸あるいはその塩の製造法。
【請求項6】 請求項1〜4に記載の生成菌を、2,6−ジメチルナフタレンを含むかもしくは含まない培地あるいは2,6−ジメチルナフタレンを溶解した有機溶媒と、培地からなる有機溶媒系培地で培養し、集菌後、その菌体もしくは休止菌体、又はその処理物もしくは菌体由来の酵素を用いて、有機溶媒系において反応させて2,6−ナフタレンジカルボン酸を生成せしめるか、もしくは2,6−ジメチルナフタレンを2,6−ナフタレンジカルボン酸に変換せしめることを特徴とする2,6−ナフタレンジカルボン酸あるいはその塩の製造法。
【図1】




【公開番号】特開平7−79768
【公開日】平成7年(1995)3月28日
【国際特許分類】
【出願番号】特願平5−249720
【出願日】平成5年(1993)9月13日
【出願人】(000001144)工業技術院長 (75)
【上記1名の復代理人】
【弁理士】
【氏名又は名称】戸田 親男 (外1名)
【出願人】(590000455)財団法人石油産業活性化センター (249)
【出願人】(000005991)三菱石油株式会社 (3)
【上記2名の代理人】
【弁理士】
【氏名又は名称】戸田 親男
【公開日】平成7年(1995)3月28日
【国際特許分類】
【出願日】平成5年(1993)9月13日
【出願人】(000001144)工業技術院長 (75)
【上記1名の復代理人】
【弁理士】
【氏名又は名称】戸田 親男 (外1名)
【出願人】(590000455)財団法人石油産業活性化センター (249)
【出願人】(000005991)三菱石油株式会社 (3)
【上記2名の代理人】
【弁理士】
【氏名又は名称】戸田 親男
[ Back to top ]

