病害ストレス及び病害抵抗性誘導剤に対する応答性を示す核酸構築物
【課題】イネにおけるWRKY45遺伝子の応答性を明らかにし、病害ストレス及び病害抵抗性誘導剤に対する応答性を示す新規な核酸構築物を提供する。
【解決手段】本発明に係る核酸構築物は、配列番号1の塩基配列からなる、イネにおけるWRKY45遺伝子の転写開始点上流1965から3'-UTRの直前までの領域からなるポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを連結してなる。
【解決手段】本発明に係る核酸構築物は、配列番号1の塩基配列からなる、イネにおけるWRKY45遺伝子の転写開始点上流1965から3'-UTRの直前までの領域からなるポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを連結してなる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、病害ストレス及び病害抵抗性誘導剤に対する応答性を示す核酸構築物、当該核酸構築物を有する発現ベクター、当該発現ベクターを有する形質転換体並びにトランスジェニック植物、病害ストレス等による遺伝子発現誘導方法及び病害抵抗性誘導剤のスクリーニング方法に関する。
【背景技術】
【0002】
陸生植物は、種々な植物病原体の感染に曝される。病害ストレスに植物が曝されると、特定の遺伝子発現といった生化学的、生理学的及び分子的な反応が誘導され、病害ストレスに対する抵抗性を示すことが知られている。この反応は、植物細胞内における刺激の認識及びシグナル伝達の結果として進行する。一方、このような植物の特異的反応を誘導する化合物は病害抵抗性誘導剤と呼ばれており、例えば、ベンゾチアジアゾールS-メチルエステル(BTH)やジクロロイソニコチン酸(INA)などが知られている(非特許文献1:石井英夫, 植物防疫, 53, 10, 393-397(1999))。病害ストレスや病害抵抗性誘導剤によ
り引き起こされる植物の抵抗性誘導メカニズムの詳細については未だ完全に解明されていないが、植物の抵抗性誘導の指標となる物質は、病害抵抗性誘導剤の開発等に有効に利用できる。
【0003】
ところで、ベンゾチアジアゾール(BTH)などの病害抵抗性誘導剤は、植物の防御応答
シグナル伝達経路(サリチル酸経路)に作用し、病原体感染時における迅速な抵抗性発現への準備効果(プライミング効果)により病害抵抗性を高めることが知られている。BTH
処理により、イネにおいて発現誘導される転写因子としてWRKY45(ワーキー45)が知られている。WRKY45は、BTHにより転写誘導される遺伝子のうち、300近くの遺伝子の転写を制御しており、サリチル酸経路を介する抵抗性誘導において非常に重要な役割を担っている(非特許文献2:Shimono et al., The Plant Cell, 19, 2064 (2007)、非特許文献3:
高辻博志ら、植物感染生理談話会論文集, 44, 1-10 (2008)及び特許文献1:WO2006/126671)。
【0004】
しかしながら、病害抵抗性誘導剤処理や病害ストレス付加に起因するWRKY45遺伝子の発現メカニズム等については未だ知られていない。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】石井英夫, 植物防疫, 53, 10, 393-397(1999)
【非特許文献2】Shimono et al., The Plant Cell, 19, 2064 (2007)
【非特許文献3】高辻博志ら, 植物感染生理談話会論文集, 44, 1-10 (2008)
【特許文献】
【0006】
【特許文献1】WO2006/126671
【発明の概要】
【発明が解決しようとする課題】
【0007】
そこで、本発明は、イネにおけるWRKY45遺伝子の応答性を明らかにし、病害ストレス及び病害抵抗性誘導剤に対する応答性を示す新規な核酸構築物及びその利用を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者は、上記課題を解決するため鋭意研究を行った結果、病害ストレスに特異的な発現パターンを示すWRKY45遺伝子の応答性メカニズムの一端を明らかにし、病害ストレス及び病害抵抗性誘導剤に対する応答性を示す核酸構築物を単離することに成功し、本発明を完成するに至った。
【0009】
すなわち、本発明は、以下を包含する。
(1)以下の(a)、(b)又は(c)のポリヌクレオチドと、目的タンパク質をコードするポリ
ヌクレオチドとを連結してなる核酸構築物。
(a)配列番号1の塩基配列からなるポリヌクレオチド
(b)配列番号1の塩基配列において1若しくは複数の塩基が欠失、置換若しくは付加さ
れた塩基配列からなり、且つ、病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
(c)配列番号1の塩基配列と相補的な塩基配列からなるDNA断片とストリンジェントな条件下でハイブリダイズし、かつ病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
(2)上記目的タンパク質をコードするポリヌクレオチドは、レポーター遺伝子のコード領域であることを特徴とする(1)記載の核酸構築物。
(3)上記(1)又は(2)の核酸構築物を含む発現ベクター。
(4)上記(3)記載の発現ベクターを含む形質転換体。
(5)上記(3)記載の発現ベクターを含むトランスジェニック植物。
(6)植物体、植物器官、植物組織又は植物培養細胞である(5)記載のトランスジェニック植物。
(7)上記(5)又は(6)記載のトランスジェニック植物を培養又は栽培する植物の製造方法。
(8)上記(5)又は(6)記載のトランスジェニック植物に病害抵抗性誘導剤を接触させる又は病害ストレスを付加し、上記目的タンパク質をコードする遺伝子の発現を誘導する、遺伝子発現誘導方法。
(9)病害抵抗性誘導剤が、ベンゾチアジアゾールS-メチルエステル(BTH)又はジクロ
ロイソニコチン酸である(8)記載の遺伝子発現誘導方法。
(10)上記(2)記載の核酸構築物を含む発現ベクターを導入されてなる形質転換体に、検査対象の化合物を接触させる工程と、上記形質転換体における上記レポーター遺伝子の発現を検出する工程とを含み、上記検査対象の化合物を接触させることで上記レポーター遺伝子の発現量が亢進した場合に当該化合物を病害抵抗性誘導剤と判定する、病害抵抗性誘導剤のスクリーニング方法。
【発明の効果】
【0010】
本発明によれば、病害ストレス及び病害抵抗性誘導剤に対する応答性を示す全く新規な核酸構築物を提供することができる。また、本発明に係る核酸構築物を利用し、レポーター遺伝子の発現を解析することで病害ストレス及び病害抵抗性誘導剤をスクリーニングすることができる。
【図面の簡単な説明】
【0011】
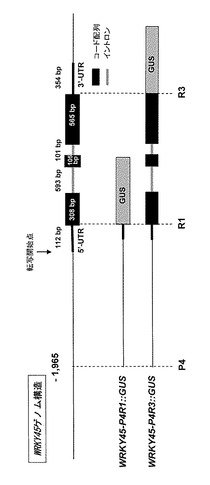
【図1】OsWRKY45のゲノム構造及びGUS遺伝子をドライブした核酸構築物の構成を模式的に示す図である。
【図2】pSAMHDN627-M2GUSベクタープラスミドのコンストラクトを示す図である。
【図3】BTH処理したWRKY45-P4R3::GUS組換えイネの葉身サンプリング前の写真である。
【図4】BTH含有ゲランガム培地で育成したWRKY45-P4R3::GUS組換えイネのサンプリング前の写真である。
【図5】WRKY45-P4R1::GUS組換えイネのサリチル酸非応答性及びWRKY45-P4R3::GUS組換えイネのサリチル酸応答性を示す図である。
【図6】WRKY45-P4R3::GUS組換えイネのイネいもち病菌感染応答性を示す図である。
【図7】WRKY45-P4R3::GUS組換えイネの白葉枯病菌感染応答性を示す図である。
【図8】素焼き鉢で栽培したWRKY45-P4R3::GUS組換えイネのBTHおよびINA応答性を示す図である。
【図9】薬剤含有ゲランガム培地で育成したWRKY45-P4R3::GUS組換えイネのBTH応答性を示す図である。
【発明を実施するための最良の形態】
【0012】
以下、本発明を詳細に説明する。
【0013】
1.核酸構築物
本発明に係る核酸構築物は、以下の(a)、(b)又は(c)のポリヌクレオチドと、目的タン
パク質をコードするポリヌクレオチドとを連結したものである。
(a)配列番号1の塩基配列からなるポリヌクレオチド
(b)配列番号1の塩基配列において1若しくは複数の塩基が欠失、置換若しくは付加さ
れた塩基配列からなり、且つ、病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
(c)配列番号1の塩基配列と相補的な塩基配列からなるDNA断片とストリンジェントな条件下でハイブリダイズし、かつ病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
【0014】
ここで、配列番号1の塩基配列は、イネのWRKY45(OsWRKY45)遺伝子の転写開始点上流1965から3'-UTRの直前までの領域(但し、WRKY45遺伝子のコード領域における終止コドンは含まない)を含む塩基配列である。すなわち、配列番号1の塩基配列は、イネにおけるWRKY45遺伝子の転写開始点上流1965塩基とWRKY45遺伝子を含む3749塩基からなる。
【0015】
また、上記(b)において、「複数の塩基」とは、例えば1〜300個の塩基、好ましく
は1〜200個の塩基、より好ましくは1〜100個の塩基、更に好ましくは1〜50個の塩基、更に好ましくは1〜10個の塩基、更に好ましくは1〜5個の塩基を意味する。これら「複数の塩基」は、上記個数の塩基が連続する領域でも良いし、不連続の複数領域でもよい。また、配列番号1の塩基配列において、1若しくは複数の塩基が欠失、置換若しくは付加され得る領域としては、特に限定されないが、配列番号1の塩基配列に含まれる、転写に関与するモチーフ配列を除く領域であることが好ましい。モチーフ配列としては、例えば、WRKY転写因子の結合部位モチーフ(配列番号1における771〜775番目および1665〜1669番目の領域)、ACGT配列モチーフ(配列番号1における101〜104番目および1270〜1273番目の領域)、TGA配列モチーフ(配列番号1における42〜44番目および1452〜1454番目の領域)、活性化配列-1要素(activation sequence-1 elements)のコア配列で
あるTGACGT/Cモチーフ(配列番号1における1179〜1184番目および1254〜1259番目の領域)、MYBモチーフ(配列番号1における1645〜1650番目の領域)及びMYCモチーフ(配列番号1における240〜245番目および1220〜1225番目の領域)を挙げることができる。
【0016】
また、配列番号1における771〜1669番目の領域は、本発明に係る核酸構築物における
病害ストレス及び病害抵抗性誘導剤に対する応答性に深く関与する領域と考えられる。よって、1若しくは複数の塩基が欠失、置換若しくは付加され得る領域としては、配列番号1における771〜1669番目の領域を除く領域であることが好ましい。
【0017】
さらに、上記(c)において、ストリンジェントな条件とは、配列類似性が高い一対のポ
リヌクレオチドが特異的にハイブリダイズできる条件を意味する。配列類似性が高い一対のポリヌクレオチドとは、例えば90%、好ましくは95%、より好ましくは97%の同
一性を有するポリヌクレオチドを意味する。一対のポリヌクレオチド間の同一性は、Blast等の相同性検索ソフトウェアをデフォルトの設定で利用して算出することができる。こ
のようなストリンジェントな条件とは、例えば、ナトリウム濃度が25〜500mM、好ましく
は25〜300mMであり、温度が42〜68℃、好ましくは42〜65℃である。より具体的には、5×SSC(83mM NaCl、83mMクエン酸ナトリウム)、温度42℃である。
【0018】
すなわち、上記(c)の要件は、配列番号1の塩基配列に対して90%、好ましくは95
%、より好ましくは97%の同一性を有するポリヌクレオチドからなり、かつ病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチドと言い換えることができる。
【0019】
一方、上述した(a)、(b)又は(c)のポリヌクレオチドと連結する、目的タンパク質をコ
ードするポリヌクレオチドは、特に限定されず、如何なるポリヌクレオチドであってもよい。すなわち、目的タンパク質としては、如何なるタンパク質でもよい。また、目的タンパク質をコードするポリヌクレオチドとは、当該タンパク質をコードするセンス鎖及びアンチセンス鎖のいずれも意味する。目的タンパク質をコードするポリヌクレオチドの一例としては、レポーター遺伝子を挙げることができる。レポーター遺伝子としては、β-グ
ルクロニダーゼ(GUS)遺伝子、緑色蛍光タンパク質(GFP)遺伝子、ルシフェラーゼ(LUC)遺伝子等を挙げることができる。これらレポーター遺伝子の発現量を測定することで
、上述した(a)、(b)又は(c)のポリヌクレオチドによる発現誘導活性を解析することがで
きる。
【0020】
ところで、所定のポリヌクレオチドが「病害ストレス及び病害抵抗性誘導剤に対する応答性を示す」ものであるか否かは、上記目的タンパク質の発現パターンを解析することで判断できる。具体的には上記目的タンパク質をコードするポリヌクレオチドとして、所謂レポーター遺伝子を利用する。そして、この核酸構築物を用いて形質転換植物を作製する。得られた形質転換植物における上記レポーター遺伝子の発現量を、病害ストレスの付加の有無又は病害抵抗性誘導剤の接触/非接触の条件で測定する。病害ストレスの付加条件
や病害抵抗性誘導剤の接触条件におけるレポーター遺伝子の発現量が、病害ストレス無し条件や病害抵抗性誘導剤の非接触条件におけるレポーター遺伝子の発現量と比較して有意に大であれば、当該ポリヌクレオチドは「病害ストレス及び病害抵抗性誘導剤に対する応答性を示す」と判断できる。
【0021】
このとき、病害ストレスとは、カビ、細菌、ウイルス等の植物病害原因微生物又はウイルスを感染させるストレスを意味する。病害抵抗性誘導剤としては、ベンゾチアジアゾールS-メチルエステル(BTH)、ジクロロイソニコチン酸(INA)、プロベナゾール、チアジアニル、イソチアニル、等を意味する。
【0022】
2.発現ベクター
本発明の発現ベクターは、適当なベクターに上記核酸構築物を連結(挿入)することにより得ることができる。上述した核酸構築物を挿入するためのベクターは、宿主中で複製可能なものであれば特に限定されず、例えばプラスミド、シャトルベクター、ヘルパープラスミドなどが挙げられる。
【0023】
プラスミド DNAとしては、大腸菌由来のプラスミド(例えばpBR322、pBR325、pUC118、pUC119、pUC18、pUC19、pBluescript等)、枯草菌由来のプラスミド(例えばpUB110、pTP5等)、酵母由来のプラスミド(例えばYEp13、YCp50等)などが挙げられ、ファージDNAとしてはλファージ(Charon4A、Charon21A、EMBL3、EMBL4、λgt10、λgt11、λZAP等)が挙げられる。さらに、レトロウイルス又はワクシニアウイルスなどの動物ウイルス、バキュロウイルスなどの昆虫ウイルスベクターを用いることもできる。
【0024】
ベクターに核酸構築物を挿入するには、まず、精製された核酸構築物を適当な制限酵素で切断し、適当なベクターDNAの制限酵素部位又はマルチクローニングサイトに挿入して
ベクターに連結する方法などが採用される。
【0025】
3.形質転換体の作製
本発明の形質転換体は、本発明の発現ベクターを宿主中に導入することにより得ることができる。ここで、宿主としては、プロモーター又は目的遺伝子を発現できるものであれば特に限定されるものではないが、植物が好ましい。宿主が植物である場合は、形質転換植物(トランスジェニック植物)は以下のようにして得ることができる。
【0026】
本発明において形質転換の対象となる植物は、植物体全体、植物器官(例えば葉、花弁
、茎、根、種子等)、植物組織(例えば表皮、師部、柔組織、木部、維管束等)又は植物培
養細胞のいずれをも意味するものである。形質転換に用いられる植物としては、アブラナ科、イネ科、ナス科、マメ科等に属する植物(下記参照)が挙げられるが、これらの植物に限定されるものではない。
【0027】
アブラナ科:シロイヌナズナ(Arabidopsis thaliana)
ナス科:タバコ(Nicotiana tabacum)
イネ科:トウモロコシ(Zea mays) 、イネ(Oryza sativa)
マメ科:ダイズ(Glycine max)
【0028】
上記組換えベクターは、通常の形質転換方法、例えば電気穿孔法(エレクトロポレーション法)、アグロバクテリウム法、パーティクルガン法、PEG法等によって植物中に導入
することができる。
【0029】
例えばエレクトロポレーション法を用いる場合は、パルスコントローラーを備えたエレクトロポレーション装置により、電圧500〜1600V、25〜1000μF、20〜30msecの条件で処
理し、遺伝子を宿主に導入する。
【0030】
また、パーティクルガン法を用いる場合は、植物体、植物器官、植物組織自体をそのまま使用してもよく、切片を調製した後に使用してもよく、プロトプラストを調製して使用してもよい。このように調製した試料を遺伝子導入装置(例えばBio-Rad社のPDS-1000/He等)を用いて処理することができる。処理条件は植物又は試料により異なるが、通常は1000〜1800psi程度の圧力、5〜6cm程度の距離で行う。
【0031】
また、植物ウイルスをベクターとして利用することによって、目的遺伝子を植物体に導入することができる。利用可能な植物ウイルスとしては、例えば、カリフラワーモザイクウイルスが挙げられる。すなわち、まず、ウイルスゲノムを大腸菌由来のベクターなどに挿入して組換え体を調製した後、ウイルスのゲノム中に、これらの目的遺伝子を挿入する。このようにして修飾されたウイルスゲノムを制限酵素によって組換え体から切り出し、植物宿主に接種することによって、目的遺伝子を植物宿主に導入することができる。
【0032】
アグロバクテリウムのTiプラスミドを利用する方法においては、アグロバクテリウム(Agrobacterium)属に属する細菌が植物に感染すると、それが有するプラスミドDNAの一部を植物ゲノム中に移行させるという性質を利用して、目的遺伝子を植物宿主に導入する。アグロバクテリウム属に属する細菌のうちアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)は、植物に感染してクラウンゴールと呼ばれる腫瘍を形成し、また
、アグロバクテリウム・リゾゲネス(Agrobacteriumu rhizogenes)は、植物に感染して毛
状根を発生させる。これらは、感染の際にTiプラスミド又はRiプラスミドと呼ばれる各々
の細菌中に存在するプラスミド上のT-DNA領域(Transferred DNA)と呼ばれる領域が植物中に移行し、植物のゲノム中に組み込まれることに起因するものである。
【0033】
Ti又はRiプラスミド上のT-DNA領域中に、植物ゲノム中に組み込みたいDNAを挿入しておけば、アグロバクテリウム属の細菌が植物宿主に感染する際に目的とするDNAを植物ゲノ
ム中に組込むことができる。
【0034】
形質転換の結果得られる腫瘍組織やシュート、毛状根などは、そのまま細胞培養、組織培養又は器官培養に用いることが可能であり、また従来知られている植物組織培養法を用い、適当な濃度の植物ホルモン(オーキシン、サイトカイニン、ジベレリン、アブシジン酸、エチレン、ブラシノライド等)の投与などにより植物体に再生させることができる。
【0035】
ところで、本発明に係るDNA断片と、当該DNA断片による発現制御可能なかたちで組み込まれたレポーター遺伝子とを有する発現ベクターにより形質転換された形質転換体に検査対象の化合物を接触させ、形質転換体におけるレポーター遺伝子の発現を検出することによって、病害抵抗性誘導活性を示す化合物をスクリーニングすることができる。
【0036】
本発明のベクターは、上記植物宿主に導入するのみならず、大腸菌(Escherichia coli)等のエッシェリヒア属、バチルス・ズブチリス(Bacillus subtilis)等のバチルス属、又
はシュードモナス・プチダ(Pseudomonas putida)等のシュードモナス属に属する細菌、サッカロミセス・セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス・ポンベ(Schizosaccharomyces pombe)等の酵母、COS細胞、CHO細胞等の動物細胞、あるいはSf9等の昆虫細胞などに導入して形質転換体を得ることもできる。大腸菌、酵母等の細菌を宿主とする場合は、本発明の組換えベクターが該細菌中で自律複製可能であると同時に、本発明のDNA断片、リボソーム結合配列、目的遺伝子、転写終結配列により構成されていること
が好ましい。また、本発明のDNAを制御する遺伝子が含まれていてもよい。
【0037】
細菌への組換えベクターの導入方法は、細菌にDNAを導入する方法であれば特に限定さ
れるものではない。例えばカルシウムイオンを用いる方法、エレクトロポレーション法等が挙げられる。
【0038】
酵母を宿主とする場合は、例えばサッカロミセス・セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス・ポンベ(Schizosaccharomyces pombe)などが用いられる。酵
母への組換えベクターの導入方法は、酵母にDNAを導入する方法であれば特に限定されず
、例えばエレクトロポレーション法、スフェロプラスト法、酢酸リチウム法等が挙げられる。
【0039】
動物細胞を宿主とする場合は、サル細胞COS-7、Vero、チャイニーズハムスター卵巣細
胞(CHO細胞)、マウスL細胞などが用いられる。動物細胞への組換えベクターの導入方法としては、例えばエレクトロポレーション法、リン酸カルシウム法、リポフェクション法等が挙げられる。
【0040】
昆虫細胞を宿主とする場合は、Sf9細胞などが用いられる。昆虫細胞への組換えベクタ
ーの導入方法としては、例えばリン酸カルシウム法、リポフェクション法、エレクトロポレーション法などが挙げられる。
【0041】
遺伝子が宿主に組み込まれたか否かの確認は、PCR法、サザンハイブリダイゼーション
法、ノーザンハイブリダイゼーション法等により行うことができる。例えば、形質転換体からDNAを調製し、DNA特異的プライマーを設計してPCRを行う。PCRは、前記プラスミドを調製するために使用した条件と同様の条件で行われる。その後は、増幅産物についてアガ
ロースゲル電気泳動、ポリアクリルアミドゲル電気泳動又はキャピラリー電気泳動等を行い、臭化エチジウム、SYBR Green液等により染色し、そして増幅産物を1本のバンドとし
て検出することにより、形質転換されたことを確認する。また、予め蛍光色素等により標識したプライマーを用いてPCRを行い、増幅産物を検出することもできる。さらに、マイ
クロプレート等の固相に増幅産物を結合させ、蛍光又は酵素反応等により増幅産物を確認する方法も採用してもよい。
【0042】
4.植物の製造
本発明においては、上記形質転換植物細胞等から形質転換植物体に再生することができる。再生方法としては、カルス状の形質転換細胞をホルモンの種類、濃度を変えた培地へ移して培養し、不定胚を形成させ、完全な植物体を得る方法が採用される。使用する培地としては、LS培地、MS培地などが例示される。また、得られた形質転換植物体から植物種子を得て、該植物種子から植物体を生産することもできる。形質転換植物体から植物種子を得るには、例えば、形質転換植物体を発根培地から採取し、水を含んだ土を入れたポットに移植し、一定温度下で生育させて、花を形成させ、最終的に種子を形成させる。また、種子から植物体を生産するには、例えば、形質転換植物体上で形成された種子が成熟したところで、単離して、水を含んだ土に播種し、一定温度、照度下で生育させることにより植物体を生産する。
【0043】
すなわち、上述のような手法により、本発明に係る核酸構築物を有する植物体を製造することができる。得られた植物体は、病害ストレス及び病害抵抗性誘導剤に応答して目的タンパク質を発現する特徴を有する。目的タンパク質として、植物体に対して病害抵抗性を付与又は強化するタンパク質を適用すれば、病害ストレス耐性植物となる。
【0044】
5.スクリーニング方法
上述した形質転換植物を利用することによって、病害抵抗性誘導剤のスクリーニング方法を構築することができる。本スクリーニング方法では、上述した(a)、(b)又は(c)のポ
リヌクレオチドと連結する、目的タンパク質をコードするポリヌクレオチドをレポーター遺伝子とする。
【0045】
本スクリーニング方法では、先ず、上述した形質転換植物に対して検査対象の化合物を接触させる。ここで、検査対象の化合物とは、特に限定されず如何なる物質であってもよい。検査対象の化合物としては、単独の物質であってもよいし、複数の構成成分からなる混合物であってもよい。検査対象の化合物としては、例えば植物からの抽出物のように未同定の物質を含むような構成であってもよいし、既知の組成物を所定の組成比で含むような構成であってもよい。また、検査対象の化合物としては、タンパク質、核酸、脂質、多糖類、有機化合物及び無機化合物のいずれでもよい。
【0046】
次に、形質転換植物における上記レポーター遺伝子の発現を検出する。レポーター遺伝子としてGUS遺伝子を使用した場合には、形質転換植物におけるGUS活性を公知の手法により測定することができる。レポーター遺伝子として他の遺伝子を使用した場合には、レポーター遺伝子に応じて公知の手法でその発現量を測定すればよい。
【0047】
そして上記検査対象の化合物を接触させたときの上記レポーター遺伝子の発現量が亢進した場合に当該化合物を病害抵抗性誘導剤と判定することができる。なお、ここで、「病害抵抗性誘導剤と判定する」とは、BTHやINA等の病害抵抗性誘導剤と同様に、WRKY45(OsWRKY45)遺伝子に対する発現誘導能を有する化合物であると判定することと同義である。
【実施例】
【0048】
以下、実施例を用いて本発明をより詳細に説明するが、本発明の技術的範囲は以下の実
施例に限定されるものではない。
【0049】
〔実施例1〕
WRKY45遺伝子のプロモーター配列の制御下にレポーター遺伝子を持つベクタープラスミドの構築
本実施例では、図1に示すように、WRKY45遺伝子の上流領域であるP4-R1間(転写開始
点上流-1965塩基から5'-UTRまでの領域、2077塩基(配列番号2))、及び上流領域と転
写領域からなるP4-R3間(転写開始点上流-1965から3'-UTRの直前までの領域、3749塩基(配列番号1))を、イネゲノムDNAからPCR増幅した。そして、図2に示すように、PCRで
得られた増幅断片をDNAベクターpSAMHDN627-M2GUSのNcoI制限サイトに挿入してWRKY45-P4R1::GUSベクタープラスミド及びWRKY45-P4R3::GUSベクタープラスミドを作製した。なお
、WRKY45-P4R3::GUSベクタープラスミドにおいて、レポーター遺伝子であるGUS遺伝子は
、WRKY45との融合タンパク質として発現する。
【0050】
WRKY45-P4R1::GUS及びWRKY45-P4R3::GUSのA. tumefaciens EHA101株への導入
上述の2種類のプラスミドをAgrobacterium tumefaciens EHA101株に導入するために、Agrobacterium tumefaciens EHA101株を、5mlのYEB培地(0.1%酵母抽出物、0.5%肉抽出
物、0.5%ペプトン、0.5%スクロース、0.05%MgSO4・7H2O)において、30℃で一晩振盪
培養した。次いで、1リットルフラスコ中で200mlのYEB培地に5mlの上記培養物を加え、
さらに30℃で5〜6時間培養した。遠心分離(4000rpmで5分間)により菌体を集め、そして100mlの10mM Tris-HCl(pH 8.0)中に懸濁した。再度、遠心分離を行い、得られた菌体を2mlのYEB培地中に懸濁した。微量遠心チューブ中でこの懸濁液の200μlと0.5μgのpBE7133H-Thioninを含む100μlのDNA溶液とを混合し、ドライアイス/エタノール浴中で凍結さ
せた(5分間)。次いで、37℃の温浴中で融解し、25分間放置した。その後、2mlのYEB培
地を添加し、30℃で1時間、振盪培養した。100μlの培養液をカナマイシン(50μg/ml)およびハイグロマイシン(50μg/ml)を含有するYEB培地上に塗布し、そして30℃で
約36時間の培養によりAgrobacterium tumefaciens EHA101株の耐性菌を得た。このAgrobacterium tumefaciens EHA101株中のGUSレポーターカセットをアルカリ-SDS法により単離
して、制限酵素分析によりその存在および構造を確認した。
【0051】
形質転換イネの作出
滅菌したイネ(Oryza sativa, cv. Nipponbare)の種子を、2mg/mlの2.4-ジクロロフェノキシ酢酸(以下2.4-D)を含むMS培地(T. Murashige et al., Physiol. Plant., 15, 473 (1962))で27℃で2週間培養し、カルスを形成させた。このカルスを共存培地(2mg/ml
2.4-Dおよび1g/l カザミノ酸を含むMS培地)に移植し、27℃で培養を行った。培養3日
目に、カナマイシンおよびハイグロマイシンを含むYEB培地で上記GUSレポーターカセットを含むAgrobacterium tumefaciens EHA101株を増殖させ、遠心分離した。ペレット化した菌体をLB培地に懸濁させた後、アセトシリンゴンを添加して感染用のAgrobacterium tumefaciens EHA101株菌液を作製した。この菌液を30℃で20分間保温した。培養4日目に感
染用Agrobacterium tumefaciens EHA101株菌液に上記カルス塊を加え、30℃で15分間緩やかに撹拌して、このカルス塊を感染させた。15分後にカルスを回収し、共存培地に置床した。27℃、16時間日長で3日間培養し、次いで、カルベニシリンを含むLB培地にて30℃で
1時間培養し、その後、カルスのみを回収して選抜(増殖)培(500mg/l カルベニシリン、50mg/l ハイグロマイシンを含む共存培地)に置床した。これを、27℃、16時間日長で2週間培養した。新たに増殖してきた黄白色のカルスを選抜(再分化前処理)培地(1mg/l2.4-D、0.5mg/l BAP、2g/l カザミノ酸、20g/l ショ糖、30g/l ソルビトール、500mg/l カルベニシリン、100mg/l ハイグロマイシンを含むN6培地)に移植し、約2週間培養した後、選抜(再分化)培地(0.01mg/l β-ナフタレン酢酸(NAA)、0.1mg/l BAP、1g/lカ
ザミノ酸、500mg/lカルベニシリン、100mg/lハイグロマイシンを含むN6培地)に移植した(Toki et al., Plant J., 47, 969 (2006))。約2〜3週間で再分化した形質転換イ
ネ(T0)が得られた。
【0052】
形質転換イネ後代の作出
形質転換イネ当代(T0)を隔離温室内で栽培してT1種子を得た。このT1種子をさら
に栽培して得られた数種類のT2種子を100mg/L ハイグロマイシンを含むゲランガム培地
に播種してハイグロマイシン抵抗性を検定した。供試した個体のすべてがハイグロマイシン抵抗性を示したものをホモ接合体とした。なお、ゲランガム培地はホグラント mix 1
缶とゲルライト 3gを1Lの蒸留水に懸濁させた後、電子レンジで加温溶解させた。この15mlを管ビンに分注し、終濃度が100mg/Lとなるようにハイグロマイシンを添加した。
【0053】
イネいもち病菌及び白葉枯病菌の接種
イネいもち病菌(Magnaporthe grisea, race 007.0)の胞子を0.01% Silwet L77水溶液に懸濁し(1〜2x105胞子/ml)、28℃(昼)/23℃(夜)の温室内で栽培した4葉期のイネ
(T0)幼苗に噴霧した後、接種箱内で暗条件下約24時間保湿後、温室に戻して栽培を続
けた。白葉枯病菌を接種するには、白葉枯病菌(Xanthomonas oryzae pv. oryzae, strain T7174)をOD600=0.03になるように水に懸濁し、この液に浸したハサミで6〜7葉期イネの最上位完全展開葉の先端から約3cmの部分を切断して感染させた(Kauffman et al., Plant Dis. Rep., 57, 537 (1973))。
【0054】
形質転換イネの栽培及び植物ホルモン処理
28℃(昼)/23℃(夜)の温室内で栽培した4葉期のイネ(T0)幼苗の第4葉身を長さ0.5〜1.0cmの葉片に切り、各種植物ホルモンを含む0.01% Silwet L77水溶液又は溶媒のみ(mock)に浸漬し、明条件下30℃で約6時間処理した。処理に用いた植物ホルモンとその濃
度は以下の通りである。すなわち、Sodium salicylate (SA, 1 mM)、Indole-3-acetic acid (IAA, 50 μM)、gibberellin A3 (GA3, 50 μM), Kinetin (CK, 50 μM)、1-aminocyclopropane-1-carboxylic acid (ACC, 50 μM)、abscisic acid ((±)-cis-trans, ABA, 50 μM)、methyl jasmonate (ME-JA, 50 μM)及びbrassinolide (BR, 2 μM)である。
【0055】
形質転換イネの栽培及び病害抵抗性誘導剤処理その1
28℃(昼)/23℃(夜)の温室内で栽培した4葉期のイネ(T0)幼苗の第4葉身を長さ0.5〜1.0cmの葉片に切り、50μMのBTHを含む0.01% Silwet L77水溶液又は溶媒のみ(mock)に浸漬し、明条件下30℃で約6時間処理した。
【0056】
形質転換イネの栽培及び病害抵抗性誘導剤処理その2
組換えイネホモ接合体(T2)の幼苗を直径6cmの素焼き鉢に移植して、32℃(昼)/27
℃(夜)で、4葉期後期まで栽培した。これに400μMのBTHおよび333倍希釈のクミテンを
含む1%アセトン水溶液または400μMのINAおよび333倍希釈のクミテンを含む1%アセトン溶液を100 ml土壌潅注処理した。無処理区は333倍希釈のクミテンを含む1%アセトン溶液処
理区とし、薬剤処理後3日目の4葉をサンプリングした(図3)。
【0057】
形質転換イネの栽培及び病害抵抗性誘導剤処理その3
組換えイネ ホモ接合体(T2)の5粒をBTH含有ゲランガム培地中に軽く埋め込み、蒸留水を入れたビーカーと一緒に透明なケースに入れ、ラップでケースの口を塞いだ。2-3葉
期まで27℃の恒温室において蛍光照明下で栽培し、地上部全てをサンプルとした(図4)
。BTHの終濃度は10-7 M、10-6 M、10-5M又は10-4 Mとし、アセトンを1%添加したものをコントロールとした。
【0058】
GUS染色
上述のイネいもち病菌を接種したイネの葉身は、90%のアセトン液で2〜3秒間洗浄する
ことにより表面のワックス層を除去した後、GUS染色液に浸して37℃で2〜4時間発色さ
せた。一方、植物ホルモン処理またはBTH処理したイネの葉片はそのままGUS染色液(下記)に浸し、37℃で2〜4時間発色させた(Gallagher, GUS protocols, Academic Press, Inc., pp. 103-104 (1992))。
【0059】
GUS染色液の組成:1.0 mM X-glucuronide、10 mM EDTA、0.5 mM Potassium Ferricyanide、0.5 mM Potassium Ferrocyanide、0.1% Triton X-100、20% Methanol、50 mM Potassium phosphate buffer、pH 7.0
【0060】
GUS活性測定
上述の素焼き鉢で栽培して薬剤処理後にサンプリングしたイネおよび薬剤含有ゲランガム培地で栽培したイネの葉身を、液体窒素を注いだ乳鉢中で粉砕した後、エッペンドルフチューブに入れて100μlのEX buffer(下記)を加えて激しく攪拌した。その後15000 rpm、4℃で5分間遠心し、上清を回収した。回収した上清10μlを100μl 4- MUG/EX bufferへ懸濁し、37℃で1時間インキュベートした。コントロールとして100μl 4- MUG/EX bufferのみもインキュベートした。インキュベート後、1.4 mlの0.2 M Na2CO3を加え、反応を停止した(コントロールも同様)。これを、GUS活性測定するまでは遮光して氷中に入れた。
【0061】
EX bufferの組成:5mM EDTA 200μl, 0.1% TritonX-100, 10mM 2-mercaptoethanol, 50mM
NaHPO4 (pH7.0)
【0062】
GUS活性は、backgroundとして0.2 M Na2CO3でゼロ補正を行った後、EX355、EM460で測
定した。検量線は4-methyl umbelliferone(4-MU)を用いて作成した。
【0063】
結果:植物ホルモン応答性
WRKY45-P4R1::GUS組換えイネ(T0)の葉片は植物ホルモンの有無に関わらずGUS活性を示した(図5)。一方、WRKY45-P4R3::GUS組換えイネ(T0)においては、mock処理(-SA
)ではGUS活性は認められないが、SA処理(+SA)により顕著にGUS活性が誘導された(図5)。他のホルモン処理によるGUS活性の誘導は認められなかった。これらの結果から、RKY45-P4R3::GUSコンストラクトを持つ組換えイネは、SAに対して特異的に応答してGUS活性
を発現することが明らかとなった。
【0064】
この結果から、WRKY45遺伝子における病害ストレスや病害抵抗性誘導剤への応答性は、WRKY45遺伝子の上流領域のみでは不十分であり、イントロンも含むWRKY45遺伝子の転写領域が必要であることが明らかとなった。
【0065】
結果:病原菌感染に対する応答性
WRKY45-P4R3::GUS組換えイネ(T0)にイネいもち病菌を接種した結果、感染部位周辺
の組織において接種後2日および3日後にGUS活性が検出された(図6)。白葉枯病菌接種後のイネ葉身においては、接種後2日目において接種部位から一定距離はなれた部位にGUS活性が検出された(図7)。いずれの場合も、非感染上位葉ではGUS活性は観察されなか
った(データ非表示)。
【0066】
なお、図7に示す写真において、右側の葉身切断面がイネ白葉枯病菌の接種部位であり、GUS活性は当該接種部位のみではなく図中左方に広がって観察される。
【0067】
結果:病害抵抗性誘導剤応答性
WRKY45-P4R3::GUS組換えイネ(T0)においては、SA処理と同様にBTH処理によって顕著にGUS活性が誘導されることがGUS染色から明らかとなった(データ非表示)。そこで、WRKY45-P4R3::GUS組換えイネホモ接合体(T2)を材料として、BTH処理により誘導されるGUS活性を定量的に測定した。その結果、素焼き鉢で栽培してBTH処理後にサンプリングした
イネ葉身では、GUS活性が顕著に誘導されることが明らかとなった(図8)。また、BTHと
同様に病害抵抗性誘導剤として知られているジクロロイソニコチン酸(INA)を処理した
場合もGUS活性が顕著に誘導された(図8)。一方、BTH含有ゲランガム培地で育成したイ
ネにおいても薬剤処理濃度の増加に伴うGUS活性の誘導が認められたが、薬害が発生する
処理濃度区ではGUS活性の誘導が小さくなった(図9)。
【技術分野】
【0001】
本発明は、病害ストレス及び病害抵抗性誘導剤に対する応答性を示す核酸構築物、当該核酸構築物を有する発現ベクター、当該発現ベクターを有する形質転換体並びにトランスジェニック植物、病害ストレス等による遺伝子発現誘導方法及び病害抵抗性誘導剤のスクリーニング方法に関する。
【背景技術】
【0002】
陸生植物は、種々な植物病原体の感染に曝される。病害ストレスに植物が曝されると、特定の遺伝子発現といった生化学的、生理学的及び分子的な反応が誘導され、病害ストレスに対する抵抗性を示すことが知られている。この反応は、植物細胞内における刺激の認識及びシグナル伝達の結果として進行する。一方、このような植物の特異的反応を誘導する化合物は病害抵抗性誘導剤と呼ばれており、例えば、ベンゾチアジアゾールS-メチルエステル(BTH)やジクロロイソニコチン酸(INA)などが知られている(非特許文献1:石井英夫, 植物防疫, 53, 10, 393-397(1999))。病害ストレスや病害抵抗性誘導剤によ
り引き起こされる植物の抵抗性誘導メカニズムの詳細については未だ完全に解明されていないが、植物の抵抗性誘導の指標となる物質は、病害抵抗性誘導剤の開発等に有効に利用できる。
【0003】
ところで、ベンゾチアジアゾール(BTH)などの病害抵抗性誘導剤は、植物の防御応答
シグナル伝達経路(サリチル酸経路)に作用し、病原体感染時における迅速な抵抗性発現への準備効果(プライミング効果)により病害抵抗性を高めることが知られている。BTH
処理により、イネにおいて発現誘導される転写因子としてWRKY45(ワーキー45)が知られている。WRKY45は、BTHにより転写誘導される遺伝子のうち、300近くの遺伝子の転写を制御しており、サリチル酸経路を介する抵抗性誘導において非常に重要な役割を担っている(非特許文献2:Shimono et al., The Plant Cell, 19, 2064 (2007)、非特許文献3:
高辻博志ら、植物感染生理談話会論文集, 44, 1-10 (2008)及び特許文献1:WO2006/126671)。
【0004】
しかしながら、病害抵抗性誘導剤処理や病害ストレス付加に起因するWRKY45遺伝子の発現メカニズム等については未だ知られていない。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】石井英夫, 植物防疫, 53, 10, 393-397(1999)
【非特許文献2】Shimono et al., The Plant Cell, 19, 2064 (2007)
【非特許文献3】高辻博志ら, 植物感染生理談話会論文集, 44, 1-10 (2008)
【特許文献】
【0006】
【特許文献1】WO2006/126671
【発明の概要】
【発明が解決しようとする課題】
【0007】
そこで、本発明は、イネにおけるWRKY45遺伝子の応答性を明らかにし、病害ストレス及び病害抵抗性誘導剤に対する応答性を示す新規な核酸構築物及びその利用を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者は、上記課題を解決するため鋭意研究を行った結果、病害ストレスに特異的な発現パターンを示すWRKY45遺伝子の応答性メカニズムの一端を明らかにし、病害ストレス及び病害抵抗性誘導剤に対する応答性を示す核酸構築物を単離することに成功し、本発明を完成するに至った。
【0009】
すなわち、本発明は、以下を包含する。
(1)以下の(a)、(b)又は(c)のポリヌクレオチドと、目的タンパク質をコードするポリ
ヌクレオチドとを連結してなる核酸構築物。
(a)配列番号1の塩基配列からなるポリヌクレオチド
(b)配列番号1の塩基配列において1若しくは複数の塩基が欠失、置換若しくは付加さ
れた塩基配列からなり、且つ、病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
(c)配列番号1の塩基配列と相補的な塩基配列からなるDNA断片とストリンジェントな条件下でハイブリダイズし、かつ病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
(2)上記目的タンパク質をコードするポリヌクレオチドは、レポーター遺伝子のコード領域であることを特徴とする(1)記載の核酸構築物。
(3)上記(1)又は(2)の核酸構築物を含む発現ベクター。
(4)上記(3)記載の発現ベクターを含む形質転換体。
(5)上記(3)記載の発現ベクターを含むトランスジェニック植物。
(6)植物体、植物器官、植物組織又は植物培養細胞である(5)記載のトランスジェニック植物。
(7)上記(5)又は(6)記載のトランスジェニック植物を培養又は栽培する植物の製造方法。
(8)上記(5)又は(6)記載のトランスジェニック植物に病害抵抗性誘導剤を接触させる又は病害ストレスを付加し、上記目的タンパク質をコードする遺伝子の発現を誘導する、遺伝子発現誘導方法。
(9)病害抵抗性誘導剤が、ベンゾチアジアゾールS-メチルエステル(BTH)又はジクロ
ロイソニコチン酸である(8)記載の遺伝子発現誘導方法。
(10)上記(2)記載の核酸構築物を含む発現ベクターを導入されてなる形質転換体に、検査対象の化合物を接触させる工程と、上記形質転換体における上記レポーター遺伝子の発現を検出する工程とを含み、上記検査対象の化合物を接触させることで上記レポーター遺伝子の発現量が亢進した場合に当該化合物を病害抵抗性誘導剤と判定する、病害抵抗性誘導剤のスクリーニング方法。
【発明の効果】
【0010】
本発明によれば、病害ストレス及び病害抵抗性誘導剤に対する応答性を示す全く新規な核酸構築物を提供することができる。また、本発明に係る核酸構築物を利用し、レポーター遺伝子の発現を解析することで病害ストレス及び病害抵抗性誘導剤をスクリーニングすることができる。
【図面の簡単な説明】
【0011】
【図1】OsWRKY45のゲノム構造及びGUS遺伝子をドライブした核酸構築物の構成を模式的に示す図である。
【図2】pSAMHDN627-M2GUSベクタープラスミドのコンストラクトを示す図である。
【図3】BTH処理したWRKY45-P4R3::GUS組換えイネの葉身サンプリング前の写真である。
【図4】BTH含有ゲランガム培地で育成したWRKY45-P4R3::GUS組換えイネのサンプリング前の写真である。
【図5】WRKY45-P4R1::GUS組換えイネのサリチル酸非応答性及びWRKY45-P4R3::GUS組換えイネのサリチル酸応答性を示す図である。
【図6】WRKY45-P4R3::GUS組換えイネのイネいもち病菌感染応答性を示す図である。
【図7】WRKY45-P4R3::GUS組換えイネの白葉枯病菌感染応答性を示す図である。
【図8】素焼き鉢で栽培したWRKY45-P4R3::GUS組換えイネのBTHおよびINA応答性を示す図である。
【図9】薬剤含有ゲランガム培地で育成したWRKY45-P4R3::GUS組換えイネのBTH応答性を示す図である。
【発明を実施するための最良の形態】
【0012】
以下、本発明を詳細に説明する。
【0013】
1.核酸構築物
本発明に係る核酸構築物は、以下の(a)、(b)又は(c)のポリヌクレオチドと、目的タン
パク質をコードするポリヌクレオチドとを連結したものである。
(a)配列番号1の塩基配列からなるポリヌクレオチド
(b)配列番号1の塩基配列において1若しくは複数の塩基が欠失、置換若しくは付加さ
れた塩基配列からなり、且つ、病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
(c)配列番号1の塩基配列と相補的な塩基配列からなるDNA断片とストリンジェントな条件下でハイブリダイズし、かつ病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
【0014】
ここで、配列番号1の塩基配列は、イネのWRKY45(OsWRKY45)遺伝子の転写開始点上流1965から3'-UTRの直前までの領域(但し、WRKY45遺伝子のコード領域における終止コドンは含まない)を含む塩基配列である。すなわち、配列番号1の塩基配列は、イネにおけるWRKY45遺伝子の転写開始点上流1965塩基とWRKY45遺伝子を含む3749塩基からなる。
【0015】
また、上記(b)において、「複数の塩基」とは、例えば1〜300個の塩基、好ましく
は1〜200個の塩基、より好ましくは1〜100個の塩基、更に好ましくは1〜50個の塩基、更に好ましくは1〜10個の塩基、更に好ましくは1〜5個の塩基を意味する。これら「複数の塩基」は、上記個数の塩基が連続する領域でも良いし、不連続の複数領域でもよい。また、配列番号1の塩基配列において、1若しくは複数の塩基が欠失、置換若しくは付加され得る領域としては、特に限定されないが、配列番号1の塩基配列に含まれる、転写に関与するモチーフ配列を除く領域であることが好ましい。モチーフ配列としては、例えば、WRKY転写因子の結合部位モチーフ(配列番号1における771〜775番目および1665〜1669番目の領域)、ACGT配列モチーフ(配列番号1における101〜104番目および1270〜1273番目の領域)、TGA配列モチーフ(配列番号1における42〜44番目および1452〜1454番目の領域)、活性化配列-1要素(activation sequence-1 elements)のコア配列で
あるTGACGT/Cモチーフ(配列番号1における1179〜1184番目および1254〜1259番目の領域)、MYBモチーフ(配列番号1における1645〜1650番目の領域)及びMYCモチーフ(配列番号1における240〜245番目および1220〜1225番目の領域)を挙げることができる。
【0016】
また、配列番号1における771〜1669番目の領域は、本発明に係る核酸構築物における
病害ストレス及び病害抵抗性誘導剤に対する応答性に深く関与する領域と考えられる。よって、1若しくは複数の塩基が欠失、置換若しくは付加され得る領域としては、配列番号1における771〜1669番目の領域を除く領域であることが好ましい。
【0017】
さらに、上記(c)において、ストリンジェントな条件とは、配列類似性が高い一対のポ
リヌクレオチドが特異的にハイブリダイズできる条件を意味する。配列類似性が高い一対のポリヌクレオチドとは、例えば90%、好ましくは95%、より好ましくは97%の同
一性を有するポリヌクレオチドを意味する。一対のポリヌクレオチド間の同一性は、Blast等の相同性検索ソフトウェアをデフォルトの設定で利用して算出することができる。こ
のようなストリンジェントな条件とは、例えば、ナトリウム濃度が25〜500mM、好ましく
は25〜300mMであり、温度が42〜68℃、好ましくは42〜65℃である。より具体的には、5×SSC(83mM NaCl、83mMクエン酸ナトリウム)、温度42℃である。
【0018】
すなわち、上記(c)の要件は、配列番号1の塩基配列に対して90%、好ましくは95
%、より好ましくは97%の同一性を有するポリヌクレオチドからなり、かつ病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチドと言い換えることができる。
【0019】
一方、上述した(a)、(b)又は(c)のポリヌクレオチドと連結する、目的タンパク質をコ
ードするポリヌクレオチドは、特に限定されず、如何なるポリヌクレオチドであってもよい。すなわち、目的タンパク質としては、如何なるタンパク質でもよい。また、目的タンパク質をコードするポリヌクレオチドとは、当該タンパク質をコードするセンス鎖及びアンチセンス鎖のいずれも意味する。目的タンパク質をコードするポリヌクレオチドの一例としては、レポーター遺伝子を挙げることができる。レポーター遺伝子としては、β-グ
ルクロニダーゼ(GUS)遺伝子、緑色蛍光タンパク質(GFP)遺伝子、ルシフェラーゼ(LUC)遺伝子等を挙げることができる。これらレポーター遺伝子の発現量を測定することで
、上述した(a)、(b)又は(c)のポリヌクレオチドによる発現誘導活性を解析することがで
きる。
【0020】
ところで、所定のポリヌクレオチドが「病害ストレス及び病害抵抗性誘導剤に対する応答性を示す」ものであるか否かは、上記目的タンパク質の発現パターンを解析することで判断できる。具体的には上記目的タンパク質をコードするポリヌクレオチドとして、所謂レポーター遺伝子を利用する。そして、この核酸構築物を用いて形質転換植物を作製する。得られた形質転換植物における上記レポーター遺伝子の発現量を、病害ストレスの付加の有無又は病害抵抗性誘導剤の接触/非接触の条件で測定する。病害ストレスの付加条件
や病害抵抗性誘導剤の接触条件におけるレポーター遺伝子の発現量が、病害ストレス無し条件や病害抵抗性誘導剤の非接触条件におけるレポーター遺伝子の発現量と比較して有意に大であれば、当該ポリヌクレオチドは「病害ストレス及び病害抵抗性誘導剤に対する応答性を示す」と判断できる。
【0021】
このとき、病害ストレスとは、カビ、細菌、ウイルス等の植物病害原因微生物又はウイルスを感染させるストレスを意味する。病害抵抗性誘導剤としては、ベンゾチアジアゾールS-メチルエステル(BTH)、ジクロロイソニコチン酸(INA)、プロベナゾール、チアジアニル、イソチアニル、等を意味する。
【0022】
2.発現ベクター
本発明の発現ベクターは、適当なベクターに上記核酸構築物を連結(挿入)することにより得ることができる。上述した核酸構築物を挿入するためのベクターは、宿主中で複製可能なものであれば特に限定されず、例えばプラスミド、シャトルベクター、ヘルパープラスミドなどが挙げられる。
【0023】
プラスミド DNAとしては、大腸菌由来のプラスミド(例えばpBR322、pBR325、pUC118、pUC119、pUC18、pUC19、pBluescript等)、枯草菌由来のプラスミド(例えばpUB110、pTP5等)、酵母由来のプラスミド(例えばYEp13、YCp50等)などが挙げられ、ファージDNAとしてはλファージ(Charon4A、Charon21A、EMBL3、EMBL4、λgt10、λgt11、λZAP等)が挙げられる。さらに、レトロウイルス又はワクシニアウイルスなどの動物ウイルス、バキュロウイルスなどの昆虫ウイルスベクターを用いることもできる。
【0024】
ベクターに核酸構築物を挿入するには、まず、精製された核酸構築物を適当な制限酵素で切断し、適当なベクターDNAの制限酵素部位又はマルチクローニングサイトに挿入して
ベクターに連結する方法などが採用される。
【0025】
3.形質転換体の作製
本発明の形質転換体は、本発明の発現ベクターを宿主中に導入することにより得ることができる。ここで、宿主としては、プロモーター又は目的遺伝子を発現できるものであれば特に限定されるものではないが、植物が好ましい。宿主が植物である場合は、形質転換植物(トランスジェニック植物)は以下のようにして得ることができる。
【0026】
本発明において形質転換の対象となる植物は、植物体全体、植物器官(例えば葉、花弁
、茎、根、種子等)、植物組織(例えば表皮、師部、柔組織、木部、維管束等)又は植物培
養細胞のいずれをも意味するものである。形質転換に用いられる植物としては、アブラナ科、イネ科、ナス科、マメ科等に属する植物(下記参照)が挙げられるが、これらの植物に限定されるものではない。
【0027】
アブラナ科:シロイヌナズナ(Arabidopsis thaliana)
ナス科:タバコ(Nicotiana tabacum)
イネ科:トウモロコシ(Zea mays) 、イネ(Oryza sativa)
マメ科:ダイズ(Glycine max)
【0028】
上記組換えベクターは、通常の形質転換方法、例えば電気穿孔法(エレクトロポレーション法)、アグロバクテリウム法、パーティクルガン法、PEG法等によって植物中に導入
することができる。
【0029】
例えばエレクトロポレーション法を用いる場合は、パルスコントローラーを備えたエレクトロポレーション装置により、電圧500〜1600V、25〜1000μF、20〜30msecの条件で処
理し、遺伝子を宿主に導入する。
【0030】
また、パーティクルガン法を用いる場合は、植物体、植物器官、植物組織自体をそのまま使用してもよく、切片を調製した後に使用してもよく、プロトプラストを調製して使用してもよい。このように調製した試料を遺伝子導入装置(例えばBio-Rad社のPDS-1000/He等)を用いて処理することができる。処理条件は植物又は試料により異なるが、通常は1000〜1800psi程度の圧力、5〜6cm程度の距離で行う。
【0031】
また、植物ウイルスをベクターとして利用することによって、目的遺伝子を植物体に導入することができる。利用可能な植物ウイルスとしては、例えば、カリフラワーモザイクウイルスが挙げられる。すなわち、まず、ウイルスゲノムを大腸菌由来のベクターなどに挿入して組換え体を調製した後、ウイルスのゲノム中に、これらの目的遺伝子を挿入する。このようにして修飾されたウイルスゲノムを制限酵素によって組換え体から切り出し、植物宿主に接種することによって、目的遺伝子を植物宿主に導入することができる。
【0032】
アグロバクテリウムのTiプラスミドを利用する方法においては、アグロバクテリウム(Agrobacterium)属に属する細菌が植物に感染すると、それが有するプラスミドDNAの一部を植物ゲノム中に移行させるという性質を利用して、目的遺伝子を植物宿主に導入する。アグロバクテリウム属に属する細菌のうちアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)は、植物に感染してクラウンゴールと呼ばれる腫瘍を形成し、また
、アグロバクテリウム・リゾゲネス(Agrobacteriumu rhizogenes)は、植物に感染して毛
状根を発生させる。これらは、感染の際にTiプラスミド又はRiプラスミドと呼ばれる各々
の細菌中に存在するプラスミド上のT-DNA領域(Transferred DNA)と呼ばれる領域が植物中に移行し、植物のゲノム中に組み込まれることに起因するものである。
【0033】
Ti又はRiプラスミド上のT-DNA領域中に、植物ゲノム中に組み込みたいDNAを挿入しておけば、アグロバクテリウム属の細菌が植物宿主に感染する際に目的とするDNAを植物ゲノ
ム中に組込むことができる。
【0034】
形質転換の結果得られる腫瘍組織やシュート、毛状根などは、そのまま細胞培養、組織培養又は器官培養に用いることが可能であり、また従来知られている植物組織培養法を用い、適当な濃度の植物ホルモン(オーキシン、サイトカイニン、ジベレリン、アブシジン酸、エチレン、ブラシノライド等)の投与などにより植物体に再生させることができる。
【0035】
ところで、本発明に係るDNA断片と、当該DNA断片による発現制御可能なかたちで組み込まれたレポーター遺伝子とを有する発現ベクターにより形質転換された形質転換体に検査対象の化合物を接触させ、形質転換体におけるレポーター遺伝子の発現を検出することによって、病害抵抗性誘導活性を示す化合物をスクリーニングすることができる。
【0036】
本発明のベクターは、上記植物宿主に導入するのみならず、大腸菌(Escherichia coli)等のエッシェリヒア属、バチルス・ズブチリス(Bacillus subtilis)等のバチルス属、又
はシュードモナス・プチダ(Pseudomonas putida)等のシュードモナス属に属する細菌、サッカロミセス・セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス・ポンベ(Schizosaccharomyces pombe)等の酵母、COS細胞、CHO細胞等の動物細胞、あるいはSf9等の昆虫細胞などに導入して形質転換体を得ることもできる。大腸菌、酵母等の細菌を宿主とする場合は、本発明の組換えベクターが該細菌中で自律複製可能であると同時に、本発明のDNA断片、リボソーム結合配列、目的遺伝子、転写終結配列により構成されていること
が好ましい。また、本発明のDNAを制御する遺伝子が含まれていてもよい。
【0037】
細菌への組換えベクターの導入方法は、細菌にDNAを導入する方法であれば特に限定さ
れるものではない。例えばカルシウムイオンを用いる方法、エレクトロポレーション法等が挙げられる。
【0038】
酵母を宿主とする場合は、例えばサッカロミセス・セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス・ポンベ(Schizosaccharomyces pombe)などが用いられる。酵
母への組換えベクターの導入方法は、酵母にDNAを導入する方法であれば特に限定されず
、例えばエレクトロポレーション法、スフェロプラスト法、酢酸リチウム法等が挙げられる。
【0039】
動物細胞を宿主とする場合は、サル細胞COS-7、Vero、チャイニーズハムスター卵巣細
胞(CHO細胞)、マウスL細胞などが用いられる。動物細胞への組換えベクターの導入方法としては、例えばエレクトロポレーション法、リン酸カルシウム法、リポフェクション法等が挙げられる。
【0040】
昆虫細胞を宿主とする場合は、Sf9細胞などが用いられる。昆虫細胞への組換えベクタ
ーの導入方法としては、例えばリン酸カルシウム法、リポフェクション法、エレクトロポレーション法などが挙げられる。
【0041】
遺伝子が宿主に組み込まれたか否かの確認は、PCR法、サザンハイブリダイゼーション
法、ノーザンハイブリダイゼーション法等により行うことができる。例えば、形質転換体からDNAを調製し、DNA特異的プライマーを設計してPCRを行う。PCRは、前記プラスミドを調製するために使用した条件と同様の条件で行われる。その後は、増幅産物についてアガ
ロースゲル電気泳動、ポリアクリルアミドゲル電気泳動又はキャピラリー電気泳動等を行い、臭化エチジウム、SYBR Green液等により染色し、そして増幅産物を1本のバンドとし
て検出することにより、形質転換されたことを確認する。また、予め蛍光色素等により標識したプライマーを用いてPCRを行い、増幅産物を検出することもできる。さらに、マイ
クロプレート等の固相に増幅産物を結合させ、蛍光又は酵素反応等により増幅産物を確認する方法も採用してもよい。
【0042】
4.植物の製造
本発明においては、上記形質転換植物細胞等から形質転換植物体に再生することができる。再生方法としては、カルス状の形質転換細胞をホルモンの種類、濃度を変えた培地へ移して培養し、不定胚を形成させ、完全な植物体を得る方法が採用される。使用する培地としては、LS培地、MS培地などが例示される。また、得られた形質転換植物体から植物種子を得て、該植物種子から植物体を生産することもできる。形質転換植物体から植物種子を得るには、例えば、形質転換植物体を発根培地から採取し、水を含んだ土を入れたポットに移植し、一定温度下で生育させて、花を形成させ、最終的に種子を形成させる。また、種子から植物体を生産するには、例えば、形質転換植物体上で形成された種子が成熟したところで、単離して、水を含んだ土に播種し、一定温度、照度下で生育させることにより植物体を生産する。
【0043】
すなわち、上述のような手法により、本発明に係る核酸構築物を有する植物体を製造することができる。得られた植物体は、病害ストレス及び病害抵抗性誘導剤に応答して目的タンパク質を発現する特徴を有する。目的タンパク質として、植物体に対して病害抵抗性を付与又は強化するタンパク質を適用すれば、病害ストレス耐性植物となる。
【0044】
5.スクリーニング方法
上述した形質転換植物を利用することによって、病害抵抗性誘導剤のスクリーニング方法を構築することができる。本スクリーニング方法では、上述した(a)、(b)又は(c)のポ
リヌクレオチドと連結する、目的タンパク質をコードするポリヌクレオチドをレポーター遺伝子とする。
【0045】
本スクリーニング方法では、先ず、上述した形質転換植物に対して検査対象の化合物を接触させる。ここで、検査対象の化合物とは、特に限定されず如何なる物質であってもよい。検査対象の化合物としては、単独の物質であってもよいし、複数の構成成分からなる混合物であってもよい。検査対象の化合物としては、例えば植物からの抽出物のように未同定の物質を含むような構成であってもよいし、既知の組成物を所定の組成比で含むような構成であってもよい。また、検査対象の化合物としては、タンパク質、核酸、脂質、多糖類、有機化合物及び無機化合物のいずれでもよい。
【0046】
次に、形質転換植物における上記レポーター遺伝子の発現を検出する。レポーター遺伝子としてGUS遺伝子を使用した場合には、形質転換植物におけるGUS活性を公知の手法により測定することができる。レポーター遺伝子として他の遺伝子を使用した場合には、レポーター遺伝子に応じて公知の手法でその発現量を測定すればよい。
【0047】
そして上記検査対象の化合物を接触させたときの上記レポーター遺伝子の発現量が亢進した場合に当該化合物を病害抵抗性誘導剤と判定することができる。なお、ここで、「病害抵抗性誘導剤と判定する」とは、BTHやINA等の病害抵抗性誘導剤と同様に、WRKY45(OsWRKY45)遺伝子に対する発現誘導能を有する化合物であると判定することと同義である。
【実施例】
【0048】
以下、実施例を用いて本発明をより詳細に説明するが、本発明の技術的範囲は以下の実
施例に限定されるものではない。
【0049】
〔実施例1〕
WRKY45遺伝子のプロモーター配列の制御下にレポーター遺伝子を持つベクタープラスミドの構築
本実施例では、図1に示すように、WRKY45遺伝子の上流領域であるP4-R1間(転写開始
点上流-1965塩基から5'-UTRまでの領域、2077塩基(配列番号2))、及び上流領域と転
写領域からなるP4-R3間(転写開始点上流-1965から3'-UTRの直前までの領域、3749塩基(配列番号1))を、イネゲノムDNAからPCR増幅した。そして、図2に示すように、PCRで
得られた増幅断片をDNAベクターpSAMHDN627-M2GUSのNcoI制限サイトに挿入してWRKY45-P4R1::GUSベクタープラスミド及びWRKY45-P4R3::GUSベクタープラスミドを作製した。なお
、WRKY45-P4R3::GUSベクタープラスミドにおいて、レポーター遺伝子であるGUS遺伝子は
、WRKY45との融合タンパク質として発現する。
【0050】
WRKY45-P4R1::GUS及びWRKY45-P4R3::GUSのA. tumefaciens EHA101株への導入
上述の2種類のプラスミドをAgrobacterium tumefaciens EHA101株に導入するために、Agrobacterium tumefaciens EHA101株を、5mlのYEB培地(0.1%酵母抽出物、0.5%肉抽出
物、0.5%ペプトン、0.5%スクロース、0.05%MgSO4・7H2O)において、30℃で一晩振盪
培養した。次いで、1リットルフラスコ中で200mlのYEB培地に5mlの上記培養物を加え、
さらに30℃で5〜6時間培養した。遠心分離(4000rpmで5分間)により菌体を集め、そして100mlの10mM Tris-HCl(pH 8.0)中に懸濁した。再度、遠心分離を行い、得られた菌体を2mlのYEB培地中に懸濁した。微量遠心チューブ中でこの懸濁液の200μlと0.5μgのpBE7133H-Thioninを含む100μlのDNA溶液とを混合し、ドライアイス/エタノール浴中で凍結さ
せた(5分間)。次いで、37℃の温浴中で融解し、25分間放置した。その後、2mlのYEB培
地を添加し、30℃で1時間、振盪培養した。100μlの培養液をカナマイシン(50μg/ml)およびハイグロマイシン(50μg/ml)を含有するYEB培地上に塗布し、そして30℃で
約36時間の培養によりAgrobacterium tumefaciens EHA101株の耐性菌を得た。このAgrobacterium tumefaciens EHA101株中のGUSレポーターカセットをアルカリ-SDS法により単離
して、制限酵素分析によりその存在および構造を確認した。
【0051】
形質転換イネの作出
滅菌したイネ(Oryza sativa, cv. Nipponbare)の種子を、2mg/mlの2.4-ジクロロフェノキシ酢酸(以下2.4-D)を含むMS培地(T. Murashige et al., Physiol. Plant., 15, 473 (1962))で27℃で2週間培養し、カルスを形成させた。このカルスを共存培地(2mg/ml
2.4-Dおよび1g/l カザミノ酸を含むMS培地)に移植し、27℃で培養を行った。培養3日
目に、カナマイシンおよびハイグロマイシンを含むYEB培地で上記GUSレポーターカセットを含むAgrobacterium tumefaciens EHA101株を増殖させ、遠心分離した。ペレット化した菌体をLB培地に懸濁させた後、アセトシリンゴンを添加して感染用のAgrobacterium tumefaciens EHA101株菌液を作製した。この菌液を30℃で20分間保温した。培養4日目に感
染用Agrobacterium tumefaciens EHA101株菌液に上記カルス塊を加え、30℃で15分間緩やかに撹拌して、このカルス塊を感染させた。15分後にカルスを回収し、共存培地に置床した。27℃、16時間日長で3日間培養し、次いで、カルベニシリンを含むLB培地にて30℃で
1時間培養し、その後、カルスのみを回収して選抜(増殖)培(500mg/l カルベニシリン、50mg/l ハイグロマイシンを含む共存培地)に置床した。これを、27℃、16時間日長で2週間培養した。新たに増殖してきた黄白色のカルスを選抜(再分化前処理)培地(1mg/l2.4-D、0.5mg/l BAP、2g/l カザミノ酸、20g/l ショ糖、30g/l ソルビトール、500mg/l カルベニシリン、100mg/l ハイグロマイシンを含むN6培地)に移植し、約2週間培養した後、選抜(再分化)培地(0.01mg/l β-ナフタレン酢酸(NAA)、0.1mg/l BAP、1g/lカ
ザミノ酸、500mg/lカルベニシリン、100mg/lハイグロマイシンを含むN6培地)に移植した(Toki et al., Plant J., 47, 969 (2006))。約2〜3週間で再分化した形質転換イ
ネ(T0)が得られた。
【0052】
形質転換イネ後代の作出
形質転換イネ当代(T0)を隔離温室内で栽培してT1種子を得た。このT1種子をさら
に栽培して得られた数種類のT2種子を100mg/L ハイグロマイシンを含むゲランガム培地
に播種してハイグロマイシン抵抗性を検定した。供試した個体のすべてがハイグロマイシン抵抗性を示したものをホモ接合体とした。なお、ゲランガム培地はホグラント mix 1
缶とゲルライト 3gを1Lの蒸留水に懸濁させた後、電子レンジで加温溶解させた。この15mlを管ビンに分注し、終濃度が100mg/Lとなるようにハイグロマイシンを添加した。
【0053】
イネいもち病菌及び白葉枯病菌の接種
イネいもち病菌(Magnaporthe grisea, race 007.0)の胞子を0.01% Silwet L77水溶液に懸濁し(1〜2x105胞子/ml)、28℃(昼)/23℃(夜)の温室内で栽培した4葉期のイネ
(T0)幼苗に噴霧した後、接種箱内で暗条件下約24時間保湿後、温室に戻して栽培を続
けた。白葉枯病菌を接種するには、白葉枯病菌(Xanthomonas oryzae pv. oryzae, strain T7174)をOD600=0.03になるように水に懸濁し、この液に浸したハサミで6〜7葉期イネの最上位完全展開葉の先端から約3cmの部分を切断して感染させた(Kauffman et al., Plant Dis. Rep., 57, 537 (1973))。
【0054】
形質転換イネの栽培及び植物ホルモン処理
28℃(昼)/23℃(夜)の温室内で栽培した4葉期のイネ(T0)幼苗の第4葉身を長さ0.5〜1.0cmの葉片に切り、各種植物ホルモンを含む0.01% Silwet L77水溶液又は溶媒のみ(mock)に浸漬し、明条件下30℃で約6時間処理した。処理に用いた植物ホルモンとその濃
度は以下の通りである。すなわち、Sodium salicylate (SA, 1 mM)、Indole-3-acetic acid (IAA, 50 μM)、gibberellin A3 (GA3, 50 μM), Kinetin (CK, 50 μM)、1-aminocyclopropane-1-carboxylic acid (ACC, 50 μM)、abscisic acid ((±)-cis-trans, ABA, 50 μM)、methyl jasmonate (ME-JA, 50 μM)及びbrassinolide (BR, 2 μM)である。
【0055】
形質転換イネの栽培及び病害抵抗性誘導剤処理その1
28℃(昼)/23℃(夜)の温室内で栽培した4葉期のイネ(T0)幼苗の第4葉身を長さ0.5〜1.0cmの葉片に切り、50μMのBTHを含む0.01% Silwet L77水溶液又は溶媒のみ(mock)に浸漬し、明条件下30℃で約6時間処理した。
【0056】
形質転換イネの栽培及び病害抵抗性誘導剤処理その2
組換えイネホモ接合体(T2)の幼苗を直径6cmの素焼き鉢に移植して、32℃(昼)/27
℃(夜)で、4葉期後期まで栽培した。これに400μMのBTHおよび333倍希釈のクミテンを
含む1%アセトン水溶液または400μMのINAおよび333倍希釈のクミテンを含む1%アセトン溶液を100 ml土壌潅注処理した。無処理区は333倍希釈のクミテンを含む1%アセトン溶液処
理区とし、薬剤処理後3日目の4葉をサンプリングした(図3)。
【0057】
形質転換イネの栽培及び病害抵抗性誘導剤処理その3
組換えイネ ホモ接合体(T2)の5粒をBTH含有ゲランガム培地中に軽く埋め込み、蒸留水を入れたビーカーと一緒に透明なケースに入れ、ラップでケースの口を塞いだ。2-3葉
期まで27℃の恒温室において蛍光照明下で栽培し、地上部全てをサンプルとした(図4)
。BTHの終濃度は10-7 M、10-6 M、10-5M又は10-4 Mとし、アセトンを1%添加したものをコントロールとした。
【0058】
GUS染色
上述のイネいもち病菌を接種したイネの葉身は、90%のアセトン液で2〜3秒間洗浄する
ことにより表面のワックス層を除去した後、GUS染色液に浸して37℃で2〜4時間発色さ
せた。一方、植物ホルモン処理またはBTH処理したイネの葉片はそのままGUS染色液(下記)に浸し、37℃で2〜4時間発色させた(Gallagher, GUS protocols, Academic Press, Inc., pp. 103-104 (1992))。
【0059】
GUS染色液の組成:1.0 mM X-glucuronide、10 mM EDTA、0.5 mM Potassium Ferricyanide、0.5 mM Potassium Ferrocyanide、0.1% Triton X-100、20% Methanol、50 mM Potassium phosphate buffer、pH 7.0
【0060】
GUS活性測定
上述の素焼き鉢で栽培して薬剤処理後にサンプリングしたイネおよび薬剤含有ゲランガム培地で栽培したイネの葉身を、液体窒素を注いだ乳鉢中で粉砕した後、エッペンドルフチューブに入れて100μlのEX buffer(下記)を加えて激しく攪拌した。その後15000 rpm、4℃で5分間遠心し、上清を回収した。回収した上清10μlを100μl 4- MUG/EX bufferへ懸濁し、37℃で1時間インキュベートした。コントロールとして100μl 4- MUG/EX bufferのみもインキュベートした。インキュベート後、1.4 mlの0.2 M Na2CO3を加え、反応を停止した(コントロールも同様)。これを、GUS活性測定するまでは遮光して氷中に入れた。
【0061】
EX bufferの組成:5mM EDTA 200μl, 0.1% TritonX-100, 10mM 2-mercaptoethanol, 50mM
NaHPO4 (pH7.0)
【0062】
GUS活性は、backgroundとして0.2 M Na2CO3でゼロ補正を行った後、EX355、EM460で測
定した。検量線は4-methyl umbelliferone(4-MU)を用いて作成した。
【0063】
結果:植物ホルモン応答性
WRKY45-P4R1::GUS組換えイネ(T0)の葉片は植物ホルモンの有無に関わらずGUS活性を示した(図5)。一方、WRKY45-P4R3::GUS組換えイネ(T0)においては、mock処理(-SA
)ではGUS活性は認められないが、SA処理(+SA)により顕著にGUS活性が誘導された(図5)。他のホルモン処理によるGUS活性の誘導は認められなかった。これらの結果から、RKY45-P4R3::GUSコンストラクトを持つ組換えイネは、SAに対して特異的に応答してGUS活性
を発現することが明らかとなった。
【0064】
この結果から、WRKY45遺伝子における病害ストレスや病害抵抗性誘導剤への応答性は、WRKY45遺伝子の上流領域のみでは不十分であり、イントロンも含むWRKY45遺伝子の転写領域が必要であることが明らかとなった。
【0065】
結果:病原菌感染に対する応答性
WRKY45-P4R3::GUS組換えイネ(T0)にイネいもち病菌を接種した結果、感染部位周辺
の組織において接種後2日および3日後にGUS活性が検出された(図6)。白葉枯病菌接種後のイネ葉身においては、接種後2日目において接種部位から一定距離はなれた部位にGUS活性が検出された(図7)。いずれの場合も、非感染上位葉ではGUS活性は観察されなか
った(データ非表示)。
【0066】
なお、図7に示す写真において、右側の葉身切断面がイネ白葉枯病菌の接種部位であり、GUS活性は当該接種部位のみではなく図中左方に広がって観察される。
【0067】
結果:病害抵抗性誘導剤応答性
WRKY45-P4R3::GUS組換えイネ(T0)においては、SA処理と同様にBTH処理によって顕著にGUS活性が誘導されることがGUS染色から明らかとなった(データ非表示)。そこで、WRKY45-P4R3::GUS組換えイネホモ接合体(T2)を材料として、BTH処理により誘導されるGUS活性を定量的に測定した。その結果、素焼き鉢で栽培してBTH処理後にサンプリングした
イネ葉身では、GUS活性が顕著に誘導されることが明らかとなった(図8)。また、BTHと
同様に病害抵抗性誘導剤として知られているジクロロイソニコチン酸(INA)を処理した
場合もGUS活性が顕著に誘導された(図8)。一方、BTH含有ゲランガム培地で育成したイ
ネにおいても薬剤処理濃度の増加に伴うGUS活性の誘導が認められたが、薬害が発生する
処理濃度区ではGUS活性の誘導が小さくなった(図9)。
【特許請求の範囲】
【請求項1】
以下の(a)、(b)又は(c)のポリヌクレオチドと、目的タンパク質をコードするポリヌク
レオチドとを連結してなる核酸構築物。
(a)配列番号1の塩基配列からなるポリヌクレオチド
(b)配列番号1の塩基配列において1若しくは複数の塩基が欠失、置換若しくは付加さ
れた塩基配列からなり、且つ、病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
(c)配列番号1の塩基配列と相補的な塩基配列からなるDNA断片とストリンジェントな条件下でハイブリダイズし、かつ病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
【請求項2】
上記目的タンパク質をコードするポリヌクレオチドが、レポーター遺伝子のコード領域であることを特徴とする請求項1記載の核酸構築物。
【請求項3】
請求項1又は2記載の核酸構築物を含む発現ベクター。
【請求項4】
請求項3記載の発現ベクターを含む形質転換体。
【請求項5】
請求項3記載の発現ベクターを含むトランスジェニック植物。
【請求項6】
植物体、植物器官、植物組織又は植物培養細胞である請求項5記載のトランスジェニック植物。
【請求項7】
請求項5又は6記載のトランスジェニック植物を培養又は栽培する植物の製造方法。
【請求項8】
請求項5又は6記載のトランスジェニック植物に病害抵抗性誘導剤を接触させる又は病害ストレスを付加し、上記目的タンパク質をコードする遺伝子の発現を誘導する、遺伝子発現誘導方法。
【請求項9】
病害抵抗性誘導剤が、ベンゾチアジアゾールS-メチルエステル(BTH)又はジクロロイ
ソニコチン酸である、請求項8記載の遺伝子発現誘導方法。
【請求項10】
請求項2記載の核酸構築物を含む発現ベクターを導入されてなる形質転換体に、検査対象の化合物を接触させる工程と、上記形質転換体における上記レポーター遺伝子の発現を検出する工程とを含み、上記検査対象の化合物を接触させることで上記レポーター遺伝子の発現量が亢進した場合に当該化合物を病害抵抗性誘導剤と判定する、病害抵抗性誘導剤のスクリーニング方法。
【請求項1】
以下の(a)、(b)又は(c)のポリヌクレオチドと、目的タンパク質をコードするポリヌク
レオチドとを連結してなる核酸構築物。
(a)配列番号1の塩基配列からなるポリヌクレオチド
(b)配列番号1の塩基配列において1若しくは複数の塩基が欠失、置換若しくは付加さ
れた塩基配列からなり、且つ、病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
(c)配列番号1の塩基配列と相補的な塩基配列からなるDNA断片とストリンジェントな条件下でハイブリダイズし、かつ病害ストレス及び病害抵抗性誘導剤に対する応答性を示すポリヌクレオチド
【請求項2】
上記目的タンパク質をコードするポリヌクレオチドが、レポーター遺伝子のコード領域であることを特徴とする請求項1記載の核酸構築物。
【請求項3】
請求項1又は2記載の核酸構築物を含む発現ベクター。
【請求項4】
請求項3記載の発現ベクターを含む形質転換体。
【請求項5】
請求項3記載の発現ベクターを含むトランスジェニック植物。
【請求項6】
植物体、植物器官、植物組織又は植物培養細胞である請求項5記載のトランスジェニック植物。
【請求項7】
請求項5又は6記載のトランスジェニック植物を培養又は栽培する植物の製造方法。
【請求項8】
請求項5又は6記載のトランスジェニック植物に病害抵抗性誘導剤を接触させる又は病害ストレスを付加し、上記目的タンパク質をコードする遺伝子の発現を誘導する、遺伝子発現誘導方法。
【請求項9】
病害抵抗性誘導剤が、ベンゾチアジアゾールS-メチルエステル(BTH)又はジクロロイ
ソニコチン酸である、請求項8記載の遺伝子発現誘導方法。
【請求項10】
請求項2記載の核酸構築物を含む発現ベクターを導入されてなる形質転換体に、検査対象の化合物を接触させる工程と、上記形質転換体における上記レポーター遺伝子の発現を検出する工程とを含み、上記検査対象の化合物を接触させることで上記レポーター遺伝子の発現量が亢進した場合に当該化合物を病害抵抗性誘導剤と判定する、病害抵抗性誘導剤のスクリーニング方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−235774(P2012−235774A)
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−100248(P2012−100248)
【出願日】平成24年4月25日(2012.4.25)
【出願人】(501167644)独立行政法人農業生物資源研究所 (200)
【出願人】(000000169)クミアイ化学工業株式会社 (86)
【Fターム(参考)】
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成24年4月25日(2012.4.25)
【出願人】(501167644)独立行政法人農業生物資源研究所 (200)
【出願人】(000000169)クミアイ化学工業株式会社 (86)
【Fターム(参考)】
[ Back to top ]

