細胞、細胞の使用、スクリーニング方法、及び細胞ストレスの判定方法
【課題】細胞に加えられたストレスを容易に検出可能な細胞、細胞の使用、及びスクリーニング方法を提供する。
【解決手段】ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域とを融合させたmRNAを有する細胞を提供する。また、当該細胞を培養することと、細胞の培養液に物質を滴下することと、培養液に物質を滴下した後、細胞の蛍光強度を観察することと、蛍光強度が上昇した場合、物質は細胞のストレス要因であると判定することと、を含む、細胞ストレス物質のスクリーニング方法を提供する。
【解決手段】ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域とを融合させたmRNAを有する細胞を提供する。また、当該細胞を培養することと、細胞の培養液に物質を滴下することと、培養液に物質を滴下した後、細胞の蛍光強度を観察することと、蛍光強度が上昇した場合、物質は細胞のストレス要因であると判定することと、を含む、細胞ストレス物質のスクリーニング方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は細胞生物学に係り、細胞、細胞の使用、スクリーニング方法、及び細胞ストレスの判定方法に関する。
【背景技術】
【0002】
細胞ストレスの一つである小胞体ストレスが生じると、小胞体内で合成中の不安定なタンパク質が正常な折りたたみ構造の形成に失敗し、異常タンパク質となって小胞体内に蓄積される。近年、異常タンパク質の蓄積と、神経疾患等の各種疾病との関係を示唆する研究結果が発表されるにつれ、細胞に加えられたストレスを容易に検出可能な技術の提案が望まれるようになった(例えば、特許文献1参照。)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2008−131899号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、細胞に加えられたストレスを容易に検出可能な細胞、細胞の使用、スクリーニング方法、及び細胞ストレスの判定方法を提供することを目的の一つとする。
【課題を解決するための手段】
【0005】
本発明の一の態様は、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有する細胞であることを要旨とする。
【0006】
また、本発明の他の態様は、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有する細胞の、細胞ストレスを検出するための使用であることを要旨とする。
【0007】
また、本発明の別の態様は、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域とを融合させたmRNAを有する細胞を培養することと、細胞の培養液に、物質を滴下することと、培養液に物質を滴下した後、細胞の蛍光強度を観察することと、蛍光強度が上昇した場合、物質は細胞のストレス要因であると判定することと、を含む、細胞ストレス物質のスクリーニング方法であることを要旨とする。当該スクリーニング方法において、細胞の蛍光強度を、細胞の核内で観察してもよい。
【0008】
また、本発明のさらに別の態様は、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域とを融合させたmRNAを有する細胞を用意することと、細胞に、細胞質を導入することと、細胞の蛍光強度を観察することと、蛍光強度が上昇した場合、導入された細胞質がストレスを受けていたと判定することと、を含む、細胞ストレスの判定方法であることを要旨とする。当該判定方法において、細胞に細胞質を導入する前に、細胞をストレプトリシンで処理し、細胞の形質膜を透過性にしてもよい。また、細胞の蛍光強度を、細胞の核内で観察してもよい。
【発明の効果】
【0009】
本発明によれば、細胞に加えられたストレスを容易に検出可能な細胞、細胞の使用、スクリーニング方法、及び細胞ストレスの判定方法を提供可能である。
【図面の簡単な説明】
【0010】
【図1】ATF4タンパク質の翻訳制御機構の概念図である。
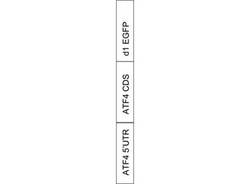
【図2】本発明の第1の実施例に係るコンストラクトの模式図である。
【図3】本発明の第1の実施例に係るコンストラクトの発現量を示す逆転写ポリメラーゼ連鎖反応の結果である。
【図4】本発明の第1の実施例に係るコンストラクトを有する細胞の蛍光顕微鏡写真である。
【図5】本発明の第1の実施例に係る小胞体ストレスを与えられた細胞の蛍光強度を示すグラフである。
【図6】本発明の第1の実施例に係る酸化ストレスを与えられた細胞の蛍光強度を示す第1のグラフである。
【図7】本発明の第1の実施例に係る紫外線ストレスを与えられた細胞の蛍光強度を示すグラフである。
【図8】本発明の第1の実施例に係る酸化ストレスを与えられた細胞の蛍光強度を示す第2のグラフである。
【図9】本発明の第1の実施例に係るウェスタン・ブロッティングの結果を示す写真である。
【図10】本発明の第2の実施例に係るセミインタクト処理を示す模式図である。
【図11】本発明の第2の実施例に係るストレス細胞質を導入された細胞の蛍光顕微鏡写真である。
【図12】本発明の第2の実施例に係る正常細胞質を導入されたコントロール細胞の蛍光顕微鏡写真である。
【図13】本発明の第2の実施例に係るTBバッファを導入されたコントロール細胞の蛍光顕微鏡写真である。
【図14】本発明の第2の実施例に係るATF4−GFPタンパク質の翻訳等に関わる因子をアッセイした結果を示すグラフである。
【図15】本発明の第3の実施例に係る糖尿病細胞質を導入された細胞の蛍光顕微鏡写真である。
【図16】本発明の第3の実施例に係る糖尿病細胞質を導入された細胞の蛍光強度を示すグラフである。
【発明を実施するための形態】
【0011】
細胞は、ストレス環境下で、ほとんどのタンパク質の合成を停止する。しかし、細胞は、ストレス環境下においても、シャペロンやある種の転写因子群の翻訳を活性化する。ATF(Activating Transcription Factor)4タンパク質は、ストレス負荷時に翻訳が活性化される転写因子である。ストレスのない平常時においては、ATF4タンパク質のmRNAは細胞質内に存在するが、ATF4タンパク質は翻訳されない。しかし、図1に示すように、酸化ストレス、小胞体ストレス、飢餓ストレス、及びウイルス感染ストレス等のストレスが細胞に加えられると、ATF4タンパク質のmRNAが活性化され、ATF4タンパク質が翻訳される。このように、ATF4タンパク質は、ストレスにより翻訳が制御されるタンパク質である。
【0012】
ATF4タンパク質の翻訳制御は、ATF4タンパク質のmRNAの5’末端の非翻訳領域(UTR:untraslational region)が担っている。ATF4タンパク質の翻訳制御は、ストレス刺激に対して細胞内で活性化されるストレス依存的なキナーゼが、転写制御因子eIF2をリン酸化することから始まる。リン酸化されたeIF2は、ATF4タンパク質の翻訳を活性化し、翻訳されたATF4タンパク質は核内に移行して、ストレスに依存した様々なストレス応答タンパク質の転写を誘起する。
【0013】
この時転写されるストレス応答タンパク質の一つに、GADD34がある。GADD34は、PP1という脱リン酸化複合体を形成することで、eIF2の脱リン酸化を行う。その結果、ATF4タンパク質の翻訳が抑制される。つまり、ATF4とGADD34は、ネガティブ・フィードバック・ループを形成し、GADD34は、ストレス負荷時における細胞のストレス応答を、ネガティブに制御している。
【0014】
ここで、本発明の発明者らは、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有する細胞の培地中にサンプル物質を添加し、細胞の核内の蛍光強度を観察することにより、サンプル物質が細胞のストレス要因であるか否かを、高い感度でスクリーニング可能であることを見出した。また、当該細胞の核内の蛍光強度を低下させる化合物を探索することにより、細胞ストレスを軽減する化合物をスクリーニングすることも可能となる。
【0015】
例えば、ATF4タンパク質のmRNAの5’末端の非翻訳領域にルシフェラーゼ(Luciferase)等のレポータ遺伝子のみを融合させたコンストラクトは、ATF4タンパク質の翻訳領域を含まないため、GADD34によるネガティブ・フィードバック・ループ機構の影響を受けない。これに対し、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを含む細胞は、与えられたストレスに応じて、ATF4−GFPタンパク質を生成する。 さらに、ATF4−GFPタンパク質は正常に核内に移行するため、GADD34とともに、ネガティブ・フィードバック・ループを形成すると考えられる。そのため、細胞の本来の姿に近い状態で、細胞ストレスをモニターすることが可能となる。
【0016】
さらに発明者らは、形質膜に孔が設けられたセミインタクト細胞においても、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAからストレスに応じてATF4−GFPタンパク質が翻訳され、核内に移行することを見出した。セミインタクト細胞には、他の細胞から抽出した細胞質を導入することが可能である。そのため、様々な病態細胞から抽出した細胞質を、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有するセミインタクト細胞に注入することにより、細胞質を抽出された病態細胞のストレス状態を検出することが可能となる。また、ストレス要因の阻害剤を添加することにより、細胞質を抽出された病態細胞のストレス要因を特定することも可能となる。
【0017】
(第1の実施例:生細胞を用いた細胞ストレスの検出アッセイ)
ATF4タンパク質の翻訳を可視化するために、図2に示すように、ATF4タンパク質のmRNAの5’UTR領域と、ATF4タンパク質コーディング領域と、半減期が約1時間の短寿命緑色蛍光タンパク質(EGFP:Enhanced Green Fluorescent Protein)コーディング領域とを融合させたコンストラクト(mRNA)を作製した。作製したコンストラクトmATF4 5’UTR+CDS/pd1EGFP−N1の配列は、配列表の配列番号1に示す。ここで、5’UTR領域は、ストレス時にATF4タンパク質が翻訳され、ストレスのない平常時にATF4タンパク質が翻訳されないよう、ATF4タンパク質の翻訳を制御する。
【0018】
次に、作製したmRNAを安定に発現する細胞株CHO−ATF4を得た。具体的には、Mouse ATF4 5’UTR−CDS/pd1EGFP−N1プラスミドをCHO(Chinese hamster ovary)細胞にトランスフェクションした。トランスフェクションはLipofectamine Plus (Invitrogen)とLipofectamine reagent (Invitrogen)とを用い、メーカーのマニュアルに基づいて行った。トランスフェクションの翌日に細胞をトリプシン溶液により培養皿より剥がし、300 ng/ml Geneticin (Gibco BRL)を含むHamF12−5% FCS培地中にまきこみ培養した。その後、3日ごとにGeneticinを含む培地を交換した。7〜10日後にGeneticin耐性の細胞(つまり当該プラスミドが染色体内に組み込まれた細胞)コロニーが出現するため、これらを24well プレートに単離した。次に小胞体ストレス誘導剤であるタプシガルジンを単離した細胞に作用させたときにのみ、ATF4−GFPが翻訳され核にATF4−GFPタンパク質が蓄積する細胞株を、蛍光顕微鏡観察により選別した。
【0019】
図3に示すように、得られたCHO−ATF4細胞において、タプシガルジン(Tg)によって小胞体ストレスが与えられた時(Tg+)のATF4−GFPタンパク質のmRNAの発現量と、小胞体ストレスを与えなかった時(Tg−)のATF4−GFPタンパク質のmRNAの発現量は同等であることが、逆転写ポリメラーゼ連鎖反応(RT−PCR)によって確認された。
【0020】
しかし、図4の蛍光顕微鏡写真に示すように、小胞体ストレスを与えなかった時(Tg−)、CHO−ATF4細胞は、ATF4−GFPタンパク質を発現しなかった。これに対し、小胞体ストレスが与えられた時(Tg+)、CHO−ATF4細胞は、ATF4−GFPタンパク質を発現し、ATF4−GFPタンパク質は核内に移行した。さらに、0.3μmol/Lのタプシガルジン(Tg)によって小胞体ストレスが与えられた細胞の時間経過を蛍光顕微鏡で確認したところ、ATF4タンパク質とネガティブ・フィードバック・ループを形成するGADD34の生成によって、図5に示すように、次第にATF4−GFPタンパク質の翻訳が抑制され、核内の蛍光強度は減少する傾向にあることが確認された。なお、図5においては、10サンプルの結果が描画されている。
【0021】
また、100μmol/Lの砒素(As)を添加し、酸化ストレスを細胞に与えた場合も、図6に示すように、時間経過と共に、ATF4−GFPタンパク質は核内に移行し、核内に蓄積した。その後、次第にATF4−GFPタンパク質の翻訳は抑制され、蛍光強度は減少した。なお、図6においても、10サンプルの結果が描画されている。さらに、500J/m2の紫外線(UV)を照射して、細胞にストレスを与えた場合も、時間経過と共に、ATF4−GFPタンパク質は核内に移行し、核内に蓄積したが、図7に示すように、次第にATF4−GFPタンパク質の翻訳は抑制され、蛍光強度は減少した。なお、図7においても、10サンプルの結果が描画されている。
【0022】
次に、100μmol/Lの砒素(As)を添加し、酸化ストレスを細胞に与えた場合のATF4タンパク質及びATF4−GFPタンパク質の発現量を、抗CREB(cAMP response element−binding protein)抗体及び抗GFP抗体を用いて、ウェスタン・ブロッティングで確認し、図8に示すグラフに描画した。また、図8に示すグラフに、同様の酸化ストレスを与えられた14個の細胞の蛍光強度を描画した。すると、ウェスタン・ブロッティングで確認されたATF4タンパク質の発現量と、蛍光顕微鏡で確認された蛍光強度は、時間経過と共に、同様に増減した。
【0023】
また、図9に示すように、CHO−ATF4細胞内のATF4−GFPタンパク質の発現量は、細胞の内在性のATF4タンパク質の発現量のほぼ2倍であった。以上示したように、第1の実施例に係るコンストラクトを導入されたCHO−ATF4細胞において、外来性のATF4−GFPタンパク質も、内在性のATF4タンパク質と同様に、ネガティブ・フィードバック・ループを形成し、GADD34によって、翻訳が抑制されることが示された。さらに、CHO−ATF4細胞において、外来性のATF4−GFPタンパク質は、内在性のATF4タンパク質より多く翻訳されることが示された。したがって、CHO−ATF4細胞は、細胞ストレスの有無の検証に有用であることが示された。
【0024】
(第2の実施例:セミインタクト細胞を用いた細胞ストレスの検出アッセイ)
まず、セミインタクト細胞について説明する。セミインタクト細胞とは、連鎖球菌の酵素感受性毒素であるストレプトリシンO(streptolysin O:SLO)等を形質膜に作用させることにより、形質膜を部分的に透過性にした細胞のことである。セミインタクト細胞を作製することにより、オルガネラや細胞骨格そのもの、及びオルガネラや細胞骨格のトポロジーを保持させたまま、細胞から細胞質を流出させることが可能となる。
【0025】
さらに、細胞質が流出したセミインタクト細胞に、新たに外部より分画した細胞質成分とATP再生系を導入することにより、細胞内膜動過程、タンパク質間相互作用、及びタンパク質のターゲティング等の細胞質に依存的な細胞内のイベントを、セミインタクト細胞内に再構成可能である(例えば、村田昌之ら、セミインタクト細胞を用いた細胞内タンパク質の動態・機能の解析技術の開発、月刊バイオインダストリー、日本、シーエムシー出版、2004年6月号参照。)。例えば、病態細胞でない正常細胞から作製したセミインタクト細胞に、病態細胞から抽出した病態細胞質を導入することにより、病態細胞の核の影響を排した細胞を作製することも可能である。
【0026】
ここで、タプシガルジン(Tg)処理により、小胞体ストレスを与えたL5178Yマウス細胞から細胞質を抽出し、抽出した細胞質をストレス細胞質とした。また、CHO−ATF4細胞をストレプトリシンOで処理し、セミインタクトCHO−ATF4細胞を作製した。次に、図10に示すように、セミインタクトCHO−ATF4細胞に、ATP再生系と共にストレス細胞質を導入した。すると、第1の実施例と同様に、ATF4−GFPタンパク質が発現及び核内移行し、核内に蓄積されることが、図11に示すように観察された。
【0027】
これに対し、ストレスを与えなかったL5178Yマウス細胞から細胞質を抽出し、抽出した細胞質を正常細胞質とした。次に、セミインタクトCHO−ATF4細胞に、ATP再生系と共に正常細胞質を導入したところ、図12に示すように、ATF4−GFPタンパク質の発現は観察されなかった。また、セミインタクトCHO−ATF4細胞に、ATP再生系と共にTBバッファを導入した場合も、図13に示すように、ATF4−GFPタンパク質の発現は観察されなかった。したがって、ストレス細胞質を導入されたセミインタクトCHO−ATF4細胞においては、ストレス細胞質依存的に、ATF4−GFPタンパク質が発現したことが示された。
【0028】
図14に、セミインタクトCHO−ATF4細胞を用いて、ストレス細胞質に依存的なATF4−GFPタンパク質の翻訳及び核内移行に関わる因子をアッセイした結果を示す。なお、図14のグラフの横軸においては、ストレス細胞質を導入した場合の核の蛍光強度を100%に、TBバッファを導入した場合の核の蛍光強度を0%に換算している。図14に示すように、ATF4−GFPタンパク質の翻訳及び核内移行は、ATP及びGTPに依存していることが明らかになった。
【0029】
また、細胞質に存在する翻訳制御領域を含むATF4−GFPの遺伝子に対応するmRNAをRNAase処理によって分解した後では、ストレス負荷細胞質をセミインタクト細胞内に添加してもATF4−GFPの発現は起こらなかった。さらに、GTPγS存在下でATF4−GFPの核内移行が阻害された。したがって、ATP及びGTPは、この翻訳制御機構の制御因子として必要なことがわかった。
【0030】
また、キナーゼ阻害剤であるスタウロスポリン(staurosporin)を導入した結果から、ATF4−GFPタンパク質の翻訳及び核内移行は、キナーゼに依存していることが明らかになった。さらに、タンパク質合成阻害剤であるシクロヘキシミド(cycloheximide)を導入した結果から、細胞内のタンパク質合成を止めると、ATF4−GFPタンパク質の翻訳及び核内移行は生じないことが明らかになった。
【0031】
以上の結果より、セミインタクトCHO−ATF4細胞に導入されたストレス細胞質によって、新たなATF4−GFPタンパク質の翻訳が行われることが示された。また、セミインタクトCHO−ATF4細胞内のmRNAをRNAaseによって予め分解した後、セミインタクトCHO−ATF4細胞にストレス細胞質を導入した場合、ATF4−GFPタンパク質の翻訳及び核内移行は起きなかった。これらの結果より、セミインタクトCHO−ATF4細胞においても、ストレス細胞質依存的にATF4−GFPタンパク質の翻訳制御機構が機能していることが示された。
【0032】
(第3の実施例:セミインタクト細胞を用いた糖尿病による細胞ストレスの検出アッセイ)
糖尿病態マウス(過脂肪食供与マウス)の副睾丸脂肪細胞から細胞質を抽出し、抽出した細胞を糖尿病細胞質とした。次に、セミインタクトCHO−ATF4細胞に、ATP再生系と共に糖尿病細胞質を導入した。すると、第2の実施例と同様に、ATF4−GFPタンパク質が発現及び核内移行し、核内に蓄積されることが、図15に示すように観察された。また、図16に示すように、ATF4−GFPタンパク質の翻訳は、細胞質濃度に依存することも示された。
【0033】
よって、糖尿病細胞質は、ATF4−GFPタンパク質の翻訳及び核内移行を活性化することが明らかになった。また、この結果は、糖尿病細胞質は「ストレス」性の細胞質であることを示している。したがって、ストレス依存的な各種キナーゼの阻害剤を、糖尿病細胞質を導入されたセミインタクトCHO−ATF4細胞に導入し、ATF4−GFPタンパク質の翻訳及び核内移行を抑制するキナーゼの阻害剤を特定することにより、糖尿病細胞質のストレス要因を特定することが可能となることが示された。
【技術分野】
【0001】
本発明は細胞生物学に係り、細胞、細胞の使用、スクリーニング方法、及び細胞ストレスの判定方法に関する。
【背景技術】
【0002】
細胞ストレスの一つである小胞体ストレスが生じると、小胞体内で合成中の不安定なタンパク質が正常な折りたたみ構造の形成に失敗し、異常タンパク質となって小胞体内に蓄積される。近年、異常タンパク質の蓄積と、神経疾患等の各種疾病との関係を示唆する研究結果が発表されるにつれ、細胞に加えられたストレスを容易に検出可能な技術の提案が望まれるようになった(例えば、特許文献1参照。)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2008−131899号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、細胞に加えられたストレスを容易に検出可能な細胞、細胞の使用、スクリーニング方法、及び細胞ストレスの判定方法を提供することを目的の一つとする。
【課題を解決するための手段】
【0005】
本発明の一の態様は、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有する細胞であることを要旨とする。
【0006】
また、本発明の他の態様は、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有する細胞の、細胞ストレスを検出するための使用であることを要旨とする。
【0007】
また、本発明の別の態様は、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域とを融合させたmRNAを有する細胞を培養することと、細胞の培養液に、物質を滴下することと、培養液に物質を滴下した後、細胞の蛍光強度を観察することと、蛍光強度が上昇した場合、物質は細胞のストレス要因であると判定することと、を含む、細胞ストレス物質のスクリーニング方法であることを要旨とする。当該スクリーニング方法において、細胞の蛍光強度を、細胞の核内で観察してもよい。
【0008】
また、本発明のさらに別の態様は、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域とを融合させたmRNAを有する細胞を用意することと、細胞に、細胞質を導入することと、細胞の蛍光強度を観察することと、蛍光強度が上昇した場合、導入された細胞質がストレスを受けていたと判定することと、を含む、細胞ストレスの判定方法であることを要旨とする。当該判定方法において、細胞に細胞質を導入する前に、細胞をストレプトリシンで処理し、細胞の形質膜を透過性にしてもよい。また、細胞の蛍光強度を、細胞の核内で観察してもよい。
【発明の効果】
【0009】
本発明によれば、細胞に加えられたストレスを容易に検出可能な細胞、細胞の使用、スクリーニング方法、及び細胞ストレスの判定方法を提供可能である。
【図面の簡単な説明】
【0010】
【図1】ATF4タンパク質の翻訳制御機構の概念図である。
【図2】本発明の第1の実施例に係るコンストラクトの模式図である。
【図3】本発明の第1の実施例に係るコンストラクトの発現量を示す逆転写ポリメラーゼ連鎖反応の結果である。
【図4】本発明の第1の実施例に係るコンストラクトを有する細胞の蛍光顕微鏡写真である。
【図5】本発明の第1の実施例に係る小胞体ストレスを与えられた細胞の蛍光強度を示すグラフである。
【図6】本発明の第1の実施例に係る酸化ストレスを与えられた細胞の蛍光強度を示す第1のグラフである。
【図7】本発明の第1の実施例に係る紫外線ストレスを与えられた細胞の蛍光強度を示すグラフである。
【図8】本発明の第1の実施例に係る酸化ストレスを与えられた細胞の蛍光強度を示す第2のグラフである。
【図9】本発明の第1の実施例に係るウェスタン・ブロッティングの結果を示す写真である。
【図10】本発明の第2の実施例に係るセミインタクト処理を示す模式図である。
【図11】本発明の第2の実施例に係るストレス細胞質を導入された細胞の蛍光顕微鏡写真である。
【図12】本発明の第2の実施例に係る正常細胞質を導入されたコントロール細胞の蛍光顕微鏡写真である。
【図13】本発明の第2の実施例に係るTBバッファを導入されたコントロール細胞の蛍光顕微鏡写真である。
【図14】本発明の第2の実施例に係るATF4−GFPタンパク質の翻訳等に関わる因子をアッセイした結果を示すグラフである。
【図15】本発明の第3の実施例に係る糖尿病細胞質を導入された細胞の蛍光顕微鏡写真である。
【図16】本発明の第3の実施例に係る糖尿病細胞質を導入された細胞の蛍光強度を示すグラフである。
【発明を実施するための形態】
【0011】
細胞は、ストレス環境下で、ほとんどのタンパク質の合成を停止する。しかし、細胞は、ストレス環境下においても、シャペロンやある種の転写因子群の翻訳を活性化する。ATF(Activating Transcription Factor)4タンパク質は、ストレス負荷時に翻訳が活性化される転写因子である。ストレスのない平常時においては、ATF4タンパク質のmRNAは細胞質内に存在するが、ATF4タンパク質は翻訳されない。しかし、図1に示すように、酸化ストレス、小胞体ストレス、飢餓ストレス、及びウイルス感染ストレス等のストレスが細胞に加えられると、ATF4タンパク質のmRNAが活性化され、ATF4タンパク質が翻訳される。このように、ATF4タンパク質は、ストレスにより翻訳が制御されるタンパク質である。
【0012】
ATF4タンパク質の翻訳制御は、ATF4タンパク質のmRNAの5’末端の非翻訳領域(UTR:untraslational region)が担っている。ATF4タンパク質の翻訳制御は、ストレス刺激に対して細胞内で活性化されるストレス依存的なキナーゼが、転写制御因子eIF2をリン酸化することから始まる。リン酸化されたeIF2は、ATF4タンパク質の翻訳を活性化し、翻訳されたATF4タンパク質は核内に移行して、ストレスに依存した様々なストレス応答タンパク質の転写を誘起する。
【0013】
この時転写されるストレス応答タンパク質の一つに、GADD34がある。GADD34は、PP1という脱リン酸化複合体を形成することで、eIF2の脱リン酸化を行う。その結果、ATF4タンパク質の翻訳が抑制される。つまり、ATF4とGADD34は、ネガティブ・フィードバック・ループを形成し、GADD34は、ストレス負荷時における細胞のストレス応答を、ネガティブに制御している。
【0014】
ここで、本発明の発明者らは、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有する細胞の培地中にサンプル物質を添加し、細胞の核内の蛍光強度を観察することにより、サンプル物質が細胞のストレス要因であるか否かを、高い感度でスクリーニング可能であることを見出した。また、当該細胞の核内の蛍光強度を低下させる化合物を探索することにより、細胞ストレスを軽減する化合物をスクリーニングすることも可能となる。
【0015】
例えば、ATF4タンパク質のmRNAの5’末端の非翻訳領域にルシフェラーゼ(Luciferase)等のレポータ遺伝子のみを融合させたコンストラクトは、ATF4タンパク質の翻訳領域を含まないため、GADD34によるネガティブ・フィードバック・ループ機構の影響を受けない。これに対し、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを含む細胞は、与えられたストレスに応じて、ATF4−GFPタンパク質を生成する。 さらに、ATF4−GFPタンパク質は正常に核内に移行するため、GADD34とともに、ネガティブ・フィードバック・ループを形成すると考えられる。そのため、細胞の本来の姿に近い状態で、細胞ストレスをモニターすることが可能となる。
【0016】
さらに発明者らは、形質膜に孔が設けられたセミインタクト細胞においても、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAからストレスに応じてATF4−GFPタンパク質が翻訳され、核内に移行することを見出した。セミインタクト細胞には、他の細胞から抽出した細胞質を導入することが可能である。そのため、様々な病態細胞から抽出した細胞質を、ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有するセミインタクト細胞に注入することにより、細胞質を抽出された病態細胞のストレス状態を検出することが可能となる。また、ストレス要因の阻害剤を添加することにより、細胞質を抽出された病態細胞のストレス要因を特定することも可能となる。
【0017】
(第1の実施例:生細胞を用いた細胞ストレスの検出アッセイ)
ATF4タンパク質の翻訳を可視化するために、図2に示すように、ATF4タンパク質のmRNAの5’UTR領域と、ATF4タンパク質コーディング領域と、半減期が約1時間の短寿命緑色蛍光タンパク質(EGFP:Enhanced Green Fluorescent Protein)コーディング領域とを融合させたコンストラクト(mRNA)を作製した。作製したコンストラクトmATF4 5’UTR+CDS/pd1EGFP−N1の配列は、配列表の配列番号1に示す。ここで、5’UTR領域は、ストレス時にATF4タンパク質が翻訳され、ストレスのない平常時にATF4タンパク質が翻訳されないよう、ATF4タンパク質の翻訳を制御する。
【0018】
次に、作製したmRNAを安定に発現する細胞株CHO−ATF4を得た。具体的には、Mouse ATF4 5’UTR−CDS/pd1EGFP−N1プラスミドをCHO(Chinese hamster ovary)細胞にトランスフェクションした。トランスフェクションはLipofectamine Plus (Invitrogen)とLipofectamine reagent (Invitrogen)とを用い、メーカーのマニュアルに基づいて行った。トランスフェクションの翌日に細胞をトリプシン溶液により培養皿より剥がし、300 ng/ml Geneticin (Gibco BRL)を含むHamF12−5% FCS培地中にまきこみ培養した。その後、3日ごとにGeneticinを含む培地を交換した。7〜10日後にGeneticin耐性の細胞(つまり当該プラスミドが染色体内に組み込まれた細胞)コロニーが出現するため、これらを24well プレートに単離した。次に小胞体ストレス誘導剤であるタプシガルジンを単離した細胞に作用させたときにのみ、ATF4−GFPが翻訳され核にATF4−GFPタンパク質が蓄積する細胞株を、蛍光顕微鏡観察により選別した。
【0019】
図3に示すように、得られたCHO−ATF4細胞において、タプシガルジン(Tg)によって小胞体ストレスが与えられた時(Tg+)のATF4−GFPタンパク質のmRNAの発現量と、小胞体ストレスを与えなかった時(Tg−)のATF4−GFPタンパク質のmRNAの発現量は同等であることが、逆転写ポリメラーゼ連鎖反応(RT−PCR)によって確認された。
【0020】
しかし、図4の蛍光顕微鏡写真に示すように、小胞体ストレスを与えなかった時(Tg−)、CHO−ATF4細胞は、ATF4−GFPタンパク質を発現しなかった。これに対し、小胞体ストレスが与えられた時(Tg+)、CHO−ATF4細胞は、ATF4−GFPタンパク質を発現し、ATF4−GFPタンパク質は核内に移行した。さらに、0.3μmol/Lのタプシガルジン(Tg)によって小胞体ストレスが与えられた細胞の時間経過を蛍光顕微鏡で確認したところ、ATF4タンパク質とネガティブ・フィードバック・ループを形成するGADD34の生成によって、図5に示すように、次第にATF4−GFPタンパク質の翻訳が抑制され、核内の蛍光強度は減少する傾向にあることが確認された。なお、図5においては、10サンプルの結果が描画されている。
【0021】
また、100μmol/Lの砒素(As)を添加し、酸化ストレスを細胞に与えた場合も、図6に示すように、時間経過と共に、ATF4−GFPタンパク質は核内に移行し、核内に蓄積した。その後、次第にATF4−GFPタンパク質の翻訳は抑制され、蛍光強度は減少した。なお、図6においても、10サンプルの結果が描画されている。さらに、500J/m2の紫外線(UV)を照射して、細胞にストレスを与えた場合も、時間経過と共に、ATF4−GFPタンパク質は核内に移行し、核内に蓄積したが、図7に示すように、次第にATF4−GFPタンパク質の翻訳は抑制され、蛍光強度は減少した。なお、図7においても、10サンプルの結果が描画されている。
【0022】
次に、100μmol/Lの砒素(As)を添加し、酸化ストレスを細胞に与えた場合のATF4タンパク質及びATF4−GFPタンパク質の発現量を、抗CREB(cAMP response element−binding protein)抗体及び抗GFP抗体を用いて、ウェスタン・ブロッティングで確認し、図8に示すグラフに描画した。また、図8に示すグラフに、同様の酸化ストレスを与えられた14個の細胞の蛍光強度を描画した。すると、ウェスタン・ブロッティングで確認されたATF4タンパク質の発現量と、蛍光顕微鏡で確認された蛍光強度は、時間経過と共に、同様に増減した。
【0023】
また、図9に示すように、CHO−ATF4細胞内のATF4−GFPタンパク質の発現量は、細胞の内在性のATF4タンパク質の発現量のほぼ2倍であった。以上示したように、第1の実施例に係るコンストラクトを導入されたCHO−ATF4細胞において、外来性のATF4−GFPタンパク質も、内在性のATF4タンパク質と同様に、ネガティブ・フィードバック・ループを形成し、GADD34によって、翻訳が抑制されることが示された。さらに、CHO−ATF4細胞において、外来性のATF4−GFPタンパク質は、内在性のATF4タンパク質より多く翻訳されることが示された。したがって、CHO−ATF4細胞は、細胞ストレスの有無の検証に有用であることが示された。
【0024】
(第2の実施例:セミインタクト細胞を用いた細胞ストレスの検出アッセイ)
まず、セミインタクト細胞について説明する。セミインタクト細胞とは、連鎖球菌の酵素感受性毒素であるストレプトリシンO(streptolysin O:SLO)等を形質膜に作用させることにより、形質膜を部分的に透過性にした細胞のことである。セミインタクト細胞を作製することにより、オルガネラや細胞骨格そのもの、及びオルガネラや細胞骨格のトポロジーを保持させたまま、細胞から細胞質を流出させることが可能となる。
【0025】
さらに、細胞質が流出したセミインタクト細胞に、新たに外部より分画した細胞質成分とATP再生系を導入することにより、細胞内膜動過程、タンパク質間相互作用、及びタンパク質のターゲティング等の細胞質に依存的な細胞内のイベントを、セミインタクト細胞内に再構成可能である(例えば、村田昌之ら、セミインタクト細胞を用いた細胞内タンパク質の動態・機能の解析技術の開発、月刊バイオインダストリー、日本、シーエムシー出版、2004年6月号参照。)。例えば、病態細胞でない正常細胞から作製したセミインタクト細胞に、病態細胞から抽出した病態細胞質を導入することにより、病態細胞の核の影響を排した細胞を作製することも可能である。
【0026】
ここで、タプシガルジン(Tg)処理により、小胞体ストレスを与えたL5178Yマウス細胞から細胞質を抽出し、抽出した細胞質をストレス細胞質とした。また、CHO−ATF4細胞をストレプトリシンOで処理し、セミインタクトCHO−ATF4細胞を作製した。次に、図10に示すように、セミインタクトCHO−ATF4細胞に、ATP再生系と共にストレス細胞質を導入した。すると、第1の実施例と同様に、ATF4−GFPタンパク質が発現及び核内移行し、核内に蓄積されることが、図11に示すように観察された。
【0027】
これに対し、ストレスを与えなかったL5178Yマウス細胞から細胞質を抽出し、抽出した細胞質を正常細胞質とした。次に、セミインタクトCHO−ATF4細胞に、ATP再生系と共に正常細胞質を導入したところ、図12に示すように、ATF4−GFPタンパク質の発現は観察されなかった。また、セミインタクトCHO−ATF4細胞に、ATP再生系と共にTBバッファを導入した場合も、図13に示すように、ATF4−GFPタンパク質の発現は観察されなかった。したがって、ストレス細胞質を導入されたセミインタクトCHO−ATF4細胞においては、ストレス細胞質依存的に、ATF4−GFPタンパク質が発現したことが示された。
【0028】
図14に、セミインタクトCHO−ATF4細胞を用いて、ストレス細胞質に依存的なATF4−GFPタンパク質の翻訳及び核内移行に関わる因子をアッセイした結果を示す。なお、図14のグラフの横軸においては、ストレス細胞質を導入した場合の核の蛍光強度を100%に、TBバッファを導入した場合の核の蛍光強度を0%に換算している。図14に示すように、ATF4−GFPタンパク質の翻訳及び核内移行は、ATP及びGTPに依存していることが明らかになった。
【0029】
また、細胞質に存在する翻訳制御領域を含むATF4−GFPの遺伝子に対応するmRNAをRNAase処理によって分解した後では、ストレス負荷細胞質をセミインタクト細胞内に添加してもATF4−GFPの発現は起こらなかった。さらに、GTPγS存在下でATF4−GFPの核内移行が阻害された。したがって、ATP及びGTPは、この翻訳制御機構の制御因子として必要なことがわかった。
【0030】
また、キナーゼ阻害剤であるスタウロスポリン(staurosporin)を導入した結果から、ATF4−GFPタンパク質の翻訳及び核内移行は、キナーゼに依存していることが明らかになった。さらに、タンパク質合成阻害剤であるシクロヘキシミド(cycloheximide)を導入した結果から、細胞内のタンパク質合成を止めると、ATF4−GFPタンパク質の翻訳及び核内移行は生じないことが明らかになった。
【0031】
以上の結果より、セミインタクトCHO−ATF4細胞に導入されたストレス細胞質によって、新たなATF4−GFPタンパク質の翻訳が行われることが示された。また、セミインタクトCHO−ATF4細胞内のmRNAをRNAaseによって予め分解した後、セミインタクトCHO−ATF4細胞にストレス細胞質を導入した場合、ATF4−GFPタンパク質の翻訳及び核内移行は起きなかった。これらの結果より、セミインタクトCHO−ATF4細胞においても、ストレス細胞質依存的にATF4−GFPタンパク質の翻訳制御機構が機能していることが示された。
【0032】
(第3の実施例:セミインタクト細胞を用いた糖尿病による細胞ストレスの検出アッセイ)
糖尿病態マウス(過脂肪食供与マウス)の副睾丸脂肪細胞から細胞質を抽出し、抽出した細胞を糖尿病細胞質とした。次に、セミインタクトCHO−ATF4細胞に、ATP再生系と共に糖尿病細胞質を導入した。すると、第2の実施例と同様に、ATF4−GFPタンパク質が発現及び核内移行し、核内に蓄積されることが、図15に示すように観察された。また、図16に示すように、ATF4−GFPタンパク質の翻訳は、細胞質濃度に依存することも示された。
【0033】
よって、糖尿病細胞質は、ATF4−GFPタンパク質の翻訳及び核内移行を活性化することが明らかになった。また、この結果は、糖尿病細胞質は「ストレス」性の細胞質であることを示している。したがって、ストレス依存的な各種キナーゼの阻害剤を、糖尿病細胞質を導入されたセミインタクトCHO−ATF4細胞に導入し、ATF4−GFPタンパク質の翻訳及び核内移行を抑制するキナーゼの阻害剤を特定することにより、糖尿病細胞質のストレス要因を特定することが可能となることが示された。
【特許請求の範囲】
【請求項1】
ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有する細胞。
【請求項2】
ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有する細胞の、細胞ストレスを検出するための使用。
【請求項3】
ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域とを融合させたmRNAを有する細胞を培養することと、
前記細胞の培養液に、物質を滴下することと、
前記培養液に前記物質を滴下した後、前記細胞の蛍光強度を観察することと、
前記蛍光強度が上昇した場合、前記物質は細胞のストレス要因であると判定することと、
を含む、細胞ストレス物質のスクリーニング方法。
【請求項4】
前記細胞の蛍光強度を、前記細胞の核内で観察する、請求項3に記載の細胞ストレス物質のスクリーニング方法。
【請求項5】
ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域とを融合させたmRNAを有する細胞を用意することと、
前記細胞に、細胞質を導入することと、
前記細胞の蛍光強度を観察することと、
前記蛍光強度が上昇した場合、前記導入された細胞質がストレスを受けていたと判定することと、
を含む、細胞ストレスの判定方法。
【請求項6】
前記細胞に前記細胞質を導入する前に、前記細胞をストレプトリシンで処理し、前記細胞の形質膜を透過性にすることを更に含む、請求項4に記載の細胞ストレスの判定方法。
【請求項7】
前記細胞の蛍光強度を、前記細胞の核内で観察する、請求項5又は6に記載の細胞ストレスの判定方法。
【請求項1】
ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有する細胞。
【請求項2】
ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域と、を融合させたmRNAを有する細胞の、細胞ストレスを検出するための使用。
【請求項3】
ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域とを融合させたmRNAを有する細胞を培養することと、
前記細胞の培養液に、物質を滴下することと、
前記培養液に前記物質を滴下した後、前記細胞の蛍光強度を観察することと、
前記蛍光強度が上昇した場合、前記物質は細胞のストレス要因であると判定することと、
を含む、細胞ストレス物質のスクリーニング方法。
【請求項4】
前記細胞の蛍光強度を、前記細胞の核内で観察する、請求項3に記載の細胞ストレス物質のスクリーニング方法。
【請求項5】
ATF4タンパク質のmRNAの5’末端の非翻訳領域と、ATF4タンパク質コーディング領域と、GFPタンパク質コーディング領域とを融合させたmRNAを有する細胞を用意することと、
前記細胞に、細胞質を導入することと、
前記細胞の蛍光強度を観察することと、
前記蛍光強度が上昇した場合、前記導入された細胞質がストレスを受けていたと判定することと、
を含む、細胞ストレスの判定方法。
【請求項6】
前記細胞に前記細胞質を導入する前に、前記細胞をストレプトリシンで処理し、前記細胞の形質膜を透過性にすることを更に含む、請求項4に記載の細胞ストレスの判定方法。
【請求項7】
前記細胞の蛍光強度を、前記細胞の核内で観察する、請求項5又は6に記載の細胞ストレスの判定方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2011−120520(P2011−120520A)
【公開日】平成23年6月23日(2011.6.23)
【国際特許分類】
【出願番号】特願2009−280285(P2009−280285)
【出願日】平成21年12月10日(2009.12.10)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度、独立行政法人新エネルギー産業技術総合開発機構、細胞内ネットワークのダイナミズム解析技術開発事業、産業技術力強化法第19条の適用を受けるもの
【出願人】(503318666)日京テクノス株式会社 (19)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成23年6月23日(2011.6.23)
【国際特許分類】
【出願日】平成21年12月10日(2009.12.10)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度、独立行政法人新エネルギー産業技術総合開発機構、細胞内ネットワークのダイナミズム解析技術開発事業、産業技術力強化法第19条の適用を受けるもの
【出願人】(503318666)日京テクノス株式会社 (19)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

