脊椎動物用の食品組成物
【課題】脊椎動物の養殖の発育速度改善、市場に出す前の培養時間の短縮および飼料要求率ならびに養殖の間の潜在的リスクの低減のための脊椎動物用食品組成物を提供する。
【解決手段】酸性かつシステイン豊富な分泌タンパク質、酸性かつシステイン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステイン豊富な非分泌性タンパク質抗体、または酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメントを含んでなる、脊椎動物用の食品組成物。
【解決手段】酸性かつシステイン豊富な分泌タンパク質、酸性かつシステイン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステイン豊富な非分泌性タンパク質抗体、または酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメントを含んでなる、脊椎動物用の食品組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は培養方法に関し、さらに詳細には、脊椎動物用の食品組成物に関する。
【背景技術】
【0002】
世界人口の急速な増加および耕地面積の低下に伴い、利用可能な飼料資源は次第に不足してきており、世界中の飼料製造において、単位面積当たりの生産量を改善し、栄養価の添加を増す傾向にある。
【0003】
水産業に関して言えば、海からの漁獲高はほぼ飽和状態にあり、また、日常の動物タンパク質市場における魚製品の需要は増大していることから、製品供給不足を補う必要がある。
【0004】
ハタ科(Epinephelus spp.) は、マハタ属、ハタ亜科、ハタ科、硬骨魚綱 スズキ目に属する温水性魚の一種であり、世界じゅうの熱帯および亜熱帯水域に幅広く分布しており、養殖業にとって、アジアおよび太平洋領域におけるもっとも重要な経済的魚種として一般に認められている。台湾では、養殖魚は主に、ヤイトハタ(Epinephelus malabaricus)、チャイロマルハタ(Epinephelus coioides)、タマカイ(Epinephelus lanceolatus)およびノミノクチ(Epinephelus fario)である。一般に、ハタ科は市場に出す少なくとも8〜12ヶ月前に養殖されなければならない;しかしながら、最終的な収穫高は高くない。ウイルスおよび細菌感染に起因する幼魚の早期死亡率に加えて、例えば、気象要因、水質汚染問題、餌料生物の管理および養殖の間の管理はすべて、実施者にとってのリスクを増大する。したがって、魚の養殖の発育速度の改善、市場に出す前の養殖時間の短縮、ならびに、飼料要求率(与えた飼料の重量/魚体の体重増加)および養殖の間の潜在的リスクの低減の方法についての研究は、ハードワークに値するものとなっている。
【0005】
酸性かつシステイン豊富な分泌タンパク質(SPARC)とは、オステオネクチンまたはBM40とも称され、約35〜45kDaのタンパク質サイズを有し、主として細胞外マトリクス(ECM)に分布する。また、これは、マトリクス細胞のタンパク質であり、ECMまたは細胞への結合特性を有する多機能性糖タンパク質である。
【0006】
SPARCは主にECM内に分布する;しかしながら、SPARCの機能は、構造の構成に関与し細胞を支持する、マトリクスの通常の構造タンパク質とは異なる;それどころか、SPARCは、特に、細胞とECMを連結する架橋の働きをし、幾つかの種類の細胞マトリクス・タンパク質の産生、貯蔵および蓄積を制御することができる調節タンパク質である(非特許文献1〜2)。しかしながら、SPARCは、主に胚発生の間に発現し、細胞分化、組織の石灰化および生成、骨の発達、形態、および器官の形成に多いに関与する。明らかな発現は、主に、傷ついた皮膚または組織の修復および再編成のプロセスを生じることから、成体生物におけるこのタンパク質の発現レベルは、低下傾向にある(非特許文献2)。
【0007】
SPARCは、3つの機能ドメインに分けることができる(非特許文献3):
1.弱い親和性で5〜8つのカルシウムイオンと結合することができ、細胞伸長を阻害し、ECMの産生を制御する機能を有する、タンパク質のN−末端にある酸性ドメイン;
2.複数のシステインを含み、ホリスタチンと似た機能を有し、細胞増殖を阻害する能力があり、さらに別の特異的配列、すなわち、銅イオン結合配列(K)GHKを含み(非特許文献4)、血管増殖促進機能を有する、ホリスタチン様ドメイン;
3.SPARCのC末端であり、2つのEF−ハンドモチーフを有し、カルシウムイオンと高い親和性で結合することができ、細胞または一部のコラーゲンと結合することができ、さらに、細胞の増殖および伸長を阻害する効果を有する、細胞外カルシウムイオン結合ドメイン(ECドメイン)(非特許文献5)。
【0008】
現在のところ、SPARCの生物学的機能についての研究および考察について幾つかの結果が報告されており、インビトロにおけるマウス内皮細胞培養の観察を通じて幾つかの特性が見出されている:
(I)SPARCの発現は、細胞形態の伸長を阻害して、細胞をほぼ円形にし(非特許文献6);また、ECM組成物および一部のECMタンパク質の発現を制御して、細胞と細胞外マトリクスとの結合を調整し、細胞形態および遊走能を変化させること(非特許文献7;および非特許文献8)ができる;
(II)細胞周期の進行を阻害して、サイクルを中期G1期で停止する、すなわち、細胞増殖阻害機能を有する(非特許文献9);
(III)血管細胞培養の研究から、内皮細胞が血管増殖促進特性を有することが見出された(非特許文献10)。インビボにおいて、SPARC遺伝子をノックダウンしたマウスが生後間もなく白内障を患うことが判明し、このことにより、SPARCは目のレンズの発達にとって必須タンパク質であると考えられる(非特許文献9)。研究を通じて、SPARC遺伝子をノックダウンしたマウスでは、皮膚構造における異常変化、すなわち、肥厚性の脂肪層の脂肪細胞の体積および数が増大し、血中の脂肪細胞によって分泌されるレプチンの濃度が上昇することも見出されており、このことにより、SPARCタンパク質はインビボにおける体内の脂肪量の変化の制御との相関関係を有すると考えられる(非特許文献11)。
【0009】
ミオスタチンは、成長および分化因子−8(GDF−8)とも称され、形質転換成長因子TGF−βの仲間である。ミオスタチンは、筋肉の成長および分化を負に制御しうる。牛およびヒトの体内における研究を通じて、ミオスタチンの機能が失われた場合に、筋肉の成長および分化の負の制御が効かなくなることから、筋肉の増大が生じることが見出されている(非特許文献12;および非特許文献13)。哺乳動物の研究では、マウスのミオスタチンがノックダウンされ(非特許文献14)、マウスの筋肉においてミオスタチン阻害タンパク質(例えば、ホリスタチン)の高レベルの発現または信号伝達にとって必須の受容タンパク質ActRIIBの機能不全(非特許文献15)が筋肉の増大を発生させる。硬骨魚の研究では、胎芽成長を促進するため、アンチセンスモルホリノ・ノックダウン技術を用いて、ゼブラフィッシュの胎芽のミオスタチン−1のmRNAを阻害する(非特許文献16);あるいは、RNAi技術を用いてゼブラフィッシュのミオスタチン−1の機能を封じ、それによって大型のゼブラフィッシュの特徴を発現させる(非特許文献17)。筋肉細胞は組織薄片についてさらに研究されており、体積の肥大および筋肉細胞数の過形成が筋肉繊維の発現をもたらしうることが判明している。
【0010】
一方、インビトロにおける細胞株の研究では、C2C12筋芽細胞株においてミオスタチンが高濃度で発現される場合、筋芽細胞の増殖は阻害され、G1期の細胞を細胞周期のS期で停止できることが指摘されている(非特許文献18)。一方、筋肉の星状膠細胞においてミオスタチンが高濃度で発現される場合には、ミオスタチンが筋肉の星状膠細胞の活性化および自己再生を阻害しうることが見出されており(非特許文献19)、このことは、ミオスタチンが筋発生の負の制御の役割を果たすことを証明している。筋肉細胞の制御に加えて、他の文献では、ミオスタチンが脂質生成を阻害する機能を有することが指摘されており(非特許文献20)、また、他の研究において、ミオスタチンが筋芽細胞のアポトーシスを阻害する機能を有することも指摘されている(非特許文献21)。
【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】Bradshaw and Sage, 2001, J Clin Invest 107;1049-1054
【非特許文献2】Lane and Sage, 1994, FASEB J 8;163-173
【非特許文献3】Hohenester et al., 1997, EMBO J 16;3778-3786
【非特許文献4】Iruela-Arispe et al., 1995, Mol Biol Cell 6;327-343
【非特許文献5】Maurer et al., 1995, J Mol Biol 253;347-357
【非特許文献6】Murphy-Ullrich et al., 1991, J Cell Biol 115;1127-1136
【非特許文献7】Hasselaar et al., 1991, J Biol Chem 266;13178-13184
【非特許文献8】Tremble et al., 1993, J Cell Biol 121;1433-1444
【非特許文献9】Yan and Sage, 1999, J Histochem Cytochem 47;1495-1506
【非特許文献10】Funk and Sage, 1991, Proc. Natl. Acad. Sci. USA 88;2648-2652
【非特許文献11】Bradshaw et al., 2003, Proc. Natl. Acad. Sci. USA 100;6045-6050
【非特許文献12】McPherron and Lee, 1997, Proc. Natl. Acad. Sci. USA 94, 12457-12461
【非特許文献13】Schuelke et al, 2004, The New England Journal of Medicine 350, 2682-2688
【非特許文献14】McPherron and Lee, Proc. Natl. Acad. Sci. USA 94;12457-12461
【非特許文献15】Lee and McPherron, 2001, Proc. Natl. Acad. Sci. USA 98;9306-9311
【非特許文献16】Amali et al, 2004, Developmental Dynamics 229;847-856
【非特許文献17】Acosta et al, 2005, Journal of Biotechnology 119;324-331
【非特許文献18】Thomas et al, 2000, The Journal of Biological Chemistry 275;40235-40243
【非特許文献19】McCroskery, 2003, The Journal of Cell Biology 162;1135-1147
【非特許文献20】Rebbapragada et al, 2003, Molecular and Cellular Biology 23;7230-7242
【非特許文献21】Rios et al, 2001, Biochemical and Biophysical Research Communications 280;561-566
【発明の概要】
【発明が解決しようとする課題】
【0012】
しかしながら、ミオスタチンおよびSPARCの研究において、筋肉増加に加えて、養殖業における原価管理にとって重要な、飼料要求率(与えた飼料の重量/体重増加)についての報告はない。さらには、脊椎動物に免疫を付与する従来の方法は、エピトープを注入するが、これは時間と人件費がかかり、脊椎動物は容易に傷む。したがって、飼料要求率を低減する食品組成物の開発は、養殖における発育速度の改善のために、当業界において必要とされている。
【課題を解決するための手段】
【0013】
本発明は、養殖の発育速度の改善、市場に出す前の培養時間の短縮、および飼料要求率および養殖の間の潜在的リスクの低減のための脊椎動物用の食品組成物に関する。
【0014】
本発明は、酸性かつシステイン豊富な分泌タンパク質(secreted protein acidic and rich in cysteine)、酸性かつシステイン豊富な分泌タンパク質のフラグメント(fragment of secreted protein acidic and rich in cysteine)、抗−酸性かつシステイン豊富な非分泌性タンパク質抗体(anti-secreted protein acidic and rich in cysteine antibody)、または酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメント(anti-fragment of secreted protein acidic and rich in cysteine antibody)を含む脊椎動物用の食品組成物を提供する。
【0015】
本発明に従った食品組成物は、ミオスタチン、ミオスタチンのフラグメント、抗ミオスタチン抗体、またはミオスタチン抗体の抗フラグメントをさらに含むことが好ましい。
【図面の簡単な説明】
【0016】
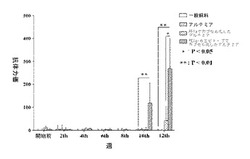
【図1】酸性かつシステイン豊富な分泌タンパク質(SPARC)の免疫阻害を受けたハタの抗体の血清力価を示すグラフ。
【図2】酸性かつシステイン豊富な分泌タンパク質の免疫阻害を受けたハタの体重変化を示すグラフ。
【図3】ミオスタチンの免疫阻害を受けたハタの抗体の血清力価を示すグラフ。
【発明を実施するための形態】
【0017】
本発明は、酸性かつシステイン豊富な分泌タンパク質、酸性かつシステイン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステイン豊富な非分泌性タンパク質抗体、または酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメントを含む脊椎動物用の食品組成物に関する。
【0018】
本発明に従った食品組成物は、酸性かつシステイン豊富な分泌タンパク質の機能を阻害することによって脊椎動物の飼料要求率を低下させる。
【0019】
好ましくは、本発明に従った食品組成物は、ミオスタチン、ミオスタチンのフラグメント、抗ミオスタチン抗体、またはミオスタチン抗体の抗フラグメントをさらに含む。
【0020】
本発明の食品組成物は、脊椎動物に適している。好ましくは、本発明の食品組成物は魚に適しており;さらに好ましくは、魚は硬骨魚綱に属し、現在、ゼブラフィッシュ(Danio rerio)、タイセイヨウサケ(Atlantic salmon)、モザンビークティラピア(Mozambique tilapia)、ストライプドバス(Morone saxatilis)、ヨーロッパヘダイ(Morone saxatilis)、ニジマス(Oncorhynchus mykiss)、カワマス(Salvelinus fontinalis)、ナマズ(Silurus asotus)、チャイロマルハタおよびスズキ(Lateolabrax japonicus)を含めた魚のミオスタチンはクローン化されてきており、そのアミノ酸配列は高度に保存されており、したがって、ミオスタチンが幾つかの機能を有すると考えられる;特に好ましくは、魚は硬骨魚綱スズキ目に属し;特に好ましくは、魚は硬骨魚綱スズキ目ハタ科に属し;特に好ましくは、魚は硬骨魚綱スズキ目ハタ科ハタ亜科に属し;特に好ましくは、魚は硬骨魚綱スズキ目ハタ科ハタ亜科マハタ属に属し;最も好ましくは、魚はチャイロマルハタである。
【0021】
本発明の食品組成物は、例えば、遺伝子、転写、翻訳、タンパク質活性および信号経路の段階において、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の機能を阻害することによって脊椎動物における飼料要求率を改善するためのものである。当業者は、例えば、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質自体の活性が阻害される、または、受容タンパク質の機能が阻害されるなど、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の機能を阻害するための適切な操作を選択することができる。好ましくは、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の機能は、免疫阻害方法を通じて阻害され、ここで、タンパク質活性は阻害されるが、脊椎動物に全体的な悪影響を生じさせない。
【0022】
本発明の好ましい実施の形態では、免疫阻害方法は、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の抗体、または酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の抗体の抗フラグメントを脊椎動物に投与することである。好ましくは、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質のフラグメントはエピトープである。当業者は、抗酸性かつシステイン豊富な分泌タンパク質および/または抗ミオスタチン抗体またはそのエピトープの抗体を得るために、タンパク質またはそのエピトープを発現する遺伝子をコードした酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質をクローン化して入手し、タンパク質またはエピトープを動物の身体に免疫を付与することができる。本発明の抗体は、脊椎動物の身体自体が抗体を産生できるように、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質またはそのエピトープを他の動物に与えて免疫付与し、精製することによって、または、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質またはそのエピトープを脊椎動物の身体に直接与えて免疫付与することによって獲得することができる。本発明の抗体はポリクローナル抗体またはモノクローナル抗体であって差し支えなく、抗体はポリクローナル抗体であることが好ましい。
【0023】
本明細書では「エピトープ」という用語は、タンパク質抗原における、抗原を発現する免疫応答を誘発することができるフラグメントのことをいい、これは、構造予測を通じて、またはタンパク質フラグメントを選択し、免疫付与された動物における免疫応答を観察することによって、入手することができる。
【0024】
ミオスタチンは、TGF−β群の他の物質とその配列が極めて類似しており、3つの部位:(1)タンパク質の分泌物から放出する信号としてのN−末端の疎水性ドメイン;(2)高度に保存されたタンパク質 開裂位置RXRR(配列番号:2);(3)システイン豊富なC末端活性ドメイン(Sharma et al、1999、Journal of cellular physiology 180;1-9)を含む。脊椎動物におけるミオスタチンのアミノ酸配列がC末端の活性ドメインにおいて高度に保存されていることが多くの報告において確認されている(McPherron et al、1997、Nature 387;83-90)。現在、ミオスタチンの研究において、ミオスタチンに対して高い特異性を有するモノクローナル抗体JA16では(Whittemore et al、2003、Biochemical and Biophysical Research Communications 300;965-971)、ミオスタチンとの結合位置を解析することによって、結合位置がマウスのミオスタチンのC末端における15のアミノ酸DFGLDCDEHSTESRC(配列番号:1)にあることが判明し、したがって、C末端ドメインは抗原性フラグメントであることが確認できる。したがって、好ましくは、ミオスタチンの抗原性フラグメントはミオスタチンのC末端ドメインであり;さらに好ましくは、ミオスタチンのC末端ドメインは配列番号:1に示す配列を有する。
【0025】
一方、エピトープは小さいペプチドフラグメントであり、小さいフラグメント抗原が動物に直接免疫付与される場合、免疫応答は十分ではない可能性がある。免疫応答の改善には、タンデムリピート単位を含む直線アレイ・エピトープ(LAE)の構築が好ましい。加えて、抗原の送達を補助するため、細菌毒素を使用して、毒素を排除した毒素活性を輸送システムとして利用し、それによって、毒素の特性を利用した全般的な免疫付与を達成してもよい。好ましくは、本発明のLAEは、シュードモナス菌の外毒素(PE)AのドメインIaと融合される。シュードモナス菌の外毒素は、66kDaの分子量を有し、613のアミノ酸を含み、そのタンパク質構造は、主として、3つのドメインを含み、ドメインIa(アミノ酸1〜252)は受容体結合領域であり、哺乳動物の細胞の細胞膜におけるα2−マクログロブリン/低密度リポタンパク質受容体(LDLR)との結合に関与し、受容体が媒介するエンドサイトーシスを通じて細胞内膜系へと入る。シュードモナス・エキソトキシンAは誘発された免疫応答を効果的に促進することができることが証明されている(Donnelly et al, 1993, Proc. Natl. Acad. Sci. USA 90; 3530-3534)。
【0026】
本発明のもう1つの好ましい実施の形態では、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の抗体、または酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質抗体の抗フラグメントは、エビ体内にバイオカプセル化される。エビは、魚に簡単に与えられる飼料として通常使用される。好ましくは、エビは幼生のエビであり;さらに好ましくは、幼生は凍結乾燥されて粉末化される。
【0027】
本発明のもう1つの別の好ましい実施の形態では、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の抗体、または酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質抗体の抗フラグメントは、微生物において発現され、その微生物は、エビにおけるカプセル化など、組成物に添加することができる。好ましくは、微生物の培養物は、凍結乾燥され、粉末化される。別の態様では、微生物は大腸菌(Escherichia coli)である。
【0028】
本発明の1つの好ましい実施の形態では、酸性かつシステイン豊富な分泌タンパク質の機能の免疫阻害は、対照群と比較して、約5%を超える飼料要求率の低減に有効であり;さらに好ましくは、約8%〜約40%である。
【0029】
以下の実施例は、単に例証の目的で与えられるものであって、本発明の範囲を制限することは意図されていない。
【実施例】
【0030】
実施例1:酸性かつシステイン豊富な分泌タンパク質(SPARC)の免疫阻害:
抗原の調製:
70±10gの平均体重および5〜6インチ(12.7〜15.24cm)の平均長を有する合計48匹のチャイロマルハタを対照群および実験群として使用し、試験期間は5ヶ月であった。プライマー1(配列番号:3)およびプライマー2(配列番号:4)を用いてsparc遺伝子を増幅することによって抗原を調製した。
【0031】
50Lの発酵タンクでエピトープを含めた大腸菌(E. coli)BL21(DE3)株を培養するために、35Lの発酵培養プロセスを確立した。4本の試験官に入った、37℃でLB/アンピシリン培地を用いて一晩培養した5mlの細菌株を、それぞれ、0.2LのLB/アンピシリン培地に接種し、合計1Lを37℃においてOD600が0.3になるまで振とう培養し、次いで、35Lの培養培地に加え、サンプルを採取して毎時のOD600を決定し、成長曲線の変化をモニタした。成長曲線に従って適切な時点をさらに選択し、0.1mMの最終濃度を有するIPTGを加え、大腸菌が融合タンパク質を高濃度で発現するように誘発し、37℃で3時間、振とう培養し、遠心分離して細菌を回収した。融合タンパク質の発現をSDS−PAGEおよびウェスタンブロット法によって決定し、最適な35Lの発酵条件を決定した。
【0032】
バイオカプセル化したアルテミア・サリナ(Altemia salina L.)の経口ワクチンの調製
アルテミア・サリナの培養:
4gのアルテミア・サリナの乾燥卵の重量を測定し、250mlのビーカーに入れ、150mlの淡水を加えて0.5時間浸漬した。アルテミア・サリナの残った卵をスクリーンでろ過し、適量の淡水で洗浄した。アルテミア・サリナの残りの卵を5Lの培養液に加えて均一に分散させた。エアストーンを設置して空気の送入を開始し、空気の取り込み量を約500cm3/分に調整した(溶存酸素が2ppmを超えるように維持)。照明装置を点灯し、室温および水温を26〜28℃に保った。24時間後、空気の送入を停止し、照明装置を容器の底部に移し、走光性を利用してアルテミア・サリナの幼生を容器の底部に引き寄せ、5分間そのままにした。この時点で、非培養の卵および培養後の空になった卵の殻を水面に浮かせて、浮いた卵の殻をサイフォンの原理または水を吸い込むことができる他の手段を利用して除去した。培養した初齢の幼生をスクリーンで穏やかにろ過し(細孔120μm)、海水で穏やかに洗浄し、2Lの新鮮な培養液に加えた。孵化液を穏やかに攪拌し、アルテミア・サリナの幼生を均一に分散させた。1mlの培養液を吸引し、1mlの格子状のカウンタプレートに滴下した。幼生の摂動を防ぐため、50℃の熱板上に10分間、幼生を置くことによって死滅させて、カウントを容易にしてもよい。カウント時には、カウンタプレートを、観察のため、60〜100倍の倍率の解剖顕微鏡下に置いた。カウンタプレートを1000格子になるように切断し、カウント方法は、10×10格子(0.1mlあたりの幼生の数)を無作為に選択して幼生の数を数え、プレート上の他の位置の数も同様にカウントし、平均し、10を乗じて、1mlあたりの幼生の数、またはプレート上の幼生の合計数を得ることによってカウントしてもよい。カウント結果に従って、アルテミア・サリナの密度を、1mlあたり500個の幼生になるように調整した。エアストーンを設置し、空気の送入を開始し、空気の取り込み量が約300〜400cm3/分になるように調整した(溶存酸素が2ppmを超えるように維持)。室温および水温を26〜28℃に保った。12〜18時間の培養後、アルテミア・サリナは最初の脱皮を経て、2齢の幼生になった。この時点で、バイオカプセル化工程が行われる。
【0033】
バイオカプセル化:大腸菌を遠心分離して1000×gで沈降させた。余った培地をデカンテーションし、細菌を等量のPBSで再懸濁し、細菌上の余剰培地を洗い流した。1000×gで再び遠心分離を行い、細菌を適量のPBSに再懸濁して、1×1010cfu/mLの濃度の細菌液を調製した。滅菌法は加熱滅菌であり、細菌液を10分間、65℃の水浴に入れ、次に、滅菌液を10分間、氷上に置いた。2齢の幼生のアルテミア・サリナを所望の容量にパッケージし、大腸菌の最終濃度が約1×1010cfu/mLになるように、調製した細菌液を加え、空気を適切に2時間送入した。
【0034】
カプセル化の結果の判定:
サンプリングの前に空気の送入を停止し、2mlのカプセル化したアルテミア・サリナ溶液を小さいスクリーン上に吸引し、大量の淡水で洗浄した。アルテミア・サリナの幼生を遠心分離管に吸引した。マイクロ遠心分離管を−20℃の冷凍庫に10分間入れて、 アルテミア・サリナの幼生を凍結して死滅させ、死滅したアルテミア・サリナの幼生を9cmの培養皿に注ぎ、少量の滅菌水を加えてアルテミア・サリナの幼生を均一に分散させ、つぎに、2齢の幼生500個をピペットマンを用いてマイクロ遠心分離管に吸引し、300rpmで遠心分離して幼生を遠心分離管の底部に集め、遠心分離管内の水を除去し、100μLの滅菌水に置き換えた。アルテミア・サリナの幼生を、マイクロ遠心分離管内で微小粉砕用の棒を用いて注意深く粉砕した。サンプルをSDS−PAGEおよびウェスタンブロット法に供した。
【0035】
アルテミア・サリナを含む飼料の調製
ろ過したまたは未ろ過の2齢のアルテミア・サリナの水を可能な限り除去し、凍結乾燥機を用いて凍結乾燥して粉末化した。アルテミア・サリナの粉末を、通常の粉砕した飼料と1:1000の比で混合し、再び粒化した。
【0036】
食品組成物の調製:
細菌液を濃縮し、凍結乾燥機を用いて凍結乾燥して粉末化した。細菌粉末を1gの飼料に対して3.3×109cfuの大腸菌粉末の比で粉砕した飼料と混合し、再び粒化した。
【0037】
動物実験
アルテミア・サリナ群:実験動物を4群:実験群のPEIa−エピトープ群、および、それぞれ、通常の飼料 、アルテミア・サリナ含有飼料およびPEIaフラグメントを用いてカプセル化したアルテミア・サリナを含む飼料を与えた、3つの対照群に分けた。約52.36gの平均体重および5〜6インチ(12.7〜15.24cm)の平均長を有する合計80尾のチャイロマルハタを使用し、実験期間は約12週間であった。動物には、毎月曜日、火曜日、水曜日に抗原を含む飼料を与え、毎木曜日、金曜日、土曜日に通常の飼料を与え、日曜日には絶食させ、魚の体液を免疫付与前および免疫付与後2週間の時点で採取し、これを20〜40分間放置した後に固化し、遠心分離し、ELISA用の血液の上清成分のサンプルを取り、血中の内因性タンパク質に対する抗体力価を決定した。
【0038】
酵素結合免疫吸着法(ELISA)
抗原−抗体の特異的結合を利用して、1μg(100μl)のSPARC−His組み換えタンパク・フラグメントを、初めにコーティングバッファーと均質に混合し、その混合物を96ウェルNunc−Immuno(商標)プレート(NUNC(商標))の底部に加え、4℃で一晩静置し、タンパク質を底部に結合させた。プレートをPBSTで3回洗浄し、5%のスキムミルクを含む100μlのTBST溶液を加えて室温で1時間反応させ、再び、PBSTで少なくとも3回洗浄した。PBSTで希釈した試験用血清を一次抗体として使用し、ウェルに加え、室温で約2〜3時間静置した。プレートPBSTで少なくとも3回洗浄し、次に、二次抗体として、100μlのマウスの非ハタ科血清を室温で1時間静置し、PBSTで少なくとも3回洗浄した。最後に、後部にアルカリ・ホスファターゼを連結させた100μlのヤギの非マウス血清を三次抗体として加え、室温で1時間静置し、プレートをPBSTで洗浄した。最後に、50μlの基質溶液p−ニトロフェニルリン酸塩の錠剤を各ウェルに加え、室温で30分間静置し(色調の顕在化に応じて)、細胞酵素分析装置でOD405における吸収度を測定した。
【0039】
結果
アルテミア・サリナ群
最初にハタ科の魚の血液を採取し、血清を分離し、酸性かつシステイン豊富な分泌タンパク質のエピトープを含む組み換え融合タンパク質の給餌後の各段階において、ELISA法で、組み換えしたハタ科の魚の酸性かつシステイン豊富な分泌タンパク質の、酸性かつシステイン豊富な分泌タンパク質エピトープについて、ハタ科の魚の血清の抗体力価を決定した。免疫付与後10週間の時点における抗体力価を決定したところ、12週間に至るまで、継続的に上昇しており、PEIa−エピトープ群の抗体力価は、通常の飼料、アルテミア・サリナを含む飼料およびPEIaフラグメントでカプセル化したアルテミア・サリナを含む飼料を与えた3つの対照群の力価に比べて高く、抗体力価は約395に至った(図1参照)。
【0040】
12週間の動物実験における飼料の合計消費量および飼料要求率を計算した。統計データから、12週間におけるPEIa−エピトープ実験群および他の3つの対照群の飼料の合計消費量はほぼ等量であり、平均飼料要求率はPEIa−エピトープ実験群では1.46、通常の飼料 、アルテミア・サリナを含む飼料およびPEIaフラグメントでカプセル化したアルテミア・サリナを含む飼料を与えた3つの対照群では2.67、2.58、および2.81であり、言い換えれば、酸性かつシステイン豊富な分泌タンパク質のエピトープを与えた実験群は、他に比べて、市場に出す前に消費した飼料の量が少なく、肉量の多いハタ科の魚が得られたことが判明した(表1参照)。
【表1】

【0041】
実施例2:ミオスタチンの免疫阻害:
ミオスタチン・エピトープ組み換えタンパク発現大腸菌(E. coli)の調製
50Lの発酵タンクでエピトープを含んだ大腸菌BL21(DE3)株を培養するため、35Lの発酵培養プロセスを確立した。4本の試験官に入った、37℃でLB/アンピシリン培地を用いて一晩培養した5mlの細菌株を、それぞれ、0.2LのLB/アンピシリン培地に接種し、合計1Lを37℃においてOD600が0.3になるまで振とう培養し、次いで、35Lの培養培地に加え、サンプルを採取して2時間毎のOD600を決定し、成長曲線の変化をモニタした。成長曲線に従って適切な時点をさらに選択し、0.1mMの最終濃度を有するIPTGを加え、大腸菌が融合タンパク質を高濃度で発現するように誘発し、37℃で3時間、振とう培養し、遠心分離して細菌を回収した。融合タンパク質の発現をSDS−PAGEおよびウェスタンブロット法によって決定し、最適な35Lの発行条件を決定した。
【0042】
バイオカプセル化したアルテミア・サリナの経口ワクチンの調製
4gのアルテミア・サリナの乾燥卵の重量を測定し、250mlのビーカーに入れ、150mlの淡水を加えて0.5時間浸漬した。アルテミア・サリナの残った卵をスクリーンでろ過し、適量の淡水で洗浄した。アルテミア・サリナの残りの卵を5Lの培養液に加えて均一に分散させた。エアストーンを設置して空気の送入を開始し、空気の取り込み量を約500cm3/分に調整した(溶存酸素が2ppmを超えるように維持)。照明装置を点灯し、室温および水温を26〜28℃に保った。24時間後、空気の送入を停止し、照明装置を容器の底部に移し、走光性を利用してアルテミア・サリナの幼生を容器の底部に引き寄せ、5分間そのままにした。この時点で、非培養の卵および培養後の空になった卵の殻を水面に浮かせて、浮いた卵の殻をサイフォンの原理または水を吸い込むことができる他の手段を利用して除去した。培養した初齢の幼生をスクリーンで穏やかにろ過し(細孔120μm)、海水で穏やかに洗浄し、2Lの新鮮な培養液に加えた。孵化液を穏やかに攪拌し、アルテミア・サリナの幼生を均一に分散させた。1mlの培養液を吸引し、1mlの格子状のカウンタプレートに滴下した。幼生の摂動を防ぐため、50℃の熱板上に10分間、幼生を置くことによって死滅させて、カウントを容易にしてもよい。カウント時には、カウンタプレートを、観察のため、60〜100倍の倍率の解剖顕微鏡下に置いた。カウンタプレートを1000格子になるように切断し、カウント方法は、10×10格子(0.1mlあたりの幼生の数)を無作為に選択して幼生の数を数え、プレート上の他の位置の数も同様にカウントし、平均し、10を乗じて、1mlあたりの幼生の数、またはプレート上の幼生の合計数を得ることによってカウントしてもよい。カウント結果に従って、アルテミア・サリナの密度を、1mlあたり500個の幼生になるように調整した。エアストーンを設置し、空気の送入を開始し、空気の取り込み量が約300〜400cm3/分になるように調整した(溶存酸素が2ppmを超えるように維持)。室温および水温を26〜28℃に保った。12〜18時間の培養後、アルテミア・サリナは最初の脱皮を経て、2齢の幼生になった。この時点で、バイオカプセル化工程が行われる。
【0043】
バイオカプセル化:大腸菌を遠心分離して1000×gで沈降させた。余った培地をデカンテーションし、細菌を等量のPBSで再懸濁し、細菌上の余剰培地を洗い流した。1000×gで再び遠心分離を行い、細菌を適量のPBSに再懸濁して、1×1010cfu/mLの濃度の細菌液を調製した。滅菌法は加熱滅菌であり、細菌液を10分間、65℃の水浴に入れ、次に、滅菌液を10分間、氷上に置いた。2齢の幼生のアルテミア・サリナを所望の容量にパッケージし、大腸菌の最終濃度が約1×1010cfu/mLになるように、調製した細菌液を加え、空気を適切に2時間送入した。
【0044】
カプセル化の結果の判定:サンプリングの前に空気の送入を停止し、2mlのカプセル化したアルテミア・サリナ溶液を小さいスクリーン上に吸引し、大量の淡水で洗浄した。アルテミア・サリナの幼生を遠心分離管に吸引した。マイクロ遠心分離管を−20℃の冷凍庫に10分間入れて、 アルテミア・サリナの幼生を凍結して死滅させ、死滅したアルテミア・サリナの幼生を9cmの培養皿に注ぎ、少量の滅菌水を加えてアルテミア・サリナの幼生を均一に分散させ、つぎに、2齢の幼生500個をピペットマンを用いてマイクロ遠心分離管に吸引し、300rpmで遠心分離して幼生を遠心分離管の底部に集め、遠心分離管内の水を除去し、100μLの滅菌水に置き換えた。アルテミア・サリナの幼生を、マイクロ遠心分離管内で微小粉砕用の棒を用いて注意深く粉砕した。サンプルをSDS−PAGEおよびウェスタンブロット法に供した。
【0045】
動物実験
アルテミア・サリナ群:実験動物を4群:実験群のPEIa−エピトープ群、および、それぞれ、通常の飼料 、アルテミア・サリナ含有飼料およびPEIaフラグメントを用いてカプセル化したアルテミア・サリナを含む飼料を与えた、3つの対照群に分けた。約157gの平均体重および5〜6インチ(12.7〜15.24cm)の平均長を有する合計40尾のチャイロマルハタを使用し、実験期間は約4ヶ月であった。動物には、毎月曜日、火曜日、水曜日に抗原を含む飼料を与え、毎木曜日、金曜日、土曜日に通常の飼料を与え、日曜日には絶食させ、魚の体液を免疫付与前および免疫付与後2週間の時点で採取し、これを20〜40分間放置した後に固化し、遠心分離し、ELISA用の血液の上清成分のサンプルを取り、血中の内因性タンパク質に対する抗体力価を決定した。
【0046】
アルテミア・サリナを含む飼料の調製:
ろ過したまたは未ろ過の2齢のアルテミア・サリナの水を可能な限り除去し、凍結乾燥機を用いて凍結乾燥して粉末化した。アルテミア・サリナの粉末を、通常の粉砕した飼料と1:1000の比で混合し、再び粒化した。
【0047】
食品組成物の調製:
細菌液を濃縮し、凍結乾燥機を用いて凍結乾燥して粉末化した。細菌粉末を1gの飼料に対して3.3×109cfuの大腸菌粉末の比で粉砕した飼料と混合し、再び粒化した。
【0048】
結果
アルテミア・サリナ群
最初にハタ科の魚の血液を採取し、血清を分離し、ミオスタチンエピトープを含めた組み換えエピトープ を含む組み換え融合タンパク質の給餌後の各段階において、ELISA法で、組み換えしたハタ科の魚のミオスタチンのC末端エピトープについて、ハタ科の魚の血清の抗体力価を決定した。免疫付与後10週間の時点における抗体力価を決定したところ、16週間に至るまで、継続的に上昇しており、PEIa−エピトープ群の抗体力価は、通常の飼料、アルテミア・サリナを含む飼料およびPEIaフラグメントでカプセル化したアルテミア・サリナを含む飼料を与えた3つの対照群の力価に比べて高く、抗体力価は約920に至った(図3参照)。
【0049】
4ヶ月の動物実験における飼料の合計消費量および飼料要求率を計算した。統計データから、4ヶ月におけるPEIa−エピトープ実験群および他の3つの対照群の飼料の合計消費量はほぼ等量であり、平均飼料要求率はPEIa−エピトープ実験群では1.35、通常の飼料 、アルテミア・サリナを含む飼料およびPEIaフラグメントでカプセル化したアルテミア・サリナを含む飼料を与えた3つの対照群では1.72、1.76、および1.82であり、言い換えれば、ミオスタチンのエピトープを与えた実験群は、他に比べて、市場に出す前に消費した飼料の量が少なく、肉量の多いハタ科の魚が得られたことが判明した(表2参照)。
【表2】

【0050】
本発明の実施の形態について例証し、説明してきたが、当業者によるさまざまな変更および改善が可能である。本発明は例証される特定の形態に限定されず、本発明の精神および範囲から逸脱していないすべての変更は添付の特許請求の範囲に定義される範囲内にあることが意図されている。
【技術分野】
【0001】
本発明は培養方法に関し、さらに詳細には、脊椎動物用の食品組成物に関する。
【背景技術】
【0002】
世界人口の急速な増加および耕地面積の低下に伴い、利用可能な飼料資源は次第に不足してきており、世界中の飼料製造において、単位面積当たりの生産量を改善し、栄養価の添加を増す傾向にある。
【0003】
水産業に関して言えば、海からの漁獲高はほぼ飽和状態にあり、また、日常の動物タンパク質市場における魚製品の需要は増大していることから、製品供給不足を補う必要がある。
【0004】
ハタ科(Epinephelus spp.) は、マハタ属、ハタ亜科、ハタ科、硬骨魚綱 スズキ目に属する温水性魚の一種であり、世界じゅうの熱帯および亜熱帯水域に幅広く分布しており、養殖業にとって、アジアおよび太平洋領域におけるもっとも重要な経済的魚種として一般に認められている。台湾では、養殖魚は主に、ヤイトハタ(Epinephelus malabaricus)、チャイロマルハタ(Epinephelus coioides)、タマカイ(Epinephelus lanceolatus)およびノミノクチ(Epinephelus fario)である。一般に、ハタ科は市場に出す少なくとも8〜12ヶ月前に養殖されなければならない;しかしながら、最終的な収穫高は高くない。ウイルスおよび細菌感染に起因する幼魚の早期死亡率に加えて、例えば、気象要因、水質汚染問題、餌料生物の管理および養殖の間の管理はすべて、実施者にとってのリスクを増大する。したがって、魚の養殖の発育速度の改善、市場に出す前の養殖時間の短縮、ならびに、飼料要求率(与えた飼料の重量/魚体の体重増加)および養殖の間の潜在的リスクの低減の方法についての研究は、ハードワークに値するものとなっている。
【0005】
酸性かつシステイン豊富な分泌タンパク質(SPARC)とは、オステオネクチンまたはBM40とも称され、約35〜45kDaのタンパク質サイズを有し、主として細胞外マトリクス(ECM)に分布する。また、これは、マトリクス細胞のタンパク質であり、ECMまたは細胞への結合特性を有する多機能性糖タンパク質である。
【0006】
SPARCは主にECM内に分布する;しかしながら、SPARCの機能は、構造の構成に関与し細胞を支持する、マトリクスの通常の構造タンパク質とは異なる;それどころか、SPARCは、特に、細胞とECMを連結する架橋の働きをし、幾つかの種類の細胞マトリクス・タンパク質の産生、貯蔵および蓄積を制御することができる調節タンパク質である(非特許文献1〜2)。しかしながら、SPARCは、主に胚発生の間に発現し、細胞分化、組織の石灰化および生成、骨の発達、形態、および器官の形成に多いに関与する。明らかな発現は、主に、傷ついた皮膚または組織の修復および再編成のプロセスを生じることから、成体生物におけるこのタンパク質の発現レベルは、低下傾向にある(非特許文献2)。
【0007】
SPARCは、3つの機能ドメインに分けることができる(非特許文献3):
1.弱い親和性で5〜8つのカルシウムイオンと結合することができ、細胞伸長を阻害し、ECMの産生を制御する機能を有する、タンパク質のN−末端にある酸性ドメイン;
2.複数のシステインを含み、ホリスタチンと似た機能を有し、細胞増殖を阻害する能力があり、さらに別の特異的配列、すなわち、銅イオン結合配列(K)GHKを含み(非特許文献4)、血管増殖促進機能を有する、ホリスタチン様ドメイン;
3.SPARCのC末端であり、2つのEF−ハンドモチーフを有し、カルシウムイオンと高い親和性で結合することができ、細胞または一部のコラーゲンと結合することができ、さらに、細胞の増殖および伸長を阻害する効果を有する、細胞外カルシウムイオン結合ドメイン(ECドメイン)(非特許文献5)。
【0008】
現在のところ、SPARCの生物学的機能についての研究および考察について幾つかの結果が報告されており、インビトロにおけるマウス内皮細胞培養の観察を通じて幾つかの特性が見出されている:
(I)SPARCの発現は、細胞形態の伸長を阻害して、細胞をほぼ円形にし(非特許文献6);また、ECM組成物および一部のECMタンパク質の発現を制御して、細胞と細胞外マトリクスとの結合を調整し、細胞形態および遊走能を変化させること(非特許文献7;および非特許文献8)ができる;
(II)細胞周期の進行を阻害して、サイクルを中期G1期で停止する、すなわち、細胞増殖阻害機能を有する(非特許文献9);
(III)血管細胞培養の研究から、内皮細胞が血管増殖促進特性を有することが見出された(非特許文献10)。インビボにおいて、SPARC遺伝子をノックダウンしたマウスが生後間もなく白内障を患うことが判明し、このことにより、SPARCは目のレンズの発達にとって必須タンパク質であると考えられる(非特許文献9)。研究を通じて、SPARC遺伝子をノックダウンしたマウスでは、皮膚構造における異常変化、すなわち、肥厚性の脂肪層の脂肪細胞の体積および数が増大し、血中の脂肪細胞によって分泌されるレプチンの濃度が上昇することも見出されており、このことにより、SPARCタンパク質はインビボにおける体内の脂肪量の変化の制御との相関関係を有すると考えられる(非特許文献11)。
【0009】
ミオスタチンは、成長および分化因子−8(GDF−8)とも称され、形質転換成長因子TGF−βの仲間である。ミオスタチンは、筋肉の成長および分化を負に制御しうる。牛およびヒトの体内における研究を通じて、ミオスタチンの機能が失われた場合に、筋肉の成長および分化の負の制御が効かなくなることから、筋肉の増大が生じることが見出されている(非特許文献12;および非特許文献13)。哺乳動物の研究では、マウスのミオスタチンがノックダウンされ(非特許文献14)、マウスの筋肉においてミオスタチン阻害タンパク質(例えば、ホリスタチン)の高レベルの発現または信号伝達にとって必須の受容タンパク質ActRIIBの機能不全(非特許文献15)が筋肉の増大を発生させる。硬骨魚の研究では、胎芽成長を促進するため、アンチセンスモルホリノ・ノックダウン技術を用いて、ゼブラフィッシュの胎芽のミオスタチン−1のmRNAを阻害する(非特許文献16);あるいは、RNAi技術を用いてゼブラフィッシュのミオスタチン−1の機能を封じ、それによって大型のゼブラフィッシュの特徴を発現させる(非特許文献17)。筋肉細胞は組織薄片についてさらに研究されており、体積の肥大および筋肉細胞数の過形成が筋肉繊維の発現をもたらしうることが判明している。
【0010】
一方、インビトロにおける細胞株の研究では、C2C12筋芽細胞株においてミオスタチンが高濃度で発現される場合、筋芽細胞の増殖は阻害され、G1期の細胞を細胞周期のS期で停止できることが指摘されている(非特許文献18)。一方、筋肉の星状膠細胞においてミオスタチンが高濃度で発現される場合には、ミオスタチンが筋肉の星状膠細胞の活性化および自己再生を阻害しうることが見出されており(非特許文献19)、このことは、ミオスタチンが筋発生の負の制御の役割を果たすことを証明している。筋肉細胞の制御に加えて、他の文献では、ミオスタチンが脂質生成を阻害する機能を有することが指摘されており(非特許文献20)、また、他の研究において、ミオスタチンが筋芽細胞のアポトーシスを阻害する機能を有することも指摘されている(非特許文献21)。
【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】Bradshaw and Sage, 2001, J Clin Invest 107;1049-1054
【非特許文献2】Lane and Sage, 1994, FASEB J 8;163-173
【非特許文献3】Hohenester et al., 1997, EMBO J 16;3778-3786
【非特許文献4】Iruela-Arispe et al., 1995, Mol Biol Cell 6;327-343
【非特許文献5】Maurer et al., 1995, J Mol Biol 253;347-357
【非特許文献6】Murphy-Ullrich et al., 1991, J Cell Biol 115;1127-1136
【非特許文献7】Hasselaar et al., 1991, J Biol Chem 266;13178-13184
【非特許文献8】Tremble et al., 1993, J Cell Biol 121;1433-1444
【非特許文献9】Yan and Sage, 1999, J Histochem Cytochem 47;1495-1506
【非特許文献10】Funk and Sage, 1991, Proc. Natl. Acad. Sci. USA 88;2648-2652
【非特許文献11】Bradshaw et al., 2003, Proc. Natl. Acad. Sci. USA 100;6045-6050
【非特許文献12】McPherron and Lee, 1997, Proc. Natl. Acad. Sci. USA 94, 12457-12461
【非特許文献13】Schuelke et al, 2004, The New England Journal of Medicine 350, 2682-2688
【非特許文献14】McPherron and Lee, Proc. Natl. Acad. Sci. USA 94;12457-12461
【非特許文献15】Lee and McPherron, 2001, Proc. Natl. Acad. Sci. USA 98;9306-9311
【非特許文献16】Amali et al, 2004, Developmental Dynamics 229;847-856
【非特許文献17】Acosta et al, 2005, Journal of Biotechnology 119;324-331
【非特許文献18】Thomas et al, 2000, The Journal of Biological Chemistry 275;40235-40243
【非特許文献19】McCroskery, 2003, The Journal of Cell Biology 162;1135-1147
【非特許文献20】Rebbapragada et al, 2003, Molecular and Cellular Biology 23;7230-7242
【非特許文献21】Rios et al, 2001, Biochemical and Biophysical Research Communications 280;561-566
【発明の概要】
【発明が解決しようとする課題】
【0012】
しかしながら、ミオスタチンおよびSPARCの研究において、筋肉増加に加えて、養殖業における原価管理にとって重要な、飼料要求率(与えた飼料の重量/体重増加)についての報告はない。さらには、脊椎動物に免疫を付与する従来の方法は、エピトープを注入するが、これは時間と人件費がかかり、脊椎動物は容易に傷む。したがって、飼料要求率を低減する食品組成物の開発は、養殖における発育速度の改善のために、当業界において必要とされている。
【課題を解決するための手段】
【0013】
本発明は、養殖の発育速度の改善、市場に出す前の培養時間の短縮、および飼料要求率および養殖の間の潜在的リスクの低減のための脊椎動物用の食品組成物に関する。
【0014】
本発明は、酸性かつシステイン豊富な分泌タンパク質(secreted protein acidic and rich in cysteine)、酸性かつシステイン豊富な分泌タンパク質のフラグメント(fragment of secreted protein acidic and rich in cysteine)、抗−酸性かつシステイン豊富な非分泌性タンパク質抗体(anti-secreted protein acidic and rich in cysteine antibody)、または酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメント(anti-fragment of secreted protein acidic and rich in cysteine antibody)を含む脊椎動物用の食品組成物を提供する。
【0015】
本発明に従った食品組成物は、ミオスタチン、ミオスタチンのフラグメント、抗ミオスタチン抗体、またはミオスタチン抗体の抗フラグメントをさらに含むことが好ましい。
【図面の簡単な説明】
【0016】
【図1】酸性かつシステイン豊富な分泌タンパク質(SPARC)の免疫阻害を受けたハタの抗体の血清力価を示すグラフ。
【図2】酸性かつシステイン豊富な分泌タンパク質の免疫阻害を受けたハタの体重変化を示すグラフ。
【図3】ミオスタチンの免疫阻害を受けたハタの抗体の血清力価を示すグラフ。
【発明を実施するための形態】
【0017】
本発明は、酸性かつシステイン豊富な分泌タンパク質、酸性かつシステイン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステイン豊富な非分泌性タンパク質抗体、または酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメントを含む脊椎動物用の食品組成物に関する。
【0018】
本発明に従った食品組成物は、酸性かつシステイン豊富な分泌タンパク質の機能を阻害することによって脊椎動物の飼料要求率を低下させる。
【0019】
好ましくは、本発明に従った食品組成物は、ミオスタチン、ミオスタチンのフラグメント、抗ミオスタチン抗体、またはミオスタチン抗体の抗フラグメントをさらに含む。
【0020】
本発明の食品組成物は、脊椎動物に適している。好ましくは、本発明の食品組成物は魚に適しており;さらに好ましくは、魚は硬骨魚綱に属し、現在、ゼブラフィッシュ(Danio rerio)、タイセイヨウサケ(Atlantic salmon)、モザンビークティラピア(Mozambique tilapia)、ストライプドバス(Morone saxatilis)、ヨーロッパヘダイ(Morone saxatilis)、ニジマス(Oncorhynchus mykiss)、カワマス(Salvelinus fontinalis)、ナマズ(Silurus asotus)、チャイロマルハタおよびスズキ(Lateolabrax japonicus)を含めた魚のミオスタチンはクローン化されてきており、そのアミノ酸配列は高度に保存されており、したがって、ミオスタチンが幾つかの機能を有すると考えられる;特に好ましくは、魚は硬骨魚綱スズキ目に属し;特に好ましくは、魚は硬骨魚綱スズキ目ハタ科に属し;特に好ましくは、魚は硬骨魚綱スズキ目ハタ科ハタ亜科に属し;特に好ましくは、魚は硬骨魚綱スズキ目ハタ科ハタ亜科マハタ属に属し;最も好ましくは、魚はチャイロマルハタである。
【0021】
本発明の食品組成物は、例えば、遺伝子、転写、翻訳、タンパク質活性および信号経路の段階において、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の機能を阻害することによって脊椎動物における飼料要求率を改善するためのものである。当業者は、例えば、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質自体の活性が阻害される、または、受容タンパク質の機能が阻害されるなど、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の機能を阻害するための適切な操作を選択することができる。好ましくは、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の機能は、免疫阻害方法を通じて阻害され、ここで、タンパク質活性は阻害されるが、脊椎動物に全体的な悪影響を生じさせない。
【0022】
本発明の好ましい実施の形態では、免疫阻害方法は、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の抗体、または酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の抗体の抗フラグメントを脊椎動物に投与することである。好ましくは、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質のフラグメントはエピトープである。当業者は、抗酸性かつシステイン豊富な分泌タンパク質および/または抗ミオスタチン抗体またはそのエピトープの抗体を得るために、タンパク質またはそのエピトープを発現する遺伝子をコードした酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質をクローン化して入手し、タンパク質またはエピトープを動物の身体に免疫を付与することができる。本発明の抗体は、脊椎動物の身体自体が抗体を産生できるように、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質またはそのエピトープを他の動物に与えて免疫付与し、精製することによって、または、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質またはそのエピトープを脊椎動物の身体に直接与えて免疫付与することによって獲得することができる。本発明の抗体はポリクローナル抗体またはモノクローナル抗体であって差し支えなく、抗体はポリクローナル抗体であることが好ましい。
【0023】
本明細書では「エピトープ」という用語は、タンパク質抗原における、抗原を発現する免疫応答を誘発することができるフラグメントのことをいい、これは、構造予測を通じて、またはタンパク質フラグメントを選択し、免疫付与された動物における免疫応答を観察することによって、入手することができる。
【0024】
ミオスタチンは、TGF−β群の他の物質とその配列が極めて類似しており、3つの部位:(1)タンパク質の分泌物から放出する信号としてのN−末端の疎水性ドメイン;(2)高度に保存されたタンパク質 開裂位置RXRR(配列番号:2);(3)システイン豊富なC末端活性ドメイン(Sharma et al、1999、Journal of cellular physiology 180;1-9)を含む。脊椎動物におけるミオスタチンのアミノ酸配列がC末端の活性ドメインにおいて高度に保存されていることが多くの報告において確認されている(McPherron et al、1997、Nature 387;83-90)。現在、ミオスタチンの研究において、ミオスタチンに対して高い特異性を有するモノクローナル抗体JA16では(Whittemore et al、2003、Biochemical and Biophysical Research Communications 300;965-971)、ミオスタチンとの結合位置を解析することによって、結合位置がマウスのミオスタチンのC末端における15のアミノ酸DFGLDCDEHSTESRC(配列番号:1)にあることが判明し、したがって、C末端ドメインは抗原性フラグメントであることが確認できる。したがって、好ましくは、ミオスタチンの抗原性フラグメントはミオスタチンのC末端ドメインであり;さらに好ましくは、ミオスタチンのC末端ドメインは配列番号:1に示す配列を有する。
【0025】
一方、エピトープは小さいペプチドフラグメントであり、小さいフラグメント抗原が動物に直接免疫付与される場合、免疫応答は十分ではない可能性がある。免疫応答の改善には、タンデムリピート単位を含む直線アレイ・エピトープ(LAE)の構築が好ましい。加えて、抗原の送達を補助するため、細菌毒素を使用して、毒素を排除した毒素活性を輸送システムとして利用し、それによって、毒素の特性を利用した全般的な免疫付与を達成してもよい。好ましくは、本発明のLAEは、シュードモナス菌の外毒素(PE)AのドメインIaと融合される。シュードモナス菌の外毒素は、66kDaの分子量を有し、613のアミノ酸を含み、そのタンパク質構造は、主として、3つのドメインを含み、ドメインIa(アミノ酸1〜252)は受容体結合領域であり、哺乳動物の細胞の細胞膜におけるα2−マクログロブリン/低密度リポタンパク質受容体(LDLR)との結合に関与し、受容体が媒介するエンドサイトーシスを通じて細胞内膜系へと入る。シュードモナス・エキソトキシンAは誘発された免疫応答を効果的に促進することができることが証明されている(Donnelly et al, 1993, Proc. Natl. Acad. Sci. USA 90; 3530-3534)。
【0026】
本発明のもう1つの好ましい実施の形態では、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の抗体、または酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質抗体の抗フラグメントは、エビ体内にバイオカプセル化される。エビは、魚に簡単に与えられる飼料として通常使用される。好ましくは、エビは幼生のエビであり;さらに好ましくは、幼生は凍結乾燥されて粉末化される。
【0027】
本発明のもう1つの別の好ましい実施の形態では、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質、酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質の抗体、または酸性かつシステインおよび/またはミオスタチン豊富な分泌タンパク質抗体の抗フラグメントは、微生物において発現され、その微生物は、エビにおけるカプセル化など、組成物に添加することができる。好ましくは、微生物の培養物は、凍結乾燥され、粉末化される。別の態様では、微生物は大腸菌(Escherichia coli)である。
【0028】
本発明の1つの好ましい実施の形態では、酸性かつシステイン豊富な分泌タンパク質の機能の免疫阻害は、対照群と比較して、約5%を超える飼料要求率の低減に有効であり;さらに好ましくは、約8%〜約40%である。
【0029】
以下の実施例は、単に例証の目的で与えられるものであって、本発明の範囲を制限することは意図されていない。
【実施例】
【0030】
実施例1:酸性かつシステイン豊富な分泌タンパク質(SPARC)の免疫阻害:
抗原の調製:
70±10gの平均体重および5〜6インチ(12.7〜15.24cm)の平均長を有する合計48匹のチャイロマルハタを対照群および実験群として使用し、試験期間は5ヶ月であった。プライマー1(配列番号:3)およびプライマー2(配列番号:4)を用いてsparc遺伝子を増幅することによって抗原を調製した。
【0031】
50Lの発酵タンクでエピトープを含めた大腸菌(E. coli)BL21(DE3)株を培養するために、35Lの発酵培養プロセスを確立した。4本の試験官に入った、37℃でLB/アンピシリン培地を用いて一晩培養した5mlの細菌株を、それぞれ、0.2LのLB/アンピシリン培地に接種し、合計1Lを37℃においてOD600が0.3になるまで振とう培養し、次いで、35Lの培養培地に加え、サンプルを採取して毎時のOD600を決定し、成長曲線の変化をモニタした。成長曲線に従って適切な時点をさらに選択し、0.1mMの最終濃度を有するIPTGを加え、大腸菌が融合タンパク質を高濃度で発現するように誘発し、37℃で3時間、振とう培養し、遠心分離して細菌を回収した。融合タンパク質の発現をSDS−PAGEおよびウェスタンブロット法によって決定し、最適な35Lの発酵条件を決定した。
【0032】
バイオカプセル化したアルテミア・サリナ(Altemia salina L.)の経口ワクチンの調製
アルテミア・サリナの培養:
4gのアルテミア・サリナの乾燥卵の重量を測定し、250mlのビーカーに入れ、150mlの淡水を加えて0.5時間浸漬した。アルテミア・サリナの残った卵をスクリーンでろ過し、適量の淡水で洗浄した。アルテミア・サリナの残りの卵を5Lの培養液に加えて均一に分散させた。エアストーンを設置して空気の送入を開始し、空気の取り込み量を約500cm3/分に調整した(溶存酸素が2ppmを超えるように維持)。照明装置を点灯し、室温および水温を26〜28℃に保った。24時間後、空気の送入を停止し、照明装置を容器の底部に移し、走光性を利用してアルテミア・サリナの幼生を容器の底部に引き寄せ、5分間そのままにした。この時点で、非培養の卵および培養後の空になった卵の殻を水面に浮かせて、浮いた卵の殻をサイフォンの原理または水を吸い込むことができる他の手段を利用して除去した。培養した初齢の幼生をスクリーンで穏やかにろ過し(細孔120μm)、海水で穏やかに洗浄し、2Lの新鮮な培養液に加えた。孵化液を穏やかに攪拌し、アルテミア・サリナの幼生を均一に分散させた。1mlの培養液を吸引し、1mlの格子状のカウンタプレートに滴下した。幼生の摂動を防ぐため、50℃の熱板上に10分間、幼生を置くことによって死滅させて、カウントを容易にしてもよい。カウント時には、カウンタプレートを、観察のため、60〜100倍の倍率の解剖顕微鏡下に置いた。カウンタプレートを1000格子になるように切断し、カウント方法は、10×10格子(0.1mlあたりの幼生の数)を無作為に選択して幼生の数を数え、プレート上の他の位置の数も同様にカウントし、平均し、10を乗じて、1mlあたりの幼生の数、またはプレート上の幼生の合計数を得ることによってカウントしてもよい。カウント結果に従って、アルテミア・サリナの密度を、1mlあたり500個の幼生になるように調整した。エアストーンを設置し、空気の送入を開始し、空気の取り込み量が約300〜400cm3/分になるように調整した(溶存酸素が2ppmを超えるように維持)。室温および水温を26〜28℃に保った。12〜18時間の培養後、アルテミア・サリナは最初の脱皮を経て、2齢の幼生になった。この時点で、バイオカプセル化工程が行われる。
【0033】
バイオカプセル化:大腸菌を遠心分離して1000×gで沈降させた。余った培地をデカンテーションし、細菌を等量のPBSで再懸濁し、細菌上の余剰培地を洗い流した。1000×gで再び遠心分離を行い、細菌を適量のPBSに再懸濁して、1×1010cfu/mLの濃度の細菌液を調製した。滅菌法は加熱滅菌であり、細菌液を10分間、65℃の水浴に入れ、次に、滅菌液を10分間、氷上に置いた。2齢の幼生のアルテミア・サリナを所望の容量にパッケージし、大腸菌の最終濃度が約1×1010cfu/mLになるように、調製した細菌液を加え、空気を適切に2時間送入した。
【0034】
カプセル化の結果の判定:
サンプリングの前に空気の送入を停止し、2mlのカプセル化したアルテミア・サリナ溶液を小さいスクリーン上に吸引し、大量の淡水で洗浄した。アルテミア・サリナの幼生を遠心分離管に吸引した。マイクロ遠心分離管を−20℃の冷凍庫に10分間入れて、 アルテミア・サリナの幼生を凍結して死滅させ、死滅したアルテミア・サリナの幼生を9cmの培養皿に注ぎ、少量の滅菌水を加えてアルテミア・サリナの幼生を均一に分散させ、つぎに、2齢の幼生500個をピペットマンを用いてマイクロ遠心分離管に吸引し、300rpmで遠心分離して幼生を遠心分離管の底部に集め、遠心分離管内の水を除去し、100μLの滅菌水に置き換えた。アルテミア・サリナの幼生を、マイクロ遠心分離管内で微小粉砕用の棒を用いて注意深く粉砕した。サンプルをSDS−PAGEおよびウェスタンブロット法に供した。
【0035】
アルテミア・サリナを含む飼料の調製
ろ過したまたは未ろ過の2齢のアルテミア・サリナの水を可能な限り除去し、凍結乾燥機を用いて凍結乾燥して粉末化した。アルテミア・サリナの粉末を、通常の粉砕した飼料と1:1000の比で混合し、再び粒化した。
【0036】
食品組成物の調製:
細菌液を濃縮し、凍結乾燥機を用いて凍結乾燥して粉末化した。細菌粉末を1gの飼料に対して3.3×109cfuの大腸菌粉末の比で粉砕した飼料と混合し、再び粒化した。
【0037】
動物実験
アルテミア・サリナ群:実験動物を4群:実験群のPEIa−エピトープ群、および、それぞれ、通常の飼料 、アルテミア・サリナ含有飼料およびPEIaフラグメントを用いてカプセル化したアルテミア・サリナを含む飼料を与えた、3つの対照群に分けた。約52.36gの平均体重および5〜6インチ(12.7〜15.24cm)の平均長を有する合計80尾のチャイロマルハタを使用し、実験期間は約12週間であった。動物には、毎月曜日、火曜日、水曜日に抗原を含む飼料を与え、毎木曜日、金曜日、土曜日に通常の飼料を与え、日曜日には絶食させ、魚の体液を免疫付与前および免疫付与後2週間の時点で採取し、これを20〜40分間放置した後に固化し、遠心分離し、ELISA用の血液の上清成分のサンプルを取り、血中の内因性タンパク質に対する抗体力価を決定した。
【0038】
酵素結合免疫吸着法(ELISA)
抗原−抗体の特異的結合を利用して、1μg(100μl)のSPARC−His組み換えタンパク・フラグメントを、初めにコーティングバッファーと均質に混合し、その混合物を96ウェルNunc−Immuno(商標)プレート(NUNC(商標))の底部に加え、4℃で一晩静置し、タンパク質を底部に結合させた。プレートをPBSTで3回洗浄し、5%のスキムミルクを含む100μlのTBST溶液を加えて室温で1時間反応させ、再び、PBSTで少なくとも3回洗浄した。PBSTで希釈した試験用血清を一次抗体として使用し、ウェルに加え、室温で約2〜3時間静置した。プレートPBSTで少なくとも3回洗浄し、次に、二次抗体として、100μlのマウスの非ハタ科血清を室温で1時間静置し、PBSTで少なくとも3回洗浄した。最後に、後部にアルカリ・ホスファターゼを連結させた100μlのヤギの非マウス血清を三次抗体として加え、室温で1時間静置し、プレートをPBSTで洗浄した。最後に、50μlの基質溶液p−ニトロフェニルリン酸塩の錠剤を各ウェルに加え、室温で30分間静置し(色調の顕在化に応じて)、細胞酵素分析装置でOD405における吸収度を測定した。
【0039】
結果
アルテミア・サリナ群
最初にハタ科の魚の血液を採取し、血清を分離し、酸性かつシステイン豊富な分泌タンパク質のエピトープを含む組み換え融合タンパク質の給餌後の各段階において、ELISA法で、組み換えしたハタ科の魚の酸性かつシステイン豊富な分泌タンパク質の、酸性かつシステイン豊富な分泌タンパク質エピトープについて、ハタ科の魚の血清の抗体力価を決定した。免疫付与後10週間の時点における抗体力価を決定したところ、12週間に至るまで、継続的に上昇しており、PEIa−エピトープ群の抗体力価は、通常の飼料、アルテミア・サリナを含む飼料およびPEIaフラグメントでカプセル化したアルテミア・サリナを含む飼料を与えた3つの対照群の力価に比べて高く、抗体力価は約395に至った(図1参照)。
【0040】
12週間の動物実験における飼料の合計消費量および飼料要求率を計算した。統計データから、12週間におけるPEIa−エピトープ実験群および他の3つの対照群の飼料の合計消費量はほぼ等量であり、平均飼料要求率はPEIa−エピトープ実験群では1.46、通常の飼料 、アルテミア・サリナを含む飼料およびPEIaフラグメントでカプセル化したアルテミア・サリナを含む飼料を与えた3つの対照群では2.67、2.58、および2.81であり、言い換えれば、酸性かつシステイン豊富な分泌タンパク質のエピトープを与えた実験群は、他に比べて、市場に出す前に消費した飼料の量が少なく、肉量の多いハタ科の魚が得られたことが判明した(表1参照)。
【表1】

【0041】
実施例2:ミオスタチンの免疫阻害:
ミオスタチン・エピトープ組み換えタンパク発現大腸菌(E. coli)の調製
50Lの発酵タンクでエピトープを含んだ大腸菌BL21(DE3)株を培養するため、35Lの発酵培養プロセスを確立した。4本の試験官に入った、37℃でLB/アンピシリン培地を用いて一晩培養した5mlの細菌株を、それぞれ、0.2LのLB/アンピシリン培地に接種し、合計1Lを37℃においてOD600が0.3になるまで振とう培養し、次いで、35Lの培養培地に加え、サンプルを採取して2時間毎のOD600を決定し、成長曲線の変化をモニタした。成長曲線に従って適切な時点をさらに選択し、0.1mMの最終濃度を有するIPTGを加え、大腸菌が融合タンパク質を高濃度で発現するように誘発し、37℃で3時間、振とう培養し、遠心分離して細菌を回収した。融合タンパク質の発現をSDS−PAGEおよびウェスタンブロット法によって決定し、最適な35Lの発行条件を決定した。
【0042】
バイオカプセル化したアルテミア・サリナの経口ワクチンの調製
4gのアルテミア・サリナの乾燥卵の重量を測定し、250mlのビーカーに入れ、150mlの淡水を加えて0.5時間浸漬した。アルテミア・サリナの残った卵をスクリーンでろ過し、適量の淡水で洗浄した。アルテミア・サリナの残りの卵を5Lの培養液に加えて均一に分散させた。エアストーンを設置して空気の送入を開始し、空気の取り込み量を約500cm3/分に調整した(溶存酸素が2ppmを超えるように維持)。照明装置を点灯し、室温および水温を26〜28℃に保った。24時間後、空気の送入を停止し、照明装置を容器の底部に移し、走光性を利用してアルテミア・サリナの幼生を容器の底部に引き寄せ、5分間そのままにした。この時点で、非培養の卵および培養後の空になった卵の殻を水面に浮かせて、浮いた卵の殻をサイフォンの原理または水を吸い込むことができる他の手段を利用して除去した。培養した初齢の幼生をスクリーンで穏やかにろ過し(細孔120μm)、海水で穏やかに洗浄し、2Lの新鮮な培養液に加えた。孵化液を穏やかに攪拌し、アルテミア・サリナの幼生を均一に分散させた。1mlの培養液を吸引し、1mlの格子状のカウンタプレートに滴下した。幼生の摂動を防ぐため、50℃の熱板上に10分間、幼生を置くことによって死滅させて、カウントを容易にしてもよい。カウント時には、カウンタプレートを、観察のため、60〜100倍の倍率の解剖顕微鏡下に置いた。カウンタプレートを1000格子になるように切断し、カウント方法は、10×10格子(0.1mlあたりの幼生の数)を無作為に選択して幼生の数を数え、プレート上の他の位置の数も同様にカウントし、平均し、10を乗じて、1mlあたりの幼生の数、またはプレート上の幼生の合計数を得ることによってカウントしてもよい。カウント結果に従って、アルテミア・サリナの密度を、1mlあたり500個の幼生になるように調整した。エアストーンを設置し、空気の送入を開始し、空気の取り込み量が約300〜400cm3/分になるように調整した(溶存酸素が2ppmを超えるように維持)。室温および水温を26〜28℃に保った。12〜18時間の培養後、アルテミア・サリナは最初の脱皮を経て、2齢の幼生になった。この時点で、バイオカプセル化工程が行われる。
【0043】
バイオカプセル化:大腸菌を遠心分離して1000×gで沈降させた。余った培地をデカンテーションし、細菌を等量のPBSで再懸濁し、細菌上の余剰培地を洗い流した。1000×gで再び遠心分離を行い、細菌を適量のPBSに再懸濁して、1×1010cfu/mLの濃度の細菌液を調製した。滅菌法は加熱滅菌であり、細菌液を10分間、65℃の水浴に入れ、次に、滅菌液を10分間、氷上に置いた。2齢の幼生のアルテミア・サリナを所望の容量にパッケージし、大腸菌の最終濃度が約1×1010cfu/mLになるように、調製した細菌液を加え、空気を適切に2時間送入した。
【0044】
カプセル化の結果の判定:サンプリングの前に空気の送入を停止し、2mlのカプセル化したアルテミア・サリナ溶液を小さいスクリーン上に吸引し、大量の淡水で洗浄した。アルテミア・サリナの幼生を遠心分離管に吸引した。マイクロ遠心分離管を−20℃の冷凍庫に10分間入れて、 アルテミア・サリナの幼生を凍結して死滅させ、死滅したアルテミア・サリナの幼生を9cmの培養皿に注ぎ、少量の滅菌水を加えてアルテミア・サリナの幼生を均一に分散させ、つぎに、2齢の幼生500個をピペットマンを用いてマイクロ遠心分離管に吸引し、300rpmで遠心分離して幼生を遠心分離管の底部に集め、遠心分離管内の水を除去し、100μLの滅菌水に置き換えた。アルテミア・サリナの幼生を、マイクロ遠心分離管内で微小粉砕用の棒を用いて注意深く粉砕した。サンプルをSDS−PAGEおよびウェスタンブロット法に供した。
【0045】
動物実験
アルテミア・サリナ群:実験動物を4群:実験群のPEIa−エピトープ群、および、それぞれ、通常の飼料 、アルテミア・サリナ含有飼料およびPEIaフラグメントを用いてカプセル化したアルテミア・サリナを含む飼料を与えた、3つの対照群に分けた。約157gの平均体重および5〜6インチ(12.7〜15.24cm)の平均長を有する合計40尾のチャイロマルハタを使用し、実験期間は約4ヶ月であった。動物には、毎月曜日、火曜日、水曜日に抗原を含む飼料を与え、毎木曜日、金曜日、土曜日に通常の飼料を与え、日曜日には絶食させ、魚の体液を免疫付与前および免疫付与後2週間の時点で採取し、これを20〜40分間放置した後に固化し、遠心分離し、ELISA用の血液の上清成分のサンプルを取り、血中の内因性タンパク質に対する抗体力価を決定した。
【0046】
アルテミア・サリナを含む飼料の調製:
ろ過したまたは未ろ過の2齢のアルテミア・サリナの水を可能な限り除去し、凍結乾燥機を用いて凍結乾燥して粉末化した。アルテミア・サリナの粉末を、通常の粉砕した飼料と1:1000の比で混合し、再び粒化した。
【0047】
食品組成物の調製:
細菌液を濃縮し、凍結乾燥機を用いて凍結乾燥して粉末化した。細菌粉末を1gの飼料に対して3.3×109cfuの大腸菌粉末の比で粉砕した飼料と混合し、再び粒化した。
【0048】
結果
アルテミア・サリナ群
最初にハタ科の魚の血液を採取し、血清を分離し、ミオスタチンエピトープを含めた組み換えエピトープ を含む組み換え融合タンパク質の給餌後の各段階において、ELISA法で、組み換えしたハタ科の魚のミオスタチンのC末端エピトープについて、ハタ科の魚の血清の抗体力価を決定した。免疫付与後10週間の時点における抗体力価を決定したところ、16週間に至るまで、継続的に上昇しており、PEIa−エピトープ群の抗体力価は、通常の飼料、アルテミア・サリナを含む飼料およびPEIaフラグメントでカプセル化したアルテミア・サリナを含む飼料を与えた3つの対照群の力価に比べて高く、抗体力価は約920に至った(図3参照)。
【0049】
4ヶ月の動物実験における飼料の合計消費量および飼料要求率を計算した。統計データから、4ヶ月におけるPEIa−エピトープ実験群および他の3つの対照群の飼料の合計消費量はほぼ等量であり、平均飼料要求率はPEIa−エピトープ実験群では1.35、通常の飼料 、アルテミア・サリナを含む飼料およびPEIaフラグメントでカプセル化したアルテミア・サリナを含む飼料を与えた3つの対照群では1.72、1.76、および1.82であり、言い換えれば、ミオスタチンのエピトープを与えた実験群は、他に比べて、市場に出す前に消費した飼料の量が少なく、肉量の多いハタ科の魚が得られたことが判明した(表2参照)。
【表2】

【0050】
本発明の実施の形態について例証し、説明してきたが、当業者によるさまざまな変更および改善が可能である。本発明は例証される特定の形態に限定されず、本発明の精神および範囲から逸脱していないすべての変更は添付の特許請求の範囲に定義される範囲内にあることが意図されている。
【特許請求の範囲】
【請求項1】
酸性かつシステイン豊富な分泌タンパク質、酸性かつシステイン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステイン豊富な非分泌性タンパク質抗体、または酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメントを含んでなる、脊椎動物用の食品組成物。
【請求項2】
前記脊椎動物が魚であることを特徴とする請求項1記載の組成物。
【請求項3】
前記酸性かつシステイン豊富な分泌タンパク質、前記酸性かつシステイン豊富な分泌タンパク質のフラグメント、前記抗−酸性かつシステイン豊富な非分泌性タンパク質抗体、または前記酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメントが、エビ体内にバイオカプセル化されることを特徴とする請求項1記載の組成物。
【請求項4】
前記酸性かつシステイン豊富な分泌タンパク質、前記酸性かつシステイン豊富な分泌タンパク質のフラグメント、前記抗−酸性かつシステイン豊富な非分泌性タンパク質抗体、または前記酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメントが、微生物において発現されることを特徴とする請求項1記載の組成物。
【請求項5】
前記酸性かつシステイン豊富な分泌タンパク質のフラグメントが、シュードモナス・エキソトキシンAのドメインIaと融合することを特徴とする請求項1記載の組成物。
【請求項6】
前記酸性かつシステイン豊富な分泌タンパク質のフラグメントがエピトープであることを特徴とする請求項1記載の組成物。
【請求項7】
前記酸性かつシステイン豊富な分泌タンパク質のフラグメントが 融合タンパク質においてタンデムリピートされることを特徴とする請求項1記載の組成物。
【請求項8】
ミオスタチン、ミオスタチンのフラグメント、抗ミオスタチン抗体、またはミオスタチン抗体の抗フラグメントを含んでなることを特徴とする請求項1記載の組成物。
【請求項9】
前記ミオスタチン、前記ミオスタチンのフラグメント、前記抗ミオスタチン抗体、または前記ミオスタチン抗体の抗フラグメントが、エビ体内にバイオカプセル化されることを特徴とする請求項8記載の組成物。
【請求項10】
前記ミオスタチン、前記ミオスタチンのフラグメント、前記抗ミオスタチン抗体、または前記ミオスタチン抗体の抗フラグメントが、微生物において発現されることを特徴とする請求項8記載の組成物。
【請求項11】
前記微生物が大腸菌(Escherichia coli)であることを特徴とする請求項4または10記載の組成物。
【請求項12】
前記ミオスタチンのフラグメントがシュードモナス・エキソトキシンAのドメインIaと融合することを特徴とする請求項8記載の組成物。
【請求項13】
前記ミオスタチンのフラグメントがエピトープであることを特徴とする請求項8記載の組成物。
【請求項14】
前記ミオスタチンのフラグメントが融合タンパク質においてタンデムリピートされることを特徴とする請求項8記載の組成物。
【請求項1】
酸性かつシステイン豊富な分泌タンパク質、酸性かつシステイン豊富な分泌タンパク質のフラグメント、抗−酸性かつシステイン豊富な非分泌性タンパク質抗体、または酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメントを含んでなる、脊椎動物用の食品組成物。
【請求項2】
前記脊椎動物が魚であることを特徴とする請求項1記載の組成物。
【請求項3】
前記酸性かつシステイン豊富な分泌タンパク質、前記酸性かつシステイン豊富な分泌タンパク質のフラグメント、前記抗−酸性かつシステイン豊富な非分泌性タンパク質抗体、または前記酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメントが、エビ体内にバイオカプセル化されることを特徴とする請求項1記載の組成物。
【請求項4】
前記酸性かつシステイン豊富な分泌タンパク質、前記酸性かつシステイン豊富な分泌タンパク質のフラグメント、前記抗−酸性かつシステイン豊富な非分泌性タンパク質抗体、または前記酸性かつシステイン豊富な分泌タンパク質の抗体の抗フラグメントが、微生物において発現されることを特徴とする請求項1記載の組成物。
【請求項5】
前記酸性かつシステイン豊富な分泌タンパク質のフラグメントが、シュードモナス・エキソトキシンAのドメインIaと融合することを特徴とする請求項1記載の組成物。
【請求項6】
前記酸性かつシステイン豊富な分泌タンパク質のフラグメントがエピトープであることを特徴とする請求項1記載の組成物。
【請求項7】
前記酸性かつシステイン豊富な分泌タンパク質のフラグメントが 融合タンパク質においてタンデムリピートされることを特徴とする請求項1記載の組成物。
【請求項8】
ミオスタチン、ミオスタチンのフラグメント、抗ミオスタチン抗体、またはミオスタチン抗体の抗フラグメントを含んでなることを特徴とする請求項1記載の組成物。
【請求項9】
前記ミオスタチン、前記ミオスタチンのフラグメント、前記抗ミオスタチン抗体、または前記ミオスタチン抗体の抗フラグメントが、エビ体内にバイオカプセル化されることを特徴とする請求項8記載の組成物。
【請求項10】
前記ミオスタチン、前記ミオスタチンのフラグメント、前記抗ミオスタチン抗体、または前記ミオスタチン抗体の抗フラグメントが、微生物において発現されることを特徴とする請求項8記載の組成物。
【請求項11】
前記微生物が大腸菌(Escherichia coli)であることを特徴とする請求項4または10記載の組成物。
【請求項12】
前記ミオスタチンのフラグメントがシュードモナス・エキソトキシンAのドメインIaと融合することを特徴とする請求項8記載の組成物。
【請求項13】
前記ミオスタチンのフラグメントがエピトープであることを特徴とする請求項8記載の組成物。
【請求項14】
前記ミオスタチンのフラグメントが融合タンパク質においてタンデムリピートされることを特徴とする請求項8記載の組成物。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−244994(P2012−244994A)
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願番号】特願2012−119999(P2012−119999)
【出願日】平成24年5月25日(2012.5.25)
【出願人】(512138046)ナショナル チォン クン ユニヴァーシティー (1)
【氏名又は名称原語表記】NATIONAL CHENG KUNG UNIVERSITY
【Fターム(参考)】
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願日】平成24年5月25日(2012.5.25)
【出願人】(512138046)ナショナル チォン クン ユニヴァーシティー (1)
【氏名又は名称原語表記】NATIONAL CHENG KUNG UNIVERSITY
【Fターム(参考)】
[ Back to top ]

