融合タンパク質
【課題】ドラッグキャリアに利用されるE型肝炎ウイルス様粒子として、発現量が多く、効率的に生産できるE型肝炎ウイルス様粒子構成タンパク質と異種タンパク質との融合タンパク質を提供する。
【解決手段】E型肝炎ウイルス様粒子構成タンパク質に少なくとも1種の異種タンパク質が挿入された融合タンパク質であって、前記異種タンパク質が挿入される位置が、前記E型肝炎ウイルス様粒子構成タンパク質がE型肝炎ウイルス様粒子を形成した際に前記E型ウイルス様粒子の粒子表面となる領域にある、前記E型肝炎ウイルス様粒子構成タンパク質と異種タンパク質との融合タンパク質。
【解決手段】E型肝炎ウイルス様粒子構成タンパク質に少なくとも1種の異種タンパク質が挿入された融合タンパク質であって、前記異種タンパク質が挿入される位置が、前記E型肝炎ウイルス様粒子構成タンパク質がE型肝炎ウイルス様粒子を形成した際に前記E型ウイルス様粒子の粒子表面となる領域にある、前記E型肝炎ウイルス様粒子構成タンパク質と異種タンパク質との融合タンパク質。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、E型肝炎ウイルス様粒子構成タンパク質と異種タンパク質との融合タンパク質に関する。
【背景技術】
【0002】
ヒトや動物に対する感染症の拡大が世界的な問題となっており、効果的な治療薬やワクチンを実用化するため、医薬成分を効率的に送達する技術が注目されている。特に、経皮、経口、経鼻等、容易な投与経路で治療・予防効果を発揮する送達技術の開発が行われている。これまで開発された送達技術としては、リポソームを利用したもの(特許文献1参照)、アミノ酸誘導体のキャリア化合物を利用したもの(特許文献2参照)や、胃粘膜傷害性らせん菌を利用したもの(特許文献3参照)等が存在する。
【0003】
近年、E型肝炎ウイルスの遺伝子がクローニングされた。さらに、E型肝炎ウイルスのキャプシドタンパク質の一部のアミノ酸を欠失させて発現させることで、E型肝炎ウイルスに対する免疫原性を有する中空粒子、すなわちE型肝炎ウイルス様粒子を得ることができるという報告がなされている(特許文献4及び5参照)。E型肝炎ウイルスは粘膜から感染するため、E型肝炎ウイルス様粒子は、ドラッグキャリアとして経鼻投与や経口投与が可能な医薬組成物への応用が期待される。
【0004】
E型肝炎ウイルス様粒子をドラッグキャリアに利用する研究としては、HIVのエピトープをウイルス様粒子構成タンパク質のC末端に挿入して融合タンパク質を生産した例(非特許文献1)があり、ウエスタンブロット法により融合タンパク質の発現が確認されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平08―059503号公報
【特許文献2】特開2010―018636号公報
【特許文献3】特開2008―127324号公報
【特許文献4】特表平10―509588号公報
【特許文献5】特開平10―234383号公報
【非特許文献】
【0006】
【非特許文献1】Niikura, M. et al. “Chimeric RecombinantHepatitis E Virus-like Particles as an Oral Vaccine Vehicle Presenting ForeighEpitopes”, Virology, Vol. 293, 2002.
【発明の概要】
【発明が解決しようとする課題】
【0007】
非特許文献1に記載された方法では、E型肝炎ウイルス様粒子構成タンパク質と異種タンパク質との融合タンパク質の発現が確認されるものの、その発現量は著しく少なかった。効率的に融合タンパク質を生産するためには、異種タンパク質を挿入する方法を検討する必要があった。
【課題を解決するための手段】
【0008】
本発明者らは、E型肝炎ウイルス様粒子の結晶構造解析を行うことで融合タンパク質の効率的な生産が可能な異種タンパク質の挿入位置を見出した。さらに、該挿入位置に異種タンパク質を挿入することで、大量に発現し、ウイルス様粒子を形成し得る融合タンパク質を得ることに成功した。
【0009】
すなわち、本発明は、E型肝炎ウイルス様粒子構成タンパク質に少なくとも1種の異種タンパク質が挿入された融合タンパク質であって、異種タンパク質が挿入される位置が、E型肝炎ウイルス様粒子構成タンパク質がE型肝炎ウイルス様粒子を形成した際に該E型ウイルス様粒子の粒子表面となる領域にある、E型肝炎ウイルス様粒子構成タンパク質と異種タンパク質との融合タンパク質を提供する。
【0010】
また、本発明が提供する別の融合タンパク質は、E型肝炎ウイルス様粒子構成タンパク質が、E型肝炎ウイルスのORF2にコードされるタンパク質の一部のアミノ酸を欠失させたものであり、異種タンパク質が、挿入される位置が以下の(a)〜(d)のいずれかである。(a)は、E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から484番目のアミノ酸と485番目のアミノ酸との間に相当する位置であり、(b)は、E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から488番目のアミノ酸と489番目のアミノ酸との間に相当する位置であり、(c)は、E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から533番目のアミノ酸と534番目のアミノ酸との間に相当する位置であり、(d)はE型肝炎ウイルスのORF2にコードされるタンパク質のN末端から555番目のアミノ酸と556番目のアミノ酸との間に相当する位置である。
【0011】
また、本発明が提供する別の融合タンパク質は、E型肝炎ウイルスのORF2にコードされるタンパク質が、以下の(e)〜(g)のいずれかである。(e)は、配列番号:1に示すアミノ酸配列を含むタンパク質であり、(f)は、配列番号:1に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質であり、(g)は、配列番号:1に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質である。
【0012】
また、本発明が提供する別の融合タンパク質は、E型肝炎ウイルス粒子構成タンパク質が、以下の(h)〜(j)のいずれかである。(h)は、配列番号:2に示すアミノ酸配列を含むタンパク質であり、(i)は、配列番号:2に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質であり、(j)は、配列番号:2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質である。
【0013】
また、本発明が提供する融合タンパク質は、異種タンパク質が5個〜20個のアミノ酸から構成されるものであってもよく、異種タンパク質が免疫原性を有するものであってもよい。
【0014】
また、本発明が提供する別の融合タンパク質は、複数の該融合タンパク質が会合してウイルス様粒子を形成し得るものであり、本発明は、融合タンパク質が複数会合して構成されたウイルス様粒子も提供する。
【0015】
さらに、本発明は、融合タンパク質、及び/又はウイルス様粒子を含む医薬組成物や、融合タンパク質をコードする遺伝子を含み、融合タンパク質を発現させる発現ベクターを提供する。
【発明の効果】
【0016】
本発明の融合タンパク質は、ヒト又は動物に対して異種タンパク質に対する特異的抗体の産出を誘導するため、感染症の治療及び/又は予防を目的とした医薬組成物に利用することができる。また、本発明の融合タンパク質は、複数が会合してウイルス様粒子を形成し、粘膜からヒト又は動物の体内へ到達することができる。したがって、経鼻投与や経口投与が可能な医薬組成物に用いることができる。さらに、本発明の融合タンパク質の発現量は非常に多いため、分子生物学的手法で大量の融合タンパク質を得ることができる。
【0017】
また、本発明の融合タンパク質は、異種タンパク質に対する特異的抗体と併せて、E型肝炎ウイルスに対する特異的抗体の産出も誘導するため、複数の感染症の治療及び/又は予防が可能な多価ワクチンとしての利用が可能である。
【図面の簡単な説明】
【0018】
【図1】本発明の融合タンパク質における異種タンパク質の挿入位置の一例を示す図である。
【図2】実施例1の融合タンパク質の発現を確認したSDS-PAGEの結果を示す図である。
【図3】実施例1の融合タンパク質のスクロース密度勾配遠心分離による各画分のSDS-PAGEの結果を示す図である。
【図4】実施例1の融合タンパク質が形成するウイルス様粒子を抗Flag抗体を用いて免疫沈降させた結果を示す図である。
【図5】実施例2の融合タンパク質の発現を確認したSDS-PAGEの結果を示す図である。
【図6】実施例2の融合タンパク質のスクロース密度勾配遠心分離による各画分のSDS-PAGEの結果を示す図である。
【図7】実施例2の融合タンパク質が形成するウイルス様粒子を、透過型電子顕微鏡を用いて観察した図である。
【発明を実施するための形態】
【0019】
以下、本発明の実施形態について説明するが、本発明はこれらに限定されるものではない。
【0020】
本明細書におけるアミノ酸の番号は、特に言及しない限り、E型肝炎ウイルスのORF2にコードされるタンパク質におけるN末端のアミノ酸を1として、C末端方向に1ずつ増加する番号で表す。E型肝炎ウイルス様粒子構成タンパク質のアミノ酸を示す番号であっても、E型肝炎ウイルスのORF2にコードされるタンパク質におけるN末端のアミノ酸に相当するアミノ酸を1として、C末端方向に1ずつ増加する番号で表す。
【0021】
E型肝炎ウイルス(以下、「HEV」と略すこともある。)はRNAをゲノムとして有するウイルスである。HEVは、4つの遺伝子型(Genotype)に分類されるが、本発明ではいずれの遺伝子型のHEVを用いることもできる。HEVのゲノムは、ORF1、ORF2、ORF3の3つのORFを含んでいる。HEVのキャプシドタンパク質はORF2によってコードされる。
【0022】
配列番号:1に示すアミノ酸配列は、遺伝子型3のHEVのORF2にコードされるキャプシドタンパク質のアミノ酸配列の一例であり、660個のアミノ酸からなる。また、他のHEVキャプシドタンパク質の例として、配列番号:1に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質、配列番号:1に示すアミノ酸配列に対して80%以上、好ましくは90%以上、さらに好ましくは95%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質、が挙げられる。
【0023】
E型肝炎ウイルス様粒子(以下、「HEV様粒子」、又は「HEV―LP」と略すこともある。)とは、HEVの免疫原性を有する中空粒子である。HEVのキャプシドタンパク質の一部のアミノ酸を欠失させると、発現されるタンパク質が会合してHEV―LPを形成する。この、HEV―LPを形成するタンパク質をE型肝炎ウイルス様粒子構成タンパク質(以下、「HEV様粒子構成タンパク質」、又は「HEV―LP構成タンパク質」と略すこともある。)という。
【0024】
HEV―LP構成タンパク質は、HEVのORF2にコードされるタンパク質の一部のアミノ酸を欠失させてなる。欠失されるアミノ酸は、N末端側の領域及び/又はC末端側の領域を構成するアミノ酸であり得る。上記のN末端側の領域は、好ましくは100番目乃至120番目のアミノ酸からN末端側の領域であり、より好ましくは、N末端のアミノ酸から111番目のアミノ酸までを含む領域である。
【0025】
また、上記のC末端側の領域は、好ましくは600番目乃至659番目のアミノ酸からC末端側の領域であり、より好ましくは、609番目のアミノ酸からC末端のアミノ酸までを含む領域である。
【0026】
配列番号:2のアミノ酸配列が示すタンパク質は、E型肝炎ウイルス様粒子構成タンパク質の一例であり、HEVのORF2によってコードされるキャプシドタンパク質のうち、N末端〜111番目のアミノ酸及び609番目〜C末端のアミノ酸を欠失させたものである。
【0027】
また、E型肝炎ウイルス様粒子構成タンパク質の他の一例は、配列番号:2に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質、配列番号:2に示すアミノ酸配列に対して80%以上、好ましくは90%以上、さらに好ましくは95%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質も、E型肝炎ウイルス様粒子構成タンパク質、が挙げられる。
【0028】
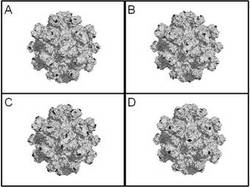
本発明者らが行ったHEV―LPの結晶構造解析によると、HEV―LPは、60個のHEV―LP構成タンパク質が会合してなる多量体の粒子であり、5回軸、3回軸及び2回軸を持つ略正二十面体の構造を有する。さらに、本発明者らは、HEV―LP構成タンパク質が会合してHEV―LPを構成した際、HEV―LPの粒子表面に局在するHEV―LP構成タンパク質の領域を特定した。
【0029】
本発明の融合タンパク質においては、少なくとも1種の異種タンパク質が、HEV―LP構成タンパク質がHEV―LPを構成した際に粒子表面となる領域に挿入される。HEV―LP構成タンパク質における上記の領域は、好ましくは、HEVのORF2にコードされるタンパク質のN末端から484番目〜485番目のアミノ酸からなる領域であり、HEVのORF2にコードされるタンパク質の488番目〜489番目のアミノ酸からなる領域であり、HEVのORF2にコードされるタンパク質の533番目〜534番目のアミノ酸からなる領域であり、HEVのORF2にコードされるタンパク質の555番目〜556番目のアミノ酸からなる領域である。
【0030】
図1はHEV―LPの立体構造を示した。図中、上記のアミノ酸からなる領域を黒で表示し、それ以外の領域を灰色で表示した。Aは、HEVのORF2にコードされるタンパク質のN末端から484番目〜485番目のアミノ酸からなる領域を、Bは、HEVのORF2にコードされるタンパク質の488番目〜489番目のアミノ酸からなる領域を、Cは、HEVのORF2にコードされるタンパク質の533番目〜534番目のアミノ酸からなる領域を、Dは、HEVのORF2にコードされるタンパク質の555番目〜556番目のアミノ酸からなる領域をそれぞれ黒く示したものである。図1を参照すれば、これらの領域がHEV―LPの粒子表面にあることがわかる。
【0031】
したがって、本発明において用いられる異種タンパク質は、HEV―LP構成タンパク質のうち、以下の(a)〜(d)いずれかの位置に挿入することができる。(a)はE型肝炎ウイルスのORF2にコードされるタンパク質のN末端から484番目のアミノ酸と485番目のアミノ酸の間に相当する位置であり、(b)はE型肝炎ウイルスのORF2にコードされるタンパク質のN末端から488番目のアミノ酸と489番目のアミノ酸の間に相当する位置であり、(c)はE型肝炎ウイルスのORF2にコードされるタンパク質のN末端から533番目のアミノ酸と534番目のアミノ酸の間に相当する位置であり、(d)はE型肝炎ウイルスのORF2にコードされるタンパク質のN末端から555番目のアミノ酸と556番目のアミノ酸の間に相当する位置である。これらの領域に異種ポリペプチドを挿入することにより、ウイルス様粒子を形成し得る融合タンパク質を得ることができる。また、本発明の融合タンパク質の発現量は非常に高い。
【0032】
また、本発明の融合タンパク質は複数が会合してウイルス様粒子を構成し得る。ウイルス様粒子を構成する融合タンパク質の数は限定されないが、HEV―LPと同様に60個の融合タンパク質が会合して構成されることが好ましい。
【0033】
本発明において用いられる異種タンパク質とは、E型肝炎ウイルス以外の種に由来するタンパク質又はポリペプチドをいう。異種タンパク質は、任意の細菌又はウイルス由来のタンパク質を用いることができる。異種タンパク質は免疫原性を有することが好ましく、エピトープであることがより好ましい。エピトープとは、特異的抗体の抗原結合部分が相互作用する部分であり、抗原決定基とも呼ばれる。
【0034】
HEV―LPと任意のエピトープとの融合タンパク質は、人又は動物に投与されることで、人又は動物の体内で任意のエピトープに相互作用する特異的抗原の産出を促す。したがって、任意の細菌又はウイルスに対する感染防御効果や治療効果を発揮することができる。また、融合タンパク質は、E型肝炎ウイルスの免疫原性を有する場合があるためE型肝炎ウイルスに相互作用する特異的抗原の産出も同時に誘導する多価ワクチンに利用することができる。
【0035】
本発明において用いられる少なくとも1種の異種タンパク質は、3個〜30個のアミノ酸から構成されることが好ましく、5個〜20個のアミノ酸から構成されることがより好ましく、8個〜18個のアミノ酸から構成されることがさらに好ましい。また、グリシン、アラニン及び/又はセリン等のアミン酸から構成されるSpacer配列を異種ポリペプチドのN末端側及び/又はC末端側に併せて挿入してもよい。
【0036】
本発明の融合タンパク質は、融合タンパク質のアミノ酸配列をコードするDNAの塩基配列を作製し、これを発現させることで得ることができる。タンパク質の発現には、無細胞系や、細胞を用いた系、大腸菌、酵母菌等の微生物を用いた系等を選択することができるが、バキュロウイルス及び昆虫細胞を用いたタンパク質発現系を用いることが好ましい。哺乳類の細胞に近い糖鎖修飾が行われる点や、分子量の大きいタンパク質の発現が可能である点等が利点として挙げられる。
【0037】
また、本発明は上記の融合タンパク質をコードする遺伝子を含み、上記融合タンパク質を発現させる発現ベクターを含む。発現ベクターとしては、プラスミドやウイルス等を用いることが可能である。特に、Autographa californica nuclear polyhedorsis virus(AcNPV)や、Bombyx mori nuclear polyhedorsis
virus(BmNPV)等のバキュロウイルスを用いることが好ましい。また、発現ベクターに用いるバキュロウイルスを感染させる昆虫細胞として、SF9細胞、Tn5細胞等を用いることができる。さらに、昆虫細胞ではなく、カイコ等、昆虫そのものを用いることも可能である。
【0038】
バキュロウイルス及び昆虫細胞の発現系を用いて本発明の融合タンパク質を得る方法の一例を概説する。まず、本発明の融合タンパク質のアミノ酸配列をコードする塩基配列を含むDNAを得て、PCR法により増幅する。この増幅産物を、バキュロウイルストランスファーベクターに挿入して発現ベクターを作製する。さらに、この発現ベクターを、リン脂質混合物等の遺伝子導入剤を用いて昆虫細胞に導入すると、本発明の融合タンパク質をコードする遺伝子を有する組換えバキュロウイルスを得ることができる。
【0039】
上述のようにして得た組換えバキュロウイルスを昆虫細胞に感染させ、昆虫細胞を24時間〜72時間振盪培養すると、培養上清に放出された本発明の融合タンパク質を得ることができる。必要に応じて、本発明の融合タンパク質を含む培養上清に対し、フィルター濾過、遠心分離、濃縮、精製等の処理を行ってもよい。
【0040】
本発明の融合タンパク質は、ヒトや動物に投与することにより、異種タンパク質及び/又はE型肝炎ウイルスに対する特異的抗体の産出を誘導することができる。したがって、本発明の融合タンパク質は感染症の予防及び/又は治療を目的とする医薬組成物に利用することができる。本発明は、上記の融合タンパク質を含む医薬組成物を提供する。
【0041】
本発明の融合タンパク質を含む医薬組成物は、静脈投与、筋肉投与、経口投与、経鼻投与等、さまざまな方法で投与することが可能である。特に、本発明の融合タンパク質は粘膜から吸収されるため、医薬組成物の経口投与、経鼻投与が可能である点が優れている。
【0042】
本発明の融合タンパク質を含む医薬組成物はアジュバントを含んでもよい。アジュバントとしては、バキュロウイルス、昆虫細胞、フロイトアジュバント、ヘモゾイン等を用いることができる。
【実施例】
【0043】
さらに実施例を用いて本発明を詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0044】
実施例1.E型肝炎ウイルス様粒子構成タンパク質と異種タンパク質(Spacer-Flag-Spacer)との融合タンパク質の作製
HEVG32712株由来ORF2を用いて、HEV-LP構成タンパク質と異種タンパク質との融合タンパク質の作製を行った。実施例1における異種タンパク質を配列番号:3に示した。該異種タンパク質は、N末端側からC末端側に向かって順にSpacer配列(アミノ酸配列:Gly-Gly-Gly-Ser)、Flagタグ配列(アミノ酸配列:Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys)、及びSpacer配列(アミノ酸配列:Gly-Gly-Gly-Ser)により構成されるものである。また、実施例1における融合タンパク質は、HEV-LP構成タンパク質におけるHEVのORF2にコードされるタンパク質のN末端から555番目のアミノ酸と556番目のアミノ酸との間に相当する位置に、該異種タンパク質が挿入されたものである。
【0045】
まず、HEVG32712由来ORF2(配列番号:4)の5’末端から334番目〜1824番目の塩基のDNAを表1に示すプライマーを用いてPCR法により増幅した。PCR法は、95℃・1分間、57℃・1分間、72℃・2分間を1サイクルとし、これを30サイクル繰り返す条件で行った。
【0046】
【表1】

【0047】
上記の方法により得られたPCR産物をpFastBac-1 vector(Invitrogen社)に設けられたマルチクローニングサイト(MCS)のBamHIサイト及びXhoIサイトに挿入しコンストラクトを作製した。以下、該コンストラクトを「pFastBac-HEVLPコンストラクト」と呼称する。
【0048】
pFastBac-HEVLPコンストラクトを鋳型として、PCR法を用いて、HEVのORF2の5’末端から334番目〜1665番目の塩基のDNAと、HEVのORF2の5’末端から1666番目〜1824番目の塩基のDNAとを増幅した。PCR法では、それぞれのDNAについて表2に示したプライマーを用いた。334番目〜1665番目の塩基対のPCR産物は、5’末端にBamH1サイト、3’末端にSalIサイトをプライマーに付加した。また、1666番目〜1824番目の塩基対のPCR産物は5’末端にXbaIサイト、3’末端にXhoIサイトをプライマーに付加した。PCR法は、95℃・1分間、57℃・1分間、72℃・2分間を1サイクルとし、これを30サイクル繰り返した。
【0049】
【表2】

【0050】
上記の方法により得られた334番目〜1665番目の塩基対のPCR産物を、pFastBac-1 vector(Invitrogen社)に設けられたマルチクローニングサイト(MCS)のBamHIサイト及びSalIサイトに挿入し、さらに、1666番目〜1824番目の塩基対のPCR産物を、FastBac-1 vector(Invitrogen社)に設けられたマルチクローニングサイト(MCS)のXbaIサイト及びXhoIサイトに挿入した。このように、HEVのORF2の5’末端から1665番目の塩基の位置にSalIを、1666番目の塩基の位置にXbaIの制限酵素サイトを有するコンストラクトを作製した。以下、該コンストラクトを「pFastBac-HEVLP-1665/1666」と呼称する。
【0051】
pFastBac-HEVLP-1665/1666コンストラクトに配列番号:9に示す塩基配列からなるDNAを挿入することで、本発明の融合タンパク質をコードするコンストラクトを作製した。以下、該コンストラクトを「pFastBac-HEVLP-Spacer-Flag-Spacer」と呼称する。配列番号:11に示す塩基配列は、Flagタグ配列の両端にスペーサを配置した異種タンパク質をコードし、5’末端にXhoIサイト、3’末端にNheIサイトを有したものである。
【0052】
pFastBac-HEVLP-Spacer-Flag-Spacerコンストラクトを大腸菌DH10Bac(Invitrogen社)に導入して形質転換を行った。ブルーセレクション法を用いて形質転換された大腸菌を回収しBacmidを調製した。得られたBacmidを、Unifector(B-bridge社製)を用いて昆虫細胞Sf9細胞に遺伝子導入して培養し、組換えバキュロウイルスを発現させた。培養4日後の培養上清を回収して組換えバキュロウイルスを得た。
【0053】
さらに、該培養上清に含まれる組換えバキュロウイルスを昆虫細胞Tn5細胞に感染させ、実施例1の融合タンパク質を発現させた。感染から7日後に実施例1の融合タンパク質を含む上清を回収した。Tn5細胞溶解物(cell lysate)及びTn5細胞培養上清(supernatant)に含まれるタンパク質をSDS-PAGEで分離し、クーマシーブルー染色を行った。結果を図2に示す。図2中、「1」と示したレーンはTn5細胞融解物、「2」と示したレーンはTn5細胞培養上清である。Tn5細胞溶解物及びTn5細胞培養上清に実施例1の融合タンパク質の発現が確認された。
【0054】
該Tn5細胞培養上清を9,600rpm、40分の条件で遠心することで組換えバキュロウイルスを除去した。さらに28,000rpm、3時間の条件で遠心することで実施例1の融合タンパク質が含まれる沈殿を回収した。
【0055】
上記の沈殿を10重量%〜40重量%の勾配に調製したスクロース密度勾配遠心分離(3,500rpm,2時間)により分画し、各画分に含まれるタンパク質をSDS-PAGEで分離し、クーマシーブルーにより染色して実施例1の融合タンパク質の存在を確認した。結果を図3に示す。実施例1の融合タンパク質が含まれる画分5から画分8までを回収し、透析膜を用いてPBSで一晩透析した後、100MWの限外ろ過により濃縮することで該融合タンパク質を精製した。該融合タンパク質は、複数が会合してウイルス様粒子を形成していると考えられる。
【0056】
さらに、実施例1の融合タンパク質について、該融合タンパク質が形成するウイルス様粒子の粒子表面に異種タンパク質が挿入されていることを、免疫沈降法を用いて確認した。
【0057】
実施例1の融合タンパク質が形成するウイルス様粒子(以下、「HEV-LP-Spacer-Flag-Spacer」と呼称する。)、抗Flag抗体(マウスIgG)、及びProtein G-Sepharose(登録商標,GEヘルスケア社)beadsを4℃の条件で1時間撹拌した。遠心によりbeadsを集め、ライシスバッファで洗浄し得られた上清、及び免疫沈降前の上清について抗HEV抗体を用いたウエスタンブロッティング法による検出を行った。さらに、対照としてHEV-LP-Spacer-Flag-Spacerの代わりにHEV-LPを用いて同様の処理を行った。
【0058】
結果を図4に示す。HEV-LP-Spacer-Flag-Spacerはウエスタンブロッティング法により検出されたが、HEV-LPは検出されなかった。したがって、HEV-LP-Spacer-Flag-Spacerは抗Flag抗体と結合して免疫沈降法により回収されており、挿入された異種タンパク質に含まれるFlagタグ配列はウイルス様粒子表面に存在することが明らかとなった。
【0059】
実施例2.E型肝炎ウイルス様粒子構成タンパク質と日本脳炎ウイルス由来タンパク質との融合タンパク質の作製
さらに、実施例2として、異種タンパク質として日本脳炎ウイルスNakayama株のエピトープのうち、337番目〜345番目(配列番号:10)の9アミノ酸からなるタンパク質を有する融合タンパク質を作製した。実施例2の融合タンパク質は、HEV-LP構成タンパク質におけるHEVのORF2にコードされるタンパク質のN末端から555番目のアミノ酸と556番目のアミノ酸との間に相当する位置に、該異種タンパク質が挿入されたものである。
【0060】
実施例1と同様の方法によりpFastBac-HEVLP-1665/1666コンストラクトを作製した。該コンストラクトに配列番号:11に示す塩基配列からなるDNAを挿入して実施例2の融合タンパク質をコードするコンストラクトを作製した。以下、該コンストラクトを「pFastBac-HEVLP-JEV」と呼称する。配列番号:11に示す塩基配列は、日本脳炎ウイルスNakayama株の337番目〜345番目のタンパク質をコードし、5’末端にSalIサイト、3’末端にXbaIサイトを有したものである。
【0061】
実施例1と同様の方法によりpFastBac-HEVLP-JEVを大腸菌に形質導入してBacmidを得て、さらに該BacmidをSf9細胞に導入して組換えバキュロウイルスを得て、さらに該組換えバキュロウイルスをTn5細胞に感染させて実施例2の融合タンパク質を得た。また、同様の方法で異種タンパク質と融合していないHEV-LP構成タンパク質を得た。Tn5細胞溶解物(cell lysate)及びTn5細胞培養上清(supernatant)に含まれるタンパク質をSDS-PAGEで分離し、クーマシーブルー染色を行った結果を図5に示す。
【0062】
図5中、「1」と示したレーンはHEV-LP構成タンパク質が含まれるTn5細胞融解物、「2」と示したレーンはHEV-LP構成タンパク質とJEVとの融合タンパク質が含まれるTn5細胞融解物、「3」と示したレーンは、HEV-LP構成タンパク質が含まれるTn5細胞培養上清、「4」と示したレーンは、HEV-LP構成タンパク質と日本脳炎ウイルスのエピトープとの融合タンパク質が含まれるTn5細胞培養上清である。Tn5細胞溶解物及びTn5細胞培養上清に実施例2の融合タンパク質の発現が確認された。
【0063】
該Tn5細胞培養上清を9,600rpm、40分の条件で遠心することで組換えバキュロウイルスを除去した。さらに28,000rpm、3時間の条件で遠心することで実施例2の融合タンパク質が含まれる沈殿を回収した。
【0064】
上記の沈殿を10重量%〜40重量%の勾配に調製したスクロース密度勾配遠心分離(3,500rpm,2時間)により分画し、各画分に含まれるタンパク質をSDS-PAGEで分離し、クーマシーブルーにより染色して実施例2の融合タンパク質の存在を確認した。結果を図6に示す。実施例2の融合タンパク質に含まれる画分4から画分8までを回収し、透析膜を用いてPBSで一晩透析した後、100MWの限外ろ過により濃縮することで該融合タンパク質を精製した。該融合タンパク質は、複数が会合してウイルス様粒子を形成していると考えられる。
【0065】
さらに、透過型電子顕微鏡を用いて実施例2の融合タンパク質が形成するウイルス様粒子(以下、「HEV-LP-JEV」と呼称する。)を観察した。精製した本実施例の融合タンパク質をネガティブ染色により染色し透過型電子顕微鏡で撮影した画像、及び同様の方法でHEV-LPを撮影した画像を図7に示す。本実施例の融合タンパク質が複数会合してウイルス様粒子を形成していることが確認された。
【産業上の利用可能性】
【0066】
本発明の融合タンパク質は、ヒトや動物の疾病の治療又は予防を目的とする医薬品に用いることができる。
【技術分野】
【0001】
本発明は、E型肝炎ウイルス様粒子構成タンパク質と異種タンパク質との融合タンパク質に関する。
【背景技術】
【0002】
ヒトや動物に対する感染症の拡大が世界的な問題となっており、効果的な治療薬やワクチンを実用化するため、医薬成分を効率的に送達する技術が注目されている。特に、経皮、経口、経鼻等、容易な投与経路で治療・予防効果を発揮する送達技術の開発が行われている。これまで開発された送達技術としては、リポソームを利用したもの(特許文献1参照)、アミノ酸誘導体のキャリア化合物を利用したもの(特許文献2参照)や、胃粘膜傷害性らせん菌を利用したもの(特許文献3参照)等が存在する。
【0003】
近年、E型肝炎ウイルスの遺伝子がクローニングされた。さらに、E型肝炎ウイルスのキャプシドタンパク質の一部のアミノ酸を欠失させて発現させることで、E型肝炎ウイルスに対する免疫原性を有する中空粒子、すなわちE型肝炎ウイルス様粒子を得ることができるという報告がなされている(特許文献4及び5参照)。E型肝炎ウイルスは粘膜から感染するため、E型肝炎ウイルス様粒子は、ドラッグキャリアとして経鼻投与や経口投与が可能な医薬組成物への応用が期待される。
【0004】
E型肝炎ウイルス様粒子をドラッグキャリアに利用する研究としては、HIVのエピトープをウイルス様粒子構成タンパク質のC末端に挿入して融合タンパク質を生産した例(非特許文献1)があり、ウエスタンブロット法により融合タンパク質の発現が確認されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平08―059503号公報
【特許文献2】特開2010―018636号公報
【特許文献3】特開2008―127324号公報
【特許文献4】特表平10―509588号公報
【特許文献5】特開平10―234383号公報
【非特許文献】
【0006】
【非特許文献1】Niikura, M. et al. “Chimeric RecombinantHepatitis E Virus-like Particles as an Oral Vaccine Vehicle Presenting ForeighEpitopes”, Virology, Vol. 293, 2002.
【発明の概要】
【発明が解決しようとする課題】
【0007】
非特許文献1に記載された方法では、E型肝炎ウイルス様粒子構成タンパク質と異種タンパク質との融合タンパク質の発現が確認されるものの、その発現量は著しく少なかった。効率的に融合タンパク質を生産するためには、異種タンパク質を挿入する方法を検討する必要があった。
【課題を解決するための手段】
【0008】
本発明者らは、E型肝炎ウイルス様粒子の結晶構造解析を行うことで融合タンパク質の効率的な生産が可能な異種タンパク質の挿入位置を見出した。さらに、該挿入位置に異種タンパク質を挿入することで、大量に発現し、ウイルス様粒子を形成し得る融合タンパク質を得ることに成功した。
【0009】
すなわち、本発明は、E型肝炎ウイルス様粒子構成タンパク質に少なくとも1種の異種タンパク質が挿入された融合タンパク質であって、異種タンパク質が挿入される位置が、E型肝炎ウイルス様粒子構成タンパク質がE型肝炎ウイルス様粒子を形成した際に該E型ウイルス様粒子の粒子表面となる領域にある、E型肝炎ウイルス様粒子構成タンパク質と異種タンパク質との融合タンパク質を提供する。
【0010】
また、本発明が提供する別の融合タンパク質は、E型肝炎ウイルス様粒子構成タンパク質が、E型肝炎ウイルスのORF2にコードされるタンパク質の一部のアミノ酸を欠失させたものであり、異種タンパク質が、挿入される位置が以下の(a)〜(d)のいずれかである。(a)は、E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から484番目のアミノ酸と485番目のアミノ酸との間に相当する位置であり、(b)は、E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から488番目のアミノ酸と489番目のアミノ酸との間に相当する位置であり、(c)は、E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から533番目のアミノ酸と534番目のアミノ酸との間に相当する位置であり、(d)はE型肝炎ウイルスのORF2にコードされるタンパク質のN末端から555番目のアミノ酸と556番目のアミノ酸との間に相当する位置である。
【0011】
また、本発明が提供する別の融合タンパク質は、E型肝炎ウイルスのORF2にコードされるタンパク質が、以下の(e)〜(g)のいずれかである。(e)は、配列番号:1に示すアミノ酸配列を含むタンパク質であり、(f)は、配列番号:1に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質であり、(g)は、配列番号:1に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質である。
【0012】
また、本発明が提供する別の融合タンパク質は、E型肝炎ウイルス粒子構成タンパク質が、以下の(h)〜(j)のいずれかである。(h)は、配列番号:2に示すアミノ酸配列を含むタンパク質であり、(i)は、配列番号:2に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質であり、(j)は、配列番号:2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質である。
【0013】
また、本発明が提供する融合タンパク質は、異種タンパク質が5個〜20個のアミノ酸から構成されるものであってもよく、異種タンパク質が免疫原性を有するものであってもよい。
【0014】
また、本発明が提供する別の融合タンパク質は、複数の該融合タンパク質が会合してウイルス様粒子を形成し得るものであり、本発明は、融合タンパク質が複数会合して構成されたウイルス様粒子も提供する。
【0015】
さらに、本発明は、融合タンパク質、及び/又はウイルス様粒子を含む医薬組成物や、融合タンパク質をコードする遺伝子を含み、融合タンパク質を発現させる発現ベクターを提供する。
【発明の効果】
【0016】
本発明の融合タンパク質は、ヒト又は動物に対して異種タンパク質に対する特異的抗体の産出を誘導するため、感染症の治療及び/又は予防を目的とした医薬組成物に利用することができる。また、本発明の融合タンパク質は、複数が会合してウイルス様粒子を形成し、粘膜からヒト又は動物の体内へ到達することができる。したがって、経鼻投与や経口投与が可能な医薬組成物に用いることができる。さらに、本発明の融合タンパク質の発現量は非常に多いため、分子生物学的手法で大量の融合タンパク質を得ることができる。
【0017】
また、本発明の融合タンパク質は、異種タンパク質に対する特異的抗体と併せて、E型肝炎ウイルスに対する特異的抗体の産出も誘導するため、複数の感染症の治療及び/又は予防が可能な多価ワクチンとしての利用が可能である。
【図面の簡単な説明】
【0018】
【図1】本発明の融合タンパク質における異種タンパク質の挿入位置の一例を示す図である。
【図2】実施例1の融合タンパク質の発現を確認したSDS-PAGEの結果を示す図である。
【図3】実施例1の融合タンパク質のスクロース密度勾配遠心分離による各画分のSDS-PAGEの結果を示す図である。
【図4】実施例1の融合タンパク質が形成するウイルス様粒子を抗Flag抗体を用いて免疫沈降させた結果を示す図である。
【図5】実施例2の融合タンパク質の発現を確認したSDS-PAGEの結果を示す図である。
【図6】実施例2の融合タンパク質のスクロース密度勾配遠心分離による各画分のSDS-PAGEの結果を示す図である。
【図7】実施例2の融合タンパク質が形成するウイルス様粒子を、透過型電子顕微鏡を用いて観察した図である。
【発明を実施するための形態】
【0019】
以下、本発明の実施形態について説明するが、本発明はこれらに限定されるものではない。
【0020】
本明細書におけるアミノ酸の番号は、特に言及しない限り、E型肝炎ウイルスのORF2にコードされるタンパク質におけるN末端のアミノ酸を1として、C末端方向に1ずつ増加する番号で表す。E型肝炎ウイルス様粒子構成タンパク質のアミノ酸を示す番号であっても、E型肝炎ウイルスのORF2にコードされるタンパク質におけるN末端のアミノ酸に相当するアミノ酸を1として、C末端方向に1ずつ増加する番号で表す。
【0021】
E型肝炎ウイルス(以下、「HEV」と略すこともある。)はRNAをゲノムとして有するウイルスである。HEVは、4つの遺伝子型(Genotype)に分類されるが、本発明ではいずれの遺伝子型のHEVを用いることもできる。HEVのゲノムは、ORF1、ORF2、ORF3の3つのORFを含んでいる。HEVのキャプシドタンパク質はORF2によってコードされる。
【0022】
配列番号:1に示すアミノ酸配列は、遺伝子型3のHEVのORF2にコードされるキャプシドタンパク質のアミノ酸配列の一例であり、660個のアミノ酸からなる。また、他のHEVキャプシドタンパク質の例として、配列番号:1に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質、配列番号:1に示すアミノ酸配列に対して80%以上、好ましくは90%以上、さらに好ましくは95%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質、が挙げられる。
【0023】
E型肝炎ウイルス様粒子(以下、「HEV様粒子」、又は「HEV―LP」と略すこともある。)とは、HEVの免疫原性を有する中空粒子である。HEVのキャプシドタンパク質の一部のアミノ酸を欠失させると、発現されるタンパク質が会合してHEV―LPを形成する。この、HEV―LPを形成するタンパク質をE型肝炎ウイルス様粒子構成タンパク質(以下、「HEV様粒子構成タンパク質」、又は「HEV―LP構成タンパク質」と略すこともある。)という。
【0024】
HEV―LP構成タンパク質は、HEVのORF2にコードされるタンパク質の一部のアミノ酸を欠失させてなる。欠失されるアミノ酸は、N末端側の領域及び/又はC末端側の領域を構成するアミノ酸であり得る。上記のN末端側の領域は、好ましくは100番目乃至120番目のアミノ酸からN末端側の領域であり、より好ましくは、N末端のアミノ酸から111番目のアミノ酸までを含む領域である。
【0025】
また、上記のC末端側の領域は、好ましくは600番目乃至659番目のアミノ酸からC末端側の領域であり、より好ましくは、609番目のアミノ酸からC末端のアミノ酸までを含む領域である。
【0026】
配列番号:2のアミノ酸配列が示すタンパク質は、E型肝炎ウイルス様粒子構成タンパク質の一例であり、HEVのORF2によってコードされるキャプシドタンパク質のうち、N末端〜111番目のアミノ酸及び609番目〜C末端のアミノ酸を欠失させたものである。
【0027】
また、E型肝炎ウイルス様粒子構成タンパク質の他の一例は、配列番号:2に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質、配列番号:2に示すアミノ酸配列に対して80%以上、好ましくは90%以上、さらに好ましくは95%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質も、E型肝炎ウイルス様粒子構成タンパク質、が挙げられる。
【0028】
本発明者らが行ったHEV―LPの結晶構造解析によると、HEV―LPは、60個のHEV―LP構成タンパク質が会合してなる多量体の粒子であり、5回軸、3回軸及び2回軸を持つ略正二十面体の構造を有する。さらに、本発明者らは、HEV―LP構成タンパク質が会合してHEV―LPを構成した際、HEV―LPの粒子表面に局在するHEV―LP構成タンパク質の領域を特定した。
【0029】
本発明の融合タンパク質においては、少なくとも1種の異種タンパク質が、HEV―LP構成タンパク質がHEV―LPを構成した際に粒子表面となる領域に挿入される。HEV―LP構成タンパク質における上記の領域は、好ましくは、HEVのORF2にコードされるタンパク質のN末端から484番目〜485番目のアミノ酸からなる領域であり、HEVのORF2にコードされるタンパク質の488番目〜489番目のアミノ酸からなる領域であり、HEVのORF2にコードされるタンパク質の533番目〜534番目のアミノ酸からなる領域であり、HEVのORF2にコードされるタンパク質の555番目〜556番目のアミノ酸からなる領域である。
【0030】
図1はHEV―LPの立体構造を示した。図中、上記のアミノ酸からなる領域を黒で表示し、それ以外の領域を灰色で表示した。Aは、HEVのORF2にコードされるタンパク質のN末端から484番目〜485番目のアミノ酸からなる領域を、Bは、HEVのORF2にコードされるタンパク質の488番目〜489番目のアミノ酸からなる領域を、Cは、HEVのORF2にコードされるタンパク質の533番目〜534番目のアミノ酸からなる領域を、Dは、HEVのORF2にコードされるタンパク質の555番目〜556番目のアミノ酸からなる領域をそれぞれ黒く示したものである。図1を参照すれば、これらの領域がHEV―LPの粒子表面にあることがわかる。
【0031】
したがって、本発明において用いられる異種タンパク質は、HEV―LP構成タンパク質のうち、以下の(a)〜(d)いずれかの位置に挿入することができる。(a)はE型肝炎ウイルスのORF2にコードされるタンパク質のN末端から484番目のアミノ酸と485番目のアミノ酸の間に相当する位置であり、(b)はE型肝炎ウイルスのORF2にコードされるタンパク質のN末端から488番目のアミノ酸と489番目のアミノ酸の間に相当する位置であり、(c)はE型肝炎ウイルスのORF2にコードされるタンパク質のN末端から533番目のアミノ酸と534番目のアミノ酸の間に相当する位置であり、(d)はE型肝炎ウイルスのORF2にコードされるタンパク質のN末端から555番目のアミノ酸と556番目のアミノ酸の間に相当する位置である。これらの領域に異種ポリペプチドを挿入することにより、ウイルス様粒子を形成し得る融合タンパク質を得ることができる。また、本発明の融合タンパク質の発現量は非常に高い。
【0032】
また、本発明の融合タンパク質は複数が会合してウイルス様粒子を構成し得る。ウイルス様粒子を構成する融合タンパク質の数は限定されないが、HEV―LPと同様に60個の融合タンパク質が会合して構成されることが好ましい。
【0033】
本発明において用いられる異種タンパク質とは、E型肝炎ウイルス以外の種に由来するタンパク質又はポリペプチドをいう。異種タンパク質は、任意の細菌又はウイルス由来のタンパク質を用いることができる。異種タンパク質は免疫原性を有することが好ましく、エピトープであることがより好ましい。エピトープとは、特異的抗体の抗原結合部分が相互作用する部分であり、抗原決定基とも呼ばれる。
【0034】
HEV―LPと任意のエピトープとの融合タンパク質は、人又は動物に投与されることで、人又は動物の体内で任意のエピトープに相互作用する特異的抗原の産出を促す。したがって、任意の細菌又はウイルスに対する感染防御効果や治療効果を発揮することができる。また、融合タンパク質は、E型肝炎ウイルスの免疫原性を有する場合があるためE型肝炎ウイルスに相互作用する特異的抗原の産出も同時に誘導する多価ワクチンに利用することができる。
【0035】
本発明において用いられる少なくとも1種の異種タンパク質は、3個〜30個のアミノ酸から構成されることが好ましく、5個〜20個のアミノ酸から構成されることがより好ましく、8個〜18個のアミノ酸から構成されることがさらに好ましい。また、グリシン、アラニン及び/又はセリン等のアミン酸から構成されるSpacer配列を異種ポリペプチドのN末端側及び/又はC末端側に併せて挿入してもよい。
【0036】
本発明の融合タンパク質は、融合タンパク質のアミノ酸配列をコードするDNAの塩基配列を作製し、これを発現させることで得ることができる。タンパク質の発現には、無細胞系や、細胞を用いた系、大腸菌、酵母菌等の微生物を用いた系等を選択することができるが、バキュロウイルス及び昆虫細胞を用いたタンパク質発現系を用いることが好ましい。哺乳類の細胞に近い糖鎖修飾が行われる点や、分子量の大きいタンパク質の発現が可能である点等が利点として挙げられる。
【0037】
また、本発明は上記の融合タンパク質をコードする遺伝子を含み、上記融合タンパク質を発現させる発現ベクターを含む。発現ベクターとしては、プラスミドやウイルス等を用いることが可能である。特に、Autographa californica nuclear polyhedorsis virus(AcNPV)や、Bombyx mori nuclear polyhedorsis
virus(BmNPV)等のバキュロウイルスを用いることが好ましい。また、発現ベクターに用いるバキュロウイルスを感染させる昆虫細胞として、SF9細胞、Tn5細胞等を用いることができる。さらに、昆虫細胞ではなく、カイコ等、昆虫そのものを用いることも可能である。
【0038】
バキュロウイルス及び昆虫細胞の発現系を用いて本発明の融合タンパク質を得る方法の一例を概説する。まず、本発明の融合タンパク質のアミノ酸配列をコードする塩基配列を含むDNAを得て、PCR法により増幅する。この増幅産物を、バキュロウイルストランスファーベクターに挿入して発現ベクターを作製する。さらに、この発現ベクターを、リン脂質混合物等の遺伝子導入剤を用いて昆虫細胞に導入すると、本発明の融合タンパク質をコードする遺伝子を有する組換えバキュロウイルスを得ることができる。
【0039】
上述のようにして得た組換えバキュロウイルスを昆虫細胞に感染させ、昆虫細胞を24時間〜72時間振盪培養すると、培養上清に放出された本発明の融合タンパク質を得ることができる。必要に応じて、本発明の融合タンパク質を含む培養上清に対し、フィルター濾過、遠心分離、濃縮、精製等の処理を行ってもよい。
【0040】
本発明の融合タンパク質は、ヒトや動物に投与することにより、異種タンパク質及び/又はE型肝炎ウイルスに対する特異的抗体の産出を誘導することができる。したがって、本発明の融合タンパク質は感染症の予防及び/又は治療を目的とする医薬組成物に利用することができる。本発明は、上記の融合タンパク質を含む医薬組成物を提供する。
【0041】
本発明の融合タンパク質を含む医薬組成物は、静脈投与、筋肉投与、経口投与、経鼻投与等、さまざまな方法で投与することが可能である。特に、本発明の融合タンパク質は粘膜から吸収されるため、医薬組成物の経口投与、経鼻投与が可能である点が優れている。
【0042】
本発明の融合タンパク質を含む医薬組成物はアジュバントを含んでもよい。アジュバントとしては、バキュロウイルス、昆虫細胞、フロイトアジュバント、ヘモゾイン等を用いることができる。
【実施例】
【0043】
さらに実施例を用いて本発明を詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0044】
実施例1.E型肝炎ウイルス様粒子構成タンパク質と異種タンパク質(Spacer-Flag-Spacer)との融合タンパク質の作製
HEVG32712株由来ORF2を用いて、HEV-LP構成タンパク質と異種タンパク質との融合タンパク質の作製を行った。実施例1における異種タンパク質を配列番号:3に示した。該異種タンパク質は、N末端側からC末端側に向かって順にSpacer配列(アミノ酸配列:Gly-Gly-Gly-Ser)、Flagタグ配列(アミノ酸配列:Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys)、及びSpacer配列(アミノ酸配列:Gly-Gly-Gly-Ser)により構成されるものである。また、実施例1における融合タンパク質は、HEV-LP構成タンパク質におけるHEVのORF2にコードされるタンパク質のN末端から555番目のアミノ酸と556番目のアミノ酸との間に相当する位置に、該異種タンパク質が挿入されたものである。
【0045】
まず、HEVG32712由来ORF2(配列番号:4)の5’末端から334番目〜1824番目の塩基のDNAを表1に示すプライマーを用いてPCR法により増幅した。PCR法は、95℃・1分間、57℃・1分間、72℃・2分間を1サイクルとし、これを30サイクル繰り返す条件で行った。
【0046】
【表1】

【0047】
上記の方法により得られたPCR産物をpFastBac-1 vector(Invitrogen社)に設けられたマルチクローニングサイト(MCS)のBamHIサイト及びXhoIサイトに挿入しコンストラクトを作製した。以下、該コンストラクトを「pFastBac-HEVLPコンストラクト」と呼称する。
【0048】
pFastBac-HEVLPコンストラクトを鋳型として、PCR法を用いて、HEVのORF2の5’末端から334番目〜1665番目の塩基のDNAと、HEVのORF2の5’末端から1666番目〜1824番目の塩基のDNAとを増幅した。PCR法では、それぞれのDNAについて表2に示したプライマーを用いた。334番目〜1665番目の塩基対のPCR産物は、5’末端にBamH1サイト、3’末端にSalIサイトをプライマーに付加した。また、1666番目〜1824番目の塩基対のPCR産物は5’末端にXbaIサイト、3’末端にXhoIサイトをプライマーに付加した。PCR法は、95℃・1分間、57℃・1分間、72℃・2分間を1サイクルとし、これを30サイクル繰り返した。
【0049】
【表2】

【0050】
上記の方法により得られた334番目〜1665番目の塩基対のPCR産物を、pFastBac-1 vector(Invitrogen社)に設けられたマルチクローニングサイト(MCS)のBamHIサイト及びSalIサイトに挿入し、さらに、1666番目〜1824番目の塩基対のPCR産物を、FastBac-1 vector(Invitrogen社)に設けられたマルチクローニングサイト(MCS)のXbaIサイト及びXhoIサイトに挿入した。このように、HEVのORF2の5’末端から1665番目の塩基の位置にSalIを、1666番目の塩基の位置にXbaIの制限酵素サイトを有するコンストラクトを作製した。以下、該コンストラクトを「pFastBac-HEVLP-1665/1666」と呼称する。
【0051】
pFastBac-HEVLP-1665/1666コンストラクトに配列番号:9に示す塩基配列からなるDNAを挿入することで、本発明の融合タンパク質をコードするコンストラクトを作製した。以下、該コンストラクトを「pFastBac-HEVLP-Spacer-Flag-Spacer」と呼称する。配列番号:11に示す塩基配列は、Flagタグ配列の両端にスペーサを配置した異種タンパク質をコードし、5’末端にXhoIサイト、3’末端にNheIサイトを有したものである。
【0052】
pFastBac-HEVLP-Spacer-Flag-Spacerコンストラクトを大腸菌DH10Bac(Invitrogen社)に導入して形質転換を行った。ブルーセレクション法を用いて形質転換された大腸菌を回収しBacmidを調製した。得られたBacmidを、Unifector(B-bridge社製)を用いて昆虫細胞Sf9細胞に遺伝子導入して培養し、組換えバキュロウイルスを発現させた。培養4日後の培養上清を回収して組換えバキュロウイルスを得た。
【0053】
さらに、該培養上清に含まれる組換えバキュロウイルスを昆虫細胞Tn5細胞に感染させ、実施例1の融合タンパク質を発現させた。感染から7日後に実施例1の融合タンパク質を含む上清を回収した。Tn5細胞溶解物(cell lysate)及びTn5細胞培養上清(supernatant)に含まれるタンパク質をSDS-PAGEで分離し、クーマシーブルー染色を行った。結果を図2に示す。図2中、「1」と示したレーンはTn5細胞融解物、「2」と示したレーンはTn5細胞培養上清である。Tn5細胞溶解物及びTn5細胞培養上清に実施例1の融合タンパク質の発現が確認された。
【0054】
該Tn5細胞培養上清を9,600rpm、40分の条件で遠心することで組換えバキュロウイルスを除去した。さらに28,000rpm、3時間の条件で遠心することで実施例1の融合タンパク質が含まれる沈殿を回収した。
【0055】
上記の沈殿を10重量%〜40重量%の勾配に調製したスクロース密度勾配遠心分離(3,500rpm,2時間)により分画し、各画分に含まれるタンパク質をSDS-PAGEで分離し、クーマシーブルーにより染色して実施例1の融合タンパク質の存在を確認した。結果を図3に示す。実施例1の融合タンパク質が含まれる画分5から画分8までを回収し、透析膜を用いてPBSで一晩透析した後、100MWの限外ろ過により濃縮することで該融合タンパク質を精製した。該融合タンパク質は、複数が会合してウイルス様粒子を形成していると考えられる。
【0056】
さらに、実施例1の融合タンパク質について、該融合タンパク質が形成するウイルス様粒子の粒子表面に異種タンパク質が挿入されていることを、免疫沈降法を用いて確認した。
【0057】
実施例1の融合タンパク質が形成するウイルス様粒子(以下、「HEV-LP-Spacer-Flag-Spacer」と呼称する。)、抗Flag抗体(マウスIgG)、及びProtein G-Sepharose(登録商標,GEヘルスケア社)beadsを4℃の条件で1時間撹拌した。遠心によりbeadsを集め、ライシスバッファで洗浄し得られた上清、及び免疫沈降前の上清について抗HEV抗体を用いたウエスタンブロッティング法による検出を行った。さらに、対照としてHEV-LP-Spacer-Flag-Spacerの代わりにHEV-LPを用いて同様の処理を行った。
【0058】
結果を図4に示す。HEV-LP-Spacer-Flag-Spacerはウエスタンブロッティング法により検出されたが、HEV-LPは検出されなかった。したがって、HEV-LP-Spacer-Flag-Spacerは抗Flag抗体と結合して免疫沈降法により回収されており、挿入された異種タンパク質に含まれるFlagタグ配列はウイルス様粒子表面に存在することが明らかとなった。
【0059】
実施例2.E型肝炎ウイルス様粒子構成タンパク質と日本脳炎ウイルス由来タンパク質との融合タンパク質の作製
さらに、実施例2として、異種タンパク質として日本脳炎ウイルスNakayama株のエピトープのうち、337番目〜345番目(配列番号:10)の9アミノ酸からなるタンパク質を有する融合タンパク質を作製した。実施例2の融合タンパク質は、HEV-LP構成タンパク質におけるHEVのORF2にコードされるタンパク質のN末端から555番目のアミノ酸と556番目のアミノ酸との間に相当する位置に、該異種タンパク質が挿入されたものである。
【0060】
実施例1と同様の方法によりpFastBac-HEVLP-1665/1666コンストラクトを作製した。該コンストラクトに配列番号:11に示す塩基配列からなるDNAを挿入して実施例2の融合タンパク質をコードするコンストラクトを作製した。以下、該コンストラクトを「pFastBac-HEVLP-JEV」と呼称する。配列番号:11に示す塩基配列は、日本脳炎ウイルスNakayama株の337番目〜345番目のタンパク質をコードし、5’末端にSalIサイト、3’末端にXbaIサイトを有したものである。
【0061】
実施例1と同様の方法によりpFastBac-HEVLP-JEVを大腸菌に形質導入してBacmidを得て、さらに該BacmidをSf9細胞に導入して組換えバキュロウイルスを得て、さらに該組換えバキュロウイルスをTn5細胞に感染させて実施例2の融合タンパク質を得た。また、同様の方法で異種タンパク質と融合していないHEV-LP構成タンパク質を得た。Tn5細胞溶解物(cell lysate)及びTn5細胞培養上清(supernatant)に含まれるタンパク質をSDS-PAGEで分離し、クーマシーブルー染色を行った結果を図5に示す。
【0062】
図5中、「1」と示したレーンはHEV-LP構成タンパク質が含まれるTn5細胞融解物、「2」と示したレーンはHEV-LP構成タンパク質とJEVとの融合タンパク質が含まれるTn5細胞融解物、「3」と示したレーンは、HEV-LP構成タンパク質が含まれるTn5細胞培養上清、「4」と示したレーンは、HEV-LP構成タンパク質と日本脳炎ウイルスのエピトープとの融合タンパク質が含まれるTn5細胞培養上清である。Tn5細胞溶解物及びTn5細胞培養上清に実施例2の融合タンパク質の発現が確認された。
【0063】
該Tn5細胞培養上清を9,600rpm、40分の条件で遠心することで組換えバキュロウイルスを除去した。さらに28,000rpm、3時間の条件で遠心することで実施例2の融合タンパク質が含まれる沈殿を回収した。
【0064】
上記の沈殿を10重量%〜40重量%の勾配に調製したスクロース密度勾配遠心分離(3,500rpm,2時間)により分画し、各画分に含まれるタンパク質をSDS-PAGEで分離し、クーマシーブルーにより染色して実施例2の融合タンパク質の存在を確認した。結果を図6に示す。実施例2の融合タンパク質に含まれる画分4から画分8までを回収し、透析膜を用いてPBSで一晩透析した後、100MWの限外ろ過により濃縮することで該融合タンパク質を精製した。該融合タンパク質は、複数が会合してウイルス様粒子を形成していると考えられる。
【0065】
さらに、透過型電子顕微鏡を用いて実施例2の融合タンパク質が形成するウイルス様粒子(以下、「HEV-LP-JEV」と呼称する。)を観察した。精製した本実施例の融合タンパク質をネガティブ染色により染色し透過型電子顕微鏡で撮影した画像、及び同様の方法でHEV-LPを撮影した画像を図7に示す。本実施例の融合タンパク質が複数会合してウイルス様粒子を形成していることが確認された。
【産業上の利用可能性】
【0066】
本発明の融合タンパク質は、ヒトや動物の疾病の治療又は予防を目的とする医薬品に用いることができる。
【特許請求の範囲】
【請求項1】
E型肝炎ウイルス様粒子構成タンパク質に少なくとも1種の異種タンパク質が挿入された融合タンパク質であって、
前記異種タンパク質が挿入される位置が、前記E型肝炎ウイルス様粒子構成タンパク質がE型肝炎ウイルス様粒子を形成した際に該E型ウイルス様粒子の粒子表面となる領域にある、
前記E型肝炎ウイルス様粒子構成タンパク質と前記異種タンパク質との融合タンパク質
【請求項2】
前記E型肝炎ウイルス様粒子構成タンパク質が、E型肝炎ウイルスのORF2にコードされるタンパク質の一部のアミノ酸を欠失させたものであり、
前記異種タンパク質が、挿入される位置が以下の(a)〜(d)のいずれかである、
請求項1に記載の融合タンパク質
(a)前記E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から484番目のアミノ酸と485番目のアミノ酸との間に相当する位置
(b)前記E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から488番目のアミノ酸と489番目のアミノ酸との間に相当する位置
(c)前記E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から533番目のアミノ酸と534番目のアミノ酸との間に相当する位置
(d)前記E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から555番目のアミノ酸と556番目のアミノ酸との間に相当する位置
【請求項3】
前記E型肝炎ウイルスのORF2にコードされるタンパク質が、以下の(e)〜(g)のいずれかである、請求項1又は2に記載の融合タンパク質
(e)配列番号:1に示すアミノ酸配列を含むタンパク質
(f)配列番号:1に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質
(g)配列番号:1に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質
【請求項4】
前記E型肝炎ウイルス粒子構成タンパク質が、以下の(h)〜(j)のいずれかである、請求項1〜3いずれか一項に記載の融合タンパク質
(h)配列番号:2に示すアミノ酸配列を含むタンパク質
(i)配列番号:2に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質
(j)配列番号:2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質
【請求項5】
前記異種タンパク質が5個〜20個のアミノ酸から構成される、請求項1〜4いずれか一項に記載の融合タンパク質
【請求項6】
前記異種タンパク質が免疫原性を有する、請求項1〜5いずれか一項に記載の融合タンパク質
【請求項7】
前記融合タンパク質は、複数の該融合タンパク質が会合してウイルス様粒子を形成し得るものである、請求項1〜6いずれか一項に記載の融合タンパク質
【請求項8】
請求項1〜7いずれか一項に記載の融合タンパク質が複数会合して構成されたウイルス様粒子
【請求項9】
請求項1〜7いずれか一項に記載の融合タンパク質をコードする遺伝子を含み、前記融合タンパク質を発現させる発現ベクター
【請求項10】
請求項1〜7に記載の融合タンパク質、及び/又は請求項8に記載のウイルス様粒子を含む医薬組成物
【請求項1】
E型肝炎ウイルス様粒子構成タンパク質に少なくとも1種の異種タンパク質が挿入された融合タンパク質であって、
前記異種タンパク質が挿入される位置が、前記E型肝炎ウイルス様粒子構成タンパク質がE型肝炎ウイルス様粒子を形成した際に該E型ウイルス様粒子の粒子表面となる領域にある、
前記E型肝炎ウイルス様粒子構成タンパク質と前記異種タンパク質との融合タンパク質
【請求項2】
前記E型肝炎ウイルス様粒子構成タンパク質が、E型肝炎ウイルスのORF2にコードされるタンパク質の一部のアミノ酸を欠失させたものであり、
前記異種タンパク質が、挿入される位置が以下の(a)〜(d)のいずれかである、
請求項1に記載の融合タンパク質
(a)前記E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から484番目のアミノ酸と485番目のアミノ酸との間に相当する位置
(b)前記E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から488番目のアミノ酸と489番目のアミノ酸との間に相当する位置
(c)前記E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から533番目のアミノ酸と534番目のアミノ酸との間に相当する位置
(d)前記E型肝炎ウイルスのORF2にコードされるタンパク質のN末端から555番目のアミノ酸と556番目のアミノ酸との間に相当する位置
【請求項3】
前記E型肝炎ウイルスのORF2にコードされるタンパク質が、以下の(e)〜(g)のいずれかである、請求項1又は2に記載の融合タンパク質
(e)配列番号:1に示すアミノ酸配列を含むタンパク質
(f)配列番号:1に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質
(g)配列番号:1に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルスのキャプシドタンパク質になり得るタンパク質
【請求項4】
前記E型肝炎ウイルス粒子構成タンパク質が、以下の(h)〜(j)のいずれかである、請求項1〜3いずれか一項に記載の融合タンパク質
(h)配列番号:2に示すアミノ酸配列を含むタンパク質
(i)配列番号:2に示すアミノ酸配列において1又は数個のアミノ酸が欠失、挿入、又は付加されたアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質
(j)配列番号:2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列を含み、E型肝炎ウイルス様粒子を形成し得るタンパク質
【請求項5】
前記異種タンパク質が5個〜20個のアミノ酸から構成される、請求項1〜4いずれか一項に記載の融合タンパク質
【請求項6】
前記異種タンパク質が免疫原性を有する、請求項1〜5いずれか一項に記載の融合タンパク質
【請求項7】
前記融合タンパク質は、複数の該融合タンパク質が会合してウイルス様粒子を形成し得るものである、請求項1〜6いずれか一項に記載の融合タンパク質
【請求項8】
請求項1〜7いずれか一項に記載の融合タンパク質が複数会合して構成されたウイルス様粒子
【請求項9】
請求項1〜7いずれか一項に記載の融合タンパク質をコードする遺伝子を含み、前記融合タンパク質を発現させる発現ベクター
【請求項10】
請求項1〜7に記載の融合タンパク質、及び/又は請求項8に記載のウイルス様粒子を含む医薬組成物
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−139193(P2012−139193A)
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願番号】特願2011−285(P2011−285)
【出願日】平成23年1月4日(2011.1.4)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度、独立行政法人農業・食品産業技術総合研究機構、基礎的試験研究「バキュロウイルスの特性を利用した家畜用ワクチンの開発」に係る委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【出願人】(000201641)全国農業協同組合連合会 (69)
【出願人】(507013280)
【Fターム(参考)】
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願日】平成23年1月4日(2011.1.4)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度、独立行政法人農業・食品産業技術総合研究機構、基礎的試験研究「バキュロウイルスの特性を利用した家畜用ワクチンの開発」に係る委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【出願人】(000201641)全国農業協同組合連合会 (69)
【出願人】(507013280)

【Fターム(参考)】
[ Back to top ]

