血管内皮細胞特異的プロモーター
【課題】従来の血管内皮細胞特異的プロモーターよりも特異性及び転写活性に優れた新規な血管内皮細胞特異的プロモーターを提供し、血管内皮特異的に所望の遺伝子やshRNA、miRNA等を高発現させることができる手段を提供すること。
【解決手段】オリジナルのジーンチップを用いて内皮細胞増殖因子VEGF-Aで刺激したHUVECにおける遺伝子発現を解析し、発現が増幅する遺伝子を鋭意スクリーニングすることにより、BAZFを同定した。BAZFのプロモーター領域を鋭意同定、解析し、BAZFプロモーターの血管内皮細胞への特異性が極めて高いこと、さらにその転写活性についても、公知の強発現用プロモーターであるCMVプロモーターの転写活性よりも遥かに強い転写活性を有することを見出した。本知見に基づき、新規な血管内皮細胞特異的プロモーターを提供した。
【解決手段】オリジナルのジーンチップを用いて内皮細胞増殖因子VEGF-Aで刺激したHUVECにおける遺伝子発現を解析し、発現が増幅する遺伝子を鋭意スクリーニングすることにより、BAZFを同定した。BAZFのプロモーター領域を鋭意同定、解析し、BAZFプロモーターの血管内皮細胞への特異性が極めて高いこと、さらにその転写活性についても、公知の強発現用プロモーターであるCMVプロモーターの転写活性よりも遥かに強い転写活性を有することを見出した。本知見に基づき、新規な血管内皮細胞特異的プロモーターを提供した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血管内皮細胞特異的プロモーターに関する。
【背景技術】
【0002】
現在、疾患部位特異的に様々な遺伝子やshRNA、miRNA等を導入し疾患の治療を行う試みがなされており、細種胞特異的な転写活性をもつプロモーター配列が求められている。基礎研究においても、臓器や細胞特異的に遺伝子を発現させることによってその臓器、細胞における遺伝子の機能解析を行うことは重要であり、細胞種特異的な転写活性を持つプロモーター配列は重要である。
【0003】
これまでに、血管内皮細胞特異的プロモーターとしていくつかのもの(Tie-2, VE-cadherin等)が報告されており(特許文献1等)、既に基礎研究において使用されている。しかしながら、これら公知のプロモーターは血管内皮細胞だけでなく平滑筋細胞や血球系細胞でも活性があり、さらに組織においても様々な組織で活性がみられ、必ずしも血管内皮細胞特異的とはいえなかった。
【0004】
一方、特許文献2には、血管形成の調節に有用な数種類の遺伝子が開示されている。例えばBAZFについては、その発現が心臓と肺に追いやられていること、及び活性化リンパ球で前初期遺伝子として誘導されること、血管形態形成時に高発現することが記載されている。しかしながら、該遺伝子が血管内皮細胞に特異的に高発現するといった記載や示唆は全くない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平7−289263
【特許文献2】特表2004−514404
【発明の概要】
【発明が解決しようとする課題】
【0006】
従って、本発明は、従来の血管内皮細胞特異的プロモーターよりも特異性及び転写活性に優れた新規な血管内皮細胞特異的プロモーターを提供し、血管内皮特異的に所望の遺伝子やshRNA、miRNA等を高発現させることができる手段を提供することにある。
【課題を解決するための手段】
【0007】
本願発明者らは、オリジナルのジーンチップを用いて内皮細胞増殖因子VEGF-Aで刺激したHUVECにおける遺伝子発現を解析し、発現が増幅する遺伝子を鋭意スクリーニングすることにより、BAZF(B-cell lymphoma 6 associated zinc finger protein)を同定した。そして、BAZFのプロモーター領域を鋭意同定し、このプロモーター領域を用いたレポーターアッセイにより、BAZFプロモーターの血管内皮細胞への特異性が極めて高いこと、さらにその転写活性についても、公知の強発現用プロモーターであるCMVプロモーターの転写活性よりも遥かに強い転写活性を有することを見出し、本願発明を完成した。
【0008】
すなわち、本発明は、下記いずれかのDNAからなり、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有する、血管内皮細胞特異的プロモーターを提供する。
(a) 配列番号1に示す塩基配列中の連続する709塩基以上の領域からなり、4312nt〜5020ntの領域を含むDNA。
(b) (a)と90%以上の同一性を有する塩基配列からなり、かつ、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有するDNA。
また、本発明は、上記本発明のプロモーターを含む、血管内皮細胞特異的に所望のRNAを産生させるための発現ベクターを提供する。さらに、本発明は、上記本発明の発現ベクターを含む細胞を提供する。さらに、本発明は、上記本発明の発現ベクターを含む、血管内皮細胞特異的に所望のRNAを産生させるための組成物を提供する。さらに、本発明は、上記本発明の発現ベクターを含む、血管内皮細胞特異的に所望のRNAを産生させるためのキットを提供する。さらに、本発明は、上記本発明のプロモーターと、該プロモーターに機能的に連結された所望のRNAをコードするDNAとがゲノム中に組み込まれ、該所望のRNAを血管内皮細胞特異的に産生するトランスジェニック非ヒト動物を提供する。さらに、本発明は、上記本発明のプロモーターと、該プロモーターに機能的に連結された所望のRNAをコードするDNAとを非ヒト動物細胞に導入することを含む、血管内皮細胞特異的に所望のRNAを産生させる方法を提供する。
【発明の効果】
【0009】
本発明により、公知の血管内皮細胞特異的プロモーターよりも優れた血管内皮細胞特異的プロモーターが提供された。本発明のプロモーターは、公知のプロモーターよりも血管内皮細胞への特異性がはるかに高く、上皮系細胞及び間葉系細胞ではほとんど全く転写活性を示さない。また、特異性が高いのみならず、転写活性の強さにも極めて優れており、遺伝子の恒常的強発現に一般に用いられるCMVプロモーターと比べても、血管内皮細胞において約10倍も強い転写活性を持つ。本発明のプロモーターを用いれば、血管内皮細胞で効率よく目的遺伝子を発現させることができるので、遺伝子治療等の臨床応用や基礎研究にも有用である。例えば、本発明のプロモーターを用いて血管内皮特異的に蛍光タンパク質を発現させ、血管内皮細胞を可視化した動物モデルを作出すれば、該モデルにより薬剤の血管に対する影響を評価することができるようになる。また、アンチセンス法やRNAiによる遺伝子ノックダウンや、Cre/LoxPシステム等を用いた遺伝子ノックアウトの手法が確立されているが、組織特異的プロモーターとして本発明のプロモーターを採用すれば、血管内皮特異的に目的遺伝子をノックダウン、ノックアウトした動物を作出することができる。こうしたノックダウンないしはノックアウト動物により、各種遺伝子の血管内皮細胞における機能を解析できる。以上の通り、本発明は、臨床及び基礎研究の双方に大いに貢献するものである。
【図面の簡単な説明】
【0010】
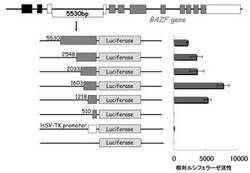
【図1】プロモーター領域の同定のために行なったレポーターアッセイの結果を示す図である。
【図2】BAZF遺伝子の-1218/+1の領域を含むプラスミドを血管内皮細、上皮系細胞及び間葉系細胞に遺伝子導入し、その転写活性を測定した結果を示す図である。
【図3】血管内皮細胞におけるBAZFプロモーターの転写活性をCMVプロモーターと比較した結果である。
【発明を実施するための形態】
【0011】
本発明のプロモーターは、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有する血管内皮特異的プロモーターであり、下記いずれかのDNAからなる。
(a) 配列番号1に示す塩基配列中の連続する709塩基以上の領域からなり、4312nt〜5020ntの領域を含むDNA。
(b) (a)と90%以上の同一性を有する塩基配列からなり、かつ、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有するDNA。
【0012】
(a)のDNAは、配列番号1に示す塩基配列中の連続する領域(部分領域又は全長領域)からなるDNAである。配列番号1に示す塩基配列は、BAZFの転写開始点より上流5530塩基の領域(-5529〜+1)であり、このうちの4312nt〜5020ntの709塩基の領域(-1218〜-510)がプロモーター活性に重要な領域である(図1)。(a)のDNAは、この4312nt〜5020ntの領域を少なくとも含む。
【0013】
(a)のDNAには、配列番号1に示す塩基配列中の連続する1094塩基以上の領域から成り、3927nt〜5020nt(-1603〜-510)の領域を含むDNAや、4312nt〜5530nt(-1218〜+1)の1219塩基の領域を含むDNAが包含される。具体例を挙げると、4312nt〜5530nt(-1218〜+1)からなるDNA、3927nt〜5530nt(-1603〜+1)からなるDNA等が挙げられるが、これらに限定されない。
【0014】
(b)のDNAは、(a)のDNAにおいて、少数の塩基が置換、欠失及び/又は挿入された塩基配列からなり、かつ、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有するDNAである。(a)のDNAとの配列の同一性が高いDNAは、(a)のDNAと同様に血管内皮細胞特異的なプロモーター活性を発揮し得る。(b)のDNAの(a)との同一性は90%以上、好ましくは95%以上、より好ましくは98%以上である。(b)のDNAの好ましい例としては、さらに、(a)のDNAにおいて1個又は数個の塩基が置換、欠失及び/又は挿入された塩基配列からなるDNAを挙げることができる。
【0015】
ここで、塩基配列の「同一性」とは、比較すべき2つの塩基配列の塩基ができるだけ多く一致するように両配列を整列させ、一致した塩基数を、全塩基数で除したものを百分率で表したものである。上記整列の際には、必要に応じ、比較する2つの配列の一方又は双方に適宜ギャップを挿入する。このような配列の整列化は、例えばBLAST、FASTA、CLUSTAL W等の周知のプログラムを用いて行なうことができる。ギャップが挿入される場合、上記全塩基数は、1つのギャップを1つの塩基として数えた塩基数となる。このようにして数えた全塩基数が、比較する2つの配列間で異なる場合には、同一性(%)は、長い方の配列の全塩基数で、一致した塩基数を除して算出される。
【0016】
ただし、比較すべき配列が他の任意の配列と連結された状態にある場合には(例えば、発現ベクターに組み込まれた状態、発現させたい所望の遺伝子と連結させた状態など)、プロモーターに相当する領域のみを取り出して配列を対比し、同一性を算出する。
【0017】
プロモーターは、発現させたいRNAをコードするDNAと連結して用いられるものであり、また多くの場合発現ベクターに組み込まれた状態で市販されるため、通常、他の配列が付加された形態にある。本発明のプロモーターの一端又は両端に任意の配列が付加されたDNAは、本発明のプロモーターを利用したものといえるため、本発明の範囲に包含される。任意の他の配列としては、特に限定されないが、例えば、ベクター由来の配列、制限酵素認識配列、スペーサー配列、マーカー遺伝子配列、血管内皮細胞で特異的に発現させたい所望のRNAをコードする塩基配列等が挙げられる。
【0018】
血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性とは、所望の遺伝子をプロモーターと機能的に連結させた形態で血管内皮細胞(例えばHUVEC等の血管内皮由来培養細胞)に導入した場合に、該血管内皮細胞内で所望の遺伝子のmRNAを転写させる活性をいう。「機能的に連結」とは、該プロモーターの支配を受けるようにその下流に遺伝子配列を連結することをいう。任意の塩基配列からなるDNAがそのようなプロモーター活性を有しているかどうかは、ルシフェラーゼ遺伝子等を利用した周知のレポーターアッセイにより容易に確認することができる。レポーターアッセイのためのキットや試薬類は市販されており、当業者であれば容易に実施できる。
【0019】
(a)のDNAは、公知の遺伝子工学的手法や市販の核酸合成機を用いた常法により容易に調製することができる。例えば、血管内皮細胞(例えばHUVEC等の血管内皮由来培養細胞)から抽出したゲノムDNAを鋳型としたPCRにより増幅して得ることができる。PCRに用いるプライマーは、配列番号1に示した塩基配列に基づいて適宜設計できる。
【0020】
(b)のDNAは、市販の核酸合成機を用いるほか、BAZFプロモーター領域に天然の変異を有する血管内皮細胞から抽出したゲノムDNAをPCRの鋳型として用いることで得ることができる。あるいは、(a)のDNAに常法により適宜変異を導入することで合成することもできる。
【0021】
本発明のプロモーターは、マルチクローニングサイト等を適宜具備する発現ベクターに組み込まれた形態で提供できる。ベクターはプラスミドでもウイルスでもよい。各種のプラスミド発現ベクター及びウイルス発現ベクターが公知であり、使用対象となる宿主細胞の種類ないしは動物種に応じて適宜選択することができる。
【0022】
本発明のプロモーターを含む発現ベクターは、さらに、該プロモーターに機能的に連結された、所望のRNAをコードするDNAを含み得る。所望のRNAをコードするDNAを、本発明のプロモーターに機能的に連結するようにして発現ベクターに組み込み、これを非ヒト動物細胞に導入してトランスジェニック動物を作出すれば、血管内皮特異的に所望のRNAを産生するトランスジェニック動物が得られる。こうしたトランスジェニック動物は、基礎研究のツールとして有用である。また、本発明のプロモーターを含む発現ベクターは、後述する通り、医薬としても有用である。
【0023】
本発明のプロモーターに機能的に連結させる所望のRNAをコードするDNAは、例えば、タンパク質をコードする遺伝子のcDNAのほか、アンチセンス核酸、shRNA、miRNA等の遺伝子発現を調節するRNAをコードするDNAであり得る。タンパク質をコードする遺伝子は特に限定されず、内在性遺伝子でも外来遺伝子でもよい。
【0024】
本発明の基礎研究への応用の具体例としては、血管内皮細胞特異的に特定の遺伝子を発現させ、又は特定の遺伝子の発現をノックアウト若しくはノックダウンさせたトランスジェニック動物が挙げられる。
【0025】
例えば、GFP等の蛍光タンパク質を本発明のプロモーターの制御下で動物(ヒトを除く)に導入すれば、血管内皮細胞を可視化した動物モデルを作出できる。この動物モデルに薬剤を投与し、血管に対する該薬剤の影響を調べることができる。
【0026】
動物において特定の遺伝子をノックダウン又はノックアウトする手法も確立している。遺伝子ノックダウンは、アンチセンス法のほか、shRNAやmiRNAを用いたRNAiにより行なうことができる。目的の遺伝子に対するアンチセンスRNA、shRNA又はmiRNAを産生できるDNAを本発明のプロモーターに機能的に連結し、これを動物に導入すれば、血管内皮において特異的に目的遺伝子の発現が低減したノックダウン動物を得ることができる。遺伝子ノックアウトは、近年ではCre/LoxPシステムが主に使用されている。欠損させたい遺伝子がゲノム中でLoxPに挟み込まれた状態にあるトランスジェニック動物を作出し、この動物内でCreリコンビナーゼを発現させると、LoxPに挟まれたゲノム領域が切り出される。別途、本発明のプロモーター制御下でCreを発現するトランスジェニック動物を作出しておき、前述のLoxPトランスジェニック動物と交配させれば、目的遺伝子の発現が血管内皮において特異的にノックアウトされたトランスジェニック動物を得ることができる。こうしたノックアウト、ノックダウン動物は、血管内皮における遺伝子の機能解析に有用である。
【0027】
また、本発明のプロモーターを含む発現ベクターは、医薬としても有用であり得る。例えば、血管内皮において特定の遺伝子産物が減少ないしは欠失することが原因で生じる疾患の場合、その遺伝子を本発明のプロモーター下流に連結した発現ベクターが治療薬として有用であり得る。このような疾患の具体例としては、例えば、血友病、第II、第V、第VII、第X因子欠乏症等を挙げることができる。また、これとは逆に、血管内皮において特定の遺伝子が過剰発現していることが原因で生じる疾患の場合、該遺伝子に対するアンチセンスRNA、shRNA、miRNA等の、対象遺伝子の発現量を低減できるRNAをコードするDNAを本発明のプロモーター下流に連結した発現ベクターが治療薬として有用であり得る。こうした疾患の具体例としては、例えば、癌、加齢黄斑変性、糖尿病性網膜症等をあげることができる。核酸医薬自体はこの分野で周知であり、そのためのプラスミドベクターやウイルスベクターが各種研究開発されている。
【0028】
本発明のプロモーターを含む発現ベクターは、適宜他の成分と組み合わせて、血管内皮細胞特異的に所望のRNAを産生させるための組成物(医薬組成物、研究用試薬組成物など)として提供することができる。あるいは、該発現ベクターは、適宜他の試薬類、ポジティブコントロールベクター等と組み合わせて、血管内皮細胞特異的に所望のRNAを産生させるためのキットとして提供することができる。
【0029】
本発明のプロモーターは、血管内皮細胞への特異性が極めて高く、上皮系細胞(例えばHEK293T, PC-9, Hela, HT-29)及び間葉系細胞(例えばFibroblast, HT1080, Huh-7, HepG2)内では実質的にプロモーター活性を発揮しない。下記実施例では、(a)の一例である、配列番号1の4312nt〜5530nt(-1218〜+1)からなるプロモーターを用いて、上皮系細胞及び間葉系細胞ではほとんど全く転写活性を示さず、血管内皮細胞に極めて特異的に転写活性を示すことが確認されている。また、本発明のプロモーターは、特異性のみならず、転写活性にも優れている。例えば、公知の強発現用プロモーターであるCMVプロモーターと比較しても、転写活性が数倍以上高い。このように、本発明のプロモーターによれば、所望のRNAを血管内皮細胞で特異的に高生産させることができるので、臨床、基礎研究の双方に非常に有用である。
【実施例】
【0030】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0031】
血管内皮特異的プロモーター候補のスクリーニング
通常の方法で培養したヒト臍帯静脈内皮細胞(HUVEC)と、内皮細胞増殖因子(VEGF-A)で刺激したHUVECから、常法によりRNAを抽出してcDNAを合成した。これらcDNAをオリジナルのジーンチップを用いて解析し、VEGF-A刺激にて発現誘導される遺伝子を選択した。ここで得られた候補遺伝子について定量PCR法で確認した結果、最も強く誘導される遺伝子がBAZF(B-cell lymphoma 6 associated zinc finger protein)であった。またデータベース(東京大学SBMシステム生物医学データベースRefExA http://157.82.78.238/refexa/main_search.jsp)にてその発現特性を確認したところ、血管内皮細胞特異的な発現をする分子であることがわかった。
【0032】
BAZFのプロモーター領域の同定
ヒト臍帯静脈内皮細胞(HUVEC)よりゲノムDNAを抽出し、これを鋳型としたPCRにより、BAZFの転写開始点より上流5530塩基の領域(配列番号1、-5529〜+1)を増幅した。luciferase(蛍由来)遺伝子を含むプラスミド(pGL4.1、Promega)に増幅断片を挿入し、luciferase遺伝子の上流に上記増幅断片が挿入されたプラスミドを構築した。また上流領域の様々な長さに短縮した変異体の作成もおこなった(-2548/+1, -2033/+1, -1603/+1, -1218/+1, -510/+1)。
【0033】
構築したプラスミドをHUVECに遺伝子導入し、その転写活性をLuciferase活性を測定することにより解析した。Luciferase活性の測定は、Dual-Luciferase Reporter Assay System(Promega)を用いて行なった。実験の際、遺伝子導入効率や細胞数のぶれを補正するために、チミジンキナーゼプロモーターの下流にluciferase(ウミシイタケ由来)を挿入したプラスミド(pRL-TK、Promega)を解析対象プラスミドと共に遺伝子導入し、そのluciferase活性を測定して解析対象プラスミドの測定値を補正した。
【0034】
結果を図1に示す。-1218/+1では転写活性が存在するが-510/+1では転写活性がないことから、BAZFプロモーターは-1218/-510に含まれることが示された。
【0035】
BAZFプロモーターの細胞種特異性の解析
上記で構築した-1218/+1の領域を含むプラスミドを血管内皮細胞(HUVEC, CAEC, Dermal MVEC, Retinal MVEC)、上皮系細胞(HEK293T, PC-9, Hela, HT-29)、間葉系細胞(Fibroblast, HT1080, Huh-7, HepG2)に遺伝子導入し、その転写活性を測定した。
【0036】
結果を図2に示す。HUVEC, CAEC, Dermal MVEC, Retinal MVECにおいて転写活性が確認できたが、他の細胞では転写活性を示さなかった。以上より、BAZFプロモーターが血管内皮細胞に極めて特異的な転写活性をもつことが示された。
【0037】
BAZFプロモーターの転写活性の解析
BAZFプロモーターの転写活性と、遺伝子の強発現に通常用いられるCMV由来プロモーターの転写活性を、HUVECにおいて比較した。CMVプロモーター領域は、公知のプラスミド(pcDNA3.1)からPCR増幅して調製し、上記で用いたluciferase(蛍由来)遺伝子を含むプラスミドに該増幅断片を挿入し、CMVプロモーターを含むプロモーターアッセイ用プラスミドを構築した。このCMVプロモータープラスミドと、BAZFの-1218/+1の領域を含むプラスミドを、それぞれHUVECに導入し、そのLuciferase活性を測定した。
【0038】
結果を図3に示す。BAZFプロモーターはCMVプロモーターと比較して強い転写活性を有することが示された。
【技術分野】
【0001】
本発明は、血管内皮細胞特異的プロモーターに関する。
【背景技術】
【0002】
現在、疾患部位特異的に様々な遺伝子やshRNA、miRNA等を導入し疾患の治療を行う試みがなされており、細種胞特異的な転写活性をもつプロモーター配列が求められている。基礎研究においても、臓器や細胞特異的に遺伝子を発現させることによってその臓器、細胞における遺伝子の機能解析を行うことは重要であり、細胞種特異的な転写活性を持つプロモーター配列は重要である。
【0003】
これまでに、血管内皮細胞特異的プロモーターとしていくつかのもの(Tie-2, VE-cadherin等)が報告されており(特許文献1等)、既に基礎研究において使用されている。しかしながら、これら公知のプロモーターは血管内皮細胞だけでなく平滑筋細胞や血球系細胞でも活性があり、さらに組織においても様々な組織で活性がみられ、必ずしも血管内皮細胞特異的とはいえなかった。
【0004】
一方、特許文献2には、血管形成の調節に有用な数種類の遺伝子が開示されている。例えばBAZFについては、その発現が心臓と肺に追いやられていること、及び活性化リンパ球で前初期遺伝子として誘導されること、血管形態形成時に高発現することが記載されている。しかしながら、該遺伝子が血管内皮細胞に特異的に高発現するといった記載や示唆は全くない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平7−289263
【特許文献2】特表2004−514404
【発明の概要】
【発明が解決しようとする課題】
【0006】
従って、本発明は、従来の血管内皮細胞特異的プロモーターよりも特異性及び転写活性に優れた新規な血管内皮細胞特異的プロモーターを提供し、血管内皮特異的に所望の遺伝子やshRNA、miRNA等を高発現させることができる手段を提供することにある。
【課題を解決するための手段】
【0007】
本願発明者らは、オリジナルのジーンチップを用いて内皮細胞増殖因子VEGF-Aで刺激したHUVECにおける遺伝子発現を解析し、発現が増幅する遺伝子を鋭意スクリーニングすることにより、BAZF(B-cell lymphoma 6 associated zinc finger protein)を同定した。そして、BAZFのプロモーター領域を鋭意同定し、このプロモーター領域を用いたレポーターアッセイにより、BAZFプロモーターの血管内皮細胞への特異性が極めて高いこと、さらにその転写活性についても、公知の強発現用プロモーターであるCMVプロモーターの転写活性よりも遥かに強い転写活性を有することを見出し、本願発明を完成した。
【0008】
すなわち、本発明は、下記いずれかのDNAからなり、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有する、血管内皮細胞特異的プロモーターを提供する。
(a) 配列番号1に示す塩基配列中の連続する709塩基以上の領域からなり、4312nt〜5020ntの領域を含むDNA。
(b) (a)と90%以上の同一性を有する塩基配列からなり、かつ、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有するDNA。
また、本発明は、上記本発明のプロモーターを含む、血管内皮細胞特異的に所望のRNAを産生させるための発現ベクターを提供する。さらに、本発明は、上記本発明の発現ベクターを含む細胞を提供する。さらに、本発明は、上記本発明の発現ベクターを含む、血管内皮細胞特異的に所望のRNAを産生させるための組成物を提供する。さらに、本発明は、上記本発明の発現ベクターを含む、血管内皮細胞特異的に所望のRNAを産生させるためのキットを提供する。さらに、本発明は、上記本発明のプロモーターと、該プロモーターに機能的に連結された所望のRNAをコードするDNAとがゲノム中に組み込まれ、該所望のRNAを血管内皮細胞特異的に産生するトランスジェニック非ヒト動物を提供する。さらに、本発明は、上記本発明のプロモーターと、該プロモーターに機能的に連結された所望のRNAをコードするDNAとを非ヒト動物細胞に導入することを含む、血管内皮細胞特異的に所望のRNAを産生させる方法を提供する。
【発明の効果】
【0009】
本発明により、公知の血管内皮細胞特異的プロモーターよりも優れた血管内皮細胞特異的プロモーターが提供された。本発明のプロモーターは、公知のプロモーターよりも血管内皮細胞への特異性がはるかに高く、上皮系細胞及び間葉系細胞ではほとんど全く転写活性を示さない。また、特異性が高いのみならず、転写活性の強さにも極めて優れており、遺伝子の恒常的強発現に一般に用いられるCMVプロモーターと比べても、血管内皮細胞において約10倍も強い転写活性を持つ。本発明のプロモーターを用いれば、血管内皮細胞で効率よく目的遺伝子を発現させることができるので、遺伝子治療等の臨床応用や基礎研究にも有用である。例えば、本発明のプロモーターを用いて血管内皮特異的に蛍光タンパク質を発現させ、血管内皮細胞を可視化した動物モデルを作出すれば、該モデルにより薬剤の血管に対する影響を評価することができるようになる。また、アンチセンス法やRNAiによる遺伝子ノックダウンや、Cre/LoxPシステム等を用いた遺伝子ノックアウトの手法が確立されているが、組織特異的プロモーターとして本発明のプロモーターを採用すれば、血管内皮特異的に目的遺伝子をノックダウン、ノックアウトした動物を作出することができる。こうしたノックダウンないしはノックアウト動物により、各種遺伝子の血管内皮細胞における機能を解析できる。以上の通り、本発明は、臨床及び基礎研究の双方に大いに貢献するものである。
【図面の簡単な説明】
【0010】
【図1】プロモーター領域の同定のために行なったレポーターアッセイの結果を示す図である。
【図2】BAZF遺伝子の-1218/+1の領域を含むプラスミドを血管内皮細、上皮系細胞及び間葉系細胞に遺伝子導入し、その転写活性を測定した結果を示す図である。
【図3】血管内皮細胞におけるBAZFプロモーターの転写活性をCMVプロモーターと比較した結果である。
【発明を実施するための形態】
【0011】
本発明のプロモーターは、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有する血管内皮特異的プロモーターであり、下記いずれかのDNAからなる。
(a) 配列番号1に示す塩基配列中の連続する709塩基以上の領域からなり、4312nt〜5020ntの領域を含むDNA。
(b) (a)と90%以上の同一性を有する塩基配列からなり、かつ、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有するDNA。
【0012】
(a)のDNAは、配列番号1に示す塩基配列中の連続する領域(部分領域又は全長領域)からなるDNAである。配列番号1に示す塩基配列は、BAZFの転写開始点より上流5530塩基の領域(-5529〜+1)であり、このうちの4312nt〜5020ntの709塩基の領域(-1218〜-510)がプロモーター活性に重要な領域である(図1)。(a)のDNAは、この4312nt〜5020ntの領域を少なくとも含む。
【0013】
(a)のDNAには、配列番号1に示す塩基配列中の連続する1094塩基以上の領域から成り、3927nt〜5020nt(-1603〜-510)の領域を含むDNAや、4312nt〜5530nt(-1218〜+1)の1219塩基の領域を含むDNAが包含される。具体例を挙げると、4312nt〜5530nt(-1218〜+1)からなるDNA、3927nt〜5530nt(-1603〜+1)からなるDNA等が挙げられるが、これらに限定されない。
【0014】
(b)のDNAは、(a)のDNAにおいて、少数の塩基が置換、欠失及び/又は挿入された塩基配列からなり、かつ、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有するDNAである。(a)のDNAとの配列の同一性が高いDNAは、(a)のDNAと同様に血管内皮細胞特異的なプロモーター活性を発揮し得る。(b)のDNAの(a)との同一性は90%以上、好ましくは95%以上、より好ましくは98%以上である。(b)のDNAの好ましい例としては、さらに、(a)のDNAにおいて1個又は数個の塩基が置換、欠失及び/又は挿入された塩基配列からなるDNAを挙げることができる。
【0015】
ここで、塩基配列の「同一性」とは、比較すべき2つの塩基配列の塩基ができるだけ多く一致するように両配列を整列させ、一致した塩基数を、全塩基数で除したものを百分率で表したものである。上記整列の際には、必要に応じ、比較する2つの配列の一方又は双方に適宜ギャップを挿入する。このような配列の整列化は、例えばBLAST、FASTA、CLUSTAL W等の周知のプログラムを用いて行なうことができる。ギャップが挿入される場合、上記全塩基数は、1つのギャップを1つの塩基として数えた塩基数となる。このようにして数えた全塩基数が、比較する2つの配列間で異なる場合には、同一性(%)は、長い方の配列の全塩基数で、一致した塩基数を除して算出される。
【0016】
ただし、比較すべき配列が他の任意の配列と連結された状態にある場合には(例えば、発現ベクターに組み込まれた状態、発現させたい所望の遺伝子と連結させた状態など)、プロモーターに相当する領域のみを取り出して配列を対比し、同一性を算出する。
【0017】
プロモーターは、発現させたいRNAをコードするDNAと連結して用いられるものであり、また多くの場合発現ベクターに組み込まれた状態で市販されるため、通常、他の配列が付加された形態にある。本発明のプロモーターの一端又は両端に任意の配列が付加されたDNAは、本発明のプロモーターを利用したものといえるため、本発明の範囲に包含される。任意の他の配列としては、特に限定されないが、例えば、ベクター由来の配列、制限酵素認識配列、スペーサー配列、マーカー遺伝子配列、血管内皮細胞で特異的に発現させたい所望のRNAをコードする塩基配列等が挙げられる。
【0018】
血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性とは、所望の遺伝子をプロモーターと機能的に連結させた形態で血管内皮細胞(例えばHUVEC等の血管内皮由来培養細胞)に導入した場合に、該血管内皮細胞内で所望の遺伝子のmRNAを転写させる活性をいう。「機能的に連結」とは、該プロモーターの支配を受けるようにその下流に遺伝子配列を連結することをいう。任意の塩基配列からなるDNAがそのようなプロモーター活性を有しているかどうかは、ルシフェラーゼ遺伝子等を利用した周知のレポーターアッセイにより容易に確認することができる。レポーターアッセイのためのキットや試薬類は市販されており、当業者であれば容易に実施できる。
【0019】
(a)のDNAは、公知の遺伝子工学的手法や市販の核酸合成機を用いた常法により容易に調製することができる。例えば、血管内皮細胞(例えばHUVEC等の血管内皮由来培養細胞)から抽出したゲノムDNAを鋳型としたPCRにより増幅して得ることができる。PCRに用いるプライマーは、配列番号1に示した塩基配列に基づいて適宜設計できる。
【0020】
(b)のDNAは、市販の核酸合成機を用いるほか、BAZFプロモーター領域に天然の変異を有する血管内皮細胞から抽出したゲノムDNAをPCRの鋳型として用いることで得ることができる。あるいは、(a)のDNAに常法により適宜変異を導入することで合成することもできる。
【0021】
本発明のプロモーターは、マルチクローニングサイト等を適宜具備する発現ベクターに組み込まれた形態で提供できる。ベクターはプラスミドでもウイルスでもよい。各種のプラスミド発現ベクター及びウイルス発現ベクターが公知であり、使用対象となる宿主細胞の種類ないしは動物種に応じて適宜選択することができる。
【0022】
本発明のプロモーターを含む発現ベクターは、さらに、該プロモーターに機能的に連結された、所望のRNAをコードするDNAを含み得る。所望のRNAをコードするDNAを、本発明のプロモーターに機能的に連結するようにして発現ベクターに組み込み、これを非ヒト動物細胞に導入してトランスジェニック動物を作出すれば、血管内皮特異的に所望のRNAを産生するトランスジェニック動物が得られる。こうしたトランスジェニック動物は、基礎研究のツールとして有用である。また、本発明のプロモーターを含む発現ベクターは、後述する通り、医薬としても有用である。
【0023】
本発明のプロモーターに機能的に連結させる所望のRNAをコードするDNAは、例えば、タンパク質をコードする遺伝子のcDNAのほか、アンチセンス核酸、shRNA、miRNA等の遺伝子発現を調節するRNAをコードするDNAであり得る。タンパク質をコードする遺伝子は特に限定されず、内在性遺伝子でも外来遺伝子でもよい。
【0024】
本発明の基礎研究への応用の具体例としては、血管内皮細胞特異的に特定の遺伝子を発現させ、又は特定の遺伝子の発現をノックアウト若しくはノックダウンさせたトランスジェニック動物が挙げられる。
【0025】
例えば、GFP等の蛍光タンパク質を本発明のプロモーターの制御下で動物(ヒトを除く)に導入すれば、血管内皮細胞を可視化した動物モデルを作出できる。この動物モデルに薬剤を投与し、血管に対する該薬剤の影響を調べることができる。
【0026】
動物において特定の遺伝子をノックダウン又はノックアウトする手法も確立している。遺伝子ノックダウンは、アンチセンス法のほか、shRNAやmiRNAを用いたRNAiにより行なうことができる。目的の遺伝子に対するアンチセンスRNA、shRNA又はmiRNAを産生できるDNAを本発明のプロモーターに機能的に連結し、これを動物に導入すれば、血管内皮において特異的に目的遺伝子の発現が低減したノックダウン動物を得ることができる。遺伝子ノックアウトは、近年ではCre/LoxPシステムが主に使用されている。欠損させたい遺伝子がゲノム中でLoxPに挟み込まれた状態にあるトランスジェニック動物を作出し、この動物内でCreリコンビナーゼを発現させると、LoxPに挟まれたゲノム領域が切り出される。別途、本発明のプロモーター制御下でCreを発現するトランスジェニック動物を作出しておき、前述のLoxPトランスジェニック動物と交配させれば、目的遺伝子の発現が血管内皮において特異的にノックアウトされたトランスジェニック動物を得ることができる。こうしたノックアウト、ノックダウン動物は、血管内皮における遺伝子の機能解析に有用である。
【0027】
また、本発明のプロモーターを含む発現ベクターは、医薬としても有用であり得る。例えば、血管内皮において特定の遺伝子産物が減少ないしは欠失することが原因で生じる疾患の場合、その遺伝子を本発明のプロモーター下流に連結した発現ベクターが治療薬として有用であり得る。このような疾患の具体例としては、例えば、血友病、第II、第V、第VII、第X因子欠乏症等を挙げることができる。また、これとは逆に、血管内皮において特定の遺伝子が過剰発現していることが原因で生じる疾患の場合、該遺伝子に対するアンチセンスRNA、shRNA、miRNA等の、対象遺伝子の発現量を低減できるRNAをコードするDNAを本発明のプロモーター下流に連結した発現ベクターが治療薬として有用であり得る。こうした疾患の具体例としては、例えば、癌、加齢黄斑変性、糖尿病性網膜症等をあげることができる。核酸医薬自体はこの分野で周知であり、そのためのプラスミドベクターやウイルスベクターが各種研究開発されている。
【0028】
本発明のプロモーターを含む発現ベクターは、適宜他の成分と組み合わせて、血管内皮細胞特異的に所望のRNAを産生させるための組成物(医薬組成物、研究用試薬組成物など)として提供することができる。あるいは、該発現ベクターは、適宜他の試薬類、ポジティブコントロールベクター等と組み合わせて、血管内皮細胞特異的に所望のRNAを産生させるためのキットとして提供することができる。
【0029】
本発明のプロモーターは、血管内皮細胞への特異性が極めて高く、上皮系細胞(例えばHEK293T, PC-9, Hela, HT-29)及び間葉系細胞(例えばFibroblast, HT1080, Huh-7, HepG2)内では実質的にプロモーター活性を発揮しない。下記実施例では、(a)の一例である、配列番号1の4312nt〜5530nt(-1218〜+1)からなるプロモーターを用いて、上皮系細胞及び間葉系細胞ではほとんど全く転写活性を示さず、血管内皮細胞に極めて特異的に転写活性を示すことが確認されている。また、本発明のプロモーターは、特異性のみならず、転写活性にも優れている。例えば、公知の強発現用プロモーターであるCMVプロモーターと比較しても、転写活性が数倍以上高い。このように、本発明のプロモーターによれば、所望のRNAを血管内皮細胞で特異的に高生産させることができるので、臨床、基礎研究の双方に非常に有用である。
【実施例】
【0030】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0031】
血管内皮特異的プロモーター候補のスクリーニング
通常の方法で培養したヒト臍帯静脈内皮細胞(HUVEC)と、内皮細胞増殖因子(VEGF-A)で刺激したHUVECから、常法によりRNAを抽出してcDNAを合成した。これらcDNAをオリジナルのジーンチップを用いて解析し、VEGF-A刺激にて発現誘導される遺伝子を選択した。ここで得られた候補遺伝子について定量PCR法で確認した結果、最も強く誘導される遺伝子がBAZF(B-cell lymphoma 6 associated zinc finger protein)であった。またデータベース(東京大学SBMシステム生物医学データベースRefExA http://157.82.78.238/refexa/main_search.jsp)にてその発現特性を確認したところ、血管内皮細胞特異的な発現をする分子であることがわかった。
【0032】
BAZFのプロモーター領域の同定
ヒト臍帯静脈内皮細胞(HUVEC)よりゲノムDNAを抽出し、これを鋳型としたPCRにより、BAZFの転写開始点より上流5530塩基の領域(配列番号1、-5529〜+1)を増幅した。luciferase(蛍由来)遺伝子を含むプラスミド(pGL4.1、Promega)に増幅断片を挿入し、luciferase遺伝子の上流に上記増幅断片が挿入されたプラスミドを構築した。また上流領域の様々な長さに短縮した変異体の作成もおこなった(-2548/+1, -2033/+1, -1603/+1, -1218/+1, -510/+1)。
【0033】
構築したプラスミドをHUVECに遺伝子導入し、その転写活性をLuciferase活性を測定することにより解析した。Luciferase活性の測定は、Dual-Luciferase Reporter Assay System(Promega)を用いて行なった。実験の際、遺伝子導入効率や細胞数のぶれを補正するために、チミジンキナーゼプロモーターの下流にluciferase(ウミシイタケ由来)を挿入したプラスミド(pRL-TK、Promega)を解析対象プラスミドと共に遺伝子導入し、そのluciferase活性を測定して解析対象プラスミドの測定値を補正した。
【0034】
結果を図1に示す。-1218/+1では転写活性が存在するが-510/+1では転写活性がないことから、BAZFプロモーターは-1218/-510に含まれることが示された。
【0035】
BAZFプロモーターの細胞種特異性の解析
上記で構築した-1218/+1の領域を含むプラスミドを血管内皮細胞(HUVEC, CAEC, Dermal MVEC, Retinal MVEC)、上皮系細胞(HEK293T, PC-9, Hela, HT-29)、間葉系細胞(Fibroblast, HT1080, Huh-7, HepG2)に遺伝子導入し、その転写活性を測定した。
【0036】
結果を図2に示す。HUVEC, CAEC, Dermal MVEC, Retinal MVECにおいて転写活性が確認できたが、他の細胞では転写活性を示さなかった。以上より、BAZFプロモーターが血管内皮細胞に極めて特異的な転写活性をもつことが示された。
【0037】
BAZFプロモーターの転写活性の解析
BAZFプロモーターの転写活性と、遺伝子の強発現に通常用いられるCMV由来プロモーターの転写活性を、HUVECにおいて比較した。CMVプロモーター領域は、公知のプラスミド(pcDNA3.1)からPCR増幅して調製し、上記で用いたluciferase(蛍由来)遺伝子を含むプラスミドに該増幅断片を挿入し、CMVプロモーターを含むプロモーターアッセイ用プラスミドを構築した。このCMVプロモータープラスミドと、BAZFの-1218/+1の領域を含むプラスミドを、それぞれHUVECに導入し、そのLuciferase活性を測定した。
【0038】
結果を図3に示す。BAZFプロモーターはCMVプロモーターと比較して強い転写活性を有することが示された。
【特許請求の範囲】
【請求項1】
下記いずれかのDNAからなり、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有する、血管内皮細胞特異的プロモーター。
(a) 配列番号1に示す塩基配列中の連続する709塩基以上の領域からなり、4312nt〜5020ntの領域を含むDNA。
(b) (a)と90%以上の同一性を有する塩基配列からなり、かつ、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有するDNA。
【請求項2】
前記(a)のDNAが、配列番号1に示す塩基配列中の連続する1094塩基以上の領域から成り、3927nt〜5020ntの領域を含む請求項1記載のプロモーター。
【請求項3】
前記(a)のDNAが、配列番号1に示す塩基配列中の連続する1219塩基以上の領域からなり、4312nt〜5530ntの領域を含む請求項1記載のプロモーター。
【請求項4】
前記(a)のDNAが、配列番号1に示す塩基配列中の4312nt〜5530ntの領域からなる請求項3記載のプロモーター。
【請求項5】
前記(a)のDNAが、配列番号1に示す塩基配列中の3927nt〜5530ntの領域からなる請求項3記載のプロモーター。
【請求項6】
前記(b)のDNAが、前記(a)と95%以上の同一性を有する塩基配列からなる請求項1ないし5のいずれか1項に記載のプロモーター。
【請求項7】
前記(b)のDNAが、前記(a)のDNAにおいて1又は数個の塩基が置換、欠失、及び/又は挿入された塩基配列からなる請求項1ないし5のいずれか1項に記載のプロモーター。
【請求項8】
請求項1ないし7のいずれか1項に記載のプロモーターを含む、血管内皮細胞特異的に所望のRNAを産生させるための発現ベクター。
【請求項9】
前記プロモーターに機能的に連結された、血管内皮細胞特異的な産生が望まれるRNAをコードするDNAをさらに含む請求項8記載の発現ベクター。
【請求項10】
請求項8又は9記載の発現ベクターを含む細胞。
【請求項11】
請求項8又は9記載の発現ベクターを含む、血管内皮細胞特異的に所望のRNAを産生させるための組成物。
【請求項12】
請求項8又は9記載の発現ベクターを含む、血管内皮細胞特異的に所望のRNAを産生させるためのキット。
【請求項13】
請求項1ないし7のいずれか1項に記載のプロモーターと、該プロモーターに機能的に連結された所望のRNAをコードするDNAとがゲノム中に組み込まれ、該所望のRNAを血管内皮細胞特異的に産生するトランスジェニック非ヒト動物。
【請求項14】
請求項1ないし7のいずれか1項に記載のプロモーターと、該プロモーターに機能的に連結された所望のRNAをコードするDNAとを非ヒト動物細胞に導入することを含む、血管内皮細胞特異的に所望のRNAを産生させる方法。
【請求項1】
下記いずれかのDNAからなり、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有する、血管内皮細胞特異的プロモーター。
(a) 配列番号1に示す塩基配列中の連続する709塩基以上の領域からなり、4312nt〜5020ntの領域を含むDNA。
(b) (a)と90%以上の同一性を有する塩基配列からなり、かつ、血管内皮細胞に特異的に遺伝子を発現させるプロモーター活性を有するDNA。
【請求項2】
前記(a)のDNAが、配列番号1に示す塩基配列中の連続する1094塩基以上の領域から成り、3927nt〜5020ntの領域を含む請求項1記載のプロモーター。
【請求項3】
前記(a)のDNAが、配列番号1に示す塩基配列中の連続する1219塩基以上の領域からなり、4312nt〜5530ntの領域を含む請求項1記載のプロモーター。
【請求項4】
前記(a)のDNAが、配列番号1に示す塩基配列中の4312nt〜5530ntの領域からなる請求項3記載のプロモーター。
【請求項5】
前記(a)のDNAが、配列番号1に示す塩基配列中の3927nt〜5530ntの領域からなる請求項3記載のプロモーター。
【請求項6】
前記(b)のDNAが、前記(a)と95%以上の同一性を有する塩基配列からなる請求項1ないし5のいずれか1項に記載のプロモーター。
【請求項7】
前記(b)のDNAが、前記(a)のDNAにおいて1又は数個の塩基が置換、欠失、及び/又は挿入された塩基配列からなる請求項1ないし5のいずれか1項に記載のプロモーター。
【請求項8】
請求項1ないし7のいずれか1項に記載のプロモーターを含む、血管内皮細胞特異的に所望のRNAを産生させるための発現ベクター。
【請求項9】
前記プロモーターに機能的に連結された、血管内皮細胞特異的な産生が望まれるRNAをコードするDNAをさらに含む請求項8記載の発現ベクター。
【請求項10】
請求項8又は9記載の発現ベクターを含む細胞。
【請求項11】
請求項8又は9記載の発現ベクターを含む、血管内皮細胞特異的に所望のRNAを産生させるための組成物。
【請求項12】
請求項8又は9記載の発現ベクターを含む、血管内皮細胞特異的に所望のRNAを産生させるためのキット。
【請求項13】
請求項1ないし7のいずれか1項に記載のプロモーターと、該プロモーターに機能的に連結された所望のRNAをコードするDNAとがゲノム中に組み込まれ、該所望のRNAを血管内皮細胞特異的に産生するトランスジェニック非ヒト動物。
【請求項14】
請求項1ないし7のいずれか1項に記載のプロモーターと、該プロモーターに機能的に連結された所望のRNAをコードするDNAとを非ヒト動物細胞に導入することを含む、血管内皮細胞特異的に所望のRNAを産生させる方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−102747(P2013−102747A)
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願番号】特願2011−250591(P2011−250591)
【出願日】平成23年11月16日(2011.11.16)
【出願人】(504147254)国立大学法人愛媛大学 (214)
【出願人】(306008724)富士レビオ株式会社 (55)
【Fターム(参考)】
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願日】平成23年11月16日(2011.11.16)
【出願人】(504147254)国立大学法人愛媛大学 (214)
【出願人】(306008724)富士レビオ株式会社 (55)
【Fターム(参考)】
[ Back to top ]

