赤外吸収フタロシアニン
【課題】大気中で安定な、1000nm以上の近赤外〜赤外領域に極大吸収を有するフタロシアニン誘導体を提供すること。
【解決手段】中心配位元素として15族元素を有し、ベンゼン環のα位炭素に16族元素が結合しているフタロシアニン。
【解決手段】中心配位元素として15族元素を有し、ベンゼン環のα位炭素に16族元素が結合しているフタロシアニン。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は1000nm以上の近赤外〜赤外領域に極大吸収を有するフタロシアニン誘導体に関する。
【背景技術】
【0002】
近赤外〜赤外領域の光を吸収する有機色素は、有機薄膜太陽電池、色素増感太陽電池、がん治療などに利用される光応答型発熱材料、赤外線センサー、赤外線イメージング素子、遮熱フィルムなど広範な分野に応用されている。中でも太陽電池は近年大きな注目を浴びているデバイスであり、有機系太陽電池は塗布や印刷プロセスで安価に製造可能であり、またフレキシブル化による形状自由度を付与できるなどのメリットがある。しかしこのように長波長の光を吸収するためには、有機色素のHOMO−LUMOのエネルギーギャップが小さい必要があるが、HOMOの準位が高くなると容易に空気酸化されてしまうため、大気中での安定性が悪くなってしまう。フタロシアニン誘導体はこのような有機色素の中でも特に安定性に優れるが、極大吸収は650〜700nmにあるものがほとんどで、800nm以上の領域に吸収を有し、かつ大気中で安定な誘導体は知られていない(非特許文献1、非特許文献2)。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】T.Fukudaら、Handbook of Porphyrin Science、 World Scientific社、2010年、9巻、1ページ
【非特許文献2】T.Nyokong、Struc.Bonding、2010年、135巻、45ページ
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明が解決しようとする課題は、大気中で安定な、1000nm以上の近赤外〜赤外領域に極大吸収を有するフタロシアニン誘導体を提供することである。
【課題を解決するための手段】
【0005】
上記課題を解決するための手段として、我々は中心配位元素として15族元素を有し、ベンゼン環のα位炭素に16族元素が結合しているフタロシアニンを発明した。中心配位元素としての15族元素はリンであることが好ましく、ベンゼン環のα位炭素に結合している16族元素は硫黄またはセレンであることが好ましい。
【0006】
本発明のフタロシアニンは極大吸収を1000〜2000nmの領域に有する。
より好適には本発明のフタロシアニンは式(1)
【0007】
【化1】

【0008】
(式中、R1Oは炭素数1〜20のアルコキシ基、Xは硫黄またはセレン、R2は炭素数1〜20の1価のアルキル基またはアリール基、Yは1価のアニオン)で示される構造を有する。
【0009】
本発明のフタロシアニンは、光電変換素子の光吸収層として用いられる。さらに本発明のフタロシアニンは樹脂中に分散させて赤外線吸収フィルム、赤外線吸収塗料、赤外線吸収接着剤などとして使用することが可能である。
【発明の効果】
【0010】
本発明のフタロシアニンは1000nm以上の近赤外〜赤外領域に極大吸収を有するため、光電変換素子の光吸収層として利用することにより赤外光に対応する太陽電池を作製することができる。また本発明のフタロシアニンは大気中、室温で長期間安定であるため、上記光電変換素子の寿命が長い。また本発明のフタロシアニンは樹脂中に分散させて赤外線吸収フィルム、赤外線吸収塗料、赤外線吸収接着剤などとして使用することが可能である。
【図面の簡単な説明】
【0011】
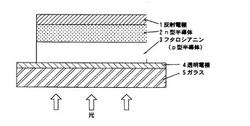
【図1】本発明のフタロシアニンを光吸収層であるp型半導体として適用した有機太陽電池の構造図(断面)である。
【図2】実施例1に記載の[(PhS)8PcP(OMe)2]+PF6−の吸収スペクトルである。
【図3】実施例2に記載の [(PhSe)8PcP(OMe)2]+PF6−の吸収スペクトルである。
【発明を実施するための形態】
【0012】
本発明のフタロシアニンは、中心配位元素として15族元素を有し、ベンゼン環のα位炭素に16族元素が結合した構造を有する。ピロール環の窒素原子はLUMOの係数が大きく、したがってこの窒素原子が配位する中心元素として電気陰性度が大きいものを用いることにより、フタロシアニンのLUMOレベルを下げる効果がある。15族元素は電気陰性度が大きいため、この目的に適している。LUMOレベルが下がるとHOMOとのエネルギー準位の差が小さくなるため、吸収波長は長波長シフトする。このような15族元素としては汎用性の点でリン、ヒ素、アンチモン、ビスマスが好ましく、安全性の点でリン、アンチモン、ビスマスがより好ましく、酸化価数が大きい点でリンが最も好ましい。
【0013】
フタロシアニンのベンゼン環のα位炭素はHOMOの係数が大きい。したがってここに電子供与性の置換基をつけることによりHOMOのレベルを上げることができ、これによってLUMOとのエネルギー準位の差を小さくすることが可能となる。このような置換基として16族元素を直接結合させることが効果的である。このような16族元素としては汎用性の点で硫黄、セレン、およびテルルが好ましく、合成の容易さの点で硫黄およびセレンがより好ましい。
【0014】
中心配位元素としてリンを用い、ベンゼン環のα位炭素に硫黄またはセレンを結合させることにより、フタロシアニンの極大吸収を1000〜2000nmの領域にシフトさせることが可能となる。
【0015】
本発明のフタロシアニンの構造としては、以下の式(1)に示すものが合成の容易さの点で好ましい。
【0016】
【化2】

【0017】
ただし式中、R1Oは炭素数1〜20のアルコキシ基、Xは硫黄またはセレン、R2は炭素数1〜20の1価のアルキル基またはアリール基、Yは1価のアニオンを示す。R1Oで表現されるアルコキシ基としては特に限定されないが、入手性および合成の容易さの点でメトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基、n−ブトキシ基、t−ブトキシ基、およびフェノキシ基が好ましく、メトキシ基およびエトキシ基がより好ましい。R2の1価のアルキル基またはアリール基としては特に限定されないが、入手性および合成の容易さの点でメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、t−ブチル基、フェニル基、p−アルキルフェニル基、p−アミノフェニル基、ナフチル基、ビフェニル基、ターフェニル基、アントリル基、フルオレニル基、フェナントリル基、インデニル基、ピレニル基が好ましく、フェニル基、p−アルキルフェニル基がより好ましく、フェニル基が最も好ましい。Yの1価のアニオンとしては特に限定されないが、合成の容易さの点でハロゲンイオン、PF6−、ClO4−、SbF6−、BF4−が好ましく、安定性の点でPF6−、SbF6−、BF4−がより好ましい。
【0018】
本発明の光電変換素子は上記フタロシアニンを光吸収層として有するものであり、その構造としては特に限定されないが、変換効率の高さからn型半導体と組み合わせて電極間に配置したpn接合構造が好ましく、フタロシアニンとn型半導体が互いに混ざり合ったバルクヘテロ構造がより好ましい。n型半導体としては特に限定されないが、変換効率の高さの点でフラーレン誘導体が好ましい。pn接合型光電変換素子の構造を図1に示す。
【0019】
本発明のフタロシアニンは樹脂中に分散させて赤外線吸収フィルム、赤外線吸収塗料、赤外線吸収接着剤などとして使用することが可能である。樹脂へ分散させる方法としては特に限定されず、溶媒を用いて混合する方法、溶融混錬する方法、フタロシアニン存在下に樹脂を重合する方法などを適用可能である。品質安定性の点で溶媒を用いて混合する方法が好ましい。使用する樹脂としては特に限定されず、アクリル樹脂、ポリカーボネート樹脂、オレフィン樹脂、ポリスチレン系樹脂、ポリエステル樹脂、ポリアミド樹脂、シリコーン樹脂、熱可塑性エラストマー、ブチルゴム、ニトリルゴム、シリコーンゴムなどに適用可能であり、光学特性に優れる点でアクリル樹脂、ポリカーボネート樹脂、オレフィン樹脂、ポリエステル樹脂、シリコーン樹脂、熱可塑性エラストマー、シリコーンゴムが好ましい。
【実施例】
【0020】
以下に本発明の実施例を記載する。
【0021】
(製造例1)
3,6−ビス(トシルオキシ)フタロニトリルの合成
2、3−ジシアノヒドロキノン1g、炭酸カリウム3.5g、トシルクロライド2.6g、アセトン8mLをフラスコに入れ、2時間リフラックスさせた。反応混合物を水に注いで1時間撹拌し、固形物をろ過して水で洗浄後、真空中60℃で乾燥させることにより3,6−ビス(トシルオキシ)フタロニトリル2.6gを薄褐色粉末として収率92%で得た。
【0022】
(製造例2)
3,6−ビス(フェニルチオ)フタロニトリルの合成
製造例1で合成した3,6−ビス(トシルオキシ)フタロニトリル234mgと炭酸カリウム280mgをチオフェノール440mg/DMSO溶液に入れ、室温で14時間撹拌した後水を加えてクエンチした。クロロホルムで抽出した後5%炭酸ナトリウム水溶液で洗浄し、硫酸マグネシウムで乾燥してから溶媒留去した。生成物をカラムクロマトグラフィーで精製後、メタノールから再結晶させることにより3,6−ビス(フェニルチオ)フタロニトリル113mgを薄黄色粉末として収率66%で得た。
【0023】
(製造例3)
オクタキス(フェニルチオ)フタロシアニンの合成
製造例2で合成した3,6−ビス(フェニルチオ)フタロニトリル103mgを、リチウム14mgをブタノール1mLに溶解させた溶液に入れ、2時間リフラックスさせた。生成物をカラムクロマトグラフィーで精製することにより、オクタキス(フェニルチオ)フタロシアニン77mgを暗赤色粉末として収率74%で得た。
【0024】
(実施例1)
[(PhS)8PcP(OMe)2]+PF6− (式(1)においてR1=メチル、X=硫黄、R2=フェニル、Y=PF6−)の合成
製造例3で合成したオクタキス(フェニルチオ)フタロシアニン8.3mgをピリジン2mLに溶解し、POBr3を150mg加えて1.5時間リフラックスさせた。溶媒留去してから残渣をジクロロメタンとメタノールの1:1(体積)混合溶媒に溶解させ室温で30分間撹拌した。有機層を水で洗浄した後溶媒留去し、得られた固体をジクロロメタンに溶解させてKPF6を4.0mg加え、室温で12時間撹拌した。溶媒留去後ジクロロメタン/n−ヘキサンから再結晶させることにより、[(PhS)8PcP(OMe)2]+PF6−3.8mgを暗青緑色粉末として収率40%で得た。このフタロシアニン誘導体の吸収スペクトル測定をクロロホルム溶液で行ったところ、1018nmに極大吸収を示した(吸光係数39000)。吸収スペクトルを図2に示す。このフタロシアニン誘導体は安定であり、室温大気中6ヶ月間放置しても吸収スペクトルに変化は認められなかった。
【0025】
(製造例4)
3,6−ビス(フェニルセレノ)フタロニトリルの合成
ジフェニルジセレナイド436mgの溶液にNaBH4を120mg加え、色が消えるまで約30分間室温で撹拌した。製造例1で合成した3,6−ビス(トシルオキシ)フタロニトリル468mgを加えて室温で3時間撹拌した。水を加えてクロロホルムで抽出し、有機層をブラインで洗浄した。溶媒留去して残渣をカラムクロマトグラフィーで精製し、続いてn−ヘキサンから再結晶させることにより3,6−ビス(フェニルセレノ)フタロニトリル161mgを薄黄色粉末として収率37%で得た。
【0026】
(製造例5)
オクタキス(フェニルセレノ)フタロシアニンの合成
製造例4で合成した3,6−ビス(フェニルセレノ)フタロニトリルを用いて製造例3の方法と同様にオクタキス(フェニルセレノ)フタロシアニン37mgを暗赤色板状結晶として56%の収率で得た。
【0027】
(実施例2)
[(PhSe)8PcP(OMe)2]+PF6− (式(1)においてR1=メチル、X=セレン、R2=フェニル、Y=PF6−)の合成
実施例1と同様に製造例5で合成したオクタキス(フェニルセレノ)フタロシアニンを用いて、[(PhSe)8PcP(OMe)2]+PF6− 1.1mgを暗青緑色粉末として収率16%で得た。このフタロシアニン誘導体の吸収スペクトルをクロロホルム中測定したところ、1033nmに極大吸収を示した(吸光係数39000)。吸収スペクトルを図3に示す。このフタロシアニン誘導体は安定であり、室温大気中6ヶ月間放置しても吸収スペクトルに変化は認められなかった。
【産業上の利用可能性】
【0028】
本発明のフタロシアニンは光電変換素子の光吸収層として利用可能である。
【符号の説明】
【0029】
1 反射電極
2 n型半導体
3 フタロシアニン(p型半導体)
4 透明電極
5 ガラス
【技術分野】
【0001】
本発明は1000nm以上の近赤外〜赤外領域に極大吸収を有するフタロシアニン誘導体に関する。
【背景技術】
【0002】
近赤外〜赤外領域の光を吸収する有機色素は、有機薄膜太陽電池、色素増感太陽電池、がん治療などに利用される光応答型発熱材料、赤外線センサー、赤外線イメージング素子、遮熱フィルムなど広範な分野に応用されている。中でも太陽電池は近年大きな注目を浴びているデバイスであり、有機系太陽電池は塗布や印刷プロセスで安価に製造可能であり、またフレキシブル化による形状自由度を付与できるなどのメリットがある。しかしこのように長波長の光を吸収するためには、有機色素のHOMO−LUMOのエネルギーギャップが小さい必要があるが、HOMOの準位が高くなると容易に空気酸化されてしまうため、大気中での安定性が悪くなってしまう。フタロシアニン誘導体はこのような有機色素の中でも特に安定性に優れるが、極大吸収は650〜700nmにあるものがほとんどで、800nm以上の領域に吸収を有し、かつ大気中で安定な誘導体は知られていない(非特許文献1、非特許文献2)。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】T.Fukudaら、Handbook of Porphyrin Science、 World Scientific社、2010年、9巻、1ページ
【非特許文献2】T.Nyokong、Struc.Bonding、2010年、135巻、45ページ
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明が解決しようとする課題は、大気中で安定な、1000nm以上の近赤外〜赤外領域に極大吸収を有するフタロシアニン誘導体を提供することである。
【課題を解決するための手段】
【0005】
上記課題を解決するための手段として、我々は中心配位元素として15族元素を有し、ベンゼン環のα位炭素に16族元素が結合しているフタロシアニンを発明した。中心配位元素としての15族元素はリンであることが好ましく、ベンゼン環のα位炭素に結合している16族元素は硫黄またはセレンであることが好ましい。
【0006】
本発明のフタロシアニンは極大吸収を1000〜2000nmの領域に有する。
より好適には本発明のフタロシアニンは式(1)
【0007】
【化1】

【0008】
(式中、R1Oは炭素数1〜20のアルコキシ基、Xは硫黄またはセレン、R2は炭素数1〜20の1価のアルキル基またはアリール基、Yは1価のアニオン)で示される構造を有する。
【0009】
本発明のフタロシアニンは、光電変換素子の光吸収層として用いられる。さらに本発明のフタロシアニンは樹脂中に分散させて赤外線吸収フィルム、赤外線吸収塗料、赤外線吸収接着剤などとして使用することが可能である。
【発明の効果】
【0010】
本発明のフタロシアニンは1000nm以上の近赤外〜赤外領域に極大吸収を有するため、光電変換素子の光吸収層として利用することにより赤外光に対応する太陽電池を作製することができる。また本発明のフタロシアニンは大気中、室温で長期間安定であるため、上記光電変換素子の寿命が長い。また本発明のフタロシアニンは樹脂中に分散させて赤外線吸収フィルム、赤外線吸収塗料、赤外線吸収接着剤などとして使用することが可能である。
【図面の簡単な説明】
【0011】
【図1】本発明のフタロシアニンを光吸収層であるp型半導体として適用した有機太陽電池の構造図(断面)である。
【図2】実施例1に記載の[(PhS)8PcP(OMe)2]+PF6−の吸収スペクトルである。
【図3】実施例2に記載の [(PhSe)8PcP(OMe)2]+PF6−の吸収スペクトルである。
【発明を実施するための形態】
【0012】
本発明のフタロシアニンは、中心配位元素として15族元素を有し、ベンゼン環のα位炭素に16族元素が結合した構造を有する。ピロール環の窒素原子はLUMOの係数が大きく、したがってこの窒素原子が配位する中心元素として電気陰性度が大きいものを用いることにより、フタロシアニンのLUMOレベルを下げる効果がある。15族元素は電気陰性度が大きいため、この目的に適している。LUMOレベルが下がるとHOMOとのエネルギー準位の差が小さくなるため、吸収波長は長波長シフトする。このような15族元素としては汎用性の点でリン、ヒ素、アンチモン、ビスマスが好ましく、安全性の点でリン、アンチモン、ビスマスがより好ましく、酸化価数が大きい点でリンが最も好ましい。
【0013】
フタロシアニンのベンゼン環のα位炭素はHOMOの係数が大きい。したがってここに電子供与性の置換基をつけることによりHOMOのレベルを上げることができ、これによってLUMOとのエネルギー準位の差を小さくすることが可能となる。このような置換基として16族元素を直接結合させることが効果的である。このような16族元素としては汎用性の点で硫黄、セレン、およびテルルが好ましく、合成の容易さの点で硫黄およびセレンがより好ましい。
【0014】
中心配位元素としてリンを用い、ベンゼン環のα位炭素に硫黄またはセレンを結合させることにより、フタロシアニンの極大吸収を1000〜2000nmの領域にシフトさせることが可能となる。
【0015】
本発明のフタロシアニンの構造としては、以下の式(1)に示すものが合成の容易さの点で好ましい。
【0016】
【化2】

【0017】
ただし式中、R1Oは炭素数1〜20のアルコキシ基、Xは硫黄またはセレン、R2は炭素数1〜20の1価のアルキル基またはアリール基、Yは1価のアニオンを示す。R1Oで表現されるアルコキシ基としては特に限定されないが、入手性および合成の容易さの点でメトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基、n−ブトキシ基、t−ブトキシ基、およびフェノキシ基が好ましく、メトキシ基およびエトキシ基がより好ましい。R2の1価のアルキル基またはアリール基としては特に限定されないが、入手性および合成の容易さの点でメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、t−ブチル基、フェニル基、p−アルキルフェニル基、p−アミノフェニル基、ナフチル基、ビフェニル基、ターフェニル基、アントリル基、フルオレニル基、フェナントリル基、インデニル基、ピレニル基が好ましく、フェニル基、p−アルキルフェニル基がより好ましく、フェニル基が最も好ましい。Yの1価のアニオンとしては特に限定されないが、合成の容易さの点でハロゲンイオン、PF6−、ClO4−、SbF6−、BF4−が好ましく、安定性の点でPF6−、SbF6−、BF4−がより好ましい。
【0018】
本発明の光電変換素子は上記フタロシアニンを光吸収層として有するものであり、その構造としては特に限定されないが、変換効率の高さからn型半導体と組み合わせて電極間に配置したpn接合構造が好ましく、フタロシアニンとn型半導体が互いに混ざり合ったバルクヘテロ構造がより好ましい。n型半導体としては特に限定されないが、変換効率の高さの点でフラーレン誘導体が好ましい。pn接合型光電変換素子の構造を図1に示す。
【0019】
本発明のフタロシアニンは樹脂中に分散させて赤外線吸収フィルム、赤外線吸収塗料、赤外線吸収接着剤などとして使用することが可能である。樹脂へ分散させる方法としては特に限定されず、溶媒を用いて混合する方法、溶融混錬する方法、フタロシアニン存在下に樹脂を重合する方法などを適用可能である。品質安定性の点で溶媒を用いて混合する方法が好ましい。使用する樹脂としては特に限定されず、アクリル樹脂、ポリカーボネート樹脂、オレフィン樹脂、ポリスチレン系樹脂、ポリエステル樹脂、ポリアミド樹脂、シリコーン樹脂、熱可塑性エラストマー、ブチルゴム、ニトリルゴム、シリコーンゴムなどに適用可能であり、光学特性に優れる点でアクリル樹脂、ポリカーボネート樹脂、オレフィン樹脂、ポリエステル樹脂、シリコーン樹脂、熱可塑性エラストマー、シリコーンゴムが好ましい。
【実施例】
【0020】
以下に本発明の実施例を記載する。
【0021】
(製造例1)
3,6−ビス(トシルオキシ)フタロニトリルの合成
2、3−ジシアノヒドロキノン1g、炭酸カリウム3.5g、トシルクロライド2.6g、アセトン8mLをフラスコに入れ、2時間リフラックスさせた。反応混合物を水に注いで1時間撹拌し、固形物をろ過して水で洗浄後、真空中60℃で乾燥させることにより3,6−ビス(トシルオキシ)フタロニトリル2.6gを薄褐色粉末として収率92%で得た。
【0022】
(製造例2)
3,6−ビス(フェニルチオ)フタロニトリルの合成
製造例1で合成した3,6−ビス(トシルオキシ)フタロニトリル234mgと炭酸カリウム280mgをチオフェノール440mg/DMSO溶液に入れ、室温で14時間撹拌した後水を加えてクエンチした。クロロホルムで抽出した後5%炭酸ナトリウム水溶液で洗浄し、硫酸マグネシウムで乾燥してから溶媒留去した。生成物をカラムクロマトグラフィーで精製後、メタノールから再結晶させることにより3,6−ビス(フェニルチオ)フタロニトリル113mgを薄黄色粉末として収率66%で得た。
【0023】
(製造例3)
オクタキス(フェニルチオ)フタロシアニンの合成
製造例2で合成した3,6−ビス(フェニルチオ)フタロニトリル103mgを、リチウム14mgをブタノール1mLに溶解させた溶液に入れ、2時間リフラックスさせた。生成物をカラムクロマトグラフィーで精製することにより、オクタキス(フェニルチオ)フタロシアニン77mgを暗赤色粉末として収率74%で得た。
【0024】
(実施例1)
[(PhS)8PcP(OMe)2]+PF6− (式(1)においてR1=メチル、X=硫黄、R2=フェニル、Y=PF6−)の合成
製造例3で合成したオクタキス(フェニルチオ)フタロシアニン8.3mgをピリジン2mLに溶解し、POBr3を150mg加えて1.5時間リフラックスさせた。溶媒留去してから残渣をジクロロメタンとメタノールの1:1(体積)混合溶媒に溶解させ室温で30分間撹拌した。有機層を水で洗浄した後溶媒留去し、得られた固体をジクロロメタンに溶解させてKPF6を4.0mg加え、室温で12時間撹拌した。溶媒留去後ジクロロメタン/n−ヘキサンから再結晶させることにより、[(PhS)8PcP(OMe)2]+PF6−3.8mgを暗青緑色粉末として収率40%で得た。このフタロシアニン誘導体の吸収スペクトル測定をクロロホルム溶液で行ったところ、1018nmに極大吸収を示した(吸光係数39000)。吸収スペクトルを図2に示す。このフタロシアニン誘導体は安定であり、室温大気中6ヶ月間放置しても吸収スペクトルに変化は認められなかった。
【0025】
(製造例4)
3,6−ビス(フェニルセレノ)フタロニトリルの合成
ジフェニルジセレナイド436mgの溶液にNaBH4を120mg加え、色が消えるまで約30分間室温で撹拌した。製造例1で合成した3,6−ビス(トシルオキシ)フタロニトリル468mgを加えて室温で3時間撹拌した。水を加えてクロロホルムで抽出し、有機層をブラインで洗浄した。溶媒留去して残渣をカラムクロマトグラフィーで精製し、続いてn−ヘキサンから再結晶させることにより3,6−ビス(フェニルセレノ)フタロニトリル161mgを薄黄色粉末として収率37%で得た。
【0026】
(製造例5)
オクタキス(フェニルセレノ)フタロシアニンの合成
製造例4で合成した3,6−ビス(フェニルセレノ)フタロニトリルを用いて製造例3の方法と同様にオクタキス(フェニルセレノ)フタロシアニン37mgを暗赤色板状結晶として56%の収率で得た。
【0027】
(実施例2)
[(PhSe)8PcP(OMe)2]+PF6− (式(1)においてR1=メチル、X=セレン、R2=フェニル、Y=PF6−)の合成
実施例1と同様に製造例5で合成したオクタキス(フェニルセレノ)フタロシアニンを用いて、[(PhSe)8PcP(OMe)2]+PF6− 1.1mgを暗青緑色粉末として収率16%で得た。このフタロシアニン誘導体の吸収スペクトルをクロロホルム中測定したところ、1033nmに極大吸収を示した(吸光係数39000)。吸収スペクトルを図3に示す。このフタロシアニン誘導体は安定であり、室温大気中6ヶ月間放置しても吸収スペクトルに変化は認められなかった。
【産業上の利用可能性】
【0028】
本発明のフタロシアニンは光電変換素子の光吸収層として利用可能である。
【符号の説明】
【0029】
1 反射電極
2 n型半導体
3 フタロシアニン(p型半導体)
4 透明電極
5 ガラス
【特許請求の範囲】
【請求項1】
中心配位元素として15族元素を有し、ベンゼン環のα位炭素に16族元素が結合しているフタロシアニン。
【請求項2】
中心配位元素がリンである、請求項1に記載のフタロシアニン。
【請求項3】
ベンゼン環のα位炭素に結合した16族元素が硫黄またはセレンである、請求項1または2のいずれかに記載のフタロシアニン。
【請求項4】
極大吸収を1000〜2000nmの領域に有する請求項1から3のいずれかに記載のフタロシアニン。
【請求項5】
式(1)で示される構造を有する、請求項1から4のいずれかに記載のフタロシアニン。
【化3】

(式中、R1Oは炭素数1〜20のアルコキシ基、Xは硫黄またはセレン、R2は炭素数1〜20の1価のアルキル基またはアリール基、Yは1価のアニオン)
【請求項6】
請求項1から5のいずれかに記載のフタロシアニンを光吸収層として有する光電変換素子。
【請求項7】
請求項1から5のいずれかに記載のフタロシアニンを樹脂に分散させてなる赤外線吸収フィルム、赤外線吸収塗料、および赤外線吸収接着剤。
【請求項1】
中心配位元素として15族元素を有し、ベンゼン環のα位炭素に16族元素が結合しているフタロシアニン。
【請求項2】
中心配位元素がリンである、請求項1に記載のフタロシアニン。
【請求項3】
ベンゼン環のα位炭素に結合した16族元素が硫黄またはセレンである、請求項1または2のいずれかに記載のフタロシアニン。
【請求項4】
極大吸収を1000〜2000nmの領域に有する請求項1から3のいずれかに記載のフタロシアニン。
【請求項5】
式(1)で示される構造を有する、請求項1から4のいずれかに記載のフタロシアニン。
【化3】

(式中、R1Oは炭素数1〜20のアルコキシ基、Xは硫黄またはセレン、R2は炭素数1〜20の1価のアルキル基またはアリール基、Yは1価のアニオン)
【請求項6】
請求項1から5のいずれかに記載のフタロシアニンを光吸収層として有する光電変換素子。
【請求項7】
請求項1から5のいずれかに記載のフタロシアニンを樹脂に分散させてなる赤外線吸収フィルム、赤外線吸収塗料、および赤外線吸収接着剤。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−103911(P2013−103911A)
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願番号】特願2011−248875(P2011−248875)
【出願日】平成23年11月14日(2011.11.14)
【出願人】(000000941)株式会社カネカ (3,932)
【Fターム(参考)】
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願日】平成23年11月14日(2011.11.14)
【出願人】(000000941)株式会社カネカ (3,932)
【Fターム(参考)】
[ Back to top ]

