農園芸用高温ストレス耐性付与剤およびそれを用いた高温ストレス耐性付与法
【課題】本発明は、消費者および使用者に対して安全性が高く、安価な農園芸用高温ストレス耐性付与剤およびそれを用いた高温ストレス耐性付与法を提供することを課題とする。
【解決手段】植物のアミノ酸代謝を変化させる活性を有するバリン、ロイシン、α−ケトイソ吉草酸をはじめとする分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体や、チフェンスルフロンメチル、イマザピル、ビスピリバックナトリウム塩をはじめとする分岐鎖アミノ酸合成酵素阻害物質、またはグリホサートをはじめとする芳香族アミノ酸合成酵素阻害物質を植物に施用することにより、高温ストレス耐性を付与する。
【解決手段】植物のアミノ酸代謝を変化させる活性を有するバリン、ロイシン、α−ケトイソ吉草酸をはじめとする分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体や、チフェンスルフロンメチル、イマザピル、ビスピリバックナトリウム塩をはじめとする分岐鎖アミノ酸合成酵素阻害物質、またはグリホサートをはじめとする芳香族アミノ酸合成酵素阻害物質を植物に施用することにより、高温ストレス耐性を付与する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、農園芸用高温ストレス耐性付与剤、および高温ストレス耐性付与方法に関する。
【背景技術】
【0002】
植物は、自ら移動することが不可能なため、地球上の様々な刺激に応答し自身の細胞活動や形態を可塑的に変化させることで生存を図っている。地球上には環境ストレスと呼ばれる刺激が恒常的に存在し、植物はこれらの刺激に適応できるよう進化してきた。しかし近年、人間活動や気候変動に由来する重度の環境ストレスは、植物のストレス応答システムの適応範囲を超え、農業あるいは地球環境レベルで多大な損害をもたらしている。人間活動や気候変動に由来する環境ストレスには、砂漠化による乾燥・高塩濃度ストレス、オゾン層破壊による紫外光ストレスなどが挙げられるが、とりわけ、近年の温室効果ガスによる地球温暖化は、農業上重大な地球規模の環境問題となっている。例えば、1980年から2002年の世界主要穀物生産は、平均気温上昇により1年あたり50億ドルの損失が出ていると言われている(非特許文献1)。一般的に、寒冷地が温暖化すると作物収量は増加すると考えられている一方、温暖地がさらに高温になることで作物収量が大幅に減少し、栽培することすら不可能になる場合が考えられるため、地球規模のトータルでは上述のようなマイナス計算になる。さらに、温暖化は植物生育域の地球規模での二極化を招き、生態系に影響する可能性が考えられている。近年の日本の農業の場合、夏季の異常な気温上昇が大きな問題になっている。高温ストレス下では、発芽率の低下、生育抑制、雄性不稔、可食部葉の障害などが引き起こされる。施設栽培では、夜温が下がりにくく、野菜の品質低下が大きな問題になっている。このように、温暖化による高温ストレスに対して農園芸作物に耐性を付与する技術を提供することは、農業市場に革命をもたらす可能性があるだけでなく、地球環境問題や食糧問題を解決する手段に繋がると考えられる。
【0003】
植物の高温耐性には、獲得型と、基礎型の二種類が存在する。獲得型は、植物が深刻な障害を被るような重度の高温ストレスを受ける直前に、軽微な高温ストレスに曝露されることにより、一定のストレス耐性を獲得し、続く重度の高温に対し耐性を示す現象である。この場合、重度の高温条件の前に必ず軽微な高温条件が必要になるため、急激な気象変化には対応できない。一方、基礎型の高温耐性は、植物に潜在的な高温耐性が備わることで、軽微な高温条件等の前提条件を必要とせず重度の高温に対しても耐性を示す現象であり、急激な気温上昇にも対応できる。よって、基礎型高温耐性が備わった場合には、結果的に獲得型高温耐性を獲得した状態になっているとも言える。そのため、高温耐性付与技術としては、後者の基礎型高温耐性を上昇させる技術が好ましい。
【0004】
植物の高温耐性に関わるタンパク質としては、熱ショックタンパク質(Heat shock protein; Hsp)と、熱ショック転写因子(Heat shock factor; Hsf)が知られている(非特許文献2)。例えばHsp100/Clpファミリーに属する分子シャペロンは、熱変性した任意タンパク質をリフォールディングする機能や、熱分解を防ぐ機能を有する(非特許文献3)。Hsfは、熱ショック誘導性遺伝子のゲノム上流に位置する熱ショックエレメントに結合して、熱ショック誘導性遺伝子(Hspなど)の発現を誘導する機能を有する(非特許文献4)。熱ショックタンパク質遺伝子を欠損する突然変異植物では高温耐性が著しく低下することなどから、これらのタンパク質量あるいは遺伝子発現量が、高温耐性に関与すると考えられている。従って、新たな高温耐性付与技術の一例としては、このようなHspやHsfのタンパク質量あるいは遺伝子発現量を上昇させることで本質的な高温耐性を上昇させる技術が好ましい。
【0005】
高温ストレスの対処法として実用化されている技術には、散水、夜冷育苗、高冷地育苗、遮光栽培などが挙げられるが、いずれも十分な効果は得られていない。この問題を解決するために、これまで遺伝子組み換え技術による高温ストレス耐性組み換え植物の作出が試みられている一方、実用に近く簡便な技術として、作物に施用することで高温耐性を付与する資材の開発が進められている。これまで農園芸作物の高温ストレス耐性付与を目的として販売されている農薬または肥料は存在しないが、下記のような物質の評価が試みられている。例えば、天然物抽出成分としては甘草抽出成分(特許文献1)、酵母細胞壁酵素分解物(特許文献2)、化学合成物質としては糖誘導体型界面活性剤(特許文献3)、炭素原子数が4〜24のケトール脂肪酸(特許文献4)、リポイド珪酸エステル(特許文献5)、酸化還元調節物質としてはピロロキノリンキノン(特許文献6、特許文献7)、カテキン、フラボン等の抗酸化剤(特許文献8)、植物ホルモン関連物質としてはオーキシン生合成経路中間体物質(特許文献9)、サリチル酸(非特許文献5)、ジャスモン酸(非特許文献6)、ウニコナゾール(非特許文献7)、その他成分としては有機ケイ素化合物(特許文献10)、1価又は2価の金属イオン、過酸化水素/一酸化窒素誘導物質、カルモジュリンアンタゴニスト、ベタインアルデヒドデヒドロゲナーゼの発現誘導物質、及びポリアルキレングリコールからなる群(特許文献11)が報告されている。このように多くの報告がある一方で、これらの物質は現時点で実用化されておらず、記載されている効果が微弱である。また、耐性を付与する仕組みが明らかになっておらず、獲得型なのか基礎型なのかも明確でない。そのため、これらの物質が必ずしも実用レベルに耐える効果を有するとは言えない。従って、さらに有用かつ強力な高温ストレス耐性付与技術が望まれていた。
【0006】
植物の環境ストレス応答に関与する物質として、いくつかのアミノ酸が知られている。例えばプロリンは、環境ストレスに曝された際に蓄積することが知られている。これまでに、乾燥(非特許文献8)、塩(非特許文献9)、微生物(非特許文献10)などの生物・非生物ストレスでプロリンが蓄積することが分かっている。γ-アミノ酪酸は、高温ストレスにより蓄積することが分かっているが(非特許文献11)、それ自体に高温耐性付与効果は認められておらず、高温障害による何らかのシグナルで結果的に増加したものと考えられている。生体異物(Xenobiotic)アミノ酸であるβ-アミノ酪酸は、獲得型高温耐性に関与することが報告されている一方(非特許文献12)、基礎型高温耐性には関与せず、本質的な高温耐性付与剤とは言えない。さらに高価で環境中に極めて微量しか存在しない生体異物であり、人為的な処理による環境汚染が懸念される。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平11-199419
【特許文献2】特開2007-45709
【特許文献3】国際公開WO2009/028626
【特許文献4】特開2001-131006
【特許文献5】特表2002-543100
【特許文献6】特開2006-151881
【特許文献7】国際公開WO2006059782
【特許文献8】特開2009-55833
【特許文献9】特開2009-55834
【特許文献10】特開2009-57316
【特許文献11】国際公開WO2002/005624
【非特許文献】
【0008】
【非特許文献1】Lobell, D. and Field, C., Environ. Res. Lett., 2007, 014002
【非特許文献2】Kotak, S. et al., Curr. Opin. Plant Biol., 2007, 10:310-316
【非特許文献3】Huang, B. and Xu, C., J. Integr. Plant Biol., 2008, 50(10):1230-1237
【非特許文献4】Baniwal, S et al., J. Biosci., 2004, 29(4):471-487
【非特許文献5】Wang, L. et al., BMC Plant Biology 2010, 10:34
【非特許文献6】Clarke, S., et al., New Phytologist 2009, 182: 175-187
【非特許文献7】Kraus, T., et al., J. Plant Growth Regul 1991, 10:229-234
【非特許文献8】Choudhary, N.L. et al., Ind. J. Biochem. Biophys., 2005, 42: 366-370
【非特許文献9】Yoshiba, Y. et al., Plant J., 1995, 7:751-760
【非特許文献10】Fabro, G. et al., Mol. Plant-Microbe Interact., 2004, 17:343-350
【非特許文献11】Wahid, A. et al., Environ. and Exp. Bot., 2007, 61:199-223
【非特許文献12】Zimmerli, L. et al., Plant J., 2008, 53:144-156
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、消費者および使用者に対して安全性が高く、安価な農園芸用高温ストレス耐性付与剤およびそれを用いた高温ストレス耐性付与法を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者は、植物の高温ストレス耐性付与物質を探索したところ、バリン処理により、高温誘導性のクロロフィル分解、細胞死、および光合成活性低下を抑制できること、すなわち、バリンに高温ストレス耐性付与効果があることを見出した。また、本発明者は、バリン処理により高温耐性に関わる熱ショック応答遺伝子の発現が上昇することを見出した。また、本発明者は、バリンの類縁化合物にも高温ストレス耐性付与効果があることを見出した。さらに、バリンは生物のアミノ酸代謝を変動させる活性が知られていることから、アミノ酸代謝変動誘発物質の中から高温ストレス耐性付与物質を探索したところ、人間には毒性を示さない複数の除草剤成分にも、バリン同様の高温ストレス耐性付与効果があることを発見した。本発明はこれらの知見に基づいて完成されたものである。
【0011】
すなわち本発明は、以下のとおりである。
[1]
植物のアミノ酸代謝を変化させる性質を有する化合物を含有する、植物高温ストレス耐性付与剤。
[2]
前記性質が、植物のアミノ酸の生合成を阻害する性質である、前記植物高温ストレス耐性付与剤。
[3]
前記化合物が、分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体からなる群より選択される1またはそれ以上の化合物である、前記植物高温ストレス耐性付与剤。
[4]
前記化合物が、分岐鎖アミノ酸合成酵素阻害活性または芳香族アミノ酸合成酵素阻害活性を有する除草剤成分からなる群より選択される1またはそれ以上の化合物である、前記植物高温ストレス耐性付与剤。
[5]
前記化合物が、バリン、ロイシン、およびα−ケトイソ吉草酸から選択される1またはそれ以上の化合物である、前記植物高温ストレス耐性付与剤。
[6]
前記化合物が、チフェンスルフロンメチル、イマザピル、ビスピリバックナトリウム塩、およびグリホサートから選択される1またはそれ以上の化合物である、前記植物高温ストレス耐性付与剤。
[7]
前記アミノ酸がL-体である、前記植物高温ストレス耐性付与剤。
[8]
前記アミノ酸がD-体である、前記植物高温ストレス耐性付与剤。
[9]
付与される耐性の性質が、基礎型である、前記植物高温ストレス耐性付与剤。
[10]
植物が正常に生育できない高温条件において、正常な生育を促す効果を有する、前記植物高温ストレス耐性付与剤。
[11]
葉面散布または根圏施用により植物に施用される、前記植物高温ストレス耐性付与剤。[12]
前記植物高温ストレス耐性付与剤を植物に施用することを特徴とする、植物に高温耐性を付与する方法。
[13]
前記植物高温ストレス耐性付与剤を、分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体からなる群より選択される1またはそれ以上の化合物の濃度として、0.2〜200mMの施用濃度で施用する、前記方法。
[14]
前記植物高温ストレス耐性付与剤を、分岐鎖アミノ酸合成酵素阻害活性または芳香族アミノ酸合成酵素阻害活性を有する除草剤成分からなる群より選択される1またはそれ以上の化合物の濃度として、20ng/mL〜200ng/mLまたは0.01mM〜1mMの施用濃度で施用する、前記方法。
【発明の効果】
【0012】
本発明により、植物の高温ストレス耐性を効果的に増強することができる。本発明は高温による植物細胞死、光合成活性低下を効果的に抑制するほか、高温耐性関連遺伝子である熱ショック応答遺伝子の発現を誘導することにより、植物にとって本質的な、基礎型高温耐性を付与することができると考えられる。これにより、これまでの高温ストレス耐性付与技術に比べて差別化され、農園芸用作物の高温による減収や品質低下を直接的に防ぐことができるため産業上有用である。また、本発明の植物高温ストレス耐性付与剤は、特にアミノ酸や安全性に優れた除草剤成分等の化合物を有効成分とする場合には、環境および動物に対し安全性が高く、安価に製造することができる。
【0013】
生物はエナンチオマーを区別して認識する。D-アミノ酸は、L-アミノ酸と比較すると環境中での微生物による分解を受けにくいと考えられている。本発明の一態様では、D-アミノ酸を利用することで、高温ストレス耐性付与効果を安定的に持続させることができると期待される。
【図面の簡単な説明】
【0014】
【図1】高温処理による植物地上部組織のクロロフィル含量変化を示す図。「-heat」は熱処理を行わなかったサンプルを、「+heat」は熱処理を行ったサンプルを示す。
【図2】クロロフィル含量変化を指標とした種々アミノ酸処理による高温ストレス耐性付与効果を示す図。「control」は対照区を示す(以下、同じ)。
【図3】バリン処理による高温誘導性細胞死の抑制効果を示す写真。
【図4】バリン処理による高温誘導性の光合成活性低下の抑制効果を示す図。
【図5】バリン処理による高温誘導性の熱ショック応答遺伝子発現の上昇効果を示す図。
【図6】クロロフィル含量変化を指標としたバリン散布濃度と高温ストレス耐性付与効果との関係を示す図。
【図7】クロロフィル含量変化を指標としたバリン根圏施用濃度と高温ストレス耐性付与効果との関係を示す図。
【図8】クロロフィル含量変化を指標としたバリン散布時期と高温ストレス耐性付与効果との関係を示す図。
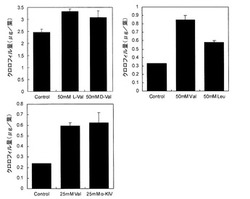
【図9】クロロフィル含量変化を指標としたバリン構造類縁化合物の高温耐性付与効果を示す図。
【図10】クロロフィル含量変化を指標としたアミノ酸代謝変動を誘発する化合物の高温耐性付与効果を示す図。
【発明を実施するための形態】
【0015】
以下、本発明を詳細に説明する。
【0016】
<本発明の高温ストレス耐性付与剤>
本発明の高温ストレス耐性付与剤は、植物のアミノ酸代謝を変化させる性質を有する化合物を含有する。本発明においては、本発明の高温ストレス耐性付与剤に含有される植物のアミノ酸代謝を変化させる性質を有する化合物を、単に「有効成分」という場合がある。また、本発明においては、植物のアミノ酸代謝を変化させる性質を有する化合物のことを「アミノ酸代謝変動を誘発する化合物」ともいう場合がある。有効成分としては、植物のアミノ酸代謝を変化させる性質を有する限り特に制限されないが、例えば、アミノ酸、アミノ酸の生合成経路および消費経路における中間体、アミノ酸の誘導体、アミノ酸のアナログ、および除草剤成分等が挙げられる。
【0017】
「植物のアミノ酸代謝を変化させる性質を有する」とは、ある化合物自体が植物のアミノ酸代謝を変化させる性質を有する場合に限られず、当該化合物が代謝されて生成する別の化合物が植物のアミノ酸代謝を変化させる性質を有する場合を含む。
【0018】
アミノ酸代謝を変化させる性質としては、アミノ酸の生合成を阻害する性質が挙げられる。
【0019】
アミノ酸の生合成を阻害する性質としては、分岐鎖アミノ酸の生合成を阻害する性質、および芳香族アミノ酸の生合成を阻害する性質が挙げられる。
【0020】
分岐鎖アミノ酸の生合成を阻害する性質としては、分岐鎖アミノ酸生合成経路の酵素(分岐鎖アミノ酸合成酵素ともいう)の活性を阻害する性質が挙げられる。芳香族アミノ酸の生合成を阻害する性質としては、芳香族アミノ酸生合成経路の酵素(芳香族アミノ酸合成酵素ともいう)の活性を阻害する性質が挙げられる。
【0021】
分岐鎖アミノ酸には、バリン、ロイシン、およびイソロイシンが含まれる。芳香族アミノ酸には、フェニルアラニン、トリプトファン、およびチロシンが含まれる。「分岐鎖アミノ酸の生合成を阻害する」とは、バリン、ロイシン、およびイソロイシンから選択される1またはそれ以上のアミノ酸の生合成を阻害することを意味し、これら全てのアミノ酸の生合成を阻害する場合を含む。「芳香族アミノ酸の生合成を阻害する」とは、フェニルアラニン、トリプトファン、およびチロシンから選択される1またはそれ以上のアミノ酸の生合成を阻害することを意味し、これら全てのアミノ酸の生合成を阻害する場合を含む。
【0022】
(物質A)
植物のアミノ酸代謝を変化させる性質を有する化合物としては、分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体(以下、これらを総称して物質Aとも言う)が挙げられる。
【0023】
植物体内における分岐鎖アミノ酸の生合成は一般的に、ピルビン酸またはスレオニン由来のケト酪酸を出発物質とし、アセト乳酸を経てバリンおよびロイシンが、アセトヒドロキシ酪酸を経てイソロイシンが合成されることが知られている。すなわち、本発明において、分岐鎖アミノ酸の生合成経路における中間体とは、ピルビン酸またはケト酪酸からバリン、ロイシン、およびイソロイシンまでの生合成経路の化合物を意味する。また、本発明において、分岐鎖アミノ酸の消費経路における中間体とは、分岐鎖アミノ酸がさらに代謝されて生成する化合物を意味する。本発明における物質Aとしては、具体的には、ピルビン酸、ケト酪酸、アセト乳酸、アセトヒドロキシ酪酸、2,3-ジヒドロキシイソ吉草酸、2,3-ジヒドロキシ-3-メチル吉草酸、α−ケトイソ吉草酸、ケトメチル吉草酸、2-イソプロピルリンゴ酸、3-イソプロピルリンゴ酸、ケトイソカプロン酸、バリン、ロイシン、及びイソロイシンからなる群より選ばれる1またはそれ以上の化合物が挙げられる。本発明における物質Aとしては、バリン、ロイシン、及びα−ケトイソ吉草酸からなる群より選ばれる1またはそれ以上の化合物が好ましい。
【0024】
分岐鎖アミノ酸はいずれも、植物のアミノ酸代謝を変化させる性質として、例えば、分岐鎖アミノ酸の共通の生合成酵素であるアセト乳酸合成酵素(Acetolactate synthase;ALS)の阻害活性を有する。なお、ALSは、アセトヒドロキシ酸合成酵素(Acetohydroxyacid synthase;AHAS)ともいい、アセト乳酸の合成とアセトヒドロキシ酸の合成の両反応を触媒する(EC 2.2.1.6)が、本願では、単にALSと記載する場合がある。
【0025】
(物質B)
分岐鎖アミノ酸の生合成を阻害する性質を有する化合物としては、分岐鎖アミノ酸合成酵素であるアセト乳酸合成酵素(Acetolactate synthase;ALS)の阻害活性を有する物質(以下、物質Bとも言う)が挙げられる。
【0026】
ALS阻害剤としては、人間には毒性を示さない、あるいは人間に対する毒性が低い化合物が好ましい。従来、除草剤として、長期残効性と共に植物選択性を有するALS阻害剤が用いられている。ALS阻害剤は、植物のALS活性を阻害することで、バリン、ロイシン、イソロイシンの生合成を阻害し、植物のアミノ酸代謝を変動させることで、植物の生育に影響を及ぼす。
【0027】
ALS阻害剤としては、例えば、スルホニルウレア系化合物(SU剤)、イミダゾリン系化合物、ピリミジニルサリチル酸系化合物およびトリアゾロピリミジンスルホンアミド系化合物等が挙げられる。
【0028】
スルホニルウレア系化合物としては、例えば、チフェンスルフロンメチル、トリフロキシスルフロンナトリウム塩、ピラゾスルフロンエチル、ベンスルフロンメチル、シノスルフロン、イマゾスルフロン、アジムスルフロン、ハロスルフロンメチル、エトキシスルフロン、シクロスルファムロン、アミドスルフロン、クロリムロンエチル、スルホメツロンメチル、オキサスルフロン、プリミスルフロン、メソスルフロンメチル、ホラムスルフロン、クロルスルフロン、メトスルフロンメチル、トリベニュロンメチル、ヨードスルフロン、イソスルフロンメチルナトリウム塩、プロスルフロン、トリアスルフロン、トリトスルフロン、エタメトスルフロンメチル、トリフルスルフロンメチル、リムスルフロン、ニコスルフロン、フルピルスルフロン、スルホスルフロン等が挙げられる。
【0029】
イミダゾリノン系化合物としては、イマザピル、イマザメタベンズ、イマザメタピル、イマゼタピル、イマザモックス、イマザキン、イマザキンアンモニウム等が挙げられる。
【0030】
ピリミジニルサリチル酸系化合物としては、ビスピリバックナトリウム塩、ピリチオバックナトリウム塩、ピリミノバックメチル、ピリフタリド、ピリベンゾキシム等が挙げられる。
【0031】
トリアゾロピリミジンスルホンアミド系化合物としては、フルメツラム、フロラスラム、メトスラム、ジクロスラム、クロランスラムメチル、ペノスクラム等が挙げられる。また類似の化合物としてDASH-001(ペノキススラム)等が挙げられるがこれらに限定されない。
【0032】
本発明における物質Bとしては、これらALS阻害剤より選ばれる1またはそれ以上の化合物を用いることができる。
【0033】
(物質C)
芳香族アミノ酸の生合成を阻害する性質を有する化合物としては、芳香族アミノ酸合成酵素である5-エノールピルビルシキミ酸-3-リン酸合成酵素(5-enolpyruvylshikimate-3-phosphate synthase;EPSPS)の阻害活性を有する物質(以下、物質Cとも言う)が挙げられる。
【0034】
EPSPS阻害剤としては、人間には毒性を示さない、あるいは人間に対する毒性が低い化合物が好ましい。従来、除草剤として、EPSPS阻害剤が用いられている。EPSPS阻害剤は、植物のEPSPS活性を阻害することで、シキミ酸経路を介するフェニルアラニン、トリプトファン、およびチロシンの生合成を阻害し、植物のアミノ酸代謝を変動させることで、植物の生育に影響を及ぼす。
【0035】
EPSPS阻害剤としては、例えばシキミ酸経路を阻害する農薬成分として知られているグリホサートが挙げられる。グリホサートは、フリー体であってもよく、塩であってもよい。グリホサートは、水溶性グリホサート塩であるのが好ましい。水溶性グリホサート塩としては、特に制限されないが、グリホサートのカリウム塩、イソプロピルアミン塩、アンモニウム塩、ナトリウム塩、およびトリメチルスルホニウム塩等が挙げられる。グリホサートは、単一の化合物であってもよく、フリー体や各種グリホサート塩から選択される複数の化合物の混合物であってもよい。
【0036】
本発明における物質Cとしては、これらEPSPS阻害剤より選ばれる1またはそれ以上の化合物を用いることができる。
【0037】
ALS阻害剤および/またはEPSPS阻害剤としては、チフェンスルフロンメチル、イマザピル、ビスピリバックナトリウム塩、およびグリホサートから選択される1またはそれ以上の化合物が好ましい。
【0038】
本発明の高温ストレス耐性付与剤に含有される植物のアミノ酸代謝を変化させる性質を有する化合物は、物質A、物質B、および物質Cのいずれかの群の化合物のみであってもよく、複数の群の化合物の組み合わせであってもよい。
【0039】
また、各有効成分は、当該有効成分を含む限りその存在形態は特に制限されず、単独の化合物であってもよく、当該有効成分を含む混合物であってもよい。例えば、有効成分がアミノ酸である場合には、一般に試薬として販売されているものであってもよく、発酵法で製造した精製品もしくは粗精製品、または精製過程で生じる副生物であってもよく、海産物からの抽出物やタンパク質の加水分解物など、当該アミノ酸を含む混合物であってもよい。また、例えば、有効成分が農薬成分である場合には、一般に試薬として販売されているものであってもよく、当該農薬成分を含む農薬等の混合物であってもよい。
【0040】
有効成分がアミノ酸である場合には、各アミノ酸は、L-体、D-体のいずれであってもよく、L-体及びD-体を任意の割合で含む混合物であってもよい。また、各アミノ酸は、フリー体でもよく、アンモニウム塩、ナトリウム塩、カリウム塩等の塩であってもよく、それらの混合物であってもよい。
【0041】
本発明の高温ストレス耐性付与剤は、本発明の効果を損なわない限り、前記のような植物のアミノ酸代謝を変化させる性質を有する化合物以外に、さらに、植物高温ストレス軽減効果を有する他の化合物を含有していてもよい。
【0042】
本発明の植物高温ストレス耐性付与剤は、本発明の効果を損なわない限り、さらに任意の成分を含んでいてもよい。このような成分としては、溶媒、担体、pH調整剤、植物体への展着力を高めるための展着剤、植物への浸透性を高めるための界面活性剤等の成分、肥効を高めるためのミネラル等の肥料成分、農薬成分、バインダー、増量剤等が挙げられる。これらの成分としては、例えば、通常農薬、肥料等に用いられている成分を用いることができる。
【0043】
本発明の植物高温ストレス耐性付与剤の剤型は液剤、粉剤、粒剤、乳剤、水和剤、油剤、エアゾール、フロアブル剤等の何れの剤型でもよく、施用の為の薬剤の形態、その使用形態、施用方法は特に限定されるものではない。
【0044】
担体成分としては、例えば、本発明の植物高温ストレス耐性付与剤が底床添加剤又は固形剤である場合には、バーミキュライト、タルク、珪藻土、カオリン、炭酸カルシウム、クレー、水酸化カルシウム、白土、シリカゲル等の無機質や小麦粉、澱粉等の固体担体を、また液剤である場合には、水、キシレン等の芳香族炭化水素類、エタノール、エチレングリコール等のアルコール類、アセトン等のケトン類、ジオキサン、テトラヒドロフラン等のエーテル類、ジメチルホルムアミド、ジメチルスルホキシド、アセトニトリル等の液体担体を用いることができる。
【0045】
また、使用に際して、固体状又は粉体状の植物高温ストレス耐性付与剤を、水、アルコール等の溶媒に溶解又は分散させてもよい。
【0046】
植物高温ストレス耐性付与剤における有効成分の含量は、高温ストレス軽減に有効な量が施用できる限り特に制限されず、当該成分が有する植物のアミノ酸代謝を変化させる性質の程度、および後述の施用量等の諸条件に応じて適宜設定することができる。
【0047】
例えば、有効成分が除草剤成分である場合には、植物高温ストレス耐性付与剤における有効成分の含量は、単一の化合物を有効成分として含有する場合には、通常20〜200ng/mL、好ましくは50〜100ng/mLである。また、複数の化合物を有効成分として含有する場合には、合計で、通常20〜200ng/mL、好ましくは50〜100ng/mLである。また、除草剤成分によっては、含量は、通常0.01mM〜1mMであってもよい。尚、前記濃度は、植物高温ストレス耐性付与剤が固形又は粉体状の場合は、使用時に溶液にしたときの濃度である。
【0048】
また、例えば、有効成分が物質Aである場合には、植物高温ストレス耐性付与剤における有効成分の含量は、単一の化合物を有効成分として含有する場合には、通常0.2〜200mM、好ましくは1〜100mMである。また、複数の化合物を有効成分として含有する場合には、合計で、通常0.2〜200mM、好ましくは1〜100mMである。尚、前記濃度は、植物高温ストレス耐性付与剤が固形又は粉体状の場合は、使用時に溶液にしたときの濃度である。
【0049】
本発明の高温ストレス耐性付与剤の対象となる植物は、特に制限されず、双子葉植物であってもよく単子葉植物であってもよい。また、樹木であってもよく、草本であってもよい。また、野生植物であってもよく、農業、園芸、又は林業用植物であってもよい。農業、園芸、又は林業用植物には、例えば作物(果菜類を含む)、穀物、観賞用植物、花卉、果樹などが含まれる。後述の実施例では、双子葉植物としてアブラナ科のシロイヌナズナ、ハクサイおよびカブ、ナス科のベンサミアナタバコ、単子葉植物としてイネ科のイネをそれぞれ選択したが、いずれの植物もバリン処理による高温ストレス耐性を示した。したがって、本発明の高温ストレス耐性付与剤は、いかなる植物にも有効に使用できる。
【0050】
本発明の高温ストレス耐性付与剤は、植物に高温ストレス耐性を付与する効果を有する。植物に高温ストレス耐性を付与することで、高温ストレスにより引き起こされる障害を軽減できる。本発明の高温ストレス耐性付与剤により付与される高温ストレス耐性の種類は、特に制限されず、基礎型高温耐性であってもよく、獲得型高温耐性であってもよい。これらの内、軽微な高温条件で耐性を誘導する過程を必要としない点で、基礎型高温耐性が好ましい。
【0051】
高温ストレスにより、例えば、HSP100やHSFA2等のストレス応答性遺伝子の発現が惹起され、また、クロロフィル(葉緑素)減少、ネクロシス(細胞死)等の障害が引き起こされる。本発明の高温ストレス耐性付与剤の高温ストレス耐性付与効果は、実施例記載の方法に従い、HSP100やHSFA2等のストレス応答性遺伝子の発現解析、クロロフィル定量、光合成活性の測定、生育の測定、または死細胞検出等を行うことで評価することが可能である。本発明の高温ストレス耐性付与剤は、種々の高温障害の全てを軽減してもよく、一部を軽減してもよい。なお、「軽減」には、これから発生する高温障害の程度を軽減すること(いわゆる予防効果)、および既に発生した高温障害の程度を軽減すること(いわゆる治療効果)が含まれる。
【0052】
高温ストレス耐性付与効果としては、例えば、高温条件において正常な生育を促す効果が挙げられる。高温条件としては、標的植物にとって高温ストレスを被る生育温度条件であれば特に制限されないが、例えば、標的植物が正常に生育できない高温条件が挙げられる。「植物が正常に生育できない高温条件」とは、植物種によって異なるが、標的植物の通常の生育温度よりも高い温度であって、当該植物を通常の生育温度で生育させた場合よりも生育が減退する温度条件であれば特に制限されない。「生育が減退する」とは、例えば、通常の生育温度で生育させた場合と比較して、植物体地上部新鮮重量が90%以下、70%以下、50%以下、あるいは20%以下に低下することをいい、全く生育が認められない場合を含む。「正常な生育を促す」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、植物体地上部新鮮重量が増大することをいう。植物体地上部新鮮重量は、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して1.2倍以上、好ましくは1.5倍以上、より好ましくは2倍以上に増大すればよい。また、「正常な生育を促す」とは、本発明の高温ストレス耐性付与剤の施用なしには全く生育が認められない場合に、本発明の高温ストレス耐性付与剤の施用により生育が認められるようになる場合を含む。植物が生育する期間の内、全期間が高温条件であってもよく、一部の期間が高温条件であってもよい。また、植物が高温条件に曝露された後、植物の生育は全期間に渡って通常の生育温度条件で行われてもよい。
【0053】
また、高温ストレス耐性付与効果としては、例えば、クロロフィルの減少を抑制する効果が挙げられる。「クロロフィルの減少を抑制する」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、高温ストレス曝露後の植物体地上部のクロロフィル含量が増大することをいう。クロロフィル含量は、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して1.2倍以上、好ましくは1.5倍以上、より好ましくは2倍以上に増大すればよい。
【0054】
また、高温ストレス耐性付与効果としては、例えば、光合成活性の低下を抑制する効果が挙げられる。「光合成活性の低下を抑制する」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、高温ストレス曝露後の光合成活性が増大することをいう。光合成活性は、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して1.2倍以上、好ましくは1.5倍以上、より好ましくは2倍以上に増大すればよい。また、「光合成活性の低下を抑制する」とは、本発明の高温ストレス耐性付与剤の施用なしには光合成活性が認められない場合に、本発明の高温ストレス耐性付与剤の施用により光合成活性が認められるようになる場合を含む。
【0055】
また、高温ストレス耐性付与効果としては、例えば、高温ストレスによる細胞死を抑制する効果が挙げられる。「細胞死を抑制する」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、高温ストレス曝露後の全細胞数に対する死細胞数の割合が低いことをいう。死細胞数の割合は、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して90%以下、好ましくは70%以下、より好ましくは50%以下に低下すればよい。
【0056】
また、高温ストレス耐性付与効果としては、例えば、HSP100やHSFA2等のストレス応答性遺伝子の発現を増強する効果が挙げられる。「遺伝子の発現を増強する」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、高温ストレス曝露後の遺伝子の発現量が増大することをいう。また、「遺伝子の発現を増強する」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、高温ストレス曝露前の遺伝子の発現量が増大することをいう場合もある。遺伝子の発現量は、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して1.2倍以上、好ましくは1.5倍以上、より好ましくは2倍以上に増大すればよい。また、「遺伝子の発現を増強する」とは、本発明の高温ストレス耐性付与剤の施用なしには発現が認められない場合に、本発明の高温ストレス耐性付与剤の施用により発現が認められるようになる場合を含む。
【0057】
<本発明の高温ストレス耐性付与方法>
本発明の高温ストレス耐性付与剤を植物に施用することにより、植物に高温ストレス耐性を付与することができる。すなわち、本発明は、本発明の植物高温ストレス耐性付与剤を植物に施用することを特徴とする、植物に高温耐性を付与する方法(本発明の高温ストレス耐性付与方法)を提供する。
【0058】
本発明の高温ストレス耐性付与方法の主な目的としては、高温障害の予防が挙げられる。よって、本発明の高温ストレス耐性付与剤は、高温条件に先駆けて施用することが好ましい。高温条件としては、標的植物にとって高温ストレスを被る生育温度条件であれば特に制限されず、自然気象における高温環境や、施設栽培時での高温環境等が挙げられる。また、高温条件の曝露後や高温障害の発生後に本発明の高温ストレス耐性付与剤を植物に施用する場合にも、高温障害の拡大を抑制する効果や、高温障害を減弱する効果は期待できる。よって、本発明の高温ストレス耐性付与剤は、高温条件の曝露後や高温障害の発生後に施用してもよい。
【0059】
本発明の高温ストレス耐性付与剤の施用の方法は特に制限されず、その剤形、施用対象の植物、畑や水田等の状態、および農業従事者の事情等に応じて適宜設定することができる。本発明の高温ストレス耐性付与剤は、植物体の一部に施用してもよく、植物体の全体に施用してもよい。例えば、植物の生長点のみならず、茎や葉をはじめとする植物体の一部又は全体に液剤や乳剤として散布、滴下あるいは塗布等することができる。また、本発明の高温ストレス耐性付与剤は、根圏に施用してもよい。根圏への施用としては、例えば土壌への表面散布、潅注、土壌への混合、又は根への浸漬処理が挙げられる。これらの中では、葉面散布か根圏施用が好ましい。
【0060】
本発明の植物高温ストレス耐性付与剤を植物に施用する時期や頻度は、施用目的や植物体の生育ステージ等に応じて適宜設定することができる。例えば、田植え前のイネに対してはイネの苗床に施用することで幼苗の高温耐性を強化できる。また、ハクサイやキャベツなど葉物野菜に対しては結球前に施用することで高温による結球不全や本葉の萎れを軽減できる。また、本発明の高温ストレス耐性付与剤は植物に施用してからの効果持続性が高いため、施用してから高温条件に曝露されるまで数日程度経過してしまった場合や、高温条件が長期間継続した場合でも、高温ストレス軽減効果は維持される。
【0061】
本発明の植物高温ストレス耐性付与剤の施用量は、有効成分の濃度、施用時期、施用回数、植物の種類、栽培密度、生育段階、施用方法等に応じて適宜設定することができる。葉面散布では、例えば、有効成分を前記含有量で含有する植物高温ストレス耐性付与剤を、通常100〜5000L/ヘクタール、好ましくは500〜1000L/ヘクタールで施用すればよい。また、植物高温ストレス耐性付与剤を根圏に施用する場合も、葉面散布の場合と同様に施用量を設定すればよい。また、有効成分である植物のアミノ酸代謝を変化させる性質を有する化合物と、それ以外の植物高温ストレス軽減効果を有する化合物を、同時に施用してもよく、別個に施用してもよい。
【実施例】
【0062】
以下、実施例をもって本発明をさらに具体的に説明するが、本発明はこれら実施例に限定されるものではない。
【0063】
〔実施例1〕クロロフィル含量変化を指標としたアミノ酸による高温ストレス耐性付与効果の評価
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptimized(Opt)MS無機塩類(下記)に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には12日間無菌栽培した植物を用いた。
<OptMS無機塩類の組成>
2.5mM NH4NO3
2.5mM KH2PO4/K2HPO4 (pH5.7)
2mM KCl
2mM KNO3
3mM Ca(NO3)2
2mM MgSO4
0.1mM Fe(III)-EDTA
0.1mM MnCl2
0.1mM H3BO3
30μM ZnSO4
0.5μM CuSO4
1μM NaMoO4
0.1μM CoCl2
10μM NaCl
【0064】
(2)アミノ酸散布および高温処理
アミノ酸エナンチオマーの表記として、以降L-またはD-の表記のない場合は、全てL-アミノ酸を指す。アミノ酸散布は、各アミノ酸(Nacalai tesque)の50mM水溶液を調製し、展着剤としてアプローチBI(花王(株)、「アプローチBI」は同社の登録商標である。)を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。対照区には水にアプローチBIを添加したものを散布した。その後23℃で24時間栽培した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にアミノ酸散布したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。また、別途、上記の噴霧処理を施さずに高温処理を行った植物体、および噴霧処理も高温処理も行っていない植物体を準備した。
【0065】
(3)葉組織のクロロフィル含量定量
クロロフィル定量はPorra, R., et al., Biochimica et Biophysica Acta, 1989, 975:384-394に記載されている方法により行った。高温処理2日後、シロイヌナズナの第5、6葉を1サンプルあたり5個体分回収してサンプリングチューブへ入れた後、直ちに液体窒素を用いて凍結させ-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER (Retsch)により破砕し、50μLの水に懸濁した。これに200μLのアセトンを加えて攪拌し、10,000rpm 5分間の遠心分離後の上清を、水で5倍に希釈した。希釈液200μLを96ウェルプレートに入れ、プレートリーダーSpectraMax M2 (Molecular Devices)を用いて647nm(クロロフィルaの吸収波長)および664nm(クロロフィルbの吸収波長)の吸光度を測定し、クロロフィル含量を算出した。
【0066】
(4)結果
噴霧処理を施さずに高温処理を行った植物体(+heat)、および噴霧処理も高温処理も行っていない植物体(-heat)について、クロロフィル含量を定量した結果を図1に示す。図1には、それぞれ3サンプルの実験の平均値と標準偏差(SD)を示した。本高温処理により、シロイヌナズナ第5、6葉のクロロフィル含量が著しく低下(分解)していることが明らかとなった。これは明確な高温障害であり、クロロフィル含量を指標として高温障害の程度を定量化できる。
【0067】
各種アミノ酸溶液を散布した後高温処理してクロロフィル含量を定量した結果を図2に示す。図2には、それぞれ3サンプルの実験の平均値とSDを示した。バリン処理により、高温処理によるクロロフィル低下(分解)、すなわち高温障害を抑制できることが示された。バリン処理区では、対照区と比較して、高温処理後のクロロフィル含量がおよそ2倍のレベルで維持されていた。このような劇的な効果を有するストレス耐性付与剤はこれまでに知られていない。
【0068】
〔実施例2〕バリン処理による高温誘導性細胞死の抑制効果
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には12日間無菌栽培した植物を用いた。
【0069】
(2)バリン散布および高温処理
バリン散布は、バリン(Nacalai tesque)の25mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理した。対照区には水にアプローチBIを添加したものを散布することで行った。その後23℃で24時間栽培した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン散布したシャーレを80分間静置することで高温処理とした。その後再び23℃で栽培した。
【0070】
(3)トリパンブルー染色による死細胞検出
高温処理して2日後、シロイヌナズナ個体を24ウェルプレートに置き、トリパンブルー染色液(10 w/v %フェノール、10 v/v %グリセロール、10 v/v %乳酸、30 v/v %エタノール、0.07 w/v %トリパンブルー)を添加して植物体の死細胞を染色した。染色15分後に染色液を廃棄し、抱水クロラール透明化液(2.5g/mL抱水クロラール;和光純薬株式会社)に置換して、一晩静置することにより植物組織を透明化した。この過程でトリパンブルー染色は残存する。透明化した植物体をスライドグラスに載せ、抱水クロラール透明化液を一滴垂らしてカバーガラスで封入したのち、実体顕微鏡(SZX7;オリンパス株式会社)で観察し、デジタルカメラ(Digital Sight DS-2Mv;ニコン株式会社)で撮影した。
【0071】
(4)結果
バリンまたは水を散布しそれぞれ高温処理した後、トリパンブルー染色した植物体写真を図3に示す。各処理区それぞれ6個体を観察し、図3にはそれらのうち典型的なサンプル像を示す。図3下段の写真は上段の写真の一部を拡大したものである。バリン散布区ではトリパンブルー染色が対照区に比べて弱く、死細胞数の減少が確認された。従って、バリン処理により、高温誘導性の細胞死を抑制できることが示された。このような高温誘導性細胞死抑制剤はこれまでに知られていない。
【0072】
〔実施例3〕バリン処理による高温誘導性の光合成活性低下の抑制効果
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には12日間無菌栽培した植物を用いた。
【0073】
(2)バリン散布および高温処理
バリン散布は、バリンの25mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。対照区には水にアプローチBIを添加したものを散布した。その後23°Cで24時間栽培した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン散布したシャーレを30分間または40分間静置することで高温処理とした。その後23℃で6時間栽培した。
【0074】
(3)光合成活性測定
光合成活性測定には、光合成活性測定装置LI-COR LI-6400(Leica)を用いた。高温処理後のシャーレを、CO2循環中のチャンバー内へ設置し、光合成を促進するため上部から照明を点灯した。一定時間後の循環CO2減少量を植物体によるCO2固定量とみなして測定し、30分間高温処理した対照区におけるCO2固定量を1として相対的な光合成活性を測定した。
【0075】
(4)結果
バリンまたは水を散布しそれぞれ高温処理した後、相対的光合成活性を測定した結果を図4に示す。図4には、それぞれ3サンプルの実験の平均値とSDを示した。N.D.は測定値が検出限界以下であったことを示す。高温処理30分間では、対照区およびバリン処理区ともに一定の光合成活性が認められた。高温処理40分間では、対照区では光合成活性が顕著に低下して検出限界を下回ったのに対し、バリン処理区では光合成活性が維持されていた。
このことから、バリン処理により、高温ストレスによる光合成活性低下を抑制できることが示された。このような高温誘導性の光合成活性低下抑制剤はこれまでに知られていない。
【0076】
〔実施例4〕バリン処理による高温誘導性の熱ショック応答遺伝子の発現量上昇効果
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には12日間無菌栽培した植物を用いた。
【0077】
(2)バリン散布および高温処理
バリン散布は、バリンの25mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。対照区には水にアプローチBIを添加したものを散布した。その後23℃で24時間栽培した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン処理したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。
【0078】
(3)RNA抽出と定量RT-PCR
熱ショック応答遺伝子の転写量を定量するため、高温処理後に23℃で1時間栽培したシロイヌナズナの地上部を回収後、直ちに液体窒素で凍結し、-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER(Retsch)により破砕した。EZ1 RNA Tissue
Mini Kit(QIAGEN)および自動抽出装置Magtration System 12GC(QIAGEN)を用いてRNA抽出を行った後、リアルタイムPCR装置(7500 Real Time PCR System;Applied Biosystems)を用い、定量的RT-PCRによりHSP100遺伝子(At2g25140)およびHSFA2遺伝子(At2g26150)の発現量の比較を行った。両遺伝子は共に植物の高温耐性に寄与することが既に報告されている(Kotak, S. et al., Curr. Opin. Plant Biol., 2007, 10:310-316)。両遺伝子の発現量は、内部標準として用いたハウスキーピング遺伝子ACTIN2(At3g18780)の発現量に対する相対値として算出した。各遺伝子の増幅に用いたプライマー配列は、表2に示すとおりである。これらの塩基配列を配列番号1〜6に示す。
【0079】
【表1】

【0080】
(4)結果
バリンまたは水を散布しそれぞれ高温処理した後の植物体から抽出したRNAを用いて熱ショック応答遺伝子の発現量を定量した結果を図5に示す。図5には、それぞれ3サンプルの実験の平均値とSDを示した。バリン処理区において、高温処理後のHsp100およびHsfA2遺伝子発現が、対照区に比べ顕著に増加していた。さらにHsp100については、バリン処理24時間後、すなわち高温処理直前の時点でも、対照区に比べ発現量が増加していた。これらのことから、バリンは高温誘導性の熱ショック応答遺伝子の発現量を上昇させる効果があることが示された。本高温耐性付与効果の仕組みの一部は、これらの遺伝子発現促進によるものと考えられる。
【0081】
〔実施例5〕クロロフィル含量変化を指標としたバリン有効濃度の検討
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には12日間無菌栽培した植物を用いた。
【0082】
(2)バリン施用および高温処理
バリンの施用方法として、植物体地上部へのバリン散布と、バリンの根圏施用を検討した。バリン散布は、バリンの0mM〜50mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。その後23℃で24時間栽培した。バリンの根圏施用は、バリンを0mM〜50mM、OptMS無機塩類、1% sucrose、0.5% ゲランガムを加えて固めたバリン含有ゲランガム培地に、植物体を移植することにより行った。植物体は、地上部が培地に触れないように地下部をゲランガム培地内に埋め込んで移植した。その後23℃で24時間栽培した。バリン散布およびバリン根圏施用のそれぞれについて、バリン濃度0mMの場合を対照区とした。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン処理したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。
【0083】
(3)葉組織のクロロフィル含量定量
クロロフィル定量はPorra, R., et al., Biochimica et Biophysica Acta, 1989, 975:384-394に記載されている方法により行った。高温処理2日後、シロイヌナズナの第5、6葉を1サンプルあたり5個体分回収してサンプリングチューブへ入れた後、直ちに液体窒素を用いて凍結させ-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER (Retsch)により破砕し、50μLの水に懸濁した。これに200μLのアセトンを加えて攪拌し、10,000rpm 5分間の遠心分離後の上清を、水で5倍に希釈した。希釈液200μLを96ウェルプレートに入れ、プレートリーダーSpectraMax M2 (Molecular Devices)を用いて647nm(クロロフィルaの吸収波長)および664nm(クロロフィルbの吸収波長)の吸光度を測定し、クロロフィル含量を算出した。
【0084】
(4)結果
各濃度のバリンを散布してそれぞれ高温処理し、クロロフィル含量を定量した結果を図6に示す。図6には、それぞれ3サンプルの実験の平均値とSDを示した。5mM〜50mMバリン散布により顕著なクロロフィル分解抑制効果が認められ、濃度依存的に、高温処理によるクロロフィル分解、すなわち高温障害を抑制できることが示された。
【0085】
各濃度のバリン含有培地を用いてバリンを根圏施用し、高温処理してクロロフィル含量を定量した結果を図7に示す。図7には、それぞれ3サンプルの実験の平均値とSDを示した。1mM〜50mMバリン根圏施用により顕著なクロロフィル分解抑制効果が認められ、濃度依存的に、高温処理によるクロロフィル分解、すなわち高温障害を抑制できることが示された。
【0086】
高温ストレスに対しバリンを施用する場合には、5mM程度の濃度で施用すれば、高温耐性を付与することができることが示された。
【0087】
〔実施例6〕クロロフィル含量変化を指標としたバリン有効散布時期の検討
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には11日間無菌栽培した植物を用いた。
【0088】
(2)バリン散布および高温処理
バリン散布は、バリンの25mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。対照区には水にアプローチBIを添加したものを散布した。その後23°Cで24、48、72時間栽培し、それぞれ高温処理に供した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン散布したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。
【0089】
(3)葉組織のクロロフィル含量定量
クロロフィル定量はPorra, R., et al., Biochimica et Biophysica Acta, 1989, 975:384-394に記載されている方法により行った。高温処理2日後、シロイヌナズナの第5、6葉を1サンプルあたり5個体分回収してサンプリングチューブへ入れた後、直ちに液体窒素を用いて凍結させ-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER (Retsch)により破砕し、50μLの水に懸濁した。これに200μLのアセトンを加えて攪拌し、10,000rpm 5分間の遠心分離後の上清を、水で5倍に希釈した。希釈液200μLを96ウェルプレートに入れ、プレートリーダーSpectraMax M2 (Molecular Devices)を用いて647nm(クロロフィルaの吸収波長)および664nm(クロロフィルbの吸収波長)の吸光度を測定し、クロロフィル含量を算出した。
【0090】
(4)結果
バリンを散布して所定の時間栽培して高温処理した上で、クロロフィル含量を定量した結果を図8に示す。図8には、それぞれ3サンプルの実験の平均値とSDを示した。高温処理の24、48、72時間前のいずれの時期にバリンを施用した場合にも顕著なクロロフィル分解抑制効果が認められた。すなわち、バリン散布は、高温処理の72時間前に行っても効果が持続し、高温耐性付与効果が認められた。一方、高温処理24時間前に行っても効果が早期に表れ、高温耐性付与効果が認められた。このことから、バリンによる高温耐性付与効果は、迅速かつ持続的であることが示された。
【0091】
〔実施例7〕各種作物におけるバリンの高温耐性付与効果
(1)植物体の栽培方法
植物材料としてハクサイ(品種「黄味小町」)、カブ(品種「CRもちばな」)、ベンサミアナタバコ(Nicotiana Benthamiana)、イネ(品種「日本晴」)を園芸用培養土(パワーソイル; 呉羽化学工業株式会社)に播種後2週間栽培した植物を用いた。ハクサイ、カブ、ベンサミアナタバコは、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。イネは、日周は16時間明期で光強度は約130μmol m-2 s-1、28℃で栽培した。
【0092】
(2)バリン施用および高温処理
バリンの施用は、ハクサイ、カブ、ベンサミアナタバコには植物体地上部へのバリン散布により、イネにはバリンの根圏施用により行った。ハクサイ、カブ、ベンサミアナタバコに対するバリン散布は、バリンの25mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。対照区には水にアプローチBIを添加したものを散布した。イネに対するバリン根圏施用は、25mMに調製したバリン水溶液にイネ栽培ポットを浸漬し、ポット底面からバリン水溶液を吸収させることで、根圏施用とした。その後各通常栽培温度で48時間栽培し、続いてそれぞれ高温処理に供した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、高温条件設定した器内にバリン処理した植物体を静置することで高温処理とした。作物によって高温に対する感受性が異なるため、ハクサイ、カブに対しては45℃ 80分間、ベンサミアナタバコに対しては45℃ 4時間、イネに対しては47℃ 4時間の処理を行い、高温処理とした。その後再び各通常栽培温度で栽培した。
【0093】
(3)バリンの高温耐性付与効果の評価
各作物におけるバリン施用の効果は、高温処理後の作物を2日間栽培し、地上部新鮮重量を測定して、対照区とバリン処理区との重量比を、対照区の重量平均値を100%として算出し比較を行うことで評価した。
【0094】
(4)結果
各作物にバリンを施用して高温処理した上で、新鮮重量を相対的に算出した結果を表2に示す。表2には、それぞれ最低4個体の重量平均値とSDを示した。表3に示すとおり、どの作物種においてもバリン処理区での地上部新鮮重量比が100%以上となり、対照区に比べて高温障害による重量低下の抑制が認められた。このことより、バリンによる高温耐性付与効果が、植物種を問わず普遍的な現象であることが明らかとなった。
【0095】
【表2】

【0096】
〔実施例8〕バリン構造類縁化合物の高温耐性付与効果
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には11日間無菌栽培した植物を用いた。
【0097】
(2)バリン構造類縁化合物散布および高温処理
バリン構造類縁化合物としては、L-バリンのエナンチオマーであるD-バリン(Nacalai tesque)、バリンと同じく分岐鎖アミノ酸であるロイシン(Nacalai tesque)、およびバリン生合成の前駆体であるα−ケトイソ吉草酸(α-KIV;SIGMA)を用いた。各化合物の25mMまたは50mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理した。対照区には水にアプローチBIを添加したものを散布した。その後23℃で24時間栽培し、それぞれ高温処理に供した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン散布したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。
【0098】
(3)葉組織のクロロフィル含量定量
クロロフィル定量はPorra, R., et al., Biochimica et Biophysica Acta, 1989, 975:384-394に記載されている方法により行った。高温処理2日後、シロイヌナズナの第5、6葉を1サンプルあたり5個体分回収してサンプリングチューブへ入れた後、直ちに液体窒素を用いて凍結させ-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER (Retsch)により破砕し、50μLの水に懸濁した。これに200μLのアセトンを加えて攪拌し、10,000rpm 5分間の遠心分離後の上清を、水で5倍に希釈した。希釈液200μLを96ウェルプレートに入れ、プレートリーダーSpectraMax M2 (Molecular Devices)を用いて647nm(クロロフィルaの吸収波長)および664nm(クロロフィルbの吸収波長)の吸光度を測定し、クロロフィル含量を算出した。
【0099】
(4)結果
各バリン構造類縁化合物を散布して高温処理した上で、クロロフィル含量を定量した結果を図9に示す。図9には、それぞれ3サンプルの実験の平均値とSDを示した。D-バリンおよびロイシンは、L-バリンに及ばないが中程度のクロロフィル分解抑制効果を示し、α-KIVはL-バリンと同等のクロロフィル分解抑制効果を示した。このようにバリンの構造類似化合物やバリンの生合成経路における中間体は、L-バリンと同様に高温耐性付与効果を有することが明らかとなった。
【0100】
〔実施例9〕アミノ酸代謝変動を誘発する化合物の高温耐性付与効果
バリンは生物のアミノ酸代謝を変動させる性質を有していることから、本実施例では、種々のアミノ酸代謝変動誘発物質について高温耐性付与効果の評価を行った。
【0101】
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には11日間無菌栽培した植物を用いた。
【0102】
(2)アミノ酸代謝変動を誘発する化合物散布および高温処理
アミノ酸代謝変動誘発物質としては、除草剤成分として知られるチフェンスルフロンメチル(TSM)、イマザピル(IMZ;和光純薬株式会社)、ビスピリバックナトリウム塩(BisP;和光純薬株式会社)、およびグリホサートを用いた。本実施例では、チフェンスルフロンメチルとしては、チフェンスルフロンメチルを有効成分として含有するハーモニー水和剤(丸和バイオケミカル株式会社)を用いた。また、グリホサートとしては、グリホサートイソプロピルアミン塩を有効成分として含有するラウンドアップ(日産化学工業株式会社;「ラウンドアップ」は同社の登録商標である。)を用いた。散布は、化合物のそれぞれ50ng/mL(TSM)、100ng/mL(IMZ)、100ng/mL(BisP)、10μM(グリホサート)の水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。上記濃度は、一般的に農業における除草目的で使用される濃度よりも相当低濃度である。対照区には水にアプローチBIを添加したものを散布した。その後23℃で24時間栽培し、それぞれ高温処理に供した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン散布したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。
【0103】
(3)葉組織のクロロフィル含量定量
クロロフィル定量はPorra, R., et al., Biochimica et Biophysica Acta, 1989, 975:384-394に記載されている方法により行った。高温処理2日後、シロイヌナズナの第5、6葉を1サンプルあたり5個体分回収してサンプリングチューブへ入れた後、直ちに液体窒素を用いて凍結させ-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER (Retsch)により破砕し、50μLの水に懸濁した。これに200μLのアセトンを加えて攪拌し、10,000rpm 5分間の遠心分離後の上清を、水で5倍に希釈した。希釈液200μLを96ウェルプレートに入れ、プレートリーダーSpectraMax M2 (Molecular Devices)を用いて647nm(クロロフィルaの吸収波長)および664nm(クロロフィルbの吸収波長)の吸光度を測定し、クロロフィル含量を算出した。
【0104】
(4)結果
各アミノ酸代謝変動誘発物質(除草剤成分)を散布してそれぞれ高温処理し、クロロフィル含量を定量した結果を図10に示す。図10には、それぞれ3サンプルの実験の平均値とSDを示した。いずれの化合物も、バリンと同等のクロロフィル分解抑制効果を示した。このように除草剤成分に代表される、植物のアミノ酸代謝変動誘発物質は、バリンと同様の高温耐性付与効果を有することが明らかとなった。
【技術分野】
【0001】
本発明は、農園芸用高温ストレス耐性付与剤、および高温ストレス耐性付与方法に関する。
【背景技術】
【0002】
植物は、自ら移動することが不可能なため、地球上の様々な刺激に応答し自身の細胞活動や形態を可塑的に変化させることで生存を図っている。地球上には環境ストレスと呼ばれる刺激が恒常的に存在し、植物はこれらの刺激に適応できるよう進化してきた。しかし近年、人間活動や気候変動に由来する重度の環境ストレスは、植物のストレス応答システムの適応範囲を超え、農業あるいは地球環境レベルで多大な損害をもたらしている。人間活動や気候変動に由来する環境ストレスには、砂漠化による乾燥・高塩濃度ストレス、オゾン層破壊による紫外光ストレスなどが挙げられるが、とりわけ、近年の温室効果ガスによる地球温暖化は、農業上重大な地球規模の環境問題となっている。例えば、1980年から2002年の世界主要穀物生産は、平均気温上昇により1年あたり50億ドルの損失が出ていると言われている(非特許文献1)。一般的に、寒冷地が温暖化すると作物収量は増加すると考えられている一方、温暖地がさらに高温になることで作物収量が大幅に減少し、栽培することすら不可能になる場合が考えられるため、地球規模のトータルでは上述のようなマイナス計算になる。さらに、温暖化は植物生育域の地球規模での二極化を招き、生態系に影響する可能性が考えられている。近年の日本の農業の場合、夏季の異常な気温上昇が大きな問題になっている。高温ストレス下では、発芽率の低下、生育抑制、雄性不稔、可食部葉の障害などが引き起こされる。施設栽培では、夜温が下がりにくく、野菜の品質低下が大きな問題になっている。このように、温暖化による高温ストレスに対して農園芸作物に耐性を付与する技術を提供することは、農業市場に革命をもたらす可能性があるだけでなく、地球環境問題や食糧問題を解決する手段に繋がると考えられる。
【0003】
植物の高温耐性には、獲得型と、基礎型の二種類が存在する。獲得型は、植物が深刻な障害を被るような重度の高温ストレスを受ける直前に、軽微な高温ストレスに曝露されることにより、一定のストレス耐性を獲得し、続く重度の高温に対し耐性を示す現象である。この場合、重度の高温条件の前に必ず軽微な高温条件が必要になるため、急激な気象変化には対応できない。一方、基礎型の高温耐性は、植物に潜在的な高温耐性が備わることで、軽微な高温条件等の前提条件を必要とせず重度の高温に対しても耐性を示す現象であり、急激な気温上昇にも対応できる。よって、基礎型高温耐性が備わった場合には、結果的に獲得型高温耐性を獲得した状態になっているとも言える。そのため、高温耐性付与技術としては、後者の基礎型高温耐性を上昇させる技術が好ましい。
【0004】
植物の高温耐性に関わるタンパク質としては、熱ショックタンパク質(Heat shock protein; Hsp)と、熱ショック転写因子(Heat shock factor; Hsf)が知られている(非特許文献2)。例えばHsp100/Clpファミリーに属する分子シャペロンは、熱変性した任意タンパク質をリフォールディングする機能や、熱分解を防ぐ機能を有する(非特許文献3)。Hsfは、熱ショック誘導性遺伝子のゲノム上流に位置する熱ショックエレメントに結合して、熱ショック誘導性遺伝子(Hspなど)の発現を誘導する機能を有する(非特許文献4)。熱ショックタンパク質遺伝子を欠損する突然変異植物では高温耐性が著しく低下することなどから、これらのタンパク質量あるいは遺伝子発現量が、高温耐性に関与すると考えられている。従って、新たな高温耐性付与技術の一例としては、このようなHspやHsfのタンパク質量あるいは遺伝子発現量を上昇させることで本質的な高温耐性を上昇させる技術が好ましい。
【0005】
高温ストレスの対処法として実用化されている技術には、散水、夜冷育苗、高冷地育苗、遮光栽培などが挙げられるが、いずれも十分な効果は得られていない。この問題を解決するために、これまで遺伝子組み換え技術による高温ストレス耐性組み換え植物の作出が試みられている一方、実用に近く簡便な技術として、作物に施用することで高温耐性を付与する資材の開発が進められている。これまで農園芸作物の高温ストレス耐性付与を目的として販売されている農薬または肥料は存在しないが、下記のような物質の評価が試みられている。例えば、天然物抽出成分としては甘草抽出成分(特許文献1)、酵母細胞壁酵素分解物(特許文献2)、化学合成物質としては糖誘導体型界面活性剤(特許文献3)、炭素原子数が4〜24のケトール脂肪酸(特許文献4)、リポイド珪酸エステル(特許文献5)、酸化還元調節物質としてはピロロキノリンキノン(特許文献6、特許文献7)、カテキン、フラボン等の抗酸化剤(特許文献8)、植物ホルモン関連物質としてはオーキシン生合成経路中間体物質(特許文献9)、サリチル酸(非特許文献5)、ジャスモン酸(非特許文献6)、ウニコナゾール(非特許文献7)、その他成分としては有機ケイ素化合物(特許文献10)、1価又は2価の金属イオン、過酸化水素/一酸化窒素誘導物質、カルモジュリンアンタゴニスト、ベタインアルデヒドデヒドロゲナーゼの発現誘導物質、及びポリアルキレングリコールからなる群(特許文献11)が報告されている。このように多くの報告がある一方で、これらの物質は現時点で実用化されておらず、記載されている効果が微弱である。また、耐性を付与する仕組みが明らかになっておらず、獲得型なのか基礎型なのかも明確でない。そのため、これらの物質が必ずしも実用レベルに耐える効果を有するとは言えない。従って、さらに有用かつ強力な高温ストレス耐性付与技術が望まれていた。
【0006】
植物の環境ストレス応答に関与する物質として、いくつかのアミノ酸が知られている。例えばプロリンは、環境ストレスに曝された際に蓄積することが知られている。これまでに、乾燥(非特許文献8)、塩(非特許文献9)、微生物(非特許文献10)などの生物・非生物ストレスでプロリンが蓄積することが分かっている。γ-アミノ酪酸は、高温ストレスにより蓄積することが分かっているが(非特許文献11)、それ自体に高温耐性付与効果は認められておらず、高温障害による何らかのシグナルで結果的に増加したものと考えられている。生体異物(Xenobiotic)アミノ酸であるβ-アミノ酪酸は、獲得型高温耐性に関与することが報告されている一方(非特許文献12)、基礎型高温耐性には関与せず、本質的な高温耐性付与剤とは言えない。さらに高価で環境中に極めて微量しか存在しない生体異物であり、人為的な処理による環境汚染が懸念される。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平11-199419
【特許文献2】特開2007-45709
【特許文献3】国際公開WO2009/028626
【特許文献4】特開2001-131006
【特許文献5】特表2002-543100
【特許文献6】特開2006-151881
【特許文献7】国際公開WO2006059782
【特許文献8】特開2009-55833
【特許文献9】特開2009-55834
【特許文献10】特開2009-57316
【特許文献11】国際公開WO2002/005624
【非特許文献】
【0008】
【非特許文献1】Lobell, D. and Field, C., Environ. Res. Lett., 2007, 014002
【非特許文献2】Kotak, S. et al., Curr. Opin. Plant Biol., 2007, 10:310-316
【非特許文献3】Huang, B. and Xu, C., J. Integr. Plant Biol., 2008, 50(10):1230-1237
【非特許文献4】Baniwal, S et al., J. Biosci., 2004, 29(4):471-487
【非特許文献5】Wang, L. et al., BMC Plant Biology 2010, 10:34
【非特許文献6】Clarke, S., et al., New Phytologist 2009, 182: 175-187
【非特許文献7】Kraus, T., et al., J. Plant Growth Regul 1991, 10:229-234
【非特許文献8】Choudhary, N.L. et al., Ind. J. Biochem. Biophys., 2005, 42: 366-370
【非特許文献9】Yoshiba, Y. et al., Plant J., 1995, 7:751-760
【非特許文献10】Fabro, G. et al., Mol. Plant-Microbe Interact., 2004, 17:343-350
【非特許文献11】Wahid, A. et al., Environ. and Exp. Bot., 2007, 61:199-223
【非特許文献12】Zimmerli, L. et al., Plant J., 2008, 53:144-156
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、消費者および使用者に対して安全性が高く、安価な農園芸用高温ストレス耐性付与剤およびそれを用いた高温ストレス耐性付与法を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者は、植物の高温ストレス耐性付与物質を探索したところ、バリン処理により、高温誘導性のクロロフィル分解、細胞死、および光合成活性低下を抑制できること、すなわち、バリンに高温ストレス耐性付与効果があることを見出した。また、本発明者は、バリン処理により高温耐性に関わる熱ショック応答遺伝子の発現が上昇することを見出した。また、本発明者は、バリンの類縁化合物にも高温ストレス耐性付与効果があることを見出した。さらに、バリンは生物のアミノ酸代謝を変動させる活性が知られていることから、アミノ酸代謝変動誘発物質の中から高温ストレス耐性付与物質を探索したところ、人間には毒性を示さない複数の除草剤成分にも、バリン同様の高温ストレス耐性付与効果があることを発見した。本発明はこれらの知見に基づいて完成されたものである。
【0011】
すなわち本発明は、以下のとおりである。
[1]
植物のアミノ酸代謝を変化させる性質を有する化合物を含有する、植物高温ストレス耐性付与剤。
[2]
前記性質が、植物のアミノ酸の生合成を阻害する性質である、前記植物高温ストレス耐性付与剤。
[3]
前記化合物が、分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体からなる群より選択される1またはそれ以上の化合物である、前記植物高温ストレス耐性付与剤。
[4]
前記化合物が、分岐鎖アミノ酸合成酵素阻害活性または芳香族アミノ酸合成酵素阻害活性を有する除草剤成分からなる群より選択される1またはそれ以上の化合物である、前記植物高温ストレス耐性付与剤。
[5]
前記化合物が、バリン、ロイシン、およびα−ケトイソ吉草酸から選択される1またはそれ以上の化合物である、前記植物高温ストレス耐性付与剤。
[6]
前記化合物が、チフェンスルフロンメチル、イマザピル、ビスピリバックナトリウム塩、およびグリホサートから選択される1またはそれ以上の化合物である、前記植物高温ストレス耐性付与剤。
[7]
前記アミノ酸がL-体である、前記植物高温ストレス耐性付与剤。
[8]
前記アミノ酸がD-体である、前記植物高温ストレス耐性付与剤。
[9]
付与される耐性の性質が、基礎型である、前記植物高温ストレス耐性付与剤。
[10]
植物が正常に生育できない高温条件において、正常な生育を促す効果を有する、前記植物高温ストレス耐性付与剤。
[11]
葉面散布または根圏施用により植物に施用される、前記植物高温ストレス耐性付与剤。[12]
前記植物高温ストレス耐性付与剤を植物に施用することを特徴とする、植物に高温耐性を付与する方法。
[13]
前記植物高温ストレス耐性付与剤を、分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体からなる群より選択される1またはそれ以上の化合物の濃度として、0.2〜200mMの施用濃度で施用する、前記方法。
[14]
前記植物高温ストレス耐性付与剤を、分岐鎖アミノ酸合成酵素阻害活性または芳香族アミノ酸合成酵素阻害活性を有する除草剤成分からなる群より選択される1またはそれ以上の化合物の濃度として、20ng/mL〜200ng/mLまたは0.01mM〜1mMの施用濃度で施用する、前記方法。
【発明の効果】
【0012】
本発明により、植物の高温ストレス耐性を効果的に増強することができる。本発明は高温による植物細胞死、光合成活性低下を効果的に抑制するほか、高温耐性関連遺伝子である熱ショック応答遺伝子の発現を誘導することにより、植物にとって本質的な、基礎型高温耐性を付与することができると考えられる。これにより、これまでの高温ストレス耐性付与技術に比べて差別化され、農園芸用作物の高温による減収や品質低下を直接的に防ぐことができるため産業上有用である。また、本発明の植物高温ストレス耐性付与剤は、特にアミノ酸や安全性に優れた除草剤成分等の化合物を有効成分とする場合には、環境および動物に対し安全性が高く、安価に製造することができる。
【0013】
生物はエナンチオマーを区別して認識する。D-アミノ酸は、L-アミノ酸と比較すると環境中での微生物による分解を受けにくいと考えられている。本発明の一態様では、D-アミノ酸を利用することで、高温ストレス耐性付与効果を安定的に持続させることができると期待される。
【図面の簡単な説明】
【0014】
【図1】高温処理による植物地上部組織のクロロフィル含量変化を示す図。「-heat」は熱処理を行わなかったサンプルを、「+heat」は熱処理を行ったサンプルを示す。
【図2】クロロフィル含量変化を指標とした種々アミノ酸処理による高温ストレス耐性付与効果を示す図。「control」は対照区を示す(以下、同じ)。
【図3】バリン処理による高温誘導性細胞死の抑制効果を示す写真。
【図4】バリン処理による高温誘導性の光合成活性低下の抑制効果を示す図。
【図5】バリン処理による高温誘導性の熱ショック応答遺伝子発現の上昇効果を示す図。
【図6】クロロフィル含量変化を指標としたバリン散布濃度と高温ストレス耐性付与効果との関係を示す図。
【図7】クロロフィル含量変化を指標としたバリン根圏施用濃度と高温ストレス耐性付与効果との関係を示す図。
【図8】クロロフィル含量変化を指標としたバリン散布時期と高温ストレス耐性付与効果との関係を示す図。
【図9】クロロフィル含量変化を指標としたバリン構造類縁化合物の高温耐性付与効果を示す図。
【図10】クロロフィル含量変化を指標としたアミノ酸代謝変動を誘発する化合物の高温耐性付与効果を示す図。
【発明を実施するための形態】
【0015】
以下、本発明を詳細に説明する。
【0016】
<本発明の高温ストレス耐性付与剤>
本発明の高温ストレス耐性付与剤は、植物のアミノ酸代謝を変化させる性質を有する化合物を含有する。本発明においては、本発明の高温ストレス耐性付与剤に含有される植物のアミノ酸代謝を変化させる性質を有する化合物を、単に「有効成分」という場合がある。また、本発明においては、植物のアミノ酸代謝を変化させる性質を有する化合物のことを「アミノ酸代謝変動を誘発する化合物」ともいう場合がある。有効成分としては、植物のアミノ酸代謝を変化させる性質を有する限り特に制限されないが、例えば、アミノ酸、アミノ酸の生合成経路および消費経路における中間体、アミノ酸の誘導体、アミノ酸のアナログ、および除草剤成分等が挙げられる。
【0017】
「植物のアミノ酸代謝を変化させる性質を有する」とは、ある化合物自体が植物のアミノ酸代謝を変化させる性質を有する場合に限られず、当該化合物が代謝されて生成する別の化合物が植物のアミノ酸代謝を変化させる性質を有する場合を含む。
【0018】
アミノ酸代謝を変化させる性質としては、アミノ酸の生合成を阻害する性質が挙げられる。
【0019】
アミノ酸の生合成を阻害する性質としては、分岐鎖アミノ酸の生合成を阻害する性質、および芳香族アミノ酸の生合成を阻害する性質が挙げられる。
【0020】
分岐鎖アミノ酸の生合成を阻害する性質としては、分岐鎖アミノ酸生合成経路の酵素(分岐鎖アミノ酸合成酵素ともいう)の活性を阻害する性質が挙げられる。芳香族アミノ酸の生合成を阻害する性質としては、芳香族アミノ酸生合成経路の酵素(芳香族アミノ酸合成酵素ともいう)の活性を阻害する性質が挙げられる。
【0021】
分岐鎖アミノ酸には、バリン、ロイシン、およびイソロイシンが含まれる。芳香族アミノ酸には、フェニルアラニン、トリプトファン、およびチロシンが含まれる。「分岐鎖アミノ酸の生合成を阻害する」とは、バリン、ロイシン、およびイソロイシンから選択される1またはそれ以上のアミノ酸の生合成を阻害することを意味し、これら全てのアミノ酸の生合成を阻害する場合を含む。「芳香族アミノ酸の生合成を阻害する」とは、フェニルアラニン、トリプトファン、およびチロシンから選択される1またはそれ以上のアミノ酸の生合成を阻害することを意味し、これら全てのアミノ酸の生合成を阻害する場合を含む。
【0022】
(物質A)
植物のアミノ酸代謝を変化させる性質を有する化合物としては、分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体(以下、これらを総称して物質Aとも言う)が挙げられる。
【0023】
植物体内における分岐鎖アミノ酸の生合成は一般的に、ピルビン酸またはスレオニン由来のケト酪酸を出発物質とし、アセト乳酸を経てバリンおよびロイシンが、アセトヒドロキシ酪酸を経てイソロイシンが合成されることが知られている。すなわち、本発明において、分岐鎖アミノ酸の生合成経路における中間体とは、ピルビン酸またはケト酪酸からバリン、ロイシン、およびイソロイシンまでの生合成経路の化合物を意味する。また、本発明において、分岐鎖アミノ酸の消費経路における中間体とは、分岐鎖アミノ酸がさらに代謝されて生成する化合物を意味する。本発明における物質Aとしては、具体的には、ピルビン酸、ケト酪酸、アセト乳酸、アセトヒドロキシ酪酸、2,3-ジヒドロキシイソ吉草酸、2,3-ジヒドロキシ-3-メチル吉草酸、α−ケトイソ吉草酸、ケトメチル吉草酸、2-イソプロピルリンゴ酸、3-イソプロピルリンゴ酸、ケトイソカプロン酸、バリン、ロイシン、及びイソロイシンからなる群より選ばれる1またはそれ以上の化合物が挙げられる。本発明における物質Aとしては、バリン、ロイシン、及びα−ケトイソ吉草酸からなる群より選ばれる1またはそれ以上の化合物が好ましい。
【0024】
分岐鎖アミノ酸はいずれも、植物のアミノ酸代謝を変化させる性質として、例えば、分岐鎖アミノ酸の共通の生合成酵素であるアセト乳酸合成酵素(Acetolactate synthase;ALS)の阻害活性を有する。なお、ALSは、アセトヒドロキシ酸合成酵素(Acetohydroxyacid synthase;AHAS)ともいい、アセト乳酸の合成とアセトヒドロキシ酸の合成の両反応を触媒する(EC 2.2.1.6)が、本願では、単にALSと記載する場合がある。
【0025】
(物質B)
分岐鎖アミノ酸の生合成を阻害する性質を有する化合物としては、分岐鎖アミノ酸合成酵素であるアセト乳酸合成酵素(Acetolactate synthase;ALS)の阻害活性を有する物質(以下、物質Bとも言う)が挙げられる。
【0026】
ALS阻害剤としては、人間には毒性を示さない、あるいは人間に対する毒性が低い化合物が好ましい。従来、除草剤として、長期残効性と共に植物選択性を有するALS阻害剤が用いられている。ALS阻害剤は、植物のALS活性を阻害することで、バリン、ロイシン、イソロイシンの生合成を阻害し、植物のアミノ酸代謝を変動させることで、植物の生育に影響を及ぼす。
【0027】
ALS阻害剤としては、例えば、スルホニルウレア系化合物(SU剤)、イミダゾリン系化合物、ピリミジニルサリチル酸系化合物およびトリアゾロピリミジンスルホンアミド系化合物等が挙げられる。
【0028】
スルホニルウレア系化合物としては、例えば、チフェンスルフロンメチル、トリフロキシスルフロンナトリウム塩、ピラゾスルフロンエチル、ベンスルフロンメチル、シノスルフロン、イマゾスルフロン、アジムスルフロン、ハロスルフロンメチル、エトキシスルフロン、シクロスルファムロン、アミドスルフロン、クロリムロンエチル、スルホメツロンメチル、オキサスルフロン、プリミスルフロン、メソスルフロンメチル、ホラムスルフロン、クロルスルフロン、メトスルフロンメチル、トリベニュロンメチル、ヨードスルフロン、イソスルフロンメチルナトリウム塩、プロスルフロン、トリアスルフロン、トリトスルフロン、エタメトスルフロンメチル、トリフルスルフロンメチル、リムスルフロン、ニコスルフロン、フルピルスルフロン、スルホスルフロン等が挙げられる。
【0029】
イミダゾリノン系化合物としては、イマザピル、イマザメタベンズ、イマザメタピル、イマゼタピル、イマザモックス、イマザキン、イマザキンアンモニウム等が挙げられる。
【0030】
ピリミジニルサリチル酸系化合物としては、ビスピリバックナトリウム塩、ピリチオバックナトリウム塩、ピリミノバックメチル、ピリフタリド、ピリベンゾキシム等が挙げられる。
【0031】
トリアゾロピリミジンスルホンアミド系化合物としては、フルメツラム、フロラスラム、メトスラム、ジクロスラム、クロランスラムメチル、ペノスクラム等が挙げられる。また類似の化合物としてDASH-001(ペノキススラム)等が挙げられるがこれらに限定されない。
【0032】
本発明における物質Bとしては、これらALS阻害剤より選ばれる1またはそれ以上の化合物を用いることができる。
【0033】
(物質C)
芳香族アミノ酸の生合成を阻害する性質を有する化合物としては、芳香族アミノ酸合成酵素である5-エノールピルビルシキミ酸-3-リン酸合成酵素(5-enolpyruvylshikimate-3-phosphate synthase;EPSPS)の阻害活性を有する物質(以下、物質Cとも言う)が挙げられる。
【0034】
EPSPS阻害剤としては、人間には毒性を示さない、あるいは人間に対する毒性が低い化合物が好ましい。従来、除草剤として、EPSPS阻害剤が用いられている。EPSPS阻害剤は、植物のEPSPS活性を阻害することで、シキミ酸経路を介するフェニルアラニン、トリプトファン、およびチロシンの生合成を阻害し、植物のアミノ酸代謝を変動させることで、植物の生育に影響を及ぼす。
【0035】
EPSPS阻害剤としては、例えばシキミ酸経路を阻害する農薬成分として知られているグリホサートが挙げられる。グリホサートは、フリー体であってもよく、塩であってもよい。グリホサートは、水溶性グリホサート塩であるのが好ましい。水溶性グリホサート塩としては、特に制限されないが、グリホサートのカリウム塩、イソプロピルアミン塩、アンモニウム塩、ナトリウム塩、およびトリメチルスルホニウム塩等が挙げられる。グリホサートは、単一の化合物であってもよく、フリー体や各種グリホサート塩から選択される複数の化合物の混合物であってもよい。
【0036】
本発明における物質Cとしては、これらEPSPS阻害剤より選ばれる1またはそれ以上の化合物を用いることができる。
【0037】
ALS阻害剤および/またはEPSPS阻害剤としては、チフェンスルフロンメチル、イマザピル、ビスピリバックナトリウム塩、およびグリホサートから選択される1またはそれ以上の化合物が好ましい。
【0038】
本発明の高温ストレス耐性付与剤に含有される植物のアミノ酸代謝を変化させる性質を有する化合物は、物質A、物質B、および物質Cのいずれかの群の化合物のみであってもよく、複数の群の化合物の組み合わせであってもよい。
【0039】
また、各有効成分は、当該有効成分を含む限りその存在形態は特に制限されず、単独の化合物であってもよく、当該有効成分を含む混合物であってもよい。例えば、有効成分がアミノ酸である場合には、一般に試薬として販売されているものであってもよく、発酵法で製造した精製品もしくは粗精製品、または精製過程で生じる副生物であってもよく、海産物からの抽出物やタンパク質の加水分解物など、当該アミノ酸を含む混合物であってもよい。また、例えば、有効成分が農薬成分である場合には、一般に試薬として販売されているものであってもよく、当該農薬成分を含む農薬等の混合物であってもよい。
【0040】
有効成分がアミノ酸である場合には、各アミノ酸は、L-体、D-体のいずれであってもよく、L-体及びD-体を任意の割合で含む混合物であってもよい。また、各アミノ酸は、フリー体でもよく、アンモニウム塩、ナトリウム塩、カリウム塩等の塩であってもよく、それらの混合物であってもよい。
【0041】
本発明の高温ストレス耐性付与剤は、本発明の効果を損なわない限り、前記のような植物のアミノ酸代謝を変化させる性質を有する化合物以外に、さらに、植物高温ストレス軽減効果を有する他の化合物を含有していてもよい。
【0042】
本発明の植物高温ストレス耐性付与剤は、本発明の効果を損なわない限り、さらに任意の成分を含んでいてもよい。このような成分としては、溶媒、担体、pH調整剤、植物体への展着力を高めるための展着剤、植物への浸透性を高めるための界面活性剤等の成分、肥効を高めるためのミネラル等の肥料成分、農薬成分、バインダー、増量剤等が挙げられる。これらの成分としては、例えば、通常農薬、肥料等に用いられている成分を用いることができる。
【0043】
本発明の植物高温ストレス耐性付与剤の剤型は液剤、粉剤、粒剤、乳剤、水和剤、油剤、エアゾール、フロアブル剤等の何れの剤型でもよく、施用の為の薬剤の形態、その使用形態、施用方法は特に限定されるものではない。
【0044】
担体成分としては、例えば、本発明の植物高温ストレス耐性付与剤が底床添加剤又は固形剤である場合には、バーミキュライト、タルク、珪藻土、カオリン、炭酸カルシウム、クレー、水酸化カルシウム、白土、シリカゲル等の無機質や小麦粉、澱粉等の固体担体を、また液剤である場合には、水、キシレン等の芳香族炭化水素類、エタノール、エチレングリコール等のアルコール類、アセトン等のケトン類、ジオキサン、テトラヒドロフラン等のエーテル類、ジメチルホルムアミド、ジメチルスルホキシド、アセトニトリル等の液体担体を用いることができる。
【0045】
また、使用に際して、固体状又は粉体状の植物高温ストレス耐性付与剤を、水、アルコール等の溶媒に溶解又は分散させてもよい。
【0046】
植物高温ストレス耐性付与剤における有効成分の含量は、高温ストレス軽減に有効な量が施用できる限り特に制限されず、当該成分が有する植物のアミノ酸代謝を変化させる性質の程度、および後述の施用量等の諸条件に応じて適宜設定することができる。
【0047】
例えば、有効成分が除草剤成分である場合には、植物高温ストレス耐性付与剤における有効成分の含量は、単一の化合物を有効成分として含有する場合には、通常20〜200ng/mL、好ましくは50〜100ng/mLである。また、複数の化合物を有効成分として含有する場合には、合計で、通常20〜200ng/mL、好ましくは50〜100ng/mLである。また、除草剤成分によっては、含量は、通常0.01mM〜1mMであってもよい。尚、前記濃度は、植物高温ストレス耐性付与剤が固形又は粉体状の場合は、使用時に溶液にしたときの濃度である。
【0048】
また、例えば、有効成分が物質Aである場合には、植物高温ストレス耐性付与剤における有効成分の含量は、単一の化合物を有効成分として含有する場合には、通常0.2〜200mM、好ましくは1〜100mMである。また、複数の化合物を有効成分として含有する場合には、合計で、通常0.2〜200mM、好ましくは1〜100mMである。尚、前記濃度は、植物高温ストレス耐性付与剤が固形又は粉体状の場合は、使用時に溶液にしたときの濃度である。
【0049】
本発明の高温ストレス耐性付与剤の対象となる植物は、特に制限されず、双子葉植物であってもよく単子葉植物であってもよい。また、樹木であってもよく、草本であってもよい。また、野生植物であってもよく、農業、園芸、又は林業用植物であってもよい。農業、園芸、又は林業用植物には、例えば作物(果菜類を含む)、穀物、観賞用植物、花卉、果樹などが含まれる。後述の実施例では、双子葉植物としてアブラナ科のシロイヌナズナ、ハクサイおよびカブ、ナス科のベンサミアナタバコ、単子葉植物としてイネ科のイネをそれぞれ選択したが、いずれの植物もバリン処理による高温ストレス耐性を示した。したがって、本発明の高温ストレス耐性付与剤は、いかなる植物にも有効に使用できる。
【0050】
本発明の高温ストレス耐性付与剤は、植物に高温ストレス耐性を付与する効果を有する。植物に高温ストレス耐性を付与することで、高温ストレスにより引き起こされる障害を軽減できる。本発明の高温ストレス耐性付与剤により付与される高温ストレス耐性の種類は、特に制限されず、基礎型高温耐性であってもよく、獲得型高温耐性であってもよい。これらの内、軽微な高温条件で耐性を誘導する過程を必要としない点で、基礎型高温耐性が好ましい。
【0051】
高温ストレスにより、例えば、HSP100やHSFA2等のストレス応答性遺伝子の発現が惹起され、また、クロロフィル(葉緑素)減少、ネクロシス(細胞死)等の障害が引き起こされる。本発明の高温ストレス耐性付与剤の高温ストレス耐性付与効果は、実施例記載の方法に従い、HSP100やHSFA2等のストレス応答性遺伝子の発現解析、クロロフィル定量、光合成活性の測定、生育の測定、または死細胞検出等を行うことで評価することが可能である。本発明の高温ストレス耐性付与剤は、種々の高温障害の全てを軽減してもよく、一部を軽減してもよい。なお、「軽減」には、これから発生する高温障害の程度を軽減すること(いわゆる予防効果)、および既に発生した高温障害の程度を軽減すること(いわゆる治療効果)が含まれる。
【0052】
高温ストレス耐性付与効果としては、例えば、高温条件において正常な生育を促す効果が挙げられる。高温条件としては、標的植物にとって高温ストレスを被る生育温度条件であれば特に制限されないが、例えば、標的植物が正常に生育できない高温条件が挙げられる。「植物が正常に生育できない高温条件」とは、植物種によって異なるが、標的植物の通常の生育温度よりも高い温度であって、当該植物を通常の生育温度で生育させた場合よりも生育が減退する温度条件であれば特に制限されない。「生育が減退する」とは、例えば、通常の生育温度で生育させた場合と比較して、植物体地上部新鮮重量が90%以下、70%以下、50%以下、あるいは20%以下に低下することをいい、全く生育が認められない場合を含む。「正常な生育を促す」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、植物体地上部新鮮重量が増大することをいう。植物体地上部新鮮重量は、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して1.2倍以上、好ましくは1.5倍以上、より好ましくは2倍以上に増大すればよい。また、「正常な生育を促す」とは、本発明の高温ストレス耐性付与剤の施用なしには全く生育が認められない場合に、本発明の高温ストレス耐性付与剤の施用により生育が認められるようになる場合を含む。植物が生育する期間の内、全期間が高温条件であってもよく、一部の期間が高温条件であってもよい。また、植物が高温条件に曝露された後、植物の生育は全期間に渡って通常の生育温度条件で行われてもよい。
【0053】
また、高温ストレス耐性付与効果としては、例えば、クロロフィルの減少を抑制する効果が挙げられる。「クロロフィルの減少を抑制する」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、高温ストレス曝露後の植物体地上部のクロロフィル含量が増大することをいう。クロロフィル含量は、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して1.2倍以上、好ましくは1.5倍以上、より好ましくは2倍以上に増大すればよい。
【0054】
また、高温ストレス耐性付与効果としては、例えば、光合成活性の低下を抑制する効果が挙げられる。「光合成活性の低下を抑制する」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、高温ストレス曝露後の光合成活性が増大することをいう。光合成活性は、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して1.2倍以上、好ましくは1.5倍以上、より好ましくは2倍以上に増大すればよい。また、「光合成活性の低下を抑制する」とは、本発明の高温ストレス耐性付与剤の施用なしには光合成活性が認められない場合に、本発明の高温ストレス耐性付与剤の施用により光合成活性が認められるようになる場合を含む。
【0055】
また、高温ストレス耐性付与効果としては、例えば、高温ストレスによる細胞死を抑制する効果が挙げられる。「細胞死を抑制する」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、高温ストレス曝露後の全細胞数に対する死細胞数の割合が低いことをいう。死細胞数の割合は、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して90%以下、好ましくは70%以下、より好ましくは50%以下に低下すればよい。
【0056】
また、高温ストレス耐性付与効果としては、例えば、HSP100やHSFA2等のストレス応答性遺伝子の発現を増強する効果が挙げられる。「遺伝子の発現を増強する」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、高温ストレス曝露後の遺伝子の発現量が増大することをいう。また、「遺伝子の発現を増強する」とは、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して、高温ストレス曝露前の遺伝子の発現量が増大することをいう場合もある。遺伝子の発現量は、例えば、本発明の高温ストレス耐性付与剤を施用しない場合と比較して1.2倍以上、好ましくは1.5倍以上、より好ましくは2倍以上に増大すればよい。また、「遺伝子の発現を増強する」とは、本発明の高温ストレス耐性付与剤の施用なしには発現が認められない場合に、本発明の高温ストレス耐性付与剤の施用により発現が認められるようになる場合を含む。
【0057】
<本発明の高温ストレス耐性付与方法>
本発明の高温ストレス耐性付与剤を植物に施用することにより、植物に高温ストレス耐性を付与することができる。すなわち、本発明は、本発明の植物高温ストレス耐性付与剤を植物に施用することを特徴とする、植物に高温耐性を付与する方法(本発明の高温ストレス耐性付与方法)を提供する。
【0058】
本発明の高温ストレス耐性付与方法の主な目的としては、高温障害の予防が挙げられる。よって、本発明の高温ストレス耐性付与剤は、高温条件に先駆けて施用することが好ましい。高温条件としては、標的植物にとって高温ストレスを被る生育温度条件であれば特に制限されず、自然気象における高温環境や、施設栽培時での高温環境等が挙げられる。また、高温条件の曝露後や高温障害の発生後に本発明の高温ストレス耐性付与剤を植物に施用する場合にも、高温障害の拡大を抑制する効果や、高温障害を減弱する効果は期待できる。よって、本発明の高温ストレス耐性付与剤は、高温条件の曝露後や高温障害の発生後に施用してもよい。
【0059】
本発明の高温ストレス耐性付与剤の施用の方法は特に制限されず、その剤形、施用対象の植物、畑や水田等の状態、および農業従事者の事情等に応じて適宜設定することができる。本発明の高温ストレス耐性付与剤は、植物体の一部に施用してもよく、植物体の全体に施用してもよい。例えば、植物の生長点のみならず、茎や葉をはじめとする植物体の一部又は全体に液剤や乳剤として散布、滴下あるいは塗布等することができる。また、本発明の高温ストレス耐性付与剤は、根圏に施用してもよい。根圏への施用としては、例えば土壌への表面散布、潅注、土壌への混合、又は根への浸漬処理が挙げられる。これらの中では、葉面散布か根圏施用が好ましい。
【0060】
本発明の植物高温ストレス耐性付与剤を植物に施用する時期や頻度は、施用目的や植物体の生育ステージ等に応じて適宜設定することができる。例えば、田植え前のイネに対してはイネの苗床に施用することで幼苗の高温耐性を強化できる。また、ハクサイやキャベツなど葉物野菜に対しては結球前に施用することで高温による結球不全や本葉の萎れを軽減できる。また、本発明の高温ストレス耐性付与剤は植物に施用してからの効果持続性が高いため、施用してから高温条件に曝露されるまで数日程度経過してしまった場合や、高温条件が長期間継続した場合でも、高温ストレス軽減効果は維持される。
【0061】
本発明の植物高温ストレス耐性付与剤の施用量は、有効成分の濃度、施用時期、施用回数、植物の種類、栽培密度、生育段階、施用方法等に応じて適宜設定することができる。葉面散布では、例えば、有効成分を前記含有量で含有する植物高温ストレス耐性付与剤を、通常100〜5000L/ヘクタール、好ましくは500〜1000L/ヘクタールで施用すればよい。また、植物高温ストレス耐性付与剤を根圏に施用する場合も、葉面散布の場合と同様に施用量を設定すればよい。また、有効成分である植物のアミノ酸代謝を変化させる性質を有する化合物と、それ以外の植物高温ストレス軽減効果を有する化合物を、同時に施用してもよく、別個に施用してもよい。
【実施例】
【0062】
以下、実施例をもって本発明をさらに具体的に説明するが、本発明はこれら実施例に限定されるものではない。
【0063】
〔実施例1〕クロロフィル含量変化を指標としたアミノ酸による高温ストレス耐性付与効果の評価
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptimized(Opt)MS無機塩類(下記)に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には12日間無菌栽培した植物を用いた。
<OptMS無機塩類の組成>
2.5mM NH4NO3
2.5mM KH2PO4/K2HPO4 (pH5.7)
2mM KCl
2mM KNO3
3mM Ca(NO3)2
2mM MgSO4
0.1mM Fe(III)-EDTA
0.1mM MnCl2
0.1mM H3BO3
30μM ZnSO4
0.5μM CuSO4
1μM NaMoO4
0.1μM CoCl2
10μM NaCl
【0064】
(2)アミノ酸散布および高温処理
アミノ酸エナンチオマーの表記として、以降L-またはD-の表記のない場合は、全てL-アミノ酸を指す。アミノ酸散布は、各アミノ酸(Nacalai tesque)の50mM水溶液を調製し、展着剤としてアプローチBI(花王(株)、「アプローチBI」は同社の登録商標である。)を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。対照区には水にアプローチBIを添加したものを散布した。その後23℃で24時間栽培した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にアミノ酸散布したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。また、別途、上記の噴霧処理を施さずに高温処理を行った植物体、および噴霧処理も高温処理も行っていない植物体を準備した。
【0065】
(3)葉組織のクロロフィル含量定量
クロロフィル定量はPorra, R., et al., Biochimica et Biophysica Acta, 1989, 975:384-394に記載されている方法により行った。高温処理2日後、シロイヌナズナの第5、6葉を1サンプルあたり5個体分回収してサンプリングチューブへ入れた後、直ちに液体窒素を用いて凍結させ-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER (Retsch)により破砕し、50μLの水に懸濁した。これに200μLのアセトンを加えて攪拌し、10,000rpm 5分間の遠心分離後の上清を、水で5倍に希釈した。希釈液200μLを96ウェルプレートに入れ、プレートリーダーSpectraMax M2 (Molecular Devices)を用いて647nm(クロロフィルaの吸収波長)および664nm(クロロフィルbの吸収波長)の吸光度を測定し、クロロフィル含量を算出した。
【0066】
(4)結果
噴霧処理を施さずに高温処理を行った植物体(+heat)、および噴霧処理も高温処理も行っていない植物体(-heat)について、クロロフィル含量を定量した結果を図1に示す。図1には、それぞれ3サンプルの実験の平均値と標準偏差(SD)を示した。本高温処理により、シロイヌナズナ第5、6葉のクロロフィル含量が著しく低下(分解)していることが明らかとなった。これは明確な高温障害であり、クロロフィル含量を指標として高温障害の程度を定量化できる。
【0067】
各種アミノ酸溶液を散布した後高温処理してクロロフィル含量を定量した結果を図2に示す。図2には、それぞれ3サンプルの実験の平均値とSDを示した。バリン処理により、高温処理によるクロロフィル低下(分解)、すなわち高温障害を抑制できることが示された。バリン処理区では、対照区と比較して、高温処理後のクロロフィル含量がおよそ2倍のレベルで維持されていた。このような劇的な効果を有するストレス耐性付与剤はこれまでに知られていない。
【0068】
〔実施例2〕バリン処理による高温誘導性細胞死の抑制効果
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には12日間無菌栽培した植物を用いた。
【0069】
(2)バリン散布および高温処理
バリン散布は、バリン(Nacalai tesque)の25mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理した。対照区には水にアプローチBIを添加したものを散布することで行った。その後23℃で24時間栽培した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン散布したシャーレを80分間静置することで高温処理とした。その後再び23℃で栽培した。
【0070】
(3)トリパンブルー染色による死細胞検出
高温処理して2日後、シロイヌナズナ個体を24ウェルプレートに置き、トリパンブルー染色液(10 w/v %フェノール、10 v/v %グリセロール、10 v/v %乳酸、30 v/v %エタノール、0.07 w/v %トリパンブルー)を添加して植物体の死細胞を染色した。染色15分後に染色液を廃棄し、抱水クロラール透明化液(2.5g/mL抱水クロラール;和光純薬株式会社)に置換して、一晩静置することにより植物組織を透明化した。この過程でトリパンブルー染色は残存する。透明化した植物体をスライドグラスに載せ、抱水クロラール透明化液を一滴垂らしてカバーガラスで封入したのち、実体顕微鏡(SZX7;オリンパス株式会社)で観察し、デジタルカメラ(Digital Sight DS-2Mv;ニコン株式会社)で撮影した。
【0071】
(4)結果
バリンまたは水を散布しそれぞれ高温処理した後、トリパンブルー染色した植物体写真を図3に示す。各処理区それぞれ6個体を観察し、図3にはそれらのうち典型的なサンプル像を示す。図3下段の写真は上段の写真の一部を拡大したものである。バリン散布区ではトリパンブルー染色が対照区に比べて弱く、死細胞数の減少が確認された。従って、バリン処理により、高温誘導性の細胞死を抑制できることが示された。このような高温誘導性細胞死抑制剤はこれまでに知られていない。
【0072】
〔実施例3〕バリン処理による高温誘導性の光合成活性低下の抑制効果
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には12日間無菌栽培した植物を用いた。
【0073】
(2)バリン散布および高温処理
バリン散布は、バリンの25mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。対照区には水にアプローチBIを添加したものを散布した。その後23°Cで24時間栽培した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン散布したシャーレを30分間または40分間静置することで高温処理とした。その後23℃で6時間栽培した。
【0074】
(3)光合成活性測定
光合成活性測定には、光合成活性測定装置LI-COR LI-6400(Leica)を用いた。高温処理後のシャーレを、CO2循環中のチャンバー内へ設置し、光合成を促進するため上部から照明を点灯した。一定時間後の循環CO2減少量を植物体によるCO2固定量とみなして測定し、30分間高温処理した対照区におけるCO2固定量を1として相対的な光合成活性を測定した。
【0075】
(4)結果
バリンまたは水を散布しそれぞれ高温処理した後、相対的光合成活性を測定した結果を図4に示す。図4には、それぞれ3サンプルの実験の平均値とSDを示した。N.D.は測定値が検出限界以下であったことを示す。高温処理30分間では、対照区およびバリン処理区ともに一定の光合成活性が認められた。高温処理40分間では、対照区では光合成活性が顕著に低下して検出限界を下回ったのに対し、バリン処理区では光合成活性が維持されていた。
このことから、バリン処理により、高温ストレスによる光合成活性低下を抑制できることが示された。このような高温誘導性の光合成活性低下抑制剤はこれまでに知られていない。
【0076】
〔実施例4〕バリン処理による高温誘導性の熱ショック応答遺伝子の発現量上昇効果
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には12日間無菌栽培した植物を用いた。
【0077】
(2)バリン散布および高温処理
バリン散布は、バリンの25mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。対照区には水にアプローチBIを添加したものを散布した。その後23℃で24時間栽培した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン処理したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。
【0078】
(3)RNA抽出と定量RT-PCR
熱ショック応答遺伝子の転写量を定量するため、高温処理後に23℃で1時間栽培したシロイヌナズナの地上部を回収後、直ちに液体窒素で凍結し、-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER(Retsch)により破砕した。EZ1 RNA Tissue
Mini Kit(QIAGEN)および自動抽出装置Magtration System 12GC(QIAGEN)を用いてRNA抽出を行った後、リアルタイムPCR装置(7500 Real Time PCR System;Applied Biosystems)を用い、定量的RT-PCRによりHSP100遺伝子(At2g25140)およびHSFA2遺伝子(At2g26150)の発現量の比較を行った。両遺伝子は共に植物の高温耐性に寄与することが既に報告されている(Kotak, S. et al., Curr. Opin. Plant Biol., 2007, 10:310-316)。両遺伝子の発現量は、内部標準として用いたハウスキーピング遺伝子ACTIN2(At3g18780)の発現量に対する相対値として算出した。各遺伝子の増幅に用いたプライマー配列は、表2に示すとおりである。これらの塩基配列を配列番号1〜6に示す。
【0079】
【表1】

【0080】
(4)結果
バリンまたは水を散布しそれぞれ高温処理した後の植物体から抽出したRNAを用いて熱ショック応答遺伝子の発現量を定量した結果を図5に示す。図5には、それぞれ3サンプルの実験の平均値とSDを示した。バリン処理区において、高温処理後のHsp100およびHsfA2遺伝子発現が、対照区に比べ顕著に増加していた。さらにHsp100については、バリン処理24時間後、すなわち高温処理直前の時点でも、対照区に比べ発現量が増加していた。これらのことから、バリンは高温誘導性の熱ショック応答遺伝子の発現量を上昇させる効果があることが示された。本高温耐性付与効果の仕組みの一部は、これらの遺伝子発現促進によるものと考えられる。
【0081】
〔実施例5〕クロロフィル含量変化を指標としたバリン有効濃度の検討
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には12日間無菌栽培した植物を用いた。
【0082】
(2)バリン施用および高温処理
バリンの施用方法として、植物体地上部へのバリン散布と、バリンの根圏施用を検討した。バリン散布は、バリンの0mM〜50mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。その後23℃で24時間栽培した。バリンの根圏施用は、バリンを0mM〜50mM、OptMS無機塩類、1% sucrose、0.5% ゲランガムを加えて固めたバリン含有ゲランガム培地に、植物体を移植することにより行った。植物体は、地上部が培地に触れないように地下部をゲランガム培地内に埋め込んで移植した。その後23℃で24時間栽培した。バリン散布およびバリン根圏施用のそれぞれについて、バリン濃度0mMの場合を対照区とした。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン処理したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。
【0083】
(3)葉組織のクロロフィル含量定量
クロロフィル定量はPorra, R., et al., Biochimica et Biophysica Acta, 1989, 975:384-394に記載されている方法により行った。高温処理2日後、シロイヌナズナの第5、6葉を1サンプルあたり5個体分回収してサンプリングチューブへ入れた後、直ちに液体窒素を用いて凍結させ-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER (Retsch)により破砕し、50μLの水に懸濁した。これに200μLのアセトンを加えて攪拌し、10,000rpm 5分間の遠心分離後の上清を、水で5倍に希釈した。希釈液200μLを96ウェルプレートに入れ、プレートリーダーSpectraMax M2 (Molecular Devices)を用いて647nm(クロロフィルaの吸収波長)および664nm(クロロフィルbの吸収波長)の吸光度を測定し、クロロフィル含量を算出した。
【0084】
(4)結果
各濃度のバリンを散布してそれぞれ高温処理し、クロロフィル含量を定量した結果を図6に示す。図6には、それぞれ3サンプルの実験の平均値とSDを示した。5mM〜50mMバリン散布により顕著なクロロフィル分解抑制効果が認められ、濃度依存的に、高温処理によるクロロフィル分解、すなわち高温障害を抑制できることが示された。
【0085】
各濃度のバリン含有培地を用いてバリンを根圏施用し、高温処理してクロロフィル含量を定量した結果を図7に示す。図7には、それぞれ3サンプルの実験の平均値とSDを示した。1mM〜50mMバリン根圏施用により顕著なクロロフィル分解抑制効果が認められ、濃度依存的に、高温処理によるクロロフィル分解、すなわち高温障害を抑制できることが示された。
【0086】
高温ストレスに対しバリンを施用する場合には、5mM程度の濃度で施用すれば、高温耐性を付与することができることが示された。
【0087】
〔実施例6〕クロロフィル含量変化を指標としたバリン有効散布時期の検討
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には11日間無菌栽培した植物を用いた。
【0088】
(2)バリン散布および高温処理
バリン散布は、バリンの25mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。対照区には水にアプローチBIを添加したものを散布した。その後23°Cで24、48、72時間栽培し、それぞれ高温処理に供した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン散布したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。
【0089】
(3)葉組織のクロロフィル含量定量
クロロフィル定量はPorra, R., et al., Biochimica et Biophysica Acta, 1989, 975:384-394に記載されている方法により行った。高温処理2日後、シロイヌナズナの第5、6葉を1サンプルあたり5個体分回収してサンプリングチューブへ入れた後、直ちに液体窒素を用いて凍結させ-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER (Retsch)により破砕し、50μLの水に懸濁した。これに200μLのアセトンを加えて攪拌し、10,000rpm 5分間の遠心分離後の上清を、水で5倍に希釈した。希釈液200μLを96ウェルプレートに入れ、プレートリーダーSpectraMax M2 (Molecular Devices)を用いて647nm(クロロフィルaの吸収波長)および664nm(クロロフィルbの吸収波長)の吸光度を測定し、クロロフィル含量を算出した。
【0090】
(4)結果
バリンを散布して所定の時間栽培して高温処理した上で、クロロフィル含量を定量した結果を図8に示す。図8には、それぞれ3サンプルの実験の平均値とSDを示した。高温処理の24、48、72時間前のいずれの時期にバリンを施用した場合にも顕著なクロロフィル分解抑制効果が認められた。すなわち、バリン散布は、高温処理の72時間前に行っても効果が持続し、高温耐性付与効果が認められた。一方、高温処理24時間前に行っても効果が早期に表れ、高温耐性付与効果が認められた。このことから、バリンによる高温耐性付与効果は、迅速かつ持続的であることが示された。
【0091】
〔実施例7〕各種作物におけるバリンの高温耐性付与効果
(1)植物体の栽培方法
植物材料としてハクサイ(品種「黄味小町」)、カブ(品種「CRもちばな」)、ベンサミアナタバコ(Nicotiana Benthamiana)、イネ(品種「日本晴」)を園芸用培養土(パワーソイル; 呉羽化学工業株式会社)に播種後2週間栽培した植物を用いた。ハクサイ、カブ、ベンサミアナタバコは、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。イネは、日周は16時間明期で光強度は約130μmol m-2 s-1、28℃で栽培した。
【0092】
(2)バリン施用および高温処理
バリンの施用は、ハクサイ、カブ、ベンサミアナタバコには植物体地上部へのバリン散布により、イネにはバリンの根圏施用により行った。ハクサイ、カブ、ベンサミアナタバコに対するバリン散布は、バリンの25mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。対照区には水にアプローチBIを添加したものを散布した。イネに対するバリン根圏施用は、25mMに調製したバリン水溶液にイネ栽培ポットを浸漬し、ポット底面からバリン水溶液を吸収させることで、根圏施用とした。その後各通常栽培温度で48時間栽培し、続いてそれぞれ高温処理に供した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、高温条件設定した器内にバリン処理した植物体を静置することで高温処理とした。作物によって高温に対する感受性が異なるため、ハクサイ、カブに対しては45℃ 80分間、ベンサミアナタバコに対しては45℃ 4時間、イネに対しては47℃ 4時間の処理を行い、高温処理とした。その後再び各通常栽培温度で栽培した。
【0093】
(3)バリンの高温耐性付与効果の評価
各作物におけるバリン施用の効果は、高温処理後の作物を2日間栽培し、地上部新鮮重量を測定して、対照区とバリン処理区との重量比を、対照区の重量平均値を100%として算出し比較を行うことで評価した。
【0094】
(4)結果
各作物にバリンを施用して高温処理した上で、新鮮重量を相対的に算出した結果を表2に示す。表2には、それぞれ最低4個体の重量平均値とSDを示した。表3に示すとおり、どの作物種においてもバリン処理区での地上部新鮮重量比が100%以上となり、対照区に比べて高温障害による重量低下の抑制が認められた。このことより、バリンによる高温耐性付与効果が、植物種を問わず普遍的な現象であることが明らかとなった。
【0095】
【表2】

【0096】
〔実施例8〕バリン構造類縁化合物の高温耐性付与効果
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には11日間無菌栽培した植物を用いた。
【0097】
(2)バリン構造類縁化合物散布および高温処理
バリン構造類縁化合物としては、L-バリンのエナンチオマーであるD-バリン(Nacalai tesque)、バリンと同じく分岐鎖アミノ酸であるロイシン(Nacalai tesque)、およびバリン生合成の前駆体であるα−ケトイソ吉草酸(α-KIV;SIGMA)を用いた。各化合物の25mMまたは50mM水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理した。対照区には水にアプローチBIを添加したものを散布した。その後23℃で24時間栽培し、それぞれ高温処理に供した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン散布したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。
【0098】
(3)葉組織のクロロフィル含量定量
クロロフィル定量はPorra, R., et al., Biochimica et Biophysica Acta, 1989, 975:384-394に記載されている方法により行った。高温処理2日後、シロイヌナズナの第5、6葉を1サンプルあたり5個体分回収してサンプリングチューブへ入れた後、直ちに液体窒素を用いて凍結させ-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER (Retsch)により破砕し、50μLの水に懸濁した。これに200μLのアセトンを加えて攪拌し、10,000rpm 5分間の遠心分離後の上清を、水で5倍に希釈した。希釈液200μLを96ウェルプレートに入れ、プレートリーダーSpectraMax M2 (Molecular Devices)を用いて647nm(クロロフィルaの吸収波長)および664nm(クロロフィルbの吸収波長)の吸光度を測定し、クロロフィル含量を算出した。
【0099】
(4)結果
各バリン構造類縁化合物を散布して高温処理した上で、クロロフィル含量を定量した結果を図9に示す。図9には、それぞれ3サンプルの実験の平均値とSDを示した。D-バリンおよびロイシンは、L-バリンに及ばないが中程度のクロロフィル分解抑制効果を示し、α-KIVはL-バリンと同等のクロロフィル分解抑制効果を示した。このようにバリンの構造類似化合物やバリンの生合成経路における中間体は、L-バリンと同様に高温耐性付与効果を有することが明らかとなった。
【0100】
〔実施例9〕アミノ酸代謝変動を誘発する化合物の高温耐性付与効果
バリンは生物のアミノ酸代謝を変動させる性質を有していることから、本実施例では、種々のアミノ酸代謝変動誘発物質について高温耐性付与効果の評価を行った。
【0101】
(1)植物体の栽培方法
植物材料としてシロイヌナズナ(Arabidopsis thaliana)の野生型株Columbia(Col-0)を用いた。栽培には、Murashige and Skoog(MS)培地組成を元にシロイヌナズナ栽培に適した組成に改良したOptMS無機塩類に、1% sucrose、0.8% agarを加えて固めた無菌寒天培地を用いた。10cm径の深底シャーレ(サンセイ医療器材株式会社)を用い、日周は16時間明期で光強度は約100μmol m-2 s-1、23℃で栽培した。実験には11日間無菌栽培した植物を用いた。
【0102】
(2)アミノ酸代謝変動を誘発する化合物散布および高温処理
アミノ酸代謝変動誘発物質としては、除草剤成分として知られるチフェンスルフロンメチル(TSM)、イマザピル(IMZ;和光純薬株式会社)、ビスピリバックナトリウム塩(BisP;和光純薬株式会社)、およびグリホサートを用いた。本実施例では、チフェンスルフロンメチルとしては、チフェンスルフロンメチルを有効成分として含有するハーモニー水和剤(丸和バイオケミカル株式会社)を用いた。また、グリホサートとしては、グリホサートイソプロピルアミン塩を有効成分として含有するラウンドアップ(日産化学工業株式会社;「ラウンドアップ」は同社の登録商標である。)を用いた。散布は、化合物のそれぞれ50ng/mL(TSM)、100ng/mL(IMZ)、100ng/mL(BisP)、10μM(グリホサート)の水溶液を調製し、展着剤としてアプローチBI(花王(株))を1/1000濃度で添加し、分注ビン(サンプラテック)を用いて寒天上の植物体地上部へ溶液を約1mL/100cm2で噴霧処理することで行った。上記濃度は、一般的に農業における除草目的で使用される濃度よりも相当低濃度である。対照区には水にアプローチBIを添加したものを散布した。その後23℃で24時間栽培し、それぞれ高温処理に供した。高温処理には、インキュベーターBR-43FL(株式会社タイテック)を用い、45℃に設定した器内にバリン散布したシャーレを90分間静置することで高温処理とした。その後再び23℃で栽培した。
【0103】
(3)葉組織のクロロフィル含量定量
クロロフィル定量はPorra, R., et al., Biochimica et Biophysica Acta, 1989, 975:384-394に記載されている方法により行った。高温処理2日後、シロイヌナズナの第5、6葉を1サンプルあたり5個体分回収してサンプリングチューブへ入れた後、直ちに液体窒素を用いて凍結させ-80℃で保存した。凍結状態のまま植物破砕機MM300 MIXER MILL GRINDER (Retsch)により破砕し、50μLの水に懸濁した。これに200μLのアセトンを加えて攪拌し、10,000rpm 5分間の遠心分離後の上清を、水で5倍に希釈した。希釈液200μLを96ウェルプレートに入れ、プレートリーダーSpectraMax M2 (Molecular Devices)を用いて647nm(クロロフィルaの吸収波長)および664nm(クロロフィルbの吸収波長)の吸光度を測定し、クロロフィル含量を算出した。
【0104】
(4)結果
各アミノ酸代謝変動誘発物質(除草剤成分)を散布してそれぞれ高温処理し、クロロフィル含量を定量した結果を図10に示す。図10には、それぞれ3サンプルの実験の平均値とSDを示した。いずれの化合物も、バリンと同等のクロロフィル分解抑制効果を示した。このように除草剤成分に代表される、植物のアミノ酸代謝変動誘発物質は、バリンと同様の高温耐性付与効果を有することが明らかとなった。
【特許請求の範囲】
【請求項1】
植物のアミノ酸代謝を変化させる性質を有する化合物を含有する、植物高温ストレス耐性付与剤。
【請求項2】
前記性質が、植物のアミノ酸の生合成を阻害する性質である、請求項1に記載の植物高温ストレス耐性付与剤。
【請求項3】
前記化合物が、分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体からなる群より選択される1またはそれ以上の化合物である、請求項1または2に記載の植物高温ストレス耐性付与剤。
【請求項4】
前記化合物が、分岐鎖アミノ酸合成酵素阻害活性または芳香族アミノ酸合成酵素阻害活性を有する除草剤成分からなる群より選択される1またはそれ以上の化合物である、請求項1または2に記載の植物高温ストレス耐性付与剤。
【請求項5】
前記化合物が、バリン、ロイシン、およびα−ケトイソ吉草酸から選択される1またはそれ以上の化合物である、請求項3に記載の植物高温ストレス耐性付与剤。
【請求項6】
前記化合物が、チフェンスルフロンメチル、イマザピル、ビスピリバックナトリウム塩、およびグリホサートから選択される1またはそれ以上の化合物である、請求項4に記載の植物高温ストレス耐性付与剤。
【請求項7】
前記アミノ酸がL-体である、請求項3または5に記載の植物高温ストレス耐性付与剤。
【請求項8】
前記アミノ酸がD-体である、請求項3または5に記載の植物高温ストレス耐性付与剤。
【請求項9】
付与される耐性の性質が、基礎型である、請求項1〜8のいずれか1項に記載の植物高温ストレス耐性付与剤。
【請求項10】
植物が正常に生育できない高温条件において、正常な生育を促す効果を有する、請求項1〜9のいずれか1項に記載の植物高温ストレス耐性付与剤。
【請求項11】
葉面散布または根圏施用により植物に施用される、請求項1〜10のいずれか1項に記載の植物高温ストレス耐性付与剤。
【請求項12】
請求項1〜11のいずれか1項に記載の植物高温ストレス耐性付与剤を植物に施用することを特徴とする、植物に高温耐性を付与する方法。
【請求項13】
前記植物高温ストレス耐性付与剤を、分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体からなる群より選択される1またはそれ以上の化合物の濃度として、0.2〜200mMの施用濃度で施用する、請求項12に記載の方法。
【請求項14】
前記植物高温ストレス耐性付与剤を、分岐鎖アミノ酸合成酵素阻害活性または芳香族アミノ酸合成酵素阻害活性を有する除草剤成分からなる群より選択される1またはそれ以上の化合物の濃度として、20ng/mL〜200ng/mLまたは0.01mM〜1mMの施用濃度で施用する、請求項12に記載の方法。
【請求項1】
植物のアミノ酸代謝を変化させる性質を有する化合物を含有する、植物高温ストレス耐性付与剤。
【請求項2】
前記性質が、植物のアミノ酸の生合成を阻害する性質である、請求項1に記載の植物高温ストレス耐性付与剤。
【請求項3】
前記化合物が、分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体からなる群より選択される1またはそれ以上の化合物である、請求項1または2に記載の植物高温ストレス耐性付与剤。
【請求項4】
前記化合物が、分岐鎖アミノ酸合成酵素阻害活性または芳香族アミノ酸合成酵素阻害活性を有する除草剤成分からなる群より選択される1またはそれ以上の化合物である、請求項1または2に記載の植物高温ストレス耐性付与剤。
【請求項5】
前記化合物が、バリン、ロイシン、およびα−ケトイソ吉草酸から選択される1またはそれ以上の化合物である、請求項3に記載の植物高温ストレス耐性付与剤。
【請求項6】
前記化合物が、チフェンスルフロンメチル、イマザピル、ビスピリバックナトリウム塩、およびグリホサートから選択される1またはそれ以上の化合物である、請求項4に記載の植物高温ストレス耐性付与剤。
【請求項7】
前記アミノ酸がL-体である、請求項3または5に記載の植物高温ストレス耐性付与剤。
【請求項8】
前記アミノ酸がD-体である、請求項3または5に記載の植物高温ストレス耐性付与剤。
【請求項9】
付与される耐性の性質が、基礎型である、請求項1〜8のいずれか1項に記載の植物高温ストレス耐性付与剤。
【請求項10】
植物が正常に生育できない高温条件において、正常な生育を促す効果を有する、請求項1〜9のいずれか1項に記載の植物高温ストレス耐性付与剤。
【請求項11】
葉面散布または根圏施用により植物に施用される、請求項1〜10のいずれか1項に記載の植物高温ストレス耐性付与剤。
【請求項12】
請求項1〜11のいずれか1項に記載の植物高温ストレス耐性付与剤を植物に施用することを特徴とする、植物に高温耐性を付与する方法。
【請求項13】
前記植物高温ストレス耐性付与剤を、分岐鎖アミノ酸、並びに、それらの生合成経路および消費経路における中間体からなる群より選択される1またはそれ以上の化合物の濃度として、0.2〜200mMの施用濃度で施用する、請求項12に記載の方法。
【請求項14】
前記植物高温ストレス耐性付与剤を、分岐鎖アミノ酸合成酵素阻害活性または芳香族アミノ酸合成酵素阻害活性を有する除草剤成分からなる群より選択される1またはそれ以上の化合物の濃度として、20ng/mL〜200ng/mLまたは0.01mM〜1mMの施用濃度で施用する、請求項12に記載の方法。
【図1】


【図2】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図3】




【図2】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図3】


【公開番号】特開2012−197249(P2012−197249A)
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願番号】特願2011−62796(P2011−62796)
【出願日】平成23年3月22日(2011.3.22)
【出願人】(000000066)味の素株式会社 (887)
【Fターム(参考)】
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願日】平成23年3月22日(2011.3.22)
【出願人】(000000066)味の素株式会社 (887)
【Fターム(参考)】
[ Back to top ]

