選択的セロトニン再取り込み阻害薬の誘発嘔吐に対する制吐剤
【課題】本発明は、選択的セロトニン再取り込み阻害薬投与に伴う悪心・嘔吐などの消化器系副作用を回避する方法及び該副作用に対する治療又は予防のための優れた医薬を提供する。
【解決手段】選択的セロトニン再取り込み阻害薬投与に伴う悪心・嘔吐などの消化器系副作用を誘発することのないSSRIが胃に直接接触しない形態である製剤、及び、4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド又はその生理学的に許容される塩の該副作用に対する制吐作用としての予防又は治療剤。
【解決手段】選択的セロトニン再取り込み阻害薬投与に伴う悪心・嘔吐などの消化器系副作用を誘発することのないSSRIが胃に直接接触しない形態である製剤、及び、4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド又はその生理学的に許容される塩の該副作用に対する制吐作用としての予防又は治療剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、選択的セロトニン再取り込み阻害薬(Selective serotonin reuptake inhibitors; 以下、「SSRI」ということがある)投与に伴う悪心・嘔吐などの消化器系副作用を回避する方法及び該副作用予防又は治療薬に関するものである。具体的には、SSRIが胃に直接接触しない剤型にすること、及び、4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド又はその生理学的に許容される塩を有効成分とする医薬に関する。
【背景技術】
【0002】
選択的セロトニン再取り込み阻害薬は、シナプスにおけるセロトニンの再吸収を阻害し、シナプス間隙のセロトニン濃度を高く維持することにより、うつ症状の改善を示す薬物である。SSRIは第三世代の抗うつ薬として位置づけられており、うつ病のほか、強迫性障害、パニック障害、不安障害全般に広く使用されており、これまでSSRIの臨床上の投与経路は、経口投与のみで処方されており、その剤型は速溶性の胃で薬剤が放出されるような一般的なものが用いられている。しかしながら、SSRIは三環系又は四環系抗うつ薬にみられる抗コリン作用に基づく副作用が少ない反面、悪心・嘔吐などの消化器系副作用の発生頻度が高いことが知られている(非特許文献1及び非特許文献2)。また、SSRIの臨床効果発現には一定期間の投与継続が必要であり、副作用による服用コンプライアンス低下は治療成績に大きく影響すると考えられる。
一般的に、悪心・嘔吐といった症状に対しては臨床において、ドンペリドン、メトクロプラミド、ジフェンヒドラミンなどの制吐剤が広く用いられてきた。しかしながら、下記に示す汎用のSSRI投与に伴う悪心・嘔吐といった副作用に対しては、上記の制吐剤は有効な治療には至っていない(非特許文献3)。従って、SSRIの消化器系副作用の発現機序を検討し、副作用を軽減させる措置をとることは臨床上有用である。
【0003】
一方、選択的セロトニン4(5−HT4)受容体作用薬である(±)−4−アミノ−5−クロロ−2−エトキシ−−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド(以下、「モサプリド」ということがある)は、慢性胃炎に伴う消化器症状(胸焼け、悪心・嘔吐)を改善する消化管運動促進剤として広く使用されており(特許文献1)、そのクエン酸塩・2水和物は、日本においてガスモチンなる商標名のもとに市販されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】米国特許第4,870,074号公報
【非特許文献】
【0005】
【非特許文献1】Hyttel, J. (1994): Pharmacological characterization of selective serotonin reuptake inhibitors (SSRIs), Int. Clin. Psychopharmacol., 9, 19-26
【非特許文献2】McManis, P.G and Talley, N.J. (1997): Nausea and vomiting associated with selective serotonin reuptake inhibitors; incidence, mechanisms and management, CNC Drugs, 8, 394-401
【非特許文献3】Fujiwara, M., Yamashita, N., Hayashi A., Imanishi T., Ichimaru Y. and Baba, J. (2000): Emetic Reaction Induced by a Selective Serotonin Reuptake Inhibitor, Fluvoxamine, in Suncus murinus. Pharmacometerics 59 (3/4) 39-46
【非特許文献4】Matsuki, N., Torii, Y., Ueno, S and Saito, H. (1992): Suncus murinus as an experimental animal model for emesis and motion sickness, In "Mechanisms and Control of Emesis", edited by Bianchi, A.L., Grelot, L., Miller, A.D and King, G.K., John Libbey Eurotext Ltd
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の課題は、選択的セロトニン再取り込み阻害薬投与に伴う悪心・嘔吐などの消化器系副作用を回避する方法び該副作用に対する治療又は予防のための優れた医薬を提供することにある。
【課題を解決するための手段】
【0007】
本発明者らは、種々の選択的セロトニン再取り込み阻害薬投与時の催吐作用について、一般的に、嘔吐の研究に用いられているスンクス(非特許文献3及び非特許文献4)又はイヌを用いて検討し、鋭意研究を行った結果、投与経路を種々変更することで嘔吐等が誘発されなくなることを見出し、臨床上有意に悪心・嘔吐等を誘発せず、服用コンプライアンスが向上する投与方法を見出した。また、下記式(I)で表される4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド又はその生理学的に許容される塩が、該副作用に対して顕著な制吐作用を有することを見出し、本発明を完成させた。本発明によれば、SSRI投与に伴う悪心・嘔吐などの消化器系副作用を回避する方法としてのSSRIが胃に直接接触しない剤型である製剤、及び該副作用に対する制吐作用を有するモサプリド又はその生理学的に許容される塩が提供される。
【0008】
[項1]4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド(以下、「化合物A」という)又はその生理学的に許容される塩を有効成分とするSSRI投与に伴う悪心及び/又は嘔吐の予防又は治療剤。
[項2]化合物Aの生理学的に許容される塩が、クエン酸・2水和物である項1に記載の予防又は治療剤。
[項3]SSRIを含有する製剤であって、該製剤が、SSRIが胃に直接接触しない形態である製剤。
[項4]製剤が、注射剤、腸溶剤、経鼻剤又は経皮剤のいずれかである項3に記載の製剤。
[項5]SSRIを含有する腸溶剤である項3に記載の製剤。
[項6]SSRIが、パロキセチン、フルボキサミン又はセルトラリンのいずれか1つの薬剤である項1〜5のいずれかに記載の予防若しくは治療剤又は製剤。
[項7]SSRIが、パロキセチンである項1〜5のいずれかに記載の予防若しくは治療剤又は製剤。
【発明の効果】
【0009】
本発明によれば、選択的セロトニン再取り込み阻害薬投与に伴う悪心・嘔吐などの消化器系副作用を軽減する優れた効果を有することが期待できる。
【図面の簡単な説明】
【0010】
【図1】ラット胃迷走神経活動電位に対するパロキセチン(静脈内投与)の作用を示した図である。
【図2】ラット胃迷走神経活動電位に対するパロキセチン(胃内投与)の作用を示した図である。
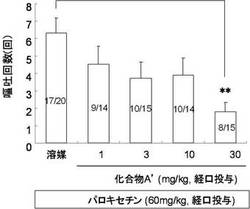
【図3】スンクスにおけるパロキセチン誘発嘔吐に対する化合物A’の作用を示した図である。
【図4】スンクスにおけるフルボキサミン及びセルトラリン誘発嘔吐に対する化合物A’の作用を示した図である。
【図5】イヌにおけるパロキセチン誘発嘔吐に対する化合物A’の作用を示した図である。
【発明を実施するための形態】
【0011】
本発明の課題である悪心・嘔吐を誘発する選択的セロトニン再取り込み阻害薬としては、市販されているSSRIに限らず、今後市販される薬剤であってもSSRIに分類される薬剤であれば特に限定されない。特に本発明の効果が期待できるSSRIとしては、(-)-(3S,4R)-4-(4-fluorophenyl)-3-[(3,4-methylenedioxy)phenoxymethyl]piperidine monohydrochloride hemihydrate(以下、「パロキセチン」)、5-methoxy-1-[4-(trifluoromethyl)phenyl]pentan-1-one (E)-O-(2-aminoethyl)oxime monomaleate(以下、「フルボキサミン」)及び(+)-(1S,4S)-4-(3,4-dichlorophenyl)-1,2,3,4-tetrahydro-N-methyl-1-naphthylamine monohydrochloride(以下、「セルトラリン」)が挙げられる。特に、本発明の効果が期待できる薬剤として、パロキセチンが挙げられる。
【0012】
発明1
本発明の課題であるSSRI投与に伴う嘔吐などを軽減する方法として、SSRIが胃に直接接触しない剤型の製剤を用いることで達成される。具体的には、胃に直接接触しない剤型であれば、特に限定されないが、好ましくは、注射剤、腸溶剤、点鼻剤、経皮剤等が好ましい。その中でも、特に注射剤又は腸溶剤が好ましい。注射剤の場合は、特に一般的によく用いられる皮下注射又は静脈内注射が好ましく、汎用される製剤処方を用いることができる。腸溶剤の場合は、汎用される腸溶性コーティングされた製剤処方を用いることができる。
【0013】
本発明において、上記SSRIは、医薬用担体と混合して調製した医薬組成物の形で医薬として適用される。投与量(有効成分量)は、特に限定されず病態やその進行状況、その他の条件(投与する対象の種類、症状、年齢、体重、性別、合併症、投与期間、投与方法、剤型、感受性差等)によって異なる。通常、成人に対して、SSRIは、例えば皮下注射投与の場合、1日あたり0.1mg〜100mg、好ましくは0.5mg〜30mgで投与され得る。また、腸溶剤で投与する場合は、1日あたり0.3mg〜500mg、好ましくは0.5mg〜100mgで投与され得る。
【0014】
発明2
本発明の課題であるSSRIの経口投与に伴う悪心・嘔吐を軽減する第2の発明としては、SSRIを服用する際に以下の化合物を投与することでその効果が達成される。
【0015】
化合物A又はその生理学的に許容される塩
本発明にかかわる化合物A、すなわち、4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミドは、下記式(I):
【0016】
【化1】

【0017】
で表される化合物である。本発明にかかわる化合物Aはラセミ体であっても、又は一方の光学活性体であってもよいが、ラセミ体が好適である。
【0018】
また、化合物Aはフリー体であってもよいし、その生理学的に許容される塩であってもよい。塩としては好ましくは酸付加塩がよい。例えば、有機酸の付加塩としては、ギ酸塩、酢酸塩、乳酸塩、アジピン酸塩、クエン酸塩、酒石酸塩、フマル酸塩、メタンスルホン酸塩、マレイン酸塩等が挙げられ、無機酸の付加塩としては、塩酸塩、硫酸塩、硝酸塩、リン酸塩等が例示できる。この中で、有機酸塩が好ましく、特にクエン酸塩が好ましい。さらに、化合物A又はその生理学的に許容される塩は、溶媒和物であってもよく、水和物及び非水和物であってもよい。好ましくはクエン酸塩の水和物がよく、とりわけクエン酸塩・2水和物が好ましい。
【0019】
上記化合物A又はその生理学的に許容される塩は、例えば、特許文献1に記載の方法又はそれに準じる方法によって製造することができる。
【0020】
化合物A又はその生理学的に許容される塩は、通常、医薬用担体と混合して調製した医薬組成物の形で医薬として適用される。本発明の医薬の投与経路は、経口投与又は非経口投与のいずれであってもよい。その剤型は、投与経路に応じて適宜選択される。投与量(有効成分量)は、特に限定されず病態やその進行状況、その他の条件(投与する対象の種類、症状、年齢、体重、性別、合併症、投与期間、投与方法、剤型、感受性差等)によって異なる。剤型としては、例えば、注射剤、輸液、散剤、顆粒剤、錠剤、カプセル剤、丸剤、腸溶剤、トローチ、内用液剤、懸濁剤、乳剤、シロップ剤、外用液剤、湿布剤、点鼻剤、点耳剤、点眼剤、吸入剤、軟膏剤、ローション剤、座剤、経腸栄養剤などが挙げられる。本発明においては、特に経口投与が好ましい。
【0021】
本発明で用いられる化合物Aを本発明に用いる場合には、SSRIは胃に接触する形態であっても良い。具体的には、SSRIを経口投与する前又は同時のいずれかのときに化合物Aを投与すること、すなわち、併用することで制吐作用が達成される。また、上記のSSRIの経口投与と同時に化合物Aを投与する方法として、SSRIと化合物Aとの合剤を用いて投与してもよい。
【0022】
本発明の医薬の投与量は、投与の目的や投与対象者の状況(性別、年齢、体重など)に応じて異なる。通常、成人に対して、化合物A(フリー体換算)は、経口投与の場合、1日あたり0.5mg〜300mg、好ましくは1mg〜100mg、一方、非経口投与の場合、1日あたり0.05mg〜100mg、好ましくは0.1mg〜30mgで投与され得る。
【0023】
本発明の製剤又は医薬を投与する対象物は、ヒト又は動物である。本発明の医薬は特にヒトにおける予防又は治療に有用である。
【実施例】
【0024】
以下に、試験例を挙げて本発明について説明する。なお、試験に使用した化合物A’は化合物Aのクエン酸・2水和物であって、大日本住友製薬株式会社製のものを使用した。また、SSRIの例として用いたパロキセチンは、市販のパキシル 20mg錠(グラクソ・スミスクライン株式会社製)又はパキシル錠より抽出され品質保証されたものを使用した。また、フルボキサミン及びセルトラリンは、それぞれルボックス錠(アステラス株式会社製)及びジョイフロスト錠(ファイザー株式会社製)より抽出され品質保証されたものを使用した。
【0025】
以下の実施例及び試験例で用いられる雄性スンクス(50-73 g, Jic:SUN-Her:日本クレア)及びラット(280-330 g, Slc:SD:日本エスエルシー)は、室温20-26℃、湿度40-70%、照明時間7:00〜19:00に設定した飼育室内で飼育し、餌(スンクス用;CIEA-312、ラット用;CE-2 :日本クレア)及び水は自由摂取とした。雄性イヌ(8-13 kg, Nosan: Beagle)は室温18-28℃、湿度40-80%、照明時間7:00〜19:00に設定した飼育室内で飼育し、餌(DS-A:オリエンタル酵母)250g/日を午前中に給餌し、水は自由摂取とした。
【0026】
各種SSRIとして、パロキセチン、フルボキサミン及びセルトラリンを使用した。各種SSRIは40%ポリエチレングリコール(PEG♯400)に溶解し、各試験例で予め設定される各SSRIの各用量が投与されるように調製した溶液を用いて、スンクスには10 mL/kgの容量を経口及び皮下投与し、イヌにおいては0.5 mL/kgの容量を皮下投与した。またイヌにおいては、パロキセチン(パキシル 20mg錠)を1〜4錠(20〜80mg / 動物)経口投与した。化合物A’は0.5%メチルセルロース溶液に懸濁し、スンクスには10 mL/kgの容量で、イヌには1 mL/kg の容量で経口投与した。化合物A’は各種SSRI投与の1時間前に経口投与した。動物は1週間以上の休薬期間の後、嘔吐実験に再度使用した。
【0027】
試験例1 経口投与及び皮下投与による嘔吐誘発実験
各種SSRIをスンクスに経口投与又は皮下投与した後、プラスチックケージ内で1時間行動観察を行い、嘔吐発現潜時及び嘔吐発現回数を記録した。同様に、パロキセチンをイヌに経口投与又は皮下投与し、1時間行動観察を行い、嘔吐発現潜時及び嘔吐発現回数を記録した。各種SSRI(パロキセチン、フルボキサミン及びセルトラリン)をスンクスに経口投与又は皮下投与した結果を表1に示す。
【0028】
【表1】

【0029】
パロキセチン10〜90 mg/kgをスンクスに経口投与すると、用量依存的に嘔吐発現率及び嘔吐回数が増加し、60 mg/kg以上ではすべての動物が嘔吐を惹起した。同様に、フルボキサミン及びセルトラリンをスンクスに経口投与すると、用量依存的な嘔吐発現率及び嘔吐回数の増加が認められた。一方、パロキセチンをスンクスに皮下投与すると、60 mg/kg投与群においても嘔吐を惹起した動物は全くなかった。パロキセチンをイヌに経口投与又は皮下投与した結果を表2に示す。
【0030】
【表2】

【0031】
イヌにおいても同様に、パロキセチンを経口投与すると用量依存的に嘔吐発現率及び嘔吐回数が増加したが、皮下投与では全く嘔吐は誘発されなかった。
これら結果より、SSRI投与による嘔吐などを軽減する方法として、SSRIが胃に直接接触しない剤型の製剤を用いることで達成されることが示唆された。
【0032】
試験例2 電気生理学実験(ラットの迷走神経求心性活動におけるパロキセチンの影響)
ラットをウレタン麻酔下にて食道に走行する迷走神経を剥離し、迷走神経胃枝の求心性神経活動電位を測定した。薬物は静脈内又は胃内投与を行った。ラットの迷走神経胃枝において、5-HT(3〜30μg/kg)の静脈内投与により神経発火が用量依存的に増加することを確認した。神経活動はデータ解析ソフト(UAS-108S)にて1秒間の神経発火数(積算値)として求めた。結果を図1及び図2に示す。
【0033】
本試験において、図1及び図2に示すパロキセチンの各用量が投与されるように調製した溶液を用いて、ラットには2mL/kgの容量のパロキセチンを静脈内投与し、4mL/kgの容量を経口投与した。また5-HTは生理食塩水に溶解し、2mL/kgを静脈内投与した。
【0034】
図1及び図2の結果から、パロキセチン(5及び10 mg/kg)を静脈内投与しても迷走神経の発火に影響を与えなかったが、パロキセチン(30 mg/kg)を胃内投与すると、著しい神経発火の増加が認められた。すなわち、SSRIが惹起する嘔吐反応は、消化管局所における作用の関与が大きく、SSRIの胃粘膜への直接刺激作用、おそらく迷走神経興奮作用により嘔吐が惹起される可能性が考えられた。以上のことから、SSRIが胃粘膜を通過せずに吸収される投与経路、すなわち注射剤、腸溶剤、点鼻剤、経皮剤等を開発すれば嘔吐などを誘発しないSSRI製剤として有用である可能性が示唆された。
【0035】
試験例3 SSRI誘発嘔吐に対する化合物A’の効果
試験例1と同様の方法でスンクスにおいてパロキセチン(60 mg/kg)を経口投与後1時間における嘔吐回数を測定した。化合物A’(1, 3, 10及び30mg/kg)はパロキセチン投与の1時間前に経口投与した。その誘発嘔吐に対して、有意な制吐作用が認められるか確認した(図3)。カラム内の数値は嘔吐発現数(嘔吐匹数/試験動物数)を示す。**P<0.01(パロキセチン単独投与群に対してDunnett 多重比較)。
【0036】
同様に、スンクスにおけるフルボキサミン(120 mg/kg)及びセルトラリン(90 mg/kg)を経口投与後1時間の嘔吐回数を測定した。これらの誘発嘔吐に対しても化合物A’(30mg/kg)が抑制作用を示すか確認した(図4)。カラム内の数値は嘔吐発現数(嘔吐匹数/試験動物数)を示す。*P<0.05(セルトラリン単独投与群に対してStudent's t test)。
【0037】
また、試験例1と同様の方法でイヌにパロキセチン(60 mg/動物) を経口投与後の嘔吐発現までの潜時及び投与後1時間の嘔吐回数を測定した。化合物A’ (1, 3, 10及び30mg/kg)はパロキセチン投与の1時間前に経口投与した(図5)。カラム内の数値は嘔吐発現数(嘔吐匹数/試験動物数)を示す。*P<0.05, **P<0.01(パロキセチン単独投与群に対してDunnett 多重比較)。
【0038】
上記の試験における統計処理としては、嘔吐発現潜時及び嘔吐発現回数について対照群と化合物A’各用量投与群の比較はDunnett 多重比較検定又はStudent's t test検定を用いて行い、危険率5%未満(P<0.05)で統計学的有意差ありと判断した。
【0039】
図3において、化合物A’は用量依存的に嘔吐を抑制し、30mg/kgにて有意な制吐作用を示した。同様に、図4においてスンクスにおけるフルボキサミン(120 mg/kg, p.o.)及びセルトラリン(90 mg/kg, p.o.)誘発嘔吐に対しても化合物A’(30mg/kg)は抑制作用を示した。図5において、化合物A’は用量依存的に嘔吐発現潜時を延長し、嘔吐回数を抑制した。嘔吐回数において、化合物A’は3 mg/kgより有意な制吐作用を示し、30 mg/kgではパロキセチン誘発嘔吐を完全に抑制した。
【0040】
実施例1 パロキセチンの腸溶性製剤
パロキセチン(20g)、コーンスターチ(284g)、カルボキシメチルセルロースカルシウム(40g)、結晶セルロース(50g)及びステアリン酸マグネシウム(6g)を、常法により混合、造粒し、1錠あたり400mgで打錠し、素錠を得る。さらに、メタクリル酸コポリマーLD(20g)を水に分散した分散液により、常法によりコーティングし、1000錠を製する。
【0041】
実施例2 化合物A’とパロキセチンとの合剤
化合物A’(15g)パロキセチン(20g)、コーンスターチ(269g)、カルボキシメチルセルロースカルシウム(40g)、結晶セルロース(50g)及びステアリン酸マグネシウム(6g)を、常法により混合、造粒し、1錠あたり400mgで打錠し、1000錠を製する。
【産業上の利用可能性】
【0042】
本発明は、選択的セロトニン再取り込み阻害薬投与に伴う悪心・嘔吐などの消化器系副作用を軽減する優れた効果を有することが期待できる。すなわち、SSRIが胃粘膜を通過せずに吸収される剤型、すなわち注射剤、腸溶剤、点鼻剤、経皮剤等を開発すれば悪心・嘔吐を誘発しないSSRI製剤として有用であることが期待できる。また、4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド(以下、「化合物A」という)又はその生理学的に許容される塩は、各種SSRI投与に伴う誘発悪心・嘔吐に対して制吐作用を示すことを明らかにし、化合物AがSSRIによる消化器系副作用である悪心・嘔吐を軽減させる有用な薬剤として期待できる。
【技術分野】
【0001】
本発明は、選択的セロトニン再取り込み阻害薬(Selective serotonin reuptake inhibitors; 以下、「SSRI」ということがある)投与に伴う悪心・嘔吐などの消化器系副作用を回避する方法及び該副作用予防又は治療薬に関するものである。具体的には、SSRIが胃に直接接触しない剤型にすること、及び、4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド又はその生理学的に許容される塩を有効成分とする医薬に関する。
【背景技術】
【0002】
選択的セロトニン再取り込み阻害薬は、シナプスにおけるセロトニンの再吸収を阻害し、シナプス間隙のセロトニン濃度を高く維持することにより、うつ症状の改善を示す薬物である。SSRIは第三世代の抗うつ薬として位置づけられており、うつ病のほか、強迫性障害、パニック障害、不安障害全般に広く使用されており、これまでSSRIの臨床上の投与経路は、経口投与のみで処方されており、その剤型は速溶性の胃で薬剤が放出されるような一般的なものが用いられている。しかしながら、SSRIは三環系又は四環系抗うつ薬にみられる抗コリン作用に基づく副作用が少ない反面、悪心・嘔吐などの消化器系副作用の発生頻度が高いことが知られている(非特許文献1及び非特許文献2)。また、SSRIの臨床効果発現には一定期間の投与継続が必要であり、副作用による服用コンプライアンス低下は治療成績に大きく影響すると考えられる。
一般的に、悪心・嘔吐といった症状に対しては臨床において、ドンペリドン、メトクロプラミド、ジフェンヒドラミンなどの制吐剤が広く用いられてきた。しかしながら、下記に示す汎用のSSRI投与に伴う悪心・嘔吐といった副作用に対しては、上記の制吐剤は有効な治療には至っていない(非特許文献3)。従って、SSRIの消化器系副作用の発現機序を検討し、副作用を軽減させる措置をとることは臨床上有用である。
【0003】
一方、選択的セロトニン4(5−HT4)受容体作用薬である(±)−4−アミノ−5−クロロ−2−エトキシ−−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド(以下、「モサプリド」ということがある)は、慢性胃炎に伴う消化器症状(胸焼け、悪心・嘔吐)を改善する消化管運動促進剤として広く使用されており(特許文献1)、そのクエン酸塩・2水和物は、日本においてガスモチンなる商標名のもとに市販されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】米国特許第4,870,074号公報
【非特許文献】
【0005】
【非特許文献1】Hyttel, J. (1994): Pharmacological characterization of selective serotonin reuptake inhibitors (SSRIs), Int. Clin. Psychopharmacol., 9, 19-26
【非特許文献2】McManis, P.G and Talley, N.J. (1997): Nausea and vomiting associated with selective serotonin reuptake inhibitors; incidence, mechanisms and management, CNC Drugs, 8, 394-401
【非特許文献3】Fujiwara, M., Yamashita, N., Hayashi A., Imanishi T., Ichimaru Y. and Baba, J. (2000): Emetic Reaction Induced by a Selective Serotonin Reuptake Inhibitor, Fluvoxamine, in Suncus murinus. Pharmacometerics 59 (3/4) 39-46
【非特許文献4】Matsuki, N., Torii, Y., Ueno, S and Saito, H. (1992): Suncus murinus as an experimental animal model for emesis and motion sickness, In "Mechanisms and Control of Emesis", edited by Bianchi, A.L., Grelot, L., Miller, A.D and King, G.K., John Libbey Eurotext Ltd
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の課題は、選択的セロトニン再取り込み阻害薬投与に伴う悪心・嘔吐などの消化器系副作用を回避する方法び該副作用に対する治療又は予防のための優れた医薬を提供することにある。
【課題を解決するための手段】
【0007】
本発明者らは、種々の選択的セロトニン再取り込み阻害薬投与時の催吐作用について、一般的に、嘔吐の研究に用いられているスンクス(非特許文献3及び非特許文献4)又はイヌを用いて検討し、鋭意研究を行った結果、投与経路を種々変更することで嘔吐等が誘発されなくなることを見出し、臨床上有意に悪心・嘔吐等を誘発せず、服用コンプライアンスが向上する投与方法を見出した。また、下記式(I)で表される4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド又はその生理学的に許容される塩が、該副作用に対して顕著な制吐作用を有することを見出し、本発明を完成させた。本発明によれば、SSRI投与に伴う悪心・嘔吐などの消化器系副作用を回避する方法としてのSSRIが胃に直接接触しない剤型である製剤、及び該副作用に対する制吐作用を有するモサプリド又はその生理学的に許容される塩が提供される。
【0008】
[項1]4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド(以下、「化合物A」という)又はその生理学的に許容される塩を有効成分とするSSRI投与に伴う悪心及び/又は嘔吐の予防又は治療剤。
[項2]化合物Aの生理学的に許容される塩が、クエン酸・2水和物である項1に記載の予防又は治療剤。
[項3]SSRIを含有する製剤であって、該製剤が、SSRIが胃に直接接触しない形態である製剤。
[項4]製剤が、注射剤、腸溶剤、経鼻剤又は経皮剤のいずれかである項3に記載の製剤。
[項5]SSRIを含有する腸溶剤である項3に記載の製剤。
[項6]SSRIが、パロキセチン、フルボキサミン又はセルトラリンのいずれか1つの薬剤である項1〜5のいずれかに記載の予防若しくは治療剤又は製剤。
[項7]SSRIが、パロキセチンである項1〜5のいずれかに記載の予防若しくは治療剤又は製剤。
【発明の効果】
【0009】
本発明によれば、選択的セロトニン再取り込み阻害薬投与に伴う悪心・嘔吐などの消化器系副作用を軽減する優れた効果を有することが期待できる。
【図面の簡単な説明】
【0010】
【図1】ラット胃迷走神経活動電位に対するパロキセチン(静脈内投与)の作用を示した図である。
【図2】ラット胃迷走神経活動電位に対するパロキセチン(胃内投与)の作用を示した図である。
【図3】スンクスにおけるパロキセチン誘発嘔吐に対する化合物A’の作用を示した図である。
【図4】スンクスにおけるフルボキサミン及びセルトラリン誘発嘔吐に対する化合物A’の作用を示した図である。
【図5】イヌにおけるパロキセチン誘発嘔吐に対する化合物A’の作用を示した図である。
【発明を実施するための形態】
【0011】
本発明の課題である悪心・嘔吐を誘発する選択的セロトニン再取り込み阻害薬としては、市販されているSSRIに限らず、今後市販される薬剤であってもSSRIに分類される薬剤であれば特に限定されない。特に本発明の効果が期待できるSSRIとしては、(-)-(3S,4R)-4-(4-fluorophenyl)-3-[(3,4-methylenedioxy)phenoxymethyl]piperidine monohydrochloride hemihydrate(以下、「パロキセチン」)、5-methoxy-1-[4-(trifluoromethyl)phenyl]pentan-1-one (E)-O-(2-aminoethyl)oxime monomaleate(以下、「フルボキサミン」)及び(+)-(1S,4S)-4-(3,4-dichlorophenyl)-1,2,3,4-tetrahydro-N-methyl-1-naphthylamine monohydrochloride(以下、「セルトラリン」)が挙げられる。特に、本発明の効果が期待できる薬剤として、パロキセチンが挙げられる。
【0012】
発明1
本発明の課題であるSSRI投与に伴う嘔吐などを軽減する方法として、SSRIが胃に直接接触しない剤型の製剤を用いることで達成される。具体的には、胃に直接接触しない剤型であれば、特に限定されないが、好ましくは、注射剤、腸溶剤、点鼻剤、経皮剤等が好ましい。その中でも、特に注射剤又は腸溶剤が好ましい。注射剤の場合は、特に一般的によく用いられる皮下注射又は静脈内注射が好ましく、汎用される製剤処方を用いることができる。腸溶剤の場合は、汎用される腸溶性コーティングされた製剤処方を用いることができる。
【0013】
本発明において、上記SSRIは、医薬用担体と混合して調製した医薬組成物の形で医薬として適用される。投与量(有効成分量)は、特に限定されず病態やその進行状況、その他の条件(投与する対象の種類、症状、年齢、体重、性別、合併症、投与期間、投与方法、剤型、感受性差等)によって異なる。通常、成人に対して、SSRIは、例えば皮下注射投与の場合、1日あたり0.1mg〜100mg、好ましくは0.5mg〜30mgで投与され得る。また、腸溶剤で投与する場合は、1日あたり0.3mg〜500mg、好ましくは0.5mg〜100mgで投与され得る。
【0014】
発明2
本発明の課題であるSSRIの経口投与に伴う悪心・嘔吐を軽減する第2の発明としては、SSRIを服用する際に以下の化合物を投与することでその効果が達成される。
【0015】
化合物A又はその生理学的に許容される塩
本発明にかかわる化合物A、すなわち、4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミドは、下記式(I):
【0016】
【化1】

【0017】
で表される化合物である。本発明にかかわる化合物Aはラセミ体であっても、又は一方の光学活性体であってもよいが、ラセミ体が好適である。
【0018】
また、化合物Aはフリー体であってもよいし、その生理学的に許容される塩であってもよい。塩としては好ましくは酸付加塩がよい。例えば、有機酸の付加塩としては、ギ酸塩、酢酸塩、乳酸塩、アジピン酸塩、クエン酸塩、酒石酸塩、フマル酸塩、メタンスルホン酸塩、マレイン酸塩等が挙げられ、無機酸の付加塩としては、塩酸塩、硫酸塩、硝酸塩、リン酸塩等が例示できる。この中で、有機酸塩が好ましく、特にクエン酸塩が好ましい。さらに、化合物A又はその生理学的に許容される塩は、溶媒和物であってもよく、水和物及び非水和物であってもよい。好ましくはクエン酸塩の水和物がよく、とりわけクエン酸塩・2水和物が好ましい。
【0019】
上記化合物A又はその生理学的に許容される塩は、例えば、特許文献1に記載の方法又はそれに準じる方法によって製造することができる。
【0020】
化合物A又はその生理学的に許容される塩は、通常、医薬用担体と混合して調製した医薬組成物の形で医薬として適用される。本発明の医薬の投与経路は、経口投与又は非経口投与のいずれであってもよい。その剤型は、投与経路に応じて適宜選択される。投与量(有効成分量)は、特に限定されず病態やその進行状況、その他の条件(投与する対象の種類、症状、年齢、体重、性別、合併症、投与期間、投与方法、剤型、感受性差等)によって異なる。剤型としては、例えば、注射剤、輸液、散剤、顆粒剤、錠剤、カプセル剤、丸剤、腸溶剤、トローチ、内用液剤、懸濁剤、乳剤、シロップ剤、外用液剤、湿布剤、点鼻剤、点耳剤、点眼剤、吸入剤、軟膏剤、ローション剤、座剤、経腸栄養剤などが挙げられる。本発明においては、特に経口投与が好ましい。
【0021】
本発明で用いられる化合物Aを本発明に用いる場合には、SSRIは胃に接触する形態であっても良い。具体的には、SSRIを経口投与する前又は同時のいずれかのときに化合物Aを投与すること、すなわち、併用することで制吐作用が達成される。また、上記のSSRIの経口投与と同時に化合物Aを投与する方法として、SSRIと化合物Aとの合剤を用いて投与してもよい。
【0022】
本発明の医薬の投与量は、投与の目的や投与対象者の状況(性別、年齢、体重など)に応じて異なる。通常、成人に対して、化合物A(フリー体換算)は、経口投与の場合、1日あたり0.5mg〜300mg、好ましくは1mg〜100mg、一方、非経口投与の場合、1日あたり0.05mg〜100mg、好ましくは0.1mg〜30mgで投与され得る。
【0023】
本発明の製剤又は医薬を投与する対象物は、ヒト又は動物である。本発明の医薬は特にヒトにおける予防又は治療に有用である。
【実施例】
【0024】
以下に、試験例を挙げて本発明について説明する。なお、試験に使用した化合物A’は化合物Aのクエン酸・2水和物であって、大日本住友製薬株式会社製のものを使用した。また、SSRIの例として用いたパロキセチンは、市販のパキシル 20mg錠(グラクソ・スミスクライン株式会社製)又はパキシル錠より抽出され品質保証されたものを使用した。また、フルボキサミン及びセルトラリンは、それぞれルボックス錠(アステラス株式会社製)及びジョイフロスト錠(ファイザー株式会社製)より抽出され品質保証されたものを使用した。
【0025】
以下の実施例及び試験例で用いられる雄性スンクス(50-73 g, Jic:SUN-Her:日本クレア)及びラット(280-330 g, Slc:SD:日本エスエルシー)は、室温20-26℃、湿度40-70%、照明時間7:00〜19:00に設定した飼育室内で飼育し、餌(スンクス用;CIEA-312、ラット用;CE-2 :日本クレア)及び水は自由摂取とした。雄性イヌ(8-13 kg, Nosan: Beagle)は室温18-28℃、湿度40-80%、照明時間7:00〜19:00に設定した飼育室内で飼育し、餌(DS-A:オリエンタル酵母)250g/日を午前中に給餌し、水は自由摂取とした。
【0026】
各種SSRIとして、パロキセチン、フルボキサミン及びセルトラリンを使用した。各種SSRIは40%ポリエチレングリコール(PEG♯400)に溶解し、各試験例で予め設定される各SSRIの各用量が投与されるように調製した溶液を用いて、スンクスには10 mL/kgの容量を経口及び皮下投与し、イヌにおいては0.5 mL/kgの容量を皮下投与した。またイヌにおいては、パロキセチン(パキシル 20mg錠)を1〜4錠(20〜80mg / 動物)経口投与した。化合物A’は0.5%メチルセルロース溶液に懸濁し、スンクスには10 mL/kgの容量で、イヌには1 mL/kg の容量で経口投与した。化合物A’は各種SSRI投与の1時間前に経口投与した。動物は1週間以上の休薬期間の後、嘔吐実験に再度使用した。
【0027】
試験例1 経口投与及び皮下投与による嘔吐誘発実験
各種SSRIをスンクスに経口投与又は皮下投与した後、プラスチックケージ内で1時間行動観察を行い、嘔吐発現潜時及び嘔吐発現回数を記録した。同様に、パロキセチンをイヌに経口投与又は皮下投与し、1時間行動観察を行い、嘔吐発現潜時及び嘔吐発現回数を記録した。各種SSRI(パロキセチン、フルボキサミン及びセルトラリン)をスンクスに経口投与又は皮下投与した結果を表1に示す。
【0028】
【表1】

【0029】
パロキセチン10〜90 mg/kgをスンクスに経口投与すると、用量依存的に嘔吐発現率及び嘔吐回数が増加し、60 mg/kg以上ではすべての動物が嘔吐を惹起した。同様に、フルボキサミン及びセルトラリンをスンクスに経口投与すると、用量依存的な嘔吐発現率及び嘔吐回数の増加が認められた。一方、パロキセチンをスンクスに皮下投与すると、60 mg/kg投与群においても嘔吐を惹起した動物は全くなかった。パロキセチンをイヌに経口投与又は皮下投与した結果を表2に示す。
【0030】
【表2】

【0031】
イヌにおいても同様に、パロキセチンを経口投与すると用量依存的に嘔吐発現率及び嘔吐回数が増加したが、皮下投与では全く嘔吐は誘発されなかった。
これら結果より、SSRI投与による嘔吐などを軽減する方法として、SSRIが胃に直接接触しない剤型の製剤を用いることで達成されることが示唆された。
【0032】
試験例2 電気生理学実験(ラットの迷走神経求心性活動におけるパロキセチンの影響)
ラットをウレタン麻酔下にて食道に走行する迷走神経を剥離し、迷走神経胃枝の求心性神経活動電位を測定した。薬物は静脈内又は胃内投与を行った。ラットの迷走神経胃枝において、5-HT(3〜30μg/kg)の静脈内投与により神経発火が用量依存的に増加することを確認した。神経活動はデータ解析ソフト(UAS-108S)にて1秒間の神経発火数(積算値)として求めた。結果を図1及び図2に示す。
【0033】
本試験において、図1及び図2に示すパロキセチンの各用量が投与されるように調製した溶液を用いて、ラットには2mL/kgの容量のパロキセチンを静脈内投与し、4mL/kgの容量を経口投与した。また5-HTは生理食塩水に溶解し、2mL/kgを静脈内投与した。
【0034】
図1及び図2の結果から、パロキセチン(5及び10 mg/kg)を静脈内投与しても迷走神経の発火に影響を与えなかったが、パロキセチン(30 mg/kg)を胃内投与すると、著しい神経発火の増加が認められた。すなわち、SSRIが惹起する嘔吐反応は、消化管局所における作用の関与が大きく、SSRIの胃粘膜への直接刺激作用、おそらく迷走神経興奮作用により嘔吐が惹起される可能性が考えられた。以上のことから、SSRIが胃粘膜を通過せずに吸収される投与経路、すなわち注射剤、腸溶剤、点鼻剤、経皮剤等を開発すれば嘔吐などを誘発しないSSRI製剤として有用である可能性が示唆された。
【0035】
試験例3 SSRI誘発嘔吐に対する化合物A’の効果
試験例1と同様の方法でスンクスにおいてパロキセチン(60 mg/kg)を経口投与後1時間における嘔吐回数を測定した。化合物A’(1, 3, 10及び30mg/kg)はパロキセチン投与の1時間前に経口投与した。その誘発嘔吐に対して、有意な制吐作用が認められるか確認した(図3)。カラム内の数値は嘔吐発現数(嘔吐匹数/試験動物数)を示す。**P<0.01(パロキセチン単独投与群に対してDunnett 多重比較)。
【0036】
同様に、スンクスにおけるフルボキサミン(120 mg/kg)及びセルトラリン(90 mg/kg)を経口投与後1時間の嘔吐回数を測定した。これらの誘発嘔吐に対しても化合物A’(30mg/kg)が抑制作用を示すか確認した(図4)。カラム内の数値は嘔吐発現数(嘔吐匹数/試験動物数)を示す。*P<0.05(セルトラリン単独投与群に対してStudent's t test)。
【0037】
また、試験例1と同様の方法でイヌにパロキセチン(60 mg/動物) を経口投与後の嘔吐発現までの潜時及び投与後1時間の嘔吐回数を測定した。化合物A’ (1, 3, 10及び30mg/kg)はパロキセチン投与の1時間前に経口投与した(図5)。カラム内の数値は嘔吐発現数(嘔吐匹数/試験動物数)を示す。*P<0.05, **P<0.01(パロキセチン単独投与群に対してDunnett 多重比較)。
【0038】
上記の試験における統計処理としては、嘔吐発現潜時及び嘔吐発現回数について対照群と化合物A’各用量投与群の比較はDunnett 多重比較検定又はStudent's t test検定を用いて行い、危険率5%未満(P<0.05)で統計学的有意差ありと判断した。
【0039】
図3において、化合物A’は用量依存的に嘔吐を抑制し、30mg/kgにて有意な制吐作用を示した。同様に、図4においてスンクスにおけるフルボキサミン(120 mg/kg, p.o.)及びセルトラリン(90 mg/kg, p.o.)誘発嘔吐に対しても化合物A’(30mg/kg)は抑制作用を示した。図5において、化合物A’は用量依存的に嘔吐発現潜時を延長し、嘔吐回数を抑制した。嘔吐回数において、化合物A’は3 mg/kgより有意な制吐作用を示し、30 mg/kgではパロキセチン誘発嘔吐を完全に抑制した。
【0040】
実施例1 パロキセチンの腸溶性製剤
パロキセチン(20g)、コーンスターチ(284g)、カルボキシメチルセルロースカルシウム(40g)、結晶セルロース(50g)及びステアリン酸マグネシウム(6g)を、常法により混合、造粒し、1錠あたり400mgで打錠し、素錠を得る。さらに、メタクリル酸コポリマーLD(20g)を水に分散した分散液により、常法によりコーティングし、1000錠を製する。
【0041】
実施例2 化合物A’とパロキセチンとの合剤
化合物A’(15g)パロキセチン(20g)、コーンスターチ(269g)、カルボキシメチルセルロースカルシウム(40g)、結晶セルロース(50g)及びステアリン酸マグネシウム(6g)を、常法により混合、造粒し、1錠あたり400mgで打錠し、1000錠を製する。
【産業上の利用可能性】
【0042】
本発明は、選択的セロトニン再取り込み阻害薬投与に伴う悪心・嘔吐などの消化器系副作用を軽減する優れた効果を有することが期待できる。すなわち、SSRIが胃粘膜を通過せずに吸収される剤型、すなわち注射剤、腸溶剤、点鼻剤、経皮剤等を開発すれば悪心・嘔吐を誘発しないSSRI製剤として有用であることが期待できる。また、4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド(以下、「化合物A」という)又はその生理学的に許容される塩は、各種SSRI投与に伴う誘発悪心・嘔吐に対して制吐作用を示すことを明らかにし、化合物AがSSRIによる消化器系副作用である悪心・嘔吐を軽減させる有用な薬剤として期待できる。
【特許請求の範囲】
【請求項1】
4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド(以下、「化合物A」という)又はその生理学的に許容される塩を有効成分とするSSRI投与に伴う悪心及び/又は嘔吐の予防又は治療剤。
【請求項2】
化合物Aの生理学的に許容される塩が、クエン酸・2水和物である請求項1に記載の予防又は治療剤。
【請求項3】
SSRIを含有する製剤であって、該製剤が、SSRIが胃に直接接触しない形態である製剤。
【請求項4】
製剤が、注射剤、腸溶剤、経鼻剤又は経皮剤のいずれかである請求項3に記載の製剤。
【請求項5】
SSRIを含有する腸溶剤である請求項3に記載の製剤。
【請求項6】
SSRIが、パロキセチン、フルボキサミン又はセルトラリンのいずれか1つの薬剤である請求項1〜5のいずれかに記載の予防若しくは治療剤又は製剤。
【請求項7】
SSRIが、パロキセチンである請求項1〜5のいずれかに記載の予防若しくは治療剤又は製剤。
【請求項1】
4−アミノ−5−クロロ−2−エトキシ−N−[[4−(4−フルオロベンジル)−2−モルホリニル]メチル]ベンズアミド(以下、「化合物A」という)又はその生理学的に許容される塩を有効成分とするSSRI投与に伴う悪心及び/又は嘔吐の予防又は治療剤。
【請求項2】
化合物Aの生理学的に許容される塩が、クエン酸・2水和物である請求項1に記載の予防又は治療剤。
【請求項3】
SSRIを含有する製剤であって、該製剤が、SSRIが胃に直接接触しない形態である製剤。
【請求項4】
製剤が、注射剤、腸溶剤、経鼻剤又は経皮剤のいずれかである請求項3に記載の製剤。
【請求項5】
SSRIを含有する腸溶剤である請求項3に記載の製剤。
【請求項6】
SSRIが、パロキセチン、フルボキサミン又はセルトラリンのいずれか1つの薬剤である請求項1〜5のいずれかに記載の予防若しくは治療剤又は製剤。
【請求項7】
SSRIが、パロキセチンである請求項1〜5のいずれかに記載の予防若しくは治療剤又は製剤。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−49643(P2013−49643A)
【公開日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願番号】特願2011−187568(P2011−187568)
【出願日】平成23年8月30日(2011.8.30)
【出願人】(000002912)大日本住友製薬株式会社 (332)
【Fターム(参考)】
【公開日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願日】平成23年8月30日(2011.8.30)
【出願人】(000002912)大日本住友製薬株式会社 (332)
【Fターム(参考)】
[ Back to top ]

