酵母の形質転換方法
【課題】コンピテントセルの調整が不要で、簡易にかつ多数の菌株を処理することのできる、酵母の形質転換方法を提供する。
【解決手段】形質転換用DNA、キャリアDNA、ポリエチレングリコールおよびリチウム塩を含む緩衝液からなり、100μLあたり形質転換用DNAを0.5〜10μg、キャリアDNAを該形質転換用DNAに対し20倍質量以上含む処理溶液に、SD固体培地上で培養した酵母菌体を形質転換用DNA1μgあたり1×107個以上添加して、25〜35℃で30分以上インキュベーションすることを特徴とする、分裂酵母を形質転換用DNAで形質転換して形質転換体を製造する方法。
【解決手段】形質転換用DNA、キャリアDNA、ポリエチレングリコールおよびリチウム塩を含む緩衝液からなり、100μLあたり形質転換用DNAを0.5〜10μg、キャリアDNAを該形質転換用DNAに対し20倍質量以上含む処理溶液に、SD固体培地上で培養した酵母菌体を形質転換用DNA1μgあたり1×107個以上添加して、25〜35℃で30分以上インキュベーションすることを特徴とする、分裂酵母を形質転換用DNAで形質転換して形質転換体を製造する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、宿主である酵母に形質転換用DNAを導入して形質転換を行う方法に関するものである。
【背景技術】
【0002】
酵母を宿主とし、組換えDNA技術を用いた異種タンパク質生産系は、既に知られている微生物学の方法と組換えDNA技術を用いて容易に実施でき、かつ高い生産能力を示すため、既に大容量の培養も実施されて実生産に急速に利用されてきている。実生産にあたり、実験室で得られた菌体あたりの高い産生効率はスケールアップ後も維持される。
【0003】
しかしながら、実生産の場合にしばしば求められる、より低コストの生産法を考えた場合、菌体の増殖効率そのものの向上、目的異種タンパク質の分解の抑制、酵母特有の修飾の効率的実施、栄養源の利用効率の向上、などの異種タンパク質の産生効率を向上させる方策が必要と考えられる。そのためには不要遺伝子を破壊する、必要遺伝子を付加する等の酵母宿主の改変が提案されている(特許文献1参照)。その場合、改変した多数の酵母宿主すべてについて異種タンパク質が効率よく生産できるかについて検討する必要があり、そのためには改変された種々の酵母宿主を各々形質転換して、形質転換体を獲得する必要がある。
【0004】
酵母の形質転換方法としては、これまで酢酸リチウム法、エレクトロポレーション法、スフェロプラスト法、ガラスビーズ法等の方法が開発されてきた。エレクトロポレーション法は簡便で効率の良い形質転換方法として広く用いられ、形質転換効率が高く、長期間保存可能なコンピテントセルの調製方法について多くの研究が成されてきた。しかしながらこれらの方法はコンピテントセルを調製する必要があるため、一度に多数の変異株等の菌株を扱う場合は不適切と考えられた。そこでパン酵母(Saccharomyces cerevisiae)などの出芽酵母では酢酸リチウム法を基に、簡便性を追求した簡易形質転換方法が開発されてきた(非特許文献1〜非特許文献3参照)。簡易形質転換方法の形質転換効率は菌体の培養条件によって異なるが、プレート上のコロニーを直接用い、96穴マイクロプレートを用いた方法では形質転換体約300個/μgDNAの形質転換効率が得られている(非特許文献3参照)。これらの簡易形質転換方法の形質転換効率は低いので、高い効率を要求されない場合には有効な方法である。形質転換効率の上昇のための工夫もいくつかなされている(非特許文献4〜非特許文献6参照)。しかし、多数の宿主を同時に扱える簡便さと形質転換効率の上昇の両方を満たす工夫には至っていない。
【0005】
一方、酵母のうちでも分裂酵母は進化過程で他の酵母とは早い時期に分かれ、別の進化をとげた結果、出芽ではなく分裂という手段で増殖することからもわかるように、動物細胞に近い性質を持つことが知られている。このため異種タンパク質を発現させる宿主として分裂酵母、特にシゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe、以下S.pombeという)、を用いることによって、動物細胞の場合と同様の、より天然体に近い遺伝子産物が得られることが期待される。しかし、前記の簡易形質転換方法は出芽酵母を対象に開発されたものであり、分裂酵母においてはこのような簡易形質転換方法の開発はほとんど検討されていない。出芽酵母における前記簡易形質転換方法を分裂酵母に適用しても形質転換可能ではあるが、転換効率は出芽酵母に比較してはるかに低く、実用的な方法ではない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第02/101038号パンフレット
【非特許文献】
【0007】
【非特許文献1】Rapid colony transformation of Saccharomyces cerevisiae. Rohan Baker, Nucleic Acids Reserch, 1991, 19 (8), 1945.
【非特許文献2】Simple and Efficient Procedure for Transformation of Yeast. Randolph Elble, Bio Techniques, 1992, 13 (1), 18-20.
【非特許文献3】An Efficient Procedure for Multiple Transformation of Yeast in Parallel. Antonio A. Firmenich and Kevin Redding, Bio Techniques, 1993, 14 (5), 713-718.
【非特許文献4】Studies on the transformation of Intact Yeast Cells by the LiAc/SS-DNA/PEG Procedure. R. Daniel Gietz, Robert H. Schiestl, Andrew R. Willems, and Robin A. Woods, Yeast, 1995, 11, 355-360.
【非特許文献5】Ethanol improves the transformation efficiency of intact yeast cells. Vit Lauermann Curr. Genet. 1991, 20, 1-3.
【非特許文献6】An Improved Protocol for the Preparation of Yeast Cells for Transformation by Electroporation. J. R. Thompson, E. Register, J. Curotto, M. Kurtz and R. kelly, Yeast, 1998, 14, 565-571.
【発明の概要】
【発明が解決しようとする課題】
【0008】
これらの状況を鑑み、分裂酵母に対する形質転換方法として、遺伝子破壊株等の多種の宿主菌体に対して同時に簡便に形質転換でき、しかも効率の高い方法を見いだすことは、異種タンパク質を効率よく生産するための重要な手段であり、形質転換の簡便化、効率化は、産生効率の良い形質転換体を選択するのに必要な課題であると考えられる。
【課題を解決するための手段】
【0009】
本発明者は、コロニーを直接用いた単純な操作で行い得る、形質転換効率の高い分裂酵母の簡易形質転換方法に関する下記発明である。
【0010】
分裂酵母を形質転換用DNAで形質転換して形質転換体を製造する方法において、形質転換用DNA、キャリアDNA、ポリエチレングリコールおよびリチウム塩を含む緩衝液からなり、100μLあたり形質転換用DNAを0.5〜10μg、キャリアDNAを該形質転換用DNAに対し20倍質量以上含む処理溶液に、SD(Synthetic Dextrose)固体培地上で培養した酵母菌体を形質転換用DNA1μgあたり1×107個以上添加して、25〜35℃で30分以上インキュベーションすることを特徴とする分裂酵母の形質転換方法。
【0011】
また、上記形質転換方法においてはマイクロプレートを使用して形質転換を行うことが好ましい。さらに、分裂酵母としては、シゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)であることが好ましい。
【発明の効果】
【0012】
本形質転換法では、コンピテントセルの調製を不要とし、簡便な操作で効率よく形質転換体を取得することができるため、一度にたくさんの菌株を形質転換する場合に有効である。また、処理溶液量の調整により96穴マイクロプレートなどを用いた複数菌体への同時形質転換を行うことができる。その結果、異種タンパク質の産生効率が上昇した株などを容易に選択することができるようになる。
【図面の簡単な説明】
【0013】
【図1】実施例1における持ち込み菌体数と形質転換菌体数との関係を示すグラフ。
【図2】実施例3における固体培地の種類によるインキュベーション時間と形質転換菌体数との関係を示すグラフ。
【図3】実施例4におけるキャリアDNA量と形質転換転換菌体数との関係を示すグラフ。
【発明を実施するための形態】
【0014】
これまでに知られている出芽酵母の簡易形質転換法は簡便性に重点を置き、酢酸リチウム法を改良して開発された方法で、固形培地上で培養したコロニーを直接用いて一度に複数の菌体を形質転換することが可能である。形質転換効率は培養条件によって異なり、固体培地上のコロニーを直接用いる場合、液体培養菌体と比較して形質転換効率は低くなる(液体培養菌体:形質転換体約10000個/μgDNA、コロニー:形質転換体960〜4000個/μgDNA)(前記非特許文献1〜非特許文献3参照)。しかし、同様の方法で出芽酵母でなく分裂酵母のコロニーを用いた場合は形質転換体208個/μgDNAであった(前記非特許文献3参照)。本発明は、形質転換条件を最適化することで形質転換効率を向上させて、これらの従来方法に比較して簡便で形質転換効率のよい分裂酵母の簡易形質転換法である。
【0015】
本発明の形質転換方法は、分裂酵母を形質転換する方法である。分裂酵母としてはシゾサッカロマイセス属の酵母であれば特に限定されないが、従来形質転換用宿主として研究や応用が進んでいるシゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)が好ましい。
【0016】
本発明の形質転換方法では、分裂酵母を固体培地上で培養し、得られるこの固体培地上の菌体を形質転換に供する。固体培地としては特に限定されず、分裂酵母培養に従来より使用されている固体培地を使用できる。具体的には、例えば、SD(Synthetic Dextrose)固体培地、MM(Minimal medium)固体培地、YES(Yeast Extract with supplements)固体培地などが好ましく、特に比較的短いインキュベーション時間で形質転換効率の高い培養酵母が得られるSD固体培地が好ましい。これら培地の組成は公知であり、例えば以下の文献に記載されている。液体培地の場合はそれに3%程度の寒天を添加して対応する固体培地とすることができる。
【0017】
SD培地:Burke D, Dawson D, and Stearns T. Methods in yeast genetics: A Cold Spring Harbor Laboratory Course Manual. Plainview: Cold Spring Harbor Laboratory Press, 2000. pp172.
MM培地:Alfa C, Fantes P, Hyams J, McLeod M, and Warbrick E. Experiments with fission yeast: A laboratory course manual. Plainview: Cold Spring Harbor Laboratory Press, 1993.pp 134.
YES培地:Moreno S, Klar A, and Nurse P. Molecular genetic analysis of fission yeast Schizosaccharomyces pombe. In: Guthrie C, Fink GR eds. Methods in Enzymology. Volume 194: Guide to yeast genetics and molecular biology. San Diego: Academic Press, Inc., 1991: 795-823.pp801.
固体培地上での培養時間は特に限定されないが、1日〜10日程度が好ましく、培養効率を高めるためには、1日〜5日間培養して形質転換に供することが好ましい。また、最小限の栄養成分しか含まない上記のような固体培地には必要により栄養源を添加して使用することができる。この追加の栄養源は多すぎると転換効率が低下しやすい。飢餓状態の菌ほど転換効率が高いといわれることもあるが、栄養源が少なすぎると菌の発育が不充分となるおそれがある。本発明における固体培地としてはグルコースなどの糖を5%以下添加した上記のようなSD固体培地等を使用することが好ましい。
【0018】
本発明の形質転換方法において使用する形質転換処理用の処理溶液は、導入目的の遺伝子を含む形質転換用DNA、キャリアDNA、ポリエチレングリコールおよびリチウム塩を含む緩衝液からなる。
【0019】
形質転換用DNAは形質転換の目的である導入する遺伝子を含む限りどのようなものであってもよいが、通常当該遺伝子を含む、発現ベクターなどのプラスミドDNA、遺伝子破壊用や遺伝子置換用のPCR増幅断片などが使用される。形質転換用DNAは環状DNA(プラスミドDNAなど)であっても線状DNA(PCR増幅断片など)であってもよい。発現ベクターには通常当該遺伝子以外にプロモーター遺伝子、マーカー遺伝子、複製開始点などの遺伝子領域を含む。発現ベクターは、マルチクローニングベクターに目的遺伝子を導入して構築されたものであってもよい。これら形質転換用DNAの大きさは特に限定されないが、通常1000〜20Kbp程度のものが使用される。
【0020】
処理用液中の形質転換用DNAの量は100μLあたり0.5〜10μg使用する。形質転換用DNAの量が多いほど形質転換菌体数は多くなるが形質転換用DNAあたりの転換効率は余り高くならず、また経済的でもないのでこの程度の量が適当と考えられ、特に0.5〜2μg程度が最適である。
【0021】
キャリアーDNAは、形質転換効率の向上に必要な成分であり、通常約200〜5000bpのサイズのSingle Strand DNAが使用される。例えば、サーモン精子DNA、子牛胸腺DNAやコイ精子DNAなどが使用できる。キャリアーDNAの量は形質転換用DNAに対して20倍質量以上使用する。キャリアーDNAの量が多いほど形質転換効率は高まるが使用量が多くなりすぎると経済性を損ね、その上限は1万倍質量程度が適当である。より好ましいキャリアーDNAの量は形質転換用DNAに対して50〜500倍質量である。
【0022】
ポリエチレングリコール(PEG)は形質転換方法に広く使用されている化合物であり、その分子量は500〜2万程度のものが使用され、特に1000〜8000程度の分子量を有するポリエチレングリコールが好ましい。リチウム塩も同じく形質転換方法に広く使用されている化合物であり、塩酸塩などの鉱酸塩、カルボン酸塩やスルホン酸塩などの有機酸塩がある。リチウム塩としては特にカルボン酸塩が好ましく、常用されている酢酸塩が最も好ましい。これらポリエチレングリコールとリチウム塩の処理用液中の量は、常用されている量が使用され、例えば、ポリエチレングリコールは10〜70%(w/v)程度が好ましく、リチウム塩は100μLあたり10〜500mmol程度が好ましい。
【0023】
処理溶液は緩衝作用を有する水溶液であり、通常上記成分以外にトリス(Tris)−HClやEDTAを含む。これらの量は形質転換方法に常用されている量が使用される。そのpHは4.5〜5.5程度に調整されていることが好ましい。pHがこの範囲外であると形質転換効率が低下しやすい。
【0024】
前記固体倍地上で培養した菌体を上記処理溶液に添加し、インキュベーションを行って形質転換体を得る。菌体量は、形質転換用DNA1μgあたり1×107個以上必要である。この菌体数が少ないと十分な数の形質転換体が得られない。より好ましい菌体数は3×107個以上である。また、処理溶液に添加する菌体数が多すぎると転換効率が低下する傾向にある。したがって、菌体数の上限は5×108個程度が好ましい。より好ましい上限は、1.5×108個程度である。インキュベーション時間は30分以上である。通常インキュベーション時間が長くなるほど形質転換した菌体数は増加するが、長時間インキュベーションを行うことは効率的ではなく、また、長時間のインキュベーションでは菌の死滅につながることがある。したがって、インキュベーション時間の上限は3日程度が適当である。また、本発明の目的である効率的な形質転換を行うためにはインキュベーション時間は短いほうがよく、したがって、48時間以下とすることがより好ましい。最も好ましくは、30分〜24時間のインキュベーションが採用される。特に、効率的な形質転換を行うためには、30分〜12時間のインキュベーションが好ましい。なお、インキュベーション温度は特に限定されるものではないが、25〜35℃が適当である。処理溶液によるインキュベーション終了後に菌体を選択培地で培養することにより、形質転換した菌体が得られる。
【0025】
処理溶液で処理する前に菌体を前処理して転換効率を高めることができ、また上記インキュベーション後かつ選択培地で培養する前に菌体を後処理して転換効率を高めることもできる。代表的な後処理としてはヒートショック処理がある。例えば、上記インキュベーション後に菌体を水に懸濁させ38〜45℃程度の温度に5〜30分曝し、その後に選択培地で培養することにより形質転換効率を高めることができる。前処理としては、高張液処理、還元剤処理など、従来転換効率を向上させるための前処理として公知の処理を本発明においても行い、形質転換効率を向上させることができる。高張液処理としては2.0Mのソルビトール水溶液に接触させる方法など、比較的高い濃度の糖や塩などの水溶液に接触させる処理がある。還元剤処理としてはDTT(ジチオスレイトール)に接触させる処理がある。これら前処理や後処理は複数の処理を組み合わせて行うこともできる。
【0026】
本発明の方法を使用した形質転換方法において、最も効率的に形質転換体を得る(最少の原材料を使用し最も短時間で目的の形質転換菌体数を得る)基本プロトコールとしては以下の方法がある。この方法を基準にし、目的に応じて変換した本発明の方法を用いて形質転換体を得ることができる。
【0027】
1.菌体を2%のグルコースを添加したSD固体培地で培養する。
【0028】
2.処理溶液として、10μLの形質転換用DNA水溶液(1.0μgの形質転換用DNAを含む)、10μLのキャリアDNA水溶液(100μgのキャリアDNAを含む)、70μLの処理原水溶液(50w/vのPEG4000、100mMの酢酸リチウム、10mMのTris−HClおよび1mMのEDTAを含む:pH=4.9)および残余の水を混合して100μLとしたものを使用する。
【0029】
3.上記1.の菌体約5×107個を上記2.の処理溶液に添加し、30℃で1時間インキュベーションして形質転換し、その後この形質転換菌体を含む処理溶液を直接選択培地に加えて形質転換体を選択する。
【0030】
4.上記3.の形質転換処理をマイクロプレートを使用して行う。
【0031】
上記基本プロトコールはより幅広い条件に適応するため、できるだけ穏やかで単純な操作手順を基本としたので、通常の株だけでなく例えば、温度、浸透圧感受性等様々な性質を示す変異株への使用も可能と考えられる。この方法で形質転換体約3000個/μgDNA/1hの効率を得ることができる。
【0032】
本発明の形質転換方法は、プレート上のコロニーを直接使用するため、コンピテントセルを調製する必要がなく、操作が非常に単純であり、反応液の量が少ないため96穴マイクロプレートを用いた複数の菌株の同時形質転換への応用が可能である。さらに、この方法は形質転換効率を向上させるために菌体の前処理の追加することができる。前処理を追加することにより、インキュベーション時間の短縮や形質転換効率のさらなる向上が可能となる。
【実施例】
【0033】
以下に本発明を具体的な実施例によりさらに詳細に説明する。実施例等では、形質転換用DNAとして公知のpAL(Tanaka, K., Yanagida, T., Kawasaki, Y., Kai, M., Furuya, K., Iwasaki, M., Murakami, H., Yanagida, M. and Okayama, H. (2000) Fission yeast Eso1p is required for establishing sister chromatid cohesion during S phase. Mol. Cell. Biol. 20, 3459-3469)を使用し、キャリアDNAとして市販のサケ精子DNAを使用した。菌株はシゾサッカロマイセス・ポンベARC039(S.pombe:h−, leu1-32, ura4-C190T)を用いた。また、インキュベーション処理は96穴マイクロプレートを用いて行った。
【0034】
[実施例1]
酵母菌体をMM固体培地上で3日間培養し、そこにできたコロニーを、直接100μLの処理溶液[10μLのpAL水溶液(1.0μgのpALを含む)、10μLのキャリアDNA水溶液(100μgのキャリアDNAを含む)、70μLの処理原水溶液(50w/vのPEG4000、100mMの酢酸リチウム、10mMのTris−HClおよび1mMのEDTAを含む:pH=4.9)および残余の水を混合して100μLとしたもの]に加え、30℃で1日間インキュベーション後、42℃で15分ヒートショック処理し、選択培地上に塗布し、培養して形質転換体の数を測定した。図1に持ち込み菌体数と形質転換菌体数との関係を示す。
【0035】
上記形質転換方法において、持ち込み菌体量を図1の横軸に示すように変化させたところ、得られた形質転換体数(/μgDNA)は縦軸に示す様に変化し、得られる形質転換体数は持ち込み菌体量が5×107〜1×108個(/100μL処理溶液)の時に最大となった。1×107個より少ない菌体数では形質転換効率は500個/μgDNAに到達しないため、酵母菌体は形質転換用DNA1μgあたり3×107個以上添加しない条件では効率的な形質転換はできないことが明らかになった。
【0036】
[実施例2]
持ち込み菌体を5×107個(/100μL処理溶液)として、処理用液中のpALの量を変える以外は実施例1と同じ実験を行った。その結果、処理溶液100μLあたり0.5μgより少ない場合は、形質転換効率は500個/μgDNA以下になり(0.1μgのpALの場合、315個/μgDNA)、効率的形質転換はできないことがわかった。
【0037】
[実施例3]
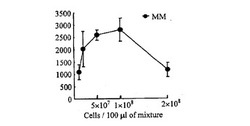
酵母菌体をSD固体培地上、MM固体培地上、YES固体培地上でそれぞれ3日間培養し、そこにできたコロニーをそれぞれ持ち込み菌体量を5×107個(/100μL処理溶液)として使用し、実施例1と同じ実験を行った。図2に固体培地の種類によるインキュベーション時間と形質転換菌体数との関係を示す。
【0038】
SD固体培地上で生育した菌体を用いた場合、得られる形質転換体数は1時間のインキュベーションで最大になった(600個/μgDNA/1h)。MM固体培地を用いた場合、インキュベーション時間に伴って形質転換体数が上昇し(3000個/μgDNA/72h)、得られる形質転換体数は使用した3種類の培地中で最も多かったが長いインキュベーション時間を必要とした。YES固体培地を用いた場合、形質転換効率は低かった(MM固体培地の約1/10)。しかしいずれの場合もインキュベーション時間を30分未満にした場合は、形質転換効率は500個/μgDNA以下になり、効率的形質転換はできないことがわかった。
【0039】
[実施例4]
持ち込み菌体を5×107個(/100μL処理溶液)として、処理用液中のキャリアーDNA量を変化させる以外は実施例1と同じ試験を行った。キャリアーDNAを100μgまで増加させたところ、形質転換効率の上昇が確認できたが、キャリアーDNA量がpALの20倍質量未満の場合、形質転換効率は500個/μgDNA以下になり、効率的形質転換はできないことがわかった。図3にキャリアDNA量と形質転換転換菌体数との関係を示す。
【産業上の利用可能性】
【0040】
酵母を宿主とし、組換えDNA技術を用いた異種タンパク質生産系を構築するためには、より効率的に異種タンパク質を産生できる酵母宿主の開発が必要である。酵母宿主の開発には、改変した多数の酵母宿主について異種タンパク質が効率よく生産できるか否かを評価する必要があり、そのためには改変された種々の酵母宿主を各々形質転換して、形質転換体を獲得する必要がある。本発明の方法は特にこの酵母宿主の評価を効率的に行うために有用な簡便かつ効率的な形質転換方法として使用できる。
【技術分野】
【0001】
本発明は、宿主である酵母に形質転換用DNAを導入して形質転換を行う方法に関するものである。
【背景技術】
【0002】
酵母を宿主とし、組換えDNA技術を用いた異種タンパク質生産系は、既に知られている微生物学の方法と組換えDNA技術を用いて容易に実施でき、かつ高い生産能力を示すため、既に大容量の培養も実施されて実生産に急速に利用されてきている。実生産にあたり、実験室で得られた菌体あたりの高い産生効率はスケールアップ後も維持される。
【0003】
しかしながら、実生産の場合にしばしば求められる、より低コストの生産法を考えた場合、菌体の増殖効率そのものの向上、目的異種タンパク質の分解の抑制、酵母特有の修飾の効率的実施、栄養源の利用効率の向上、などの異種タンパク質の産生効率を向上させる方策が必要と考えられる。そのためには不要遺伝子を破壊する、必要遺伝子を付加する等の酵母宿主の改変が提案されている(特許文献1参照)。その場合、改変した多数の酵母宿主すべてについて異種タンパク質が効率よく生産できるかについて検討する必要があり、そのためには改変された種々の酵母宿主を各々形質転換して、形質転換体を獲得する必要がある。
【0004】
酵母の形質転換方法としては、これまで酢酸リチウム法、エレクトロポレーション法、スフェロプラスト法、ガラスビーズ法等の方法が開発されてきた。エレクトロポレーション法は簡便で効率の良い形質転換方法として広く用いられ、形質転換効率が高く、長期間保存可能なコンピテントセルの調製方法について多くの研究が成されてきた。しかしながらこれらの方法はコンピテントセルを調製する必要があるため、一度に多数の変異株等の菌株を扱う場合は不適切と考えられた。そこでパン酵母(Saccharomyces cerevisiae)などの出芽酵母では酢酸リチウム法を基に、簡便性を追求した簡易形質転換方法が開発されてきた(非特許文献1〜非特許文献3参照)。簡易形質転換方法の形質転換効率は菌体の培養条件によって異なるが、プレート上のコロニーを直接用い、96穴マイクロプレートを用いた方法では形質転換体約300個/μgDNAの形質転換効率が得られている(非特許文献3参照)。これらの簡易形質転換方法の形質転換効率は低いので、高い効率を要求されない場合には有効な方法である。形質転換効率の上昇のための工夫もいくつかなされている(非特許文献4〜非特許文献6参照)。しかし、多数の宿主を同時に扱える簡便さと形質転換効率の上昇の両方を満たす工夫には至っていない。
【0005】
一方、酵母のうちでも分裂酵母は進化過程で他の酵母とは早い時期に分かれ、別の進化をとげた結果、出芽ではなく分裂という手段で増殖することからもわかるように、動物細胞に近い性質を持つことが知られている。このため異種タンパク質を発現させる宿主として分裂酵母、特にシゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe、以下S.pombeという)、を用いることによって、動物細胞の場合と同様の、より天然体に近い遺伝子産物が得られることが期待される。しかし、前記の簡易形質転換方法は出芽酵母を対象に開発されたものであり、分裂酵母においてはこのような簡易形質転換方法の開発はほとんど検討されていない。出芽酵母における前記簡易形質転換方法を分裂酵母に適用しても形質転換可能ではあるが、転換効率は出芽酵母に比較してはるかに低く、実用的な方法ではない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第02/101038号パンフレット
【非特許文献】
【0007】
【非特許文献1】Rapid colony transformation of Saccharomyces cerevisiae. Rohan Baker, Nucleic Acids Reserch, 1991, 19 (8), 1945.
【非特許文献2】Simple and Efficient Procedure for Transformation of Yeast. Randolph Elble, Bio Techniques, 1992, 13 (1), 18-20.
【非特許文献3】An Efficient Procedure for Multiple Transformation of Yeast in Parallel. Antonio A. Firmenich and Kevin Redding, Bio Techniques, 1993, 14 (5), 713-718.
【非特許文献4】Studies on the transformation of Intact Yeast Cells by the LiAc/SS-DNA/PEG Procedure. R. Daniel Gietz, Robert H. Schiestl, Andrew R. Willems, and Robin A. Woods, Yeast, 1995, 11, 355-360.
【非特許文献5】Ethanol improves the transformation efficiency of intact yeast cells. Vit Lauermann Curr. Genet. 1991, 20, 1-3.
【非特許文献6】An Improved Protocol for the Preparation of Yeast Cells for Transformation by Electroporation. J. R. Thompson, E. Register, J. Curotto, M. Kurtz and R. kelly, Yeast, 1998, 14, 565-571.
【発明の概要】
【発明が解決しようとする課題】
【0008】
これらの状況を鑑み、分裂酵母に対する形質転換方法として、遺伝子破壊株等の多種の宿主菌体に対して同時に簡便に形質転換でき、しかも効率の高い方法を見いだすことは、異種タンパク質を効率よく生産するための重要な手段であり、形質転換の簡便化、効率化は、産生効率の良い形質転換体を選択するのに必要な課題であると考えられる。
【課題を解決するための手段】
【0009】
本発明者は、コロニーを直接用いた単純な操作で行い得る、形質転換効率の高い分裂酵母の簡易形質転換方法に関する下記発明である。
【0010】
分裂酵母を形質転換用DNAで形質転換して形質転換体を製造する方法において、形質転換用DNA、キャリアDNA、ポリエチレングリコールおよびリチウム塩を含む緩衝液からなり、100μLあたり形質転換用DNAを0.5〜10μg、キャリアDNAを該形質転換用DNAに対し20倍質量以上含む処理溶液に、SD(Synthetic Dextrose)固体培地上で培養した酵母菌体を形質転換用DNA1μgあたり1×107個以上添加して、25〜35℃で30分以上インキュベーションすることを特徴とする分裂酵母の形質転換方法。
【0011】
また、上記形質転換方法においてはマイクロプレートを使用して形質転換を行うことが好ましい。さらに、分裂酵母としては、シゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)であることが好ましい。
【発明の効果】
【0012】
本形質転換法では、コンピテントセルの調製を不要とし、簡便な操作で効率よく形質転換体を取得することができるため、一度にたくさんの菌株を形質転換する場合に有効である。また、処理溶液量の調整により96穴マイクロプレートなどを用いた複数菌体への同時形質転換を行うことができる。その結果、異種タンパク質の産生効率が上昇した株などを容易に選択することができるようになる。
【図面の簡単な説明】
【0013】
【図1】実施例1における持ち込み菌体数と形質転換菌体数との関係を示すグラフ。
【図2】実施例3における固体培地の種類によるインキュベーション時間と形質転換菌体数との関係を示すグラフ。
【図3】実施例4におけるキャリアDNA量と形質転換転換菌体数との関係を示すグラフ。
【発明を実施するための形態】
【0014】
これまでに知られている出芽酵母の簡易形質転換法は簡便性に重点を置き、酢酸リチウム法を改良して開発された方法で、固形培地上で培養したコロニーを直接用いて一度に複数の菌体を形質転換することが可能である。形質転換効率は培養条件によって異なり、固体培地上のコロニーを直接用いる場合、液体培養菌体と比較して形質転換効率は低くなる(液体培養菌体:形質転換体約10000個/μgDNA、コロニー:形質転換体960〜4000個/μgDNA)(前記非特許文献1〜非特許文献3参照)。しかし、同様の方法で出芽酵母でなく分裂酵母のコロニーを用いた場合は形質転換体208個/μgDNAであった(前記非特許文献3参照)。本発明は、形質転換条件を最適化することで形質転換効率を向上させて、これらの従来方法に比較して簡便で形質転換効率のよい分裂酵母の簡易形質転換法である。
【0015】
本発明の形質転換方法は、分裂酵母を形質転換する方法である。分裂酵母としてはシゾサッカロマイセス属の酵母であれば特に限定されないが、従来形質転換用宿主として研究や応用が進んでいるシゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)が好ましい。
【0016】
本発明の形質転換方法では、分裂酵母を固体培地上で培養し、得られるこの固体培地上の菌体を形質転換に供する。固体培地としては特に限定されず、分裂酵母培養に従来より使用されている固体培地を使用できる。具体的には、例えば、SD(Synthetic Dextrose)固体培地、MM(Minimal medium)固体培地、YES(Yeast Extract with supplements)固体培地などが好ましく、特に比較的短いインキュベーション時間で形質転換効率の高い培養酵母が得られるSD固体培地が好ましい。これら培地の組成は公知であり、例えば以下の文献に記載されている。液体培地の場合はそれに3%程度の寒天を添加して対応する固体培地とすることができる。
【0017】
SD培地:Burke D, Dawson D, and Stearns T. Methods in yeast genetics: A Cold Spring Harbor Laboratory Course Manual. Plainview: Cold Spring Harbor Laboratory Press, 2000. pp172.
MM培地:Alfa C, Fantes P, Hyams J, McLeod M, and Warbrick E. Experiments with fission yeast: A laboratory course manual. Plainview: Cold Spring Harbor Laboratory Press, 1993.pp 134.
YES培地:Moreno S, Klar A, and Nurse P. Molecular genetic analysis of fission yeast Schizosaccharomyces pombe. In: Guthrie C, Fink GR eds. Methods in Enzymology. Volume 194: Guide to yeast genetics and molecular biology. San Diego: Academic Press, Inc., 1991: 795-823.pp801.
固体培地上での培養時間は特に限定されないが、1日〜10日程度が好ましく、培養効率を高めるためには、1日〜5日間培養して形質転換に供することが好ましい。また、最小限の栄養成分しか含まない上記のような固体培地には必要により栄養源を添加して使用することができる。この追加の栄養源は多すぎると転換効率が低下しやすい。飢餓状態の菌ほど転換効率が高いといわれることもあるが、栄養源が少なすぎると菌の発育が不充分となるおそれがある。本発明における固体培地としてはグルコースなどの糖を5%以下添加した上記のようなSD固体培地等を使用することが好ましい。
【0018】
本発明の形質転換方法において使用する形質転換処理用の処理溶液は、導入目的の遺伝子を含む形質転換用DNA、キャリアDNA、ポリエチレングリコールおよびリチウム塩を含む緩衝液からなる。
【0019】
形質転換用DNAは形質転換の目的である導入する遺伝子を含む限りどのようなものであってもよいが、通常当該遺伝子を含む、発現ベクターなどのプラスミドDNA、遺伝子破壊用や遺伝子置換用のPCR増幅断片などが使用される。形質転換用DNAは環状DNA(プラスミドDNAなど)であっても線状DNA(PCR増幅断片など)であってもよい。発現ベクターには通常当該遺伝子以外にプロモーター遺伝子、マーカー遺伝子、複製開始点などの遺伝子領域を含む。発現ベクターは、マルチクローニングベクターに目的遺伝子を導入して構築されたものであってもよい。これら形質転換用DNAの大きさは特に限定されないが、通常1000〜20Kbp程度のものが使用される。
【0020】
処理用液中の形質転換用DNAの量は100μLあたり0.5〜10μg使用する。形質転換用DNAの量が多いほど形質転換菌体数は多くなるが形質転換用DNAあたりの転換効率は余り高くならず、また経済的でもないのでこの程度の量が適当と考えられ、特に0.5〜2μg程度が最適である。
【0021】
キャリアーDNAは、形質転換効率の向上に必要な成分であり、通常約200〜5000bpのサイズのSingle Strand DNAが使用される。例えば、サーモン精子DNA、子牛胸腺DNAやコイ精子DNAなどが使用できる。キャリアーDNAの量は形質転換用DNAに対して20倍質量以上使用する。キャリアーDNAの量が多いほど形質転換効率は高まるが使用量が多くなりすぎると経済性を損ね、その上限は1万倍質量程度が適当である。より好ましいキャリアーDNAの量は形質転換用DNAに対して50〜500倍質量である。
【0022】
ポリエチレングリコール(PEG)は形質転換方法に広く使用されている化合物であり、その分子量は500〜2万程度のものが使用され、特に1000〜8000程度の分子量を有するポリエチレングリコールが好ましい。リチウム塩も同じく形質転換方法に広く使用されている化合物であり、塩酸塩などの鉱酸塩、カルボン酸塩やスルホン酸塩などの有機酸塩がある。リチウム塩としては特にカルボン酸塩が好ましく、常用されている酢酸塩が最も好ましい。これらポリエチレングリコールとリチウム塩の処理用液中の量は、常用されている量が使用され、例えば、ポリエチレングリコールは10〜70%(w/v)程度が好ましく、リチウム塩は100μLあたり10〜500mmol程度が好ましい。
【0023】
処理溶液は緩衝作用を有する水溶液であり、通常上記成分以外にトリス(Tris)−HClやEDTAを含む。これらの量は形質転換方法に常用されている量が使用される。そのpHは4.5〜5.5程度に調整されていることが好ましい。pHがこの範囲外であると形質転換効率が低下しやすい。
【0024】
前記固体倍地上で培養した菌体を上記処理溶液に添加し、インキュベーションを行って形質転換体を得る。菌体量は、形質転換用DNA1μgあたり1×107個以上必要である。この菌体数が少ないと十分な数の形質転換体が得られない。より好ましい菌体数は3×107個以上である。また、処理溶液に添加する菌体数が多すぎると転換効率が低下する傾向にある。したがって、菌体数の上限は5×108個程度が好ましい。より好ましい上限は、1.5×108個程度である。インキュベーション時間は30分以上である。通常インキュベーション時間が長くなるほど形質転換した菌体数は増加するが、長時間インキュベーションを行うことは効率的ではなく、また、長時間のインキュベーションでは菌の死滅につながることがある。したがって、インキュベーション時間の上限は3日程度が適当である。また、本発明の目的である効率的な形質転換を行うためにはインキュベーション時間は短いほうがよく、したがって、48時間以下とすることがより好ましい。最も好ましくは、30分〜24時間のインキュベーションが採用される。特に、効率的な形質転換を行うためには、30分〜12時間のインキュベーションが好ましい。なお、インキュベーション温度は特に限定されるものではないが、25〜35℃が適当である。処理溶液によるインキュベーション終了後に菌体を選択培地で培養することにより、形質転換した菌体が得られる。
【0025】
処理溶液で処理する前に菌体を前処理して転換効率を高めることができ、また上記インキュベーション後かつ選択培地で培養する前に菌体を後処理して転換効率を高めることもできる。代表的な後処理としてはヒートショック処理がある。例えば、上記インキュベーション後に菌体を水に懸濁させ38〜45℃程度の温度に5〜30分曝し、その後に選択培地で培養することにより形質転換効率を高めることができる。前処理としては、高張液処理、還元剤処理など、従来転換効率を向上させるための前処理として公知の処理を本発明においても行い、形質転換効率を向上させることができる。高張液処理としては2.0Mのソルビトール水溶液に接触させる方法など、比較的高い濃度の糖や塩などの水溶液に接触させる処理がある。還元剤処理としてはDTT(ジチオスレイトール)に接触させる処理がある。これら前処理や後処理は複数の処理を組み合わせて行うこともできる。
【0026】
本発明の方法を使用した形質転換方法において、最も効率的に形質転換体を得る(最少の原材料を使用し最も短時間で目的の形質転換菌体数を得る)基本プロトコールとしては以下の方法がある。この方法を基準にし、目的に応じて変換した本発明の方法を用いて形質転換体を得ることができる。
【0027】
1.菌体を2%のグルコースを添加したSD固体培地で培養する。
【0028】
2.処理溶液として、10μLの形質転換用DNA水溶液(1.0μgの形質転換用DNAを含む)、10μLのキャリアDNA水溶液(100μgのキャリアDNAを含む)、70μLの処理原水溶液(50w/vのPEG4000、100mMの酢酸リチウム、10mMのTris−HClおよび1mMのEDTAを含む:pH=4.9)および残余の水を混合して100μLとしたものを使用する。
【0029】
3.上記1.の菌体約5×107個を上記2.の処理溶液に添加し、30℃で1時間インキュベーションして形質転換し、その後この形質転換菌体を含む処理溶液を直接選択培地に加えて形質転換体を選択する。
【0030】
4.上記3.の形質転換処理をマイクロプレートを使用して行う。
【0031】
上記基本プロトコールはより幅広い条件に適応するため、できるだけ穏やかで単純な操作手順を基本としたので、通常の株だけでなく例えば、温度、浸透圧感受性等様々な性質を示す変異株への使用も可能と考えられる。この方法で形質転換体約3000個/μgDNA/1hの効率を得ることができる。
【0032】
本発明の形質転換方法は、プレート上のコロニーを直接使用するため、コンピテントセルを調製する必要がなく、操作が非常に単純であり、反応液の量が少ないため96穴マイクロプレートを用いた複数の菌株の同時形質転換への応用が可能である。さらに、この方法は形質転換効率を向上させるために菌体の前処理の追加することができる。前処理を追加することにより、インキュベーション時間の短縮や形質転換効率のさらなる向上が可能となる。
【実施例】
【0033】
以下に本発明を具体的な実施例によりさらに詳細に説明する。実施例等では、形質転換用DNAとして公知のpAL(Tanaka, K., Yanagida, T., Kawasaki, Y., Kai, M., Furuya, K., Iwasaki, M., Murakami, H., Yanagida, M. and Okayama, H. (2000) Fission yeast Eso1p is required for establishing sister chromatid cohesion during S phase. Mol. Cell. Biol. 20, 3459-3469)を使用し、キャリアDNAとして市販のサケ精子DNAを使用した。菌株はシゾサッカロマイセス・ポンベARC039(S.pombe:h−, leu1-32, ura4-C190T)を用いた。また、インキュベーション処理は96穴マイクロプレートを用いて行った。
【0034】
[実施例1]
酵母菌体をMM固体培地上で3日間培養し、そこにできたコロニーを、直接100μLの処理溶液[10μLのpAL水溶液(1.0μgのpALを含む)、10μLのキャリアDNA水溶液(100μgのキャリアDNAを含む)、70μLの処理原水溶液(50w/vのPEG4000、100mMの酢酸リチウム、10mMのTris−HClおよび1mMのEDTAを含む:pH=4.9)および残余の水を混合して100μLとしたもの]に加え、30℃で1日間インキュベーション後、42℃で15分ヒートショック処理し、選択培地上に塗布し、培養して形質転換体の数を測定した。図1に持ち込み菌体数と形質転換菌体数との関係を示す。
【0035】
上記形質転換方法において、持ち込み菌体量を図1の横軸に示すように変化させたところ、得られた形質転換体数(/μgDNA)は縦軸に示す様に変化し、得られる形質転換体数は持ち込み菌体量が5×107〜1×108個(/100μL処理溶液)の時に最大となった。1×107個より少ない菌体数では形質転換効率は500個/μgDNAに到達しないため、酵母菌体は形質転換用DNA1μgあたり3×107個以上添加しない条件では効率的な形質転換はできないことが明らかになった。
【0036】
[実施例2]
持ち込み菌体を5×107個(/100μL処理溶液)として、処理用液中のpALの量を変える以外は実施例1と同じ実験を行った。その結果、処理溶液100μLあたり0.5μgより少ない場合は、形質転換効率は500個/μgDNA以下になり(0.1μgのpALの場合、315個/μgDNA)、効率的形質転換はできないことがわかった。
【0037】
[実施例3]
酵母菌体をSD固体培地上、MM固体培地上、YES固体培地上でそれぞれ3日間培養し、そこにできたコロニーをそれぞれ持ち込み菌体量を5×107個(/100μL処理溶液)として使用し、実施例1と同じ実験を行った。図2に固体培地の種類によるインキュベーション時間と形質転換菌体数との関係を示す。
【0038】
SD固体培地上で生育した菌体を用いた場合、得られる形質転換体数は1時間のインキュベーションで最大になった(600個/μgDNA/1h)。MM固体培地を用いた場合、インキュベーション時間に伴って形質転換体数が上昇し(3000個/μgDNA/72h)、得られる形質転換体数は使用した3種類の培地中で最も多かったが長いインキュベーション時間を必要とした。YES固体培地を用いた場合、形質転換効率は低かった(MM固体培地の約1/10)。しかしいずれの場合もインキュベーション時間を30分未満にした場合は、形質転換効率は500個/μgDNA以下になり、効率的形質転換はできないことがわかった。
【0039】
[実施例4]
持ち込み菌体を5×107個(/100μL処理溶液)として、処理用液中のキャリアーDNA量を変化させる以外は実施例1と同じ試験を行った。キャリアーDNAを100μgまで増加させたところ、形質転換効率の上昇が確認できたが、キャリアーDNA量がpALの20倍質量未満の場合、形質転換効率は500個/μgDNA以下になり、効率的形質転換はできないことがわかった。図3にキャリアDNA量と形質転換転換菌体数との関係を示す。
【産業上の利用可能性】
【0040】
酵母を宿主とし、組換えDNA技術を用いた異種タンパク質生産系を構築するためには、より効率的に異種タンパク質を産生できる酵母宿主の開発が必要である。酵母宿主の開発には、改変した多数の酵母宿主について異種タンパク質が効率よく生産できるか否かを評価する必要があり、そのためには改変された種々の酵母宿主を各々形質転換して、形質転換体を獲得する必要がある。本発明の方法は特にこの酵母宿主の評価を効率的に行うために有用な簡便かつ効率的な形質転換方法として使用できる。
【特許請求の範囲】
【請求項1】
分裂酵母を形質転換用DNAで形質転換して形質転換体を製造する方法において、形質転換用DNA、キャリアDNA、ポリエチレングリコールおよびリチウム塩を含む緩衝液からなり、100μLあたり形質転換用DNAを0.5〜10μg、キャリアDNAを該形質転換用DNAに対し20倍質量以上含む処理溶液に、SD(Synthetic Dextrose)固体培地上で培養した酵母菌体を形質転換用DNA1μgあたり1×107個以上添加して、25〜35℃で30分以上インキュベーションすることを特徴とする分裂酵母の形質転換方法。
【請求項2】
マイクロプレートを使用して形質転換を行う、請求項1に記載の方法。
【請求項3】
分裂酵母がシゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)である、請求項1または2に記載の方法。
【請求項4】
前記インキュベーションの時間が30分〜1時間である請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記酵母菌体が、前記SD固体培地上で1日〜10日培養した酵母菌体である請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記SD固体培地が、5%以下の糖が添加されたSD固体培地である請求項1〜5のいずれか一項に記載の方法。
【請求項1】
分裂酵母を形質転換用DNAで形質転換して形質転換体を製造する方法において、形質転換用DNA、キャリアDNA、ポリエチレングリコールおよびリチウム塩を含む緩衝液からなり、100μLあたり形質転換用DNAを0.5〜10μg、キャリアDNAを該形質転換用DNAに対し20倍質量以上含む処理溶液に、SD(Synthetic Dextrose)固体培地上で培養した酵母菌体を形質転換用DNA1μgあたり1×107個以上添加して、25〜35℃で30分以上インキュベーションすることを特徴とする分裂酵母の形質転換方法。
【請求項2】
マイクロプレートを使用して形質転換を行う、請求項1に記載の方法。
【請求項3】
分裂酵母がシゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)である、請求項1または2に記載の方法。
【請求項4】
前記インキュベーションの時間が30分〜1時間である請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記酵母菌体が、前記SD固体培地上で1日〜10日培養した酵母菌体である請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記SD固体培地が、5%以下の糖が添加されたSD固体培地である請求項1〜5のいずれか一項に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−158256(P2010−158256A)
【公開日】平成22年7月22日(2010.7.22)
【国際特許分類】
【出願番号】特願2010−99985(P2010−99985)
【出願日】平成22年4月23日(2010.4.23)
【分割の表示】特願2004−10373(P2004−10373)の分割
【原出願日】平成16年1月19日(2004.1.19)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成15年度新エネルギー・産業技術総合開発機構、生物機能を活用した生産プロセスの基盤技術開発、産業活力再生特別措置法第30条の適用を受けるもの)
【出願人】(000000044)旭硝子株式会社 (2,665)
【Fターム(参考)】
【公開日】平成22年7月22日(2010.7.22)
【国際特許分類】
【出願日】平成22年4月23日(2010.4.23)
【分割の表示】特願2004−10373(P2004−10373)の分割
【原出願日】平成16年1月19日(2004.1.19)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成15年度新エネルギー・産業技術総合開発機構、生物機能を活用した生産プロセスの基盤技術開発、産業活力再生特別措置法第30条の適用を受けるもの)
【出願人】(000000044)旭硝子株式会社 (2,665)
【Fターム(参考)】
[ Back to top ]

