L−アミノ酸の製造法
【課題】L-アミノ酸を効率よく発酵生産する。
【解決手段】L-アミノ酸生産能を有し、カルボニックアンヒドラーゼ活性が増強されるように改変されたコリネ型細菌を培地で培養して、L-アミノ酸を該培地中又は菌体内に生成蓄積させ、該培地又は菌体よりL-アミノ酸を採取する、L-アミノ酸の製造法。
【解決手段】L-アミノ酸生産能を有し、カルボニックアンヒドラーゼ活性が増強されるように改変されたコリネ型細菌を培地で培養して、L-アミノ酸を該培地中又は菌体内に生成蓄積させ、該培地又は菌体よりL-アミノ酸を採取する、L-アミノ酸の製造法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、L-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-アスパラギン、L-アスパラギン酸、L-リジン、L-メチオニン、L-スレオニン、L-イソロイシンなどのL-アミノ酸を発酵により効率よく製造する方法に関する。
【背景技術】
【0002】
L−アミノ酸は、主としてブレビバクテリウム属、コリネバクテリウム属、ミクロバクテリウム属に属するいわゆるコリネ型細菌のL−アミノ酸生産菌またはそれらの変異株を用いた発酵法により製造されている(例えば、非特許文献1参照)。その他の菌株を用いた発酵法によるL−アミノ酸の製造法としては、バチルス属、ストレプトミセス属、ペニシリウム属等の微生物を用いる方法(例えば、特許文献1参照)、シュードモナス属、アースロバクター属、セラチア属、キャンディダ属等の微生物を用いる方法(例えば、特許文献2参照)、バチルス属、シュードモナス属、セラチア属、アエロバクター・アエロゲネス(現エンテロバクター・アエロゲネス)等の微生物を用いる方法(例えば、特許文献3参照)、エシェリヒア・コリの変異株を用いる方法(例えば、特許文献4参照)等が知られている。また、クレブシエラ属、エルビニア属又はパントテア属、エンテロバクター属に属する微生物を用いたL−アミノ酸の製造法も開示されている(例えば、特許文献5〜7参照)。
【0003】
また、組換えDNA技術によりL−アミノ酸の生合成酵素の活性を増強することによって、L−アミノ酸の生産能を増加させる種々の技術が開示されている。例えば、コリネバクテリウム属またはブレビバクテリウム属細菌において、エシェリヒア・コリ又はコリネバクテリウム・グルタミカム由来のクエン酸シンターゼをコードする遺伝子の導入が、コリネ型細菌のL−グルタミン酸生産能の増強に効果的であったことが報告されている(例えば、特許文献8参照)。またコリネ型細菌由来のクエン酸シンターゼ遺伝子のエンテロバクター属、クレブシエラ属、セラチア属、エルビニア属、又はエシェリヒア属に属する腸内細菌への導入が、L-グルタミン酸生産能の増強に効果的であったことが報告されている(例えば、特許文献9参照)。
【0004】
カルボニックアンヒドラーゼは二酸化炭素と重炭酸根の相互変換に関与している酵素である。エシェリヒア・コリはCan(Carbonic anhydrase 2)、CynT(Carbonic anhydrase 1)の2種のカルボニックアンヒドラーゼを有することが報告されており(非特許文献2、非特許文献3)、Canはβ型のカルボニックアンヒドラーゼであり、エシェリヒア・コリが通常大気の二酸化炭素分圧下で生育するために必須であることがわかっている。Can, CynTはそれぞれyadF,cynT遺伝子にコードされている。一方、コリネバクテリウム・グルタミカムにおいては、βタイプとγタイプのカルボニックアンヒドラーゼが見出されており主にβタイプが機能していることが知られている(非特許文献4参照)。
【0005】
カルボニックアンヒドラーゼを用いた有用物質の生産としては、リグノセルロースを含む植物原料からのエタノールの生産における原料の前処理工程における利用(特許文献10参照)が知られている。一方、コリネバクテリウムのβカルボニックアンヒドラーゼの増強が検討されたが、リジンの生産量は増加しないことが報告されており(非特許文献4参照)、βカルボニックアンヒドラーゼの増強が物質生産に有効であること、及びβカルボニックアンヒドラーゼ活性とL-アミノ酸生産性との関係については不明であった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許第3,220,929号明細書
【特許文献2】米国特許第3,563,857号明細書
【特許文献3】特公昭32−9393号公報
【特許文献4】特開平5−244970号公報
【特許文献5】特開2000−106869号公報
【特許文献6】特開2000−189169号公報
【特許文献7】特開2000−189175号公報
【特許文献8】特公平7−121228号公報
【特許文献9】特開2000−189175号公報
【特許文献10】米国特許公開2008−0171370号明細書
【非特許文献】
【0007】
【非特許文献1】明石邦彦ら著 アミノ酸発酵、学会出版センター、195〜215頁、1986年
【非特許文献2】J. Biol. Chem 1992年、267巻、3731-3734
【非特許文献3】Smith KS, Ferry JG (2000). "Prokaryotic carbonic anhydrases." FEMS Microbiol Rev 24(4);335-66.
【非特許文献4】Appl. Microbiol. Biotechnol. 2004年、63巻、592-601
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明はL-アミノ酸、特にL-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-アスパラギン、L-アスパラギン酸、L-リジン、L-メチオニン、L-スレオニン、L-イソロイシンを発酵法によって製造する新規な方法を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者らは上記課題を解決するために鋭意検討を行った。その結果、L-アミノ酸生産能が付与され、カルボニックアンヒドラーゼ(以下、特に断りがなければβ-カルボニックアンヒドラーゼを指す)活性が増強されるように改変されたコリネ型細菌を培養することにより、L-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-アスパラギン、L-アスパラギン酸、L-リジン、L-メチオニン、L-スレオニン、L-イソロイシンなどのL-アミノ酸を効率よく製造できることを見出し、本発明を完成させるに至った。
【0010】
すなわち、本発明は以下のとおりである。
(1)L-アミノ酸生産能を有し、カルボニックアンヒドラーゼ活性が増強されるように改変されたコリネ型細菌を培地で培養して、L-アミノ酸を該培地中又は菌体内に生成蓄積させ、該培地又は菌体よりL-アミノ酸を採取する、L-アミノ酸の製造法。
(2)前記細菌が、カルボニックアンヒドラーゼをコードする遺伝子のコピー数を高めること、又は該遺伝子の発現調節配列を改変することによりカルボニックアンヒドラーゼ活性が増強した細菌である、(1)に記載の製造法。
(3)前記カルボニックアンヒドラーゼをコードする遺伝子が下記(a)又は(b)に示すDNAである(2)に記載の製造法:
(a)配列番号11の塩基番号562〜1182、もしくは配列番号13の塩基配列を含むDNA、または
(b)配列番号11の塩基番号562〜1182、もしくは配列番号13の塩基配列の相補鎖とストリンジェントな条件下でハイブリダイズし、かつ、カルボニックアンヒドラーゼ活性を示すタンパク質をコードするDNA。
(4)前記細菌がさらにD−キシロース−5−リン酸−ホスホケトラーゼ及び/又はフルクトース−6−リン酸ホスホケトラーゼ活性が付与されるように改変された細菌である(1)〜(3)のいずれかに記載の製造法。
(5)前記細菌がさらにホスホトランスアセチラーゼ活性が増強するように改変された細菌である(1)〜(4)のいずれかに記載の製造法。
(6)前記細菌がさらにピルビン酸カルボキシラーゼ活性が増強されるように改変された細菌である(1)〜(5)のいずれかに記載の製造法。
(7)前記細菌がさらにホスホエノールピルビン酸カルボキシラーゼ活性が増強されるように改変された細菌である(1)〜(6)のいずれかに記載の製造法。
(8)前記L-アミノ酸が、L-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-ロイシン、L-システインから選択されるL -アミノ酸である、(1)〜(7)のいずれかに記載の製造法。
【発明の効果】
【0011】
本発明の製造法により、L-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-アスパラギン、L-アスパラギン酸、L-リジン、L-メチオニン、L-スレオニン、L-イソロイシンなどのL-アミノ酸を効率よく製造することができる。
【図面の簡単な説明】
【0012】
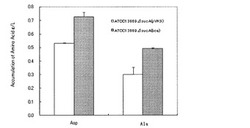
【図1】BCA増強株のL-アミノ酸蓄積量を示す図。
【発明を実施するための形態】
【0013】
以下、本発明を詳細に説明する。
<1>本発明の方法に使用されるコリネ型細菌
本発明の方法に使用されるコリネ型細菌は、L-アミノ酸生産能を有し、カルボニックアンヒドラーゼ活性が増強されるように改変されたコリネ型細菌である。本発明の方法に使用されるコリネ型細菌は、L-アミノ酸生産能を有するコリネ型細菌を親株とし、それをカルボニックアンヒドラーゼ活性が増強するように改変することによって得ることができる。本発明の方法に使用されるコリネ型細菌は、本来的にL-アミノ酸生産能を有するものであってもよいし、変異法や組換えDNA技術などを利用した育種によりL-アミノ酸生産能を付与されたものであってもよい。本発明において、「コリネ型細菌」とは、従来ブレビバクテリウム属に分類されていたが、現在コリネバクテリウム属に分類された細菌も含み(Int. J. Syst. Bacteriol., 41, 255(1991))、またコリネバクテリウム属と非常に近縁なブレビバクテリウム属細菌を含む。このようなコリネ型細菌の例として以下のものが挙げられる。
【0014】
コリネバクテリウム・アセトアシドフィラム
コリネバクテリウム・アセトグルタミカム
コリネバクテリウム・アルカノリティカム
コリネバクテリウム・カルナエ
コリネバクテリウム・グルタミカム
コリネバクテリウム・リリウム
コリネバクテリウム・メラセコーラ
コリネバクテリウム・サーモアミノゲネス (コリネバクテリウム・エフィシエンス)
コリネバクテリウム・ハーキュリス
ブレビバクテリウム・ディバリカタム
ブレビバクテリウム・フラバム
ブレビバクテリウム・インマリオフィラム
ブレビバクテリウム・ラクトファーメンタム
ブレビバクテリウム・ロゼウム
ブレビバクテリウム・サッカロリティカム
ブレビバクテリウム・チオゲニタリス
コリネバクテリウム・アンモニアゲネス
ブレビバクテリウム・アルバム
ブレビバクテリウム・セリヌム
ミクロバクテリウム・アンモニアフィラム
具体的には、下記のような菌株を例示することができる。
【0015】
コリネバクテリウム・アセトアシドフィラム ATCC13870
コリネバクテリウム・アセトグルタミカム ATCC15806
コリネバクテリウム・アルカノリティカム ATCC21511
コリネバクテリウム・カルナエ ATCC15991
コリネバクテリウム・グルタミカム ATCC13020, ATCC13032, ATCC13060
コリネバクテリウム・リリウム ATCC15990
コリネバクテリウム・メラセコーラ ATCC17965
コリネバクテリウム・サーモアミノゲネス AJ12340(FERM BP-1539)
コリネバクテリウム・ハーキュリス ATCC13868
ブレビバクテリウム・ディバリカタム ATCC14020
ブレビバクテリウム・フラバム ATCC13826, ATCC14067
ブレビバクテリウム・インマリオフィラム ATCC14068
ブレビバクテリウム・ラクトファーメンタム ATCC13869
ブレビバクテリウム・ロゼウム ATCC13825
ブレビバクテリウム・サッカロリティカム ATCC14066
ブレビバクテリウム・チオゲニタリス ATCC19240
コリネバクテリウム・アンモニアゲネス ATCC6871、ATCC6872
ブレビバクテリウム・アルバム ATCC15111
ブレビバクテリウム・セリヌム ATCC15112
ミクロバクテリウム・アンモニアフィラム ATCC15354
【0016】
これらを入手するには、例えばアメリカン・タイプ・カルチャー・コレクション(住所 12301 Parklawn Drive, Rockville, Maryland 20852 P.O. Box 1549, Manassas, VA 20108, United States of America)より分譲を受けることができる。すなわち、各菌株毎に対応する登録番号が付与されており、この登録番号を利用して分譲を受けることができる(http://www.atcc.org/参照)。各菌株に対応する登録番号はアメリカン・タイプ・カルチャー・コレクションのカタログに記載されている。また、AJ12340株は、1987年10月27日付けで通商産業省工業技術院生命工学工業技術研究所(現独立行政法人 産業技術総合研究所 特許微生物寄託センター)(〒305-5466 日本国茨城県つくば市東1丁目1番地1 中央第6)にFERM BP-1539の受託番号でブダペスト条約に基づいて寄託されている。
【0017】
本発明において、「L−アミノ酸生産能」とは、本発明の方法に使用されるコリネ型細菌を培養したときに、培地中にL−アミノ酸を蓄積する能力をいう。このL−アミノ酸生産能は、コリネ型細菌の野生株の性質として有するものであってもよく、育種によって付与または増強された性質であってもよい。
L−アミノ酸としては、L−リジン、L−グルタミン酸、L−スレオニン、L−バリン、L−ロイシン、L−イソロイシン、L−セリン、L−アスパラギン酸、L−アスパラギン、L−グルタミン、L−アルギニン、L−システイン(シスチン)、L−メチオニン、L−フェニルアラニン、L−トリプトファン、L−チロシン、L−グリシン、L−アラニン、L−プロリン、L−オルニチン、L−シトルリン、L−ホモセリンが挙げられるが、オキサロ酢酸およびアセチルCoA由来のL−アミノ酸が好ましく、特にL−グルタミン酸、L−グルタミン、L−プロリン、L−アルギニン、L−アスパラギン、L−アスパラギン酸、L−リジン、L−メチオニン、L−スレオニン、L−イソロイシンが好ましい。
【0018】
<1−1>L-アミノ酸生産能の付与
以下、コリネ型細菌にL-アミノ酸生産能を付与する方法およびL-アミノ酸生産能が付与されたコリネ型細菌について例を挙げて説明する。
育種によってL−グルタミン酸生産能を付与または増強するための方法としては、例えば、L−グルタミン酸生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。L−グルタミン酸生合成に関与する酵素としては、例えば、グルタミン酸デヒドロゲナーゼ、グルタミンシンテターゼ、グルタミン酸シンターゼ、イソクエン酸デヒドロゲナーゼ、アコニット酸ヒドラターゼ、クエン酸シンターゼ、ホスホエノールピルビン酸カルボキシラーゼ、ピルビン酸カルボキシラーゼ、ピルビン酸デヒドロゲナーゼ、ピルビン酸キナーゼ、ホスホエノールピルビン酸シンターゼ、エノラーゼ、ホスホグリセルムターゼ、ホスホグリセリン酸キナーゼ、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ、トリオースリン酸イソメラーゼ、フルトースビスリン酸アルドラーゼ、ホスホフルクトキナーゼ、グルコースリン酸イソメラーゼなどが挙げられる。
【0019】
これらの遺伝子の発現を増強するための方法としては、これらの遺伝子を含むDNA断片を、適当なプラスミド、例えばコリネ型細菌内でプラスミドの複製増殖機能を司る遺伝子を少なくとも含むプラスミドベクターに導入した増幅プラスミドを導入すること、または、これらの遺伝子を染色体上で接合、転移等により多コピー化すること、またこれらの遺伝子のプロモーター領域に変異を導入することにより達成することもできる。(国際公開パンフレットWO95-34672号参照)
【0020】
上記増幅プラスミドまたは染色体上で多コピー化させる場合、これらの遺伝子を発現させるためのプロモーターはコリネ型細菌において機能するものであればいかなるプロモーターであっても良く、用いる遺伝子自身のプロモーターであってもよい。プロモーターを適宜選択することによっても、遺伝子の発現量の調節が可能である。以上のような方法により、クエン酸シンターゼ遺伝子、フォスフォエノールピルベートカルボキシラーゼ遺伝子、及び/又はグルタミン酸デヒドロゲナーゼ遺伝子の発現が増強するように改変されたコリネ型細菌としては、WO00/18935等に記載されたコリネ型細菌が例示できる。
【0021】
L−グルタミン酸生産能を付与するための改変は、L−グルタミン酸の生合成経路から分岐して他の化合物を生成する反応を触媒する酵素の活性を低下または欠損させることにより行ってもよい。L−グルタミン酸の生合成経路から分岐してL−グルタミン酸以外の化合物を生成する反応を触媒する酵素としては、イソクエン酸リアーゼ、α−ケトグルタル酸デヒドロゲナーゼ、リン酸アセチルトランスフェラーゼ、酢酸キナーゼ、アセトヒドロキシ酸シンターゼ、アセト乳酸シンターゼ、ギ酸アセチルトランスフェラーゼ、乳酸デヒドロゲナーゼ、グルタミン酸デカルボキシラーゼ、1−ピロリンデヒドロゲナーゼなどが挙げられる。
上記のような酵素の活性を低下または欠損させるには、通常の変異処理法によって、染色体上の上記酵素の遺伝子に、細胞中の当該酵素の活性が低下または欠損するような変異を導入すればよい。例えば、遺伝子組換えによって、染色体上の酵素をコードする遺伝子を欠損させたり、プロモーターやシャインダルガルノ(SD)配列等の発現調節配列を改変したりすることなどによって達成される。また、染色体上の酵素をコードする領域にアミノ酸置換(ミスセンス変異)を導入すること、また終始コドンを導入すること(ナンセンス変異)、一〜二塩基付加・欠失するフレームシフト変異を導入すること、遺伝子の一部分を欠失させることによっても達成出来る。(Journal of biological Chemistry 272:8611-8617(1997))また、コード領域が欠失したような変異酵素をコードする遺伝子を構築し、相同組換えなどによって、該遺伝子で染色体上の正常遺伝子を置換することによっても酵素活性を低下または欠損させることができる。
例えば、α−ケトグルタル酸デヒドロゲナーゼ活性を低下させるには該酵素のE1oサブユニットをコードするsucA(odhA)遺伝子を用いて改変すればよい。
sucA遺伝子の塩基配列とそれにコードされるアミノ酸配列を配列番号9,10に示す。例えば、sucA遺伝子の破壊は配列番号1〜6のプライマーを用い、後述の実施例に記載の方法によって行うことができる。
その他にも、α−ケトグルタル酸デヒドロゲナーゼ活性が低下した株として、例えば、以下の株が挙げられる。
ブレビバクテリウム・ラクトファーメンタムΔS株(国際公開95/34672号パンフレット)
ブレビバクテリウム・ラクトファーメンタムAJ12821(FERMBP−4172;フランス特許公報9401748号明細書参照)
ブレビバクテリウム・フラバムAJ12822 (FERMBP−4173;フランス特許公報9401748号明細書参照)
コリネバクテリウム・グルタミカムAJ12823(FERMBP−4174;フランス特許公報9401748号明細書参照)
【0022】
L−グルタミン酸生産能を付与または増強する別の方法として、有機酸アナログや呼吸阻害剤などへの耐性を付与する方法や細胞壁合成阻害剤に対する感受性を付与する方法も挙げられる。例えば、ベンゾピロンまたはナフトキノン類に耐性を付与する方法(特開昭56-1889)、HOQNO耐性を付与する方法(特開昭56-140895)、α-ケトマロン酸耐性を付与する方法(特開昭57-2689)、グアニジン耐性を付与する方法(特開昭56-35981)、ペニシリンに対する感受性を付与する方法(特開平4-88994)などが挙げられる。
このような耐性菌の具体例としては、下記のような菌株が挙げられる。
ブレビバクテリウム・フラバムAJ11355(FERM P-5007;特開昭56-1889号公報参照)
コリネバクテリウム・グルタミカムAJ11368(FERM P- P-5020;特開昭56-1889号公報参照)
ブレビバクテリウム・フラバムAJ11217(FERM P-4318;特開昭57-2689号公報参照)
コリネバクテリウム・グルタミカムAJ11218(FERM-P4319;特開昭57-2689号公報参照)
ブレビバクテリウム・フラバムAJ11564(FERM P-5472;特開昭56-140895公報参照)
ブレビバクテリウム・フラバムAJ11439(FERM P-5136;特開昭56-35981号公報参照)
コリネバクテリウム・グルタミカムH7684(FERM BP-3004;特開平04-88994号公報参照)
【0023】
L−グルタミン生産能を付与するための方法としては、例えば、L−グルタミン生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。例えば、L−グルタミン酸生合成に関与する酵素としては、グルタミンシンテターゼ、グルタミン酸デヒドロゲナーゼが挙げられる(特開2002-300887号公報)。
また、L−グルタミン生産能を付与するための改変は、L−グルタミンの生合成経路から分岐して他の化合物を生成する反応を触媒する酵素の活性を低下または欠損させることにより行ってもよい。例えば、細胞内のグルタミナーゼ活性を低下させることが挙げられる(特開2004-187684号公報)。
【0024】
また、アミノ酸アナログなどへの耐性を付与する方法も挙げられる。具体的には、6-ジアゾ-5-オキソ-ノルロイシン耐性を付与する方法(特開平3-232497号公報)、プリンアナログ耐性および/またはメチオニンスルホキサイド耐性を付与する方法(特開昭61-202694号公報)、α-ケトマロン酸耐性を付与する方法(特開昭56-151495号公報)、グルタミン酸を含有するペプチドに耐性を付与する方法(特開平2-186994号公報)などが挙げられる。
L−グルタミン生産能を有するコリネ型細菌の具体例としては、下記のような菌株が挙げられる。
ブレビバクテリウム・フラバムAJ11573(FERM P-5492) 特開昭56-151495号公報、
ブレビバクテリウム・フラバムAJ12210(FERM P-8123) 特開昭61-202694号公報、
ブレビバクテリウム・フラバムAJ12212(FERM P-8125) 特開昭61-202694号公報、
ブレビバクテリウム・フラバムAJ12418(FERM-BP2205) 特開平2-186994号公報、
ブレビバクテリウム・フラバムDH18(FERM P-11116) 特開平3-232497号公報、
コリネバクテリウム・メラセコラDH344(FERM P-11117) 特開平3-232497号公報、
コリネバクテリウム・グルタミカムAJ11574(FERM P-5493) 特開昭56-151495号公報。
【0025】
L−プロリン生産能を付与するための方法としては、例えば、L−プロリン生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。例えば、L−プロリン生合成に関与する酵素としては、グルタミン酸5‐キナーゼ、γ‐グルタミル−リン酸レダクターゼ、ピロリン−5−カルボキシレートレダクターゼが挙げられる。
【0026】
L−プロリン生産能を付与するための改変は、L−プロリンの生合成経路から分岐して他の化合物を生成する反応を触媒する酵素の活性を低下または欠損させることにより行ってもよい。例えば、細胞内のオルニチンーアミノトランスフェラーゼ活性を低下させることが挙げられる。
【0027】
L−アルギニン生産能を付与するための方法としては、例えば、L−アルギニン生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。L−アルギニン生合成系酵素としては、N−アセチルグルタミルリン酸レダクターゼ(argC)、オルニチンアセチルトランスフェラーゼ(argJ)、N−アセチルグルタメートキナーゼ(argB)、アセチルオルニチントランスアミナーゼ(argD)、オルニチンカルバモイルトランスフェラーゼ(argF)、アルギニノコハク酸シンターゼ(argG)、アルギニノコハク酸リアーゼ(argH)、カルバモイルリン酸シンターゼから選ばれる1種又は2種以上が挙げられる。
【0028】
L−アルギニン生産能を付与する別の方法として、アミノ酸アナログなどへの耐性を付与する方法も挙げられる。このような細菌として、2−チアゾールアラニン耐性に加えて、L−ヒスチジン、L−プロリン、L−スレオニン、L−イソロイシン、L−メチオニンまたはL−トリプトファン要求性を有するコリネ型細菌(特開昭54−44096号公報);ケトマロン酸、フルオロマロン酸又はモノフルオロ酢酸に耐性を有するコリネ型細菌(特開昭57−18989号公報);アルギニノールに耐性を有するコリネ型細菌(特公昭62−24075号公報);または、X−グアニジン(Xは脂肪酸又は脂肪鎖の誘導体)に耐性を有するコリネ型細菌(特開平2−186995号公報);アルギニンヒドロキサメート及び6−アザウラシルに耐性を有するコリネ型細菌(特開昭57-150381号公報)等が挙げられる。
【0029】
なお、L−アルギニン、L−グルタミン、L−プロリンはL−グルタミン酸を骨格としているので、上述のL−グルタミン酸生産菌において、L−グルタミン酸から各L−アミノ酸を生成する反応を触媒する酵素をコードする遺伝子を増幅して育種してもよい。
【0030】
また、L−シトルリン、L−オルニチンもL−アルギニンと生合成経路が共通しており、N−アセチルグルタミン酸シンターゼ(argA)、N−アセチルグルタミルリン酸レダクターゼ(argC)、オルニチンアセチルトランスフェラーゼ(argJ)、N-アセチルグルタミン酸キナーゼ(argB)、アセチルオルニチントランスアミナーゼ(argD)、アセチルオルニチンデアセチラーゼ(argE)の酵素活性を上昇させることによってこれらの生産能を付与することができる。
【0031】
L-システイン生産能を有するコリネ型細菌としては、L−システインによるフィードバック阻害が低減されたセリンアセチルトランスフェラーゼを保持することにより、細胞内のセリンアセチルトランスフェラーゼ活性が上昇したコリネ型細菌(特開2002−233384号公報)が知られている。
【0032】
L−バリン生産能を付与するための方法としては、例えば、L−バリン生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。L−バリン生合成に関与する酵素としては、例えば、ilvBNCオペロンの遺伝子、すなわちilvBNをコードするアセトヒドロキシ酸シンタ−ゼやイソメロリダクターゼ(ilvC)(国際公開00/50624号パンフレット)が挙げられる。尚、ilvBNCオペロンは、L−バリン及び/又はL−イソロイシン及び/又はL−ロイシンによるオペロンの発現調節を受けるので、生成するL−バリンによる発現抑制を解除するためにアテニュエーションを解除することが望ましい。
【0033】
L−バリン生産能を有するコリネ型細菌を得るためには、L-バリン産生を減少させる物質代謝経路に関与する、少なくとも1種の酵素の活性を低下あるいは欠損させることにより行ってもよい。例えば、L-ロイシン合成に関与するスレオニンデヒドラターゼやD-パントセナート合成に関与する酵素の活性を低下させることが考えられる。(国際公開00/50624号パンフレット)
【0034】
L−バリン生産能を付与する別の方法として、アミノ酸アナログなどへの耐性を付与する方法も挙げられる。このような細菌として、L−イソロイシンおよびL−メチオニン要求性,ならびにD−リボ−ス,プリンリボヌクレオシドまたはピリミジンリボヌクレオシドに耐性を有し,かつL−バリン生産能を有する変異株(FERM P-1841、FERM P-29、特公昭53-025034号公報) や、ポリケトイド類に耐性を有する変異株(FERM P-1763、FERM P-1764;特公平06-065314号公報) 、更には酢酸を唯一の炭素源とする培地でL-バリン耐性を示し、且つグルコースを唯一の炭素源とする培地でピルビン酸アナログ(β−フルオロピルビン酸等)に感受性を有する変異株(FERM BP-3006、BP-3007 特許3006929号明細書)が挙げられる。
【0035】
L-アラニン生産能が付与されたコリネ型細菌としては、例えば、H+-ATPase 活性が欠損したコリネ型細菌 (Appl Microbiol Biotechnol. 2001 Nov;57(4):534-40)やアスパラギン酸 β−デカルボキシラーゼ遺伝子が増幅されたコリネ型細菌(特開平07-163383)などが挙げられる。
【0036】
L−リジン生産能が付与されたコリネ型細菌としては、L−リジン生産能を有するL−リジンアナログ耐性株又は代謝制御変異株が挙げられる。具体的には、S−(2−アミノエチル)−システイン(以下、「AEC」と略記する)耐性変異株(ブレビバクテリウム・ラクトファーメンタムAJ11082(NRRL B-11470)株など:特公昭56-1914号公報、特公昭56-1915号公報、特公昭57-14157号公報、特公昭57-14158号公報、特公昭57-30474号公報、特公昭58-10075号公報、特公昭59-4993号公報、特公昭61-35840号公報、特公昭62-24074号公報、特公昭62-36673号公報、特公平5-11958号公報、特公平7-112437号公報、特公平7-112438号公報参照);その生育にL−ホモセリン等のアミノ酸を必要とする変異株(特公昭48-28078号公報、特公昭56-6499号公報参照);AECに耐性を示し、更にL−ロイシン、L−ホモセリン、L−プロリン、L−セリン、L−アルギニン、L−アラニン、L−バリン等のアミノ酸を要求する変異株(米国特許第3708395号及び第3825472号明細書参照);DL−α−アミノ−ε−カプロラクタム、α−アミノ−ラウリルラクタム、アスパラギン酸−アナログ、スルファ剤、キノイド、N−ラウロイルロイシンに耐性を示すL−リジン生産変異株;オキザロ酢酸脱炭酸酵素(デカルボキシラーゼ)または呼吸系酵素阻害剤の耐性を示すL−リジン生産変異株(特開昭50-53588号公報、特開昭50-31093号公報、特開昭52-102498号公報、特開昭53-9394号公報、特開昭53-86089号公報、特開昭55-9783号公報、特開昭55-9759号公報、特開昭56-32995号公報、特開昭56-39778号公報、特公昭53-43591号公報、特公昭53-1833号公報);イノシトールまたは酢酸を要求するL−リジン生産変異株(特開昭55-9784号公報、特開昭56-8692号公報);フルオロピルビン酸または34℃以上の温度に対して感受性を示すL−リジン生産変異株(特開昭55-9783号公報、特開昭53-86090号公報);エチレングリコールに耐性を示し、L−リジンを生産するブレビバクテリウム属またはコリネバクテリウム属の生産変異株(米国特許第4411997号明細書)などが挙げられる。
【0037】
また、L−リジン生合成系の酵素活性を上昇させることによっても、L−リジン生産能が付与されたコリネ型細菌を得ることが出来る。これらの酵素活性の上昇は、酵素をコードする遺伝子のコピー数を細胞内で上昇させること、発現調節配列を改変することによって、達成できる。
L−リジン生合成系酵素をコードする遺伝子としては、ジヒドロジピコリン酸合成酵素遺伝子(dapA)、アスパルトキナーゼ遺伝子(lysC)、ジヒドロジピコリン酸レダクターゼ遺伝子(dapB)、ジアミノピメリン酸脱炭酸酵素遺伝子(lysA)、ジアミノピメリン酸デヒドロゲナーゼ遺伝子(ddh)(以上、国際公開第96/40934号パンフレット)、ホスホエノールピルビン酸カルボキシラーゼ遺伝子(ppc) (特開昭60-87788号公報)、アスパラギン酸アミノトランスフェラーゼ遺伝子(aspC)(特公平6-102028号公報)、ジアミノピメリン酸エピメラーゼ遺伝子(dapF)(特開2003-135066号公報)、アスパラギン酸セミアルデヒド脱水素酵素遺伝子(asd)(国際公開第00/61723号パンフレット)等のジアミノピメリン酸経路の酵素の遺伝子、あるいはホモアコニット酸ヒドラターゼ遺伝子(特開2000-157276号公報)等のアミノアジピン酸経路の酵素等の遺伝子が挙げられる。これらの遺伝子を用いて改変されたコリネ型細菌が、特開平10-215883特開平10-165180WO96/40934などに開示されている。
【0038】
また、アスパルトキナ−ゼIII遺伝子(lysC)は、L−リジンによるフィ−ドバック阻害を受けないように改変した遺伝子を用いることが望ましい。このようなフィ−ドバック阻害を受けないように改変したlysC遺伝子は、米国特許5,932,453号明細書に記載の方法により取得できる。
【0039】
さらに、L−リジン生産能が付与されたコリネ型細菌は、L−リジン以外の化合物を生成する反応を触媒する酵素の活性や、L−リジン生産に負に機能する酵素活性が低下または欠損していてもよい。このような酵素としては、ホモセリンデヒドロゲナーゼ、リジンデカルボキシラーゼ(cadA, ldcC)、マリックエンザイムがあり、該酵素の活性が低下または欠損した株は国際公開第WO95/23864号パンフレットなどに記載されている。
【0040】
L−トリプトファン生産能が付与されたコリネ型細菌として好ましいものは、アントラニル酸合成酵素活性、ホスホグリセリン酸デヒドロゲナーゼ活性もしくはトリプトファンシンターゼ活性のうち、1又は2以上の活性が増強された細菌である。アントラニル酸合成酵素及びホスホグリセリン酸デヒドロゲナーゼは、それぞれL−トリプトファン及びL−セリンによるフィードバック阻害を受けるため、脱感作型の変異酵素を保持させることにより、酵素活性を強化することができる。
【0041】
また、トリプトファンオペロンを含む組換えDNAが導入することによってもL−トリプトファン生産能を付与することができる。また、トリプトファンオペロンのうち、トリプトファンシンターゼをコードする遺伝子(trpBA)の発現を強化することによっても、L−トリプトファン生産能を向上又は付与することができる。トリプトファンシンターゼは、α及びβサブユニットからなり、それぞれtrpA、trpBによってコードされている。トリプトファンオペロンの塩基配列及びtrpA、trpBの塩基配列はGenBank Accession No. J01714に登録されている(国際公開第2005/103275号パンフレット)。
L−トリプトファン生産能が付与されたコリネ型細菌として、ブレビバクテリウム・フラバムAJ11667(特開昭57−174096参照)が挙げられる。
【0042】
L−チロシン生産能が付与されたコリネ型細菌として、コリネバクテリウム・グルタミカムAJ11655(FERM P-5836)(特公平2−6517参照)、ブレビバクテリウム・ラクトファーメンタムAJ12081(FERM P-7249)(特開昭60−70093参照)が挙げられる。
【0043】
L−フェニルアラニン生産能を有するコリネ型細菌としては、チロシン要求性とL−フェニルアラニル−L−チロシン耐性を有する株(特開平5−49489号公報)やブレビバクテリウム・ラクトファーメンタム AJ12637(FERM BP-4160)(フランス特許出願公開第2,686,898号参照)が挙げられる。
【0044】
L−トリプトファン、L−フェニルアラニン、L−チロシンは共に芳香族アミノ酸で生合成系が共通しており、芳香族アミノ酸の生合成系酵素をコードする遺伝子としては、デオキシアラビノ−ヘプツロン酸リン酸シンターゼ(aroG)、3−デヒドロキネートシンターゼ(aroB)、シキミ酸デヒドラターゼ、シキミ酸キナーゼ(aroL)、5−エノール酸ピルビンシキミ酸3−リン酸シンターゼ(aroA)、コリスミ酸シンターゼ(aroC)が挙げられる。(欧州出願公開763127号明細書)従って、これらの酵素をコードする遺伝子をプラスミド、あるいはゲノム上で多コピー化することにより、芳香族アミノ酸の生産能を向上させることができる。また、これらの遺伝子はチロシンリプレッサーによって制御されることが知られており(tyrR)、tyrR遺伝子を欠損させることによって、芳香族アミノ酸の生合成系酵素活性を上昇してもよい。(欧州特許763127号明細書参照)
【0045】
また、L−スレオニン生産能を有するコリネ型細菌としては、コリネバクテリウム・アセトアシドフィラム AJ12318(FERM BP-1172)(米国特許第5,188,949号参照)等が挙げられる。
【0046】
L-ロイシン生産能が付与されたコリネ型細菌としては、ブレビバクテリウム・ラクトファーメンタム(Brevibacterium lactofermentum)AJ3718(FERM P−2516;2−チアゾールアラニン及びβ−ハイドロキシロイシン耐性かつイソロイシン及びメチオニン要求性)が挙げられる。
【0047】
L−イソロイシン生産能を有するコリネ型細菌としてはブレビバクテリウム・フラバム AJ12149(FERM BP-759)(米国特許第4,656,135号参照)等が挙げられる。
【0048】
<1−2> カルボニックアンヒドラーゼ活性の増強
上記のようなL-アミノ酸生産能が付与されたコリネ型細菌を、カルボニックアンヒドラーゼ活性が増強するように改変することによって、本発明の製造法に用いるコリネ型細菌を得ることができる。ただし、カルボニックアンヒドラーゼ活性増強のための改変とL-アミノ酸生産能の付与はどちらを先に行ってもよい。
「カルボニックアンヒドラーゼ活性が増強するように改変された」とは、親株、あるいは野生株に対して細胞当たりのカルボニックアンヒドラーゼ分子の数が増加した場合や、カルボニックアンヒドラーゼ分子当たりの活性が上昇した場合などが該当する。また、比較対象となる野生株とは、例えばコリネバクテリウム・グルタミカム(ブレビバクテリウム・ラクトファーメンタム)ATCC13869株やATCC13032株である。
【0049】
カルボニックアンヒドラーゼ活性が増強されたことの確認は、カルボニックアンヒドラーゼをコードする遺伝子のm-RNAの量を野生型、あるいは非改変株と比較することによって確認出来る。発現量の確認方法としては、ノーザンハイブリダイゼーション、RT-PCRが挙げられる(Molecular cloning(Cold spring Harbor Laboratory Press,Cold spring Harbor(USA),2001))。活性あるいは発現量については、野生株あるいは非改変株と比較して、上昇していればいずれでもよいが、例えば野生株、非改変株と比べて1.5倍以上、より好ましくは2倍以上、さらに好ましくは3倍以上上昇していることが望ましい。
【0050】
カルボニックアンヒドラーゼとは、二酸化炭素と重炭酸根の相互変換に関与している酵素である。(EC 4.2.1.1)。カルボニックアンヒドラーゼ活性は、Wilburらの方法(Wilbur KM, Anderson NG (1948) Electrometric and colorimetric determination of carbonic anhydrase. J Biol Chem 176:147−154)によって測定することができる。
コリネ型細菌のカルボニックアンヒドラーゼをコードする遺伝子(ca遺伝子)としては、βタイプのカルボニックアンヒドラーゼをコードする遺伝子(bca)ととγタイプのカルボニックアンヒドラーゼをコードする遺伝子(gca)の2種類が報告されているが、より好ましくはGenbankに登録されている、C.glutamicum ATCC13032株のNCgl2579 (bcaに相当、accession BA_000036.3 の2837954..2838577の相補鎖)が利用できる。該遺伝子の塩基配列を配列番号13(コード領域は塩基番号1〜621)に、コードされるタンパク質のアミノ酸配列を配列番号14に示す。またC.glutamicum ATCC13869株のbca遺伝子の塩基配列を配列番号11の塩基番号562〜1182に、コードされるタンパク質のアミノ酸配列を配列番号12に示す。
エシェリヒア・コリのカルボニックアンヒドラーゼをコードする遺伝子としては、Can(Carbonic anhydrase 2)、CynT(Carbonic anhydrase 1)の2種のカルボニックアンヒドラーゼをそれぞれコードするyadF,cynT遺伝子が報告されているおり、より好ましくは、Genbankに登録されている、Escherichia coli MG1655のyadF(accession EG_12319)が利用できる。該遺伝子の塩基配列を配列番号27(コード領域201-860)に、コードされるアミノ酸配列を28に示す。また、cynT(accession EG_10176)も利用することができる。cynT遺伝子の塩基配列番号を29(コード領域201-857)に、コードされるアミノ酸配列を30に示す。
【0051】
また、本発明に用いることのできる遺伝子は、コリネ型細菌においてカルボニックアンヒドラーゼ活性を有するタンパク質をコードする限り、他の微生物由来のca遺伝子のホモログ遺伝子を用いてもよい。ca遺伝子のホモログは、BLAST等によって配列番号11の塩基番号562〜1182または配列番号13の塩基配列を参照して、検索出来る(http://blast.genome.jp/)。
【0052】
本発明に用いることが出来るbca遺伝子は既に配列が明らかにされているので、それらの塩基配列に基づいて作製したプライマー、例えば配列番号7及び8に示すプライマーを用いてコリネ型細菌の染色体DNAを鋳型とするPCRにより、bcaとbcaの制御領域を含む領域を取得することができる。他の微生物のbcaのホモログも、同様にして取得され得る。
【0053】
また、コリネ型細菌の種や菌株によってbca遺伝子の塩基配列に差異が存在することがあるため、本発明に用いるbca遺伝子は配列番号11の塩基番号562〜1182または13の配列には限られず、コードされるBcaタンパク質の機能、カルボニックアンヒドラーゼ活性を有する限り、配列番号12または14のアミノ酸配列において、1若しくは複数の位置での1若しくは数個のアミノ酸の置換、欠失、挿入又は付加等を含む配列を有するタンパク質をコードする変異体又は人為的な改変体であってもよい。ここで、「1若しくは数個」とは、アミノ酸残基のタンパク質の立体構造における位置や種類によっても異なるが、具体的には1から20個、好ましくは、1から10個、より好ましくは1から5個である。また、このようなアミノ酸の置換、欠失、挿入、付加、または逆位等には、bca遺伝子を保持する微生物の個体差、種の違いに基づく場合などの天然に生じる変異(mutant又はvariant)によって生じるものも含まれる。
【0054】
上記置換は機能的に変化しない中性変異である保存的置換が好ましい。保存的変異とは、置換部位が芳香族アミノ酸である場合には、phe,trp,tyr間で、置換部位が疎水性アミノ酸である場合には、leu,ile,val間で、極性アミノ酸である場合には、gln,asn間で、塩基性アミノ酸である場合には、lys,arg,his間で、酸性アミノ酸である場合には、asp,glu間で、ヒドロキシル基を持つアミノ酸である場合には、ser,thr間でお互いに置換する変異である。より具体的には、保存的置換としては、alaからser又はthrへの置換、argからgln、his又はlysへの置換、asnからglu、gln、lys、his又はaspへの置換、aspからasn、glu又はglnへの置換、cysからser又はalaへの置換、glnからasn、glu、lys、his、asp又はargへの置換、gluからgly、asn、gln、lys又はaspへの置換、glyからproへの置換、hisからasn、lys、gln、arg又はtyrへの置換、ileからleu、met、val又はpheへの置換、leuからile、met、val又はpheへの置換、lysからasn、glu、gln、his又はargへの置換、metからile、leu、val又はpheへの置換、pheからtrp、tyr、met、ile又はleuへの置換、serからthr又はalaへの置換、thrからser又はalaへの置換、trpからphe又はtyrへの置換、tyrからhis、phe又はtrpへの置換、及び、valからmet、ile又はleuへの置換が挙げられる。
【0055】
さらに、bca遺伝子は、配列番号12あるいは14のアミノ酸配列全体に対して、80%以上、好ましくは90%以上、より好ましくは95%以上、特に好ましくは97%以上の相同性を有し、カルボニックアンヒドラーゼ活性を有するタンパク質をコードする配列を用いることも出来る。また、それぞれ導入する宿主により、遺伝子の縮重性が異なるので、それぞれbcaが導入される宿主で使用しやすいコドンに置換したものでもよい。尚、本明細書において、「相同性」(homology)」は、「同一性」(identity)を指すことがある。
同様にbca遺伝子は、カルボニックアンヒドラーゼ活性を有する限り、N末端側、C末端側が延長したものあるいは削られているものでもよい。例えば延長・削除する長さは、アミノ酸残基で50以下、好ましくは20以下、より好ましくは10以下、特に好ましくは5以下である。より具体的には、配列番号12あるいは14のアミノ酸配列のN末端側50アミノ酸から5アミノ酸、C末端側50アミノ酸から5アミノ酸延長・削除したものでもよい。
【0056】
このようなbca遺伝子と相同な遺伝子は、例えば、部位特異的変異法によって、コードされるタンパク質の特定の部位のアミノ酸残基が置換、欠失、挿入または付加を含むように配列番号11の塩基番号562〜1182、または配列番号13の塩基配列を改変することによって取得することができる。また、以下のような従来知られている変異処理によっても取得され得る。変異処理としては、上記塩基配列をヒドロキシルアミン等でインビトロ処理する方法、および該遺伝子を保持する微生物、例えばコリネ型細菌を、紫外線またはN-メチル-N’-ニトロ-N-ニトロソグアニジン(NTG)もしくはエチルメタンスルフォネート(EMS)等の通常変異処理に用いられている変異剤によって処理する方法、エラ−プロ−ンPCR 、DNA shuffling, StEP−PCRによって、遺伝子組換えにより人工的にbcaに変異を導入して活性の高いbca遺伝子を取得することが出来る。(Firth AE, Patrick WM ;Bioinformatics. 2005 Jun 2; Statistics of protein library construction.)
【0057】
またbca遺伝子は、配列番号11の塩基番号562〜1182または配列番号13の塩基配列と相補的な配列又はこれらの配列から調製され得るプローブとストリンジェントな条件下でハイブリダイズし、カルボニックアンヒドラーゼ活性を有するタンパク質をコードするDNAが挙げられる。ここで、「ストリンジェントな条件」とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。一例を示せば、相同性が高いDNA同士、例えば80, 90, 95 ,または97%以上の相同性を有するDNA同士がハイブリダイズし、それより相同性が低いDNA同士がハイブリダイズしない条件、あるいは通常のサザンハイブリダイゼ−ションの洗いの条件である60℃、1×SSC,0.1%SDS、好ましくは、0.1×SSC、0.1%SDSさらに好ましくは、68℃、0.1×SSC、0.1%SDSに相当する塩濃度、温度で、1回より好ましくは2〜3回洗浄する条件が挙げられる。
【0058】
プローブとして、配列番号11の塩基番号562〜1182、配列番号13の塩基配列の一部の配列を用いることもできる。そのようなプローブは、該塩基配列に基づいて作製したオリゴヌクレオチドをプライマーとし、配列番号11の塩基番号562〜1182の塩基配列、または配列番号13の塩基配列を含むDNA断片を鋳型とするPCRによって作製することができる。例えば、プローブとして、300bp程度の長さのDNA断片を用いる場合には、ハイブリダイゼーションの洗いの条件は、50℃、2×SSC、0.1%SDSが挙げられる。
【0059】
bca遺伝子の発現量の増強は、bca遺伝子のコピー数を高めることによって達成される。例えば、bcaを含む遺伝子をコードする断片を、コリネ型細菌で機能するベクター、好ましくはマルチコピー型のベクターと連結して組換えDNAを作製し、これを上述のようなL−アミノ酸生産能を有する微生物に導入して形質転換すればよい。また、野生型のコリネ型細菌に上記組換えDNAを導入して形質転換株を得、その後当該形質転換株にL−アミノ酸生産能を付与してもよい。また、コピー数の上昇は、bcaをコードする遺伝子を染色体上に1コピーあるいは複数コピー転移させることによっても達成される。染色体上にbca遺伝子が転移したことの確認は、bca遺伝子の一部をプローブとして、サザンハイブリダイゼーションを行うことによって確認出来る。
【0060】
また、bca遺伝子の発現の増強は、bca遺伝子の発現調節領域を改変することによっても達成出来る。例えば、bcaのプロモーターの配列をより強いプロモーターに置換すること、プロモーター配列をコンセンサスに近づけることによって達成出来る。(国際公開第WO00/18935号パンフレット)
【0061】
以下、カルボニックアンヒドラーゼ活性が上昇するように改変したコリネ型細菌の構築方法を示す。これらの方法は、Molecular cloning(Cold spring Harbor Laboratory Press,Cold spring Harbor(USA),2001)等のマニュアルに従って実施出来る。
【0062】
同遺伝子の発現量の増強は、bca遺伝子のコピー数を高めることによって達成でき、コピー数を高めることは、以下のようにプラスミドでbca遺伝子を増幅することによって達成出来る。まずbca遺伝子は、コリネ型細菌の染色体からクローニングする。染色体DNAは、DNA供与体である細菌から、例えば、斎藤、三浦の方法(H. Saito and K.Miura, Biochem.B iophys. Acta, 72, 619 (1963)、生物工学実験書、日本生物工学会編、97〜98頁、培風館、1992年参照)等により調製することができる。PCRに用いるオリゴヌクレオチドは上記の公知情報に基づいて合成でき、例えば配列番号7、8に記載の合成オリゴヌクレオチドを用いbca遺伝子を増幅することが出来る。
【0063】
PCR法により増幅されたbca遺伝子を含む遺伝子断片は、エシェリヒア・コリ及び/またはコリネ型細菌の細胞内において自律複製可能なベクターDNAに接続して組換えDNAを調製し、これをエシェリヒア・コリに導入しておくと、後の操作がしやすくなる。エシェリヒア・コリ細胞内において自律複製可能なベクターとしては、pUC19、pUC18、pHSG299, pHSG399, pHSG398, RSF1010, pBR322, pACYC184, pMW219等が挙げられる。
【0064】
上記DNAをコリネ型細菌で機能するベクターに導入する。コリネ型細菌で機能するベクターとは、例えばコリネ型細菌で自律複製できるプラスミドである。具体的に例示すれば、コリネ型細菌で自律複製可能なプラスミドとしては、例えば、特開平3−210184号公報に記載のプラスミドpCRY30;特開平2−72876号公報及び米国特許5,185,262号公報に記載のプラスミドpCRY21、pCRY2KE、pCRY2KX、pCRY31、pCRY3KE及びpCRY3KX;特開平1−191686号公報に記載のプラスミドpCRY2およびpCRY3;特開昭58−67679号公報に記載のpAM330;特開昭58−77895号公報に記載のpHM1519;特開昭58−192900号公報に記載のpAJ655、pAJ611及びpAJ1844;特開昭57−134500号公報に記載のpCG1;特開昭58−35197号公報に記載のpCG2;特開昭57−183799号公報に記載のpCG4およびpCG11等、特開平10-215883号公報に記載のpVK7を挙げることができる。
また、これらのベクターからコリネ型細菌中でプラスミドを自律複製可能にする能力を持つDNA断片を取り出し、前記エシェリヒア・コリ用のベクターに挿入すると、エシェリヒア・コリ及びコリネ型細菌の両方で自律複製可能ないわゆるシャトルベクターとして使用することができる。
【0065】
これらのベクターは、寄託微生物から次のようにして得られる。対数増殖期に集められた細胞をリゾチーム及びSDSを用いて溶菌し、30000×gで遠心分離して溶解物から得た上澄液にポリエチレングリコールを添加し、セシウムクロライド−エチジウムブロマイド平衡密度勾配遠心分離により分別精製する。
【0066】
bca遺伝子とコリネ型細菌で機能するベクターを連結して組換えDNAを調製するには、 bcaの末端に合うような制限酵素でベクターを切断する。この制限酵素サイトはあらかじめbcaの増幅に用いる合成オリゴヌクレオチドに導入されていてもよい。連結はT4DNAリガーゼ等のリガーゼを用いて行うのが普通である。
【0067】
上記のように調製した組換えプラスミドをコリネ型細菌に導入するには、これまでに報告されている形質転換法に従って行えばよい。例えば、エシェリヒア・コリ K−12について報告されているような、受容菌細胞を塩化カルシウムで処理してDNAの透過性を増す方法(Mandel,M.and Higa,A.,J. Mol. Biol., 53, 159 (1970))があり、バチルス・ズブチリスについて報告されているような、増殖段階の細胞からコンピテントセルを調製してDNAを導入する方法(Duncan,C.H.,Wilson,G.A.and Young,F.E., Gene, 1, 153 (1977))がある。あるいは、バチルス・ズブチリス、放線菌類及び酵母について知られているような、DNA受容菌の細胞を、組換えDNAを容易に取り込むプロトプラストまたはスフェロプラストの状態にして組換えDNAをDNA受容菌に導入する方法(Chang,S. and Choen,S.N., Mol.Gen.Genet., 168, 111 (1979); Bibb,M.J., Ward,J.M. andHopwood,O.A., Nature, 274, 398 (1978); Hinnen,A., Hicks,J.B. and Fink,G.R., Proc. Natl. Acad. Sci. USA, 75 1929 (1978))も応用できる。また、電気パルス法(特開平2-207791号公報)や、接合伝達法(Biotechnology (N Y). 1991 Jan;9(1):84-7)によっても、コリネ型細菌の形質転換を行うことができる。
【0068】
bcaのコピー数を高めることは、bcaをコリネ型細菌の染色体DNA上に複数コピー存在させることによっても達成できる。コリネ型細菌の染色体DNA上にbcaを複数コピー導入するには、染色体DNA上に複数コピー存在する配列を標的に利用して相同組換えにより行う。染色体DNA上に多コピー存在する配列としては、レペティティブDNA、転移因子の端部に存在するインバーテッド・リピートが利用できる。あるいは、特開平2-109985号公報に開示されているように、bcaをトランスポゾンに搭載してこれを転移させて染色体DNA上に多コピー導入することも可能である。(特開平2-109985号、特開平7−107976号、Mol.Gen.Genet.,245, 397-405 (1994)、Plasmid. 2000 Nov;44(3):285-91)。
【0069】
また、宿主で複製できない複製起点あるいは、宿主で複製出来ない複製起点と宿主への接合伝達能を有するプラスミドにbca遺伝子を導入して、染色体上で増幅させる方法も適用できる。例えば用いることが出来るベクターは、pSUP301(Simo等, Bio/Technology 1, 784〜791 (1983) )、pK18mobまたはpK19mob(Schaefer等, Gene 145, 69〜73 (1994) )、pGEM−T(Promega corporation, Madison, WI, USA)、pCR2.1−TOPO(Shuman (1994). Journal of Biological Chemisty 269: 32678〜84; US-A 5487993)、pCR Blunt(Invitrogen, Groningen, Netherlands; Bernard et al., Journal of Molecular Biology, 234: 534〜541 (1993))、pEM1(Schrumpf等,1991, Journal of Bacteriology 173: 4510〜4516)またはpBGS8(spratt等, 1986, Gene, 41:337〜342)等が挙げられる。bca遺伝子を含むプラスミドベクターをコリネ型細菌中に接合または形質転換によって転移させる。接合法は、例えばSchaefer等(Applied and Environmental Microbiology 60, 756〜759 (1994))に記載されている。形質転換法は、例えばTheirbach等(Applied Microbiology and Biotechnology 29, 356〜362 (1988))、DunicanおよびShivinan(Bio/Technology 7, 1067〜1070 (1989))およびTauch等(FEMS Microbiological Letters 123, 343〜347 (1994))に記載されている。
【0070】
また、bcaの活性を上昇させる手段として染色体DNA上またはプラスミド上のbca遺伝子のプロモーター等の発現調節配列を強力なものに置換すること、bcaの発現調節に関与する因子、例えばオペレーターやリプレッサーを改変すること、強力なターミネーターを連結することによっても達成される。(Hamilton et al,; Journal of Bacterology171:4617-4622) 例えば、lacプロモーター、trpプロモーター、trcプロモーター、PS2プロモーター等が強力なプロモーターとして知られている。プロモーターの強度の評価法および強力なプロモーターの例は、Goldsteinらの論文(Prokaryotic promoters in biotechnology. Biotechnol. Annu. Rev., 1995, 1, 105-128)等に記載されている。また、国際公開WO00/18935に開示されているように、目的遺伝子のプロモーター領域に数塩基の塩基置換を導入し、よりコンセンサスに近づける配列に置換し、強力なものに改変することも可能である。例えば、−35領域をTTGACA、TTGCCA配列に、−10領域をTATAAT、TATAAC配列に置換することが考えられる。さらに、リボソーム結合部位(RBS)と開始コドンとの間のスペーサ、特に開始コドンのすぐ上流の配列における数個のヌクレオチドの置換がmRNAの翻訳効率に非常に影響を及ぼすことが知られており、これらを改変することも可能である。
【0071】
bca遺伝子の上流領域としては、例えば、配列番号11の塩基番号1〜561の領域が挙げられる。bca遺伝子上流のプロモーター等の発現調節配列は、プロモーター検索ベクターやGENETYX等の遺伝子解析ソフトを用いて決定することも出来る。これらのプロモーター置換または改変によりbca遺伝子の発現が強化される。発現調節配列の置換は、例えば温度感受性プラスミドを用いて行うことができる。なお、発現調節配列の改変は、bca遺伝子のコピー数を高めることと組み合わせてもよい。
また、発現量の上昇は、m-RNAの生存時間を延長させることや、酵素タンパク質の細胞内での分解を防ぐことによっても達成可能である。
【0072】
本発明の製造法に使用する微生物は、カルボニックアンヒドラーゼ活性の増強に加えて、さらにD-キシロース5−リン酸−ホスホケトラーゼ及び/又はフルクトース6-リン酸ホスホケトラーゼ活性が付与されるように改変された微生物でもよい。
【0073】
D-キシロース5−リン酸−ホスホケトラーゼ活性及びフルクトース6-リン酸ホスホケトラーゼ活性はいずれか一方を活性付与してもよいし、両方を活性付与してもよい。なお、本明細書ではD-キシロース5−リン酸−ホスホケトラーゼとフルクトース6-リン酸ホスホケトラーゼをまとめてホスホケトラーゼと呼ぶことがある。
【0074】
D-キシロース5−リン酸−ホスホケトラーゼ活性とは、リン酸を消費して、キシルロース−5−リン酸をグリセルアルデヒド-3-リン酸とアセチルリン酸に変換し、一分子のH2Oを放出する活性を意味する。この活性は、Goldberg, M.らの文献 (Methods Enzymol., 9, 515-520 (1966) またはL.Meileの文献 (J.Bacteriol. (2001) 183; 2929-2936)に記載の方法によって測定することができる。
【0075】
また、フルクトース6-リン酸ホスホケトラーゼ活性とは、リン酸を消費して、フルクトース6-リン酸をエリスロース-4-リン酸とアセチルリン酸に変換し、一分子のH2Oを放出する活性を意味する。この活性は、Racker, Eの文献 (Methods Enzymol., 5, 276-280 (1962)) またはL.Meileの文献 (J.Bacteriol. (2001) 183; 2929-2936)に記載の方法によって測定することができる。
【0076】
ホスホケトラーゼの活性付与は、ホスホケトラーゼをコードする遺伝子をプラスミドを用いてコリネ型細菌の細胞内に導入すること、当該遺伝子をコリネ型細菌の染色体上に組み込むことなどにより行うことができる。
【0077】
コリネ型細菌は本来的にホスホケトラーゼ活性を有していないため、他の生物由来のホスホケトラーゼ遺伝子を含むプラスミドを細胞内に導入したり、他の生物由来のホスホケトラーゼ遺伝子を染色体上に組み込んだりすることにより、ホスホケトラーゼ活性を付与することができる。
D-キシロース5−リン酸−ホスホケトラーゼをコードする遺伝子は、該酵素活性を有する微生物の染色体DNAを鋳型にしてPCRなどの手段によって得ることができる。このような微生物としては、乳酸菌、メタノール資化性細菌、メタン資化性細菌、ストレプトコッカス属細菌、アセトバクター(Acetobacter)属細菌、ビフィドバクテリウム(Bifidobacterium)属細菌、ラクトバチルス(Lactobacillus)属細菌、チオバチルス(Thiobacillus)属細菌、メチロコッカス(Methylococus)属細菌、ブチリビブリオ(Butyrivibrio)属細菌、フィブロバクター(Fibrobacter)属細菌などの細菌や、キャンディダ(Candida)属、ロドトルラ(Rhodotorula)属、ロドスポリディウム(Rhodosporidium)属、ピキア(Pichia)属、ヤロウィア(Yarrowia)属、ハンセヌラ(Hansenula)属、クルイベロミセス(Kluyveromyces)属、サッカロミセス(Saccharomyces)属、トリコスポロン(Trichosporon)属、ウィンゲア(Wingea) 属などに属する酵母などが挙げられる。
【0078】
フルクトース6-リン酸ホスホケトラーゼをコードする遺伝子は、該酵素活性を有する微生物の染色体DNAを鋳型にしてPCRなどの手段によって得ることができる。このような微生物としては、アセトバクター属細菌、ビフィドバクテリウム属細菌、クロロビウム(Chlorobium)属細菌、ブルセラ(Brucella)属細菌、メチロコッカス属細菌、ガードネレラ( Gardnerella)属細菌などの細菌や、キャンディダ属、ロドトルラ属、サッカロミセス属などに属する酵母などが挙げられる。
【0079】
D-キシロース5−リン酸−ホスホケトラーゼをコードする遺伝子として具体的には、Lactobacillus pentosus MD363 のD-キシロース5−リン酸−ホスホケトラーゼをコードするxpkA 遺伝子を挙げることができる。この塩基配列はEMBL/GenBank データベースにアクセス番号AJ309011 (Posthuma, C.C. et al, Appl. Environ. Microbiol., 68(2), 831-7 (2002))で登録されている(配列番号15)。
また、Lactobacillus plantarum のxpk1遺伝子を使用することもできる。この塩基配列はEMBL/GenBank データベースにアクセス番号NC_004567 Region: complement (2362936..2365302) (Kleerebezem, M., et al, Proc. Natl. Acad. Sci. U.S.A. 100 (4), 1990-1995 (2003)) で登録されている(配列番号17)。
【0080】
その他にも、これらの遺伝子のホモログとして、GenBank Accession No. NC_004567 Complement (3169067-3171478)の Lactobacillus plantarum の遺伝子、GenBank Accession No. NP_736274のアミノ酸配列をコードするStreptococcus agalactiae の遺伝子、GenBank Accession No. NP_267658のアミノ酸配列をコードするLactococcus lactis subsp. Lactisの遺伝子、GenBank Accession No. のNC_005362 696462..698867のLactobacillus johnsonii の遺伝子、GenBank Accession No. YP_193510のアミノ酸配列をコードするLactobacillus acidophilus の遺伝子などが挙げられる。
【0081】
D-キシロース5−リン酸−ホスホケトラーゼ及びフルクトース6-リン酸ホスホケトラーゼの両方の活性を有するタンパク質をコードする遺伝子を用いることもできる。このような遺伝子としては、Bifidobacterium lactisの xfp遺伝子が挙げられ、この塩基配列は、EMBL/ GenBank データベースにアクセス番号AJ293946 (Meile, L. et al, J. Bacteriol., 183(9), 2929-36 (2001)) で登録されている(配列番号19)。
xfp遺伝子のホモログ遺伝子として、GenBank Accession No. NP_696135のアミノ酸配列をコードするBifidobacterium longum の遺伝子、GenBank Accession No. NP_662409のアミノ酸配列をコードするChlorobium tepidum の遺伝子、GenBank Accession No. NP_699578のアミノ酸配列をコードするBrucella suis の遺伝子、GenBank Accession No. YP_223570のアミノ酸配列をコードするBrucella abortus の遺伝子などを用いることもできる。
なお、ホスホケトラーゼ遺伝子は、上記いずれかの塩基配列の相補配列もしくはこの相補配列から調製され得るプローブとストリンジェントな条件下でハイブリダイズし、かつホスホケトラーゼ活性を有するタンパク質をコードするDNAであってもよい。
【0082】
本発明の製造法に使用する微生物は、カルボニックアンヒドラーゼ活性の増強に加えて、さらにホスホトランスアセチラーゼ活性を増強するように改変された微生物でも良い。ホスホトランスアセチラーゼは酢酸代謝に関与している酵素である。エシェリヒア・コリにおいては、酢酸生成の主経路の一部であるアセチル−CoAとリン酸からアセチルリン酸を生成する反応を担っている。一方、コリネバクテリウム・グルタミカムにおいては、酢酸を資化しアセチル−CoAを生成する時にホスホトランスアセチラーゼの活性が上がること、また、ホスホトランスアセチラーゼ活性の負の制御に転写因子であるRamBが関与していることが知られている(Microbiology 1999年 第145巻 p.503-513、Journal of Bacteriology 2004年 Vol.186, No.9 p.2798-2809)。ホスホトランスアセチラーゼ活性増強は、上述したホスホトランスアセチラーゼの活性増強と同様に、ホスホトランスアセチラーゼをコードする遺伝子のコピー数の増加やホスホトランスアセチラーゼをコードする遺伝子のプロモーターの改変などによって行うことができる。また、上記ramB遺伝子を欠損しても良く、ホスホトランスアセチラーゼをコードする遺伝子上流のRamBタンパク質結合部位を改変することによっても達成される。
コリネ型細菌のホスホトランスアセチラーゼをコードする遺伝子(pta遺伝子)としては、Genbankに登録されている、ATCC13032のNCgl2657 (accession NC_003450.3 の2936506..2937891の相補鎖)が利用できる。該遺伝子の塩基配列を配列番号21に、コードされるタンパク質のアミノ酸配列を配列番号22に示す。またC.glutamicumATCC13869株のpta遺伝子の塩基配列を配列番号23の塩基番号1214〜2641に、コードされるタンパク質のアミノ酸配列を配列番号24に示す。
【0083】
また、本発明の遺伝子は、コリネ型細菌においてホスホトランスアセチラーゼ活性を有する限り、他の微生物由来のpta遺伝子のホモログ遺伝子を用いてもよい。pta遺伝子のホモログは、BLAST等によって配列番号23の塩基番号1214〜2641の塩基配列を参照して、検索出来る(http://blast.genome.jp/)。
本発明に用いることが出来るpta遺伝子は、既に配列が明らかにされているので、それらの塩基配列に基づいて作製したプライマー、例えば配列番号25及び26に示すプライマーを用いて、コリネ型細菌の染色体DNAを鋳型とするPCR法(PCR:polymerase chain reaction; White,T.J. et al., Trends Genet. 5, 185 (1989)参照)によって、ptaとptaの制御領域を含む領域を取得することができる。他の微生物のptaのホモログも、同様にして取得され得る。
【0084】
また、コリネ型細菌の種や菌株によってpta遺伝子の塩基配列に差異が存在することがあるため、本発明に用いるpta遺伝子は配列番号23の塩基番号1214〜2641または21の配列には限られず、コードされるPtaタンパク質の機能、ホスホトランスアセチラーゼ活性を有する限り、配列番号24または22のアミノ酸配列において、1若しくは複数の位置での1若しくは数個のアミノ酸の置換、欠失、挿入又は付加等を含む配列を有するタンパク質をコードする変異体又は人為的な改変体であってもよい。ここで、「1〜数個」とは、アミノ酸残基のタンパク質の立体構造における位置や種類によっても異なるが、具体的には1から20個、好ましくは、1から10個、より好ましくは1から5個である。また、このようなアミノ酸の置換、欠失、挿入、付加、または逆位等には、pta遺伝子を保持する微生物の個体差、種の違いに基づく場合などの天然に生じる変異(mutant又はvariant)によって生じるものも含まれる。
【0085】
本発明の製造法に使用するコリネ型細菌は、上記改変に加えて、さらにピルビン酸カルボキシーゼ活性が増強されるように改変された微生物でもよい。ピルビン酸カルボキシーゼをコードする遺伝子は、例えば、コリネ型細菌、バチルス属細菌由来の遺伝子を利用でき、C.glutamicum ATCC13032のpyc遺伝子(Genbank Accession No. NCgl0659)やB.subtilisのpyc遺伝子(欧州特許 1092776号)が利用できる。
【0086】
本発明の製造法に使用するコリネ型細菌は、上記改変に加えて、さらにホスホエノールピルビン酸カルボキシラーゼ活性が増強されるように改変された細菌でもよい。ホスホエノールピルビン酸カルボキシラーゼをコードする遺伝子は、例えば、コリネ型細菌、エシェリヒア属細菌の遺伝子が利用でき、C.glutamicum ATCC13032のppc遺伝子(Genbank Accession No. NCgl1523)や、E.coli MG1655のppc遺伝子(Genbank Accession No. NP_418391)が利用できる。
なお、ホスホエノールピルビン酸カルボキシラーゼはアスパラギン酸にフィードバック阻害を受けることがあるので、アスパラギン酸にフィードバック阻害を受けないように改変することが好ましい。(欧州特許0723011号)
【0087】
<2>L-アミノ酸物質の製造法
上記のようにして得られるコリネ型細菌を培地に培養し、培地中にL-アミノ酸を生成蓄積せしめ、L-アミノ酸を該培地から採取することにより、L-アミノ酸を製造することが出来る。
【0088】
培養に用いる培地は、炭素源、窒素源、無機塩類、その他必要に応じてアミノ酸、ビタミン等の有機微量栄養素を含有する通常の培地を用いることができる。合成培地または天然培地のいずれも使用可能である。培地に使用される炭素源および窒素源は培養する菌株が利用可能であるものならばいずれの種類を用いてもよい。
【0089】
炭素源としては、グルコース、グリセロール、フラクトース、スクロース、マルトース、マンノース、ガラクトース、澱粉加水分解物、糖蜜等の糖類が使用でき、その他、酢酸、クエン酸等の有機酸、エタノール等のアルコール類も単独あるいは他の炭素源と併用して用いることができる。窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、りん酸アンモニウム、酢酸アンモニウム等のアンモニウム塩または硝酸塩等が使用することができる。有機微量栄養素としては、アミノ酸、ビタミン、脂肪酸、核酸、更にこれらのものを含有するペプトン、カザミノ酸、酵母エキス、大豆たん白分解物等が使用でき、生育にアミノ酸などを要求する栄養要求性変異株を使用する場合には要求される栄養素を補添することが好ましい。無機塩類としてはりん酸塩、マグネシウム塩、カルシウム塩、鉄塩、マンガン塩等が使用できる。
【0090】
培養は、好ましくは、発酵温度20〜45℃、pHを3〜9に制御し、通気培養を行う。培養中にpHが下がる場合には、例えば、炭酸カルシウムを加えるか、アンモニアガス等のアルカリで中和する。このような条件下で、好ましくは10時間〜120時間程度培養することにより、培養液中に著量のL−グルタミン酸などのL-アミノ酸が蓄積される。
【0091】
また、L-グルタミン酸を製造する場合、L-グルタミン酸が析出するような条件に調整された液体培地を用いて、培地中にL−グルタミン酸を析出させながら培養を行うことも出来る。L−グルタミン酸が析出する条件としては、例えば、pH5.0〜4.0、好ましくはpH4.5〜4.0、さらに好ましくはpH4.3〜4.0、特に好ましくはpH4.0を挙げることができる(欧州特許出願公開第1078989号明細書)。
【0092】
培養終了後の培養液からL-アミノ酸を採取する方法は、公知の回収方法に従って行えばよい。例えば、培養液から菌体を除去した後に濃縮晶析する方法あるいはイオン交換クロマトグラフィー等によって採取される。L−グルタミン酸が析出するような条件下で培養した場合、培養液中に析出したL−グルタミン酸は、遠心分離又は濾過等により採取することができる。この場合、培地中に溶解しているL−グルタミン酸を晶析した後に、併せて単離してもよい。
【0093】
[実施例]
以下、実施例を挙げて本発明を具体的に説明する。ただし、本発明は以下の実施例に限定されない。
【0094】
1. C.glutamicum ATCC13869 bca増幅株の構築
bca遺伝子増幅の親株として、sucA欠損株を用いた。sucA欠損株は以下の方法で構築できる。
(1−1) sucA欠損株の構築
ATCC13869のsucA欠損株(ATCC13869ΔsucA)は以下のようにして構築した。
α−ケトグルタル酸デヒドロゲナーゼのE1oサブユニットをコードするsucA遺伝子の破壊は、レバンシュークラーゼをコードするsacB遺伝子を搭載したプラスミドpBS3を用いて行った。sacB搭載遺伝子破壊用ベクターの構築は、国際公開2005/113745 号パンフレット及び2005/113744号パンフレットに記載のpBS3を用いた。
【0095】
C.glutamicum ATCC13869株由来のsucAのORFを欠失した遺伝子断片は、既に公開されているC.glutamicum ATCC13032 (GenBank Database Accession No.NC_003450)の該遺伝子の塩基配列(配列番号9)を参考に設計した合成DNAをプライマーとして用いたオーバーラップPCR 法で取得した。具体的にはC.glutamicum ATCC13869株の染色体DNAを鋳型として、配列番号1、2の合成DNAをプライマーとして常法によりPCRを行い、sucA遺伝子N末端側の増幅産物を得た。一方、sucA遺伝子C末端側の増幅産物を得るために、C.glutamicum ATCC13869株ゲノムDNAを鋳型とし、配列番号3、4の合成DNAをプライマーとして常法によりPCRを行った。配列番号2と3は互いに相補的であり、sucAのORFの全配列を欠損させた構造となっている。
次に内部配列を欠失したsucA遺伝子断片を得るために、上記sucA N末側およびC末側の遺伝子産物をそれぞれほぼ等モルとなるように混合し、これを鋳型として配列番号5と6の合成DNAをプライマーとして常法によりPCRを行い変異導入されたsucA遺伝子増幅産物を得た。生成したPCR産物を常法により精製後BamHIで消化し、上述のpBS3 のBamHI部位に挿入する。このDNAを用いて、エシェリヒア・コリJM109のコンピテントセル(宝バイオ社製)に形質転換を行い、IPTG 100μM、X-Gal 40μg/mlおよびKm 25μg/mlを含むLBプレート培地に塗布し、一晩培養し、出現した白色のコロニーを釣り上げ、単コロニー分離し、形質転換体を得る。得られた形質転換体よりプラスミドを抽出し、目的のPCR産物が挿入されていたプラスミドをpBS3ΔsucAと命名した。
【0096】
(1−2)sucA欠損株の作成
上記(1−1)で得られたpBS3ΔsucAはコリネ型細菌の細胞内で自律複製可能とする領域を含まないため、本プラスミドでコリネ型細菌を形質転換した場合、低頻度であるが本プラスミドが相同組換えにより染色体に組み込まれた株が形質転換体として出現した。C.glutamicumATCC13869株を電気パルス法により高濃度のプラスミドpBS3ΔsucAを用いて形質転換し、カナマイシン25μg/mlを含むCM-Dexプレート培地(グルコース 5g/L、ポリペプトン 10g/L、イーストエキストラクト 10g/L、KH2PO4 1g/L、MgSO4・7H2O 0.4g/L、FeSO4・7H2O 0.01g/L、MnSO4・7H2O 0.01g/L、尿素 3g/L、大豆加水分解物 1.2g/L、biotin 10 ug/L、寒天15g/L、 NaOHでpH7.5に調整)に塗布し、31.5℃で約30時間培養した。この培地上に生育した株は該プラスミドのsucA遺伝子断片とATCC13869株ゲノム上の同遺伝子との間で相同組み換えを起こした結果、同ゲノムに該プラスミドに由来するカナマイシン耐性遺伝子およびsacB遺伝子が挿入されている株である。
次にこれらの一回目の組換え体をカナマイシンを含まないCM-Dex液体培地(CM-Dexプレート培地の成分から寒天を除いて作成)にて31.5℃で一晩培養し、適当に希釈した後、カナマイシンを含まない10%ショ糖含有Dex-S10プレート培地(ショ糖 100g/L、ポリペプトン 10g/L、イーストエキストラクト 10g/L、KH2PO4 1g/L、MgSO4・7H2O 0.4g/L、FeSO4・7H2O 0.01g/L、MnSO4・4H2O 0.01g/L、尿素 3g/L、大豆加水分解物 1.2g/L、ビオチン 10μg/L、寒天15g/L、 KOHでpH7.5に調整)に塗布にし、31.5℃にて約30時間培養する。その結果、2回目の相同組み換えによりsacB遺伝子が脱落しシュークロース非感受性となったと推定される株を得ることができる。
【0097】
この様にして得られた株の中には、そのsucA遺伝子がpBS3ΔsucAに由来する変異型に置き換わったものと野生型に戻ったものが含まれる。sucA遺伝子が変異型であるか野生型であるかの確認は、Dex-S10プレート培地にて培養して得られた菌体を直接PCR反応に供し、sucA遺伝子の検出を行うことによって容易に確認できる。sucA遺伝子をPCR増幅するためのプライマー(配列番号5および配列番号6)を用いて分析した際、ATCC13869株の染色体DNAを鋳型にしたものよりもPCR産物の大きさが小さいものをsucA欠損株として以降の実験に使用した。
【0098】
sucA欠損株のL−グルタミン酸の生産能の評価を以下の方法で行った。これらの菌株をCM-Dexプレート培地にて培養して、生育した各菌株を、グルコース 30g、KH2PO4 1g、MgSO4 0.4g、(NH4)2SO4 15g、FeSO4・7H2O 0.01g、MnSO4・7H2O 0.01g、大豆加水分解液 13.7ml、サイアミン塩酸塩 200μg、ビオチン 300μg、及びCaCO3 50gを純水 1L中に含む培地(KOHを用いてpHは8.0に調整されている)20mlを坂口フラスコに分注して、31.5℃にてしんとう培養する。培地中のグルコースを全て消費した時点で培養を終了した。L−グルタミン酸濃度は、培養液上清を適当倍率に水で希釈した後に、バイオテックアナライザー(AS-210 サクラエスアイ(株))により測定した。L-グルタミン酸発酵収率が大きい株を選択し、ATCC13869ΔsucAとした。
【0099】
(1−3) bca増幅用プラスミドの構築
カルボニックアンヒドラーゼ(bca)遺伝子の発現を増強した株を構築するため、pVK9シャトルベクターをBamHIにて処理し、ここに当該酵素をコードするDNA断片(配列番号7と配列番号8をプライマーとし、C.glutamicum ATCC 13869株の染色体DNAを鋳型としたPCRにより増幅し、BamHIで処理することで得た。)を連結し、エシェリヒア・コリJM109のコンピテントセル(宝バイオ社製)に形質転換を行い、IPTG 100μM、X-Gal 40μg/mlおよびCm 25μg/mlを含むLBプレート培地に塗布し、一晩培養した。その後、出現した白色のコロニーを釣り上げ、単コロニー分離し、形質転換体を得た。得られた形質転換体よりプラスミドを抽出し、lacZ遺伝子順向きにbca遺伝子が連結されたプラスミドをpVK9-bcaと命名した。
なお、pVK9はpHSG299(タカラバイオ)のAvaII部位を平滑末端化し、pHK4(特開平05-007491)に含まれるコリネ型細菌内で自律複製可能な領域をBamHIおよびKpnIで切り出し平滑末端化した断片を挿入したシャトルベクターである。
また、配列番号7および配列番号8の合成DNAは、既に公開されているコリネバクテリウム・グルタミカムATCC13032 (GenBank Database Accession No.NC_003450 配列番号13)のカルボニックアンヒドラーゼ遺伝子の塩基配列を参考に設計可能である。
【0100】
(1−4)ATCC13869Δ sucA株へのBCA増幅用プラスミドの導入
ATCC13869ΔsucAをpVK9(コントロール用プラスミド)、及びpVK9-bca(BCA増幅用プラスミド)により形質転換した株を取得した。形質転換は電気パルス法により行い、カナマイシン25μg/mlを含むCM-Dexプレート培地に塗布し、31.5℃で約30時間培養することで得た。それぞれ上記プラスミドを導入した株をATCC13869ΔsucA(pVK9)およびATCC13869ΔsucA(pVK9-bca)と命名した。
【0101】
2. BCA増強ATCC13869ΔsucA株におけるL-グルタミン酸蓄積向上効果の確認
bca増幅効果は1−2に示したフラスコ培養の評価系を用いて評価した。
【0102】
(2−1)BCA増強株のグルタミン酸蓄積
C.glutamicum ATCC13869ΔsucA(pVK9)株およびATCC13869ΔsucA(pVK9-bca)株を用い、BCA増強によるL−グルタミン酸蓄積向上の効果を上記1−2のsucA欠損株評価と同様の方法で培養評価した。培養12時間後の結果を以下の表に示す。L−グルタミン酸蓄積量は、対照株と比べてBCA増強株が高いことが明らかになった(n=4)。
【0103】
【表1】

【0104】
(2−2)BCA増強株のL-アミノ酸蓄積
C.glutamicum ATCC13869ΔsucA(pVK9)株およびATCC13869ΔsucA(pVK9-bca)株を用い、BCA増強によるL−アミノ酸蓄積向上の効果を上記1−2のsucA欠損株の評価と同様の方法で培養評価した。計2株の培養24時間後の培養上清、各1サンプルを0.02N塩酸にて51倍に希釈し、アミノ酸分析器(L−8500(日立製作所製))を用いて各種L−アミノ酸の定量を行った。その結果を図1に示す。BCA増強によってL−アスパラギン酸およびL-アラニンの蓄積量が、対照株と比べて向上することが明らかになった(n=2)。
【0105】
〔配列表の説明〕
配列番号1:C.glutamicum ATCC13869 sucA遺伝子破壊用プライマー塩基配列
配列番号2:C.glutamicum ATCC13869 sucA遺伝子破壊用プライマー塩基配列
配列番号3:C.glutamicum ATCC13869 sucA遺伝子破壊用プライマー塩基配列
配列番号4:C.glutamicum ATCC13869 sucA遺伝子破壊用プライマー塩基配列
配列番号5:C.glutamicum ATCC13869 sucA遺伝子増幅用プライマー塩基配列
配列番号6:C.glutamicum ATCC13869 sucA遺伝子増幅用プライマー塩基配列
配列番号7:C.glutamicum bca遺伝子増幅用プライマー塩基配列
配列番号8:C.glutamicum bca遺伝子増幅用プライマー塩基配列
配列番号9:C.glutamicum ATCC13869 sucA遺伝子塩基配列
配列番号10:C.glutamicum ATCC13869 α-KGDHアミノ酸配列
配列番号11:C.glutamicum ATCC13869 bca遺伝子塩基配列
配列番号12:C.glutamicum ATCC13869 Bcaアミノ酸配列
配列番号13:C. glutamicum ATCC13032 bca遺伝子塩基配列
配列番号14:C. glutamicum ATCC13032 Bcaアミノ酸配列
配列番号15:Lactobacillus pentosus MD363 xpkA遺伝子塩基配列
配列番号16:Lactobacillus pentosus MD363 XpkAアミノ酸配列
配列番号17:Lactobacillus plantarum xpk1遺伝子塩基配列
配列番号18:Lactobacillus plantarum Xpk1アミノ酸配列
配列番号19:Bifidobacterium lactisの xfp遺伝子塩基配列
配列番号20:Bifidobacterium lactisの Xfpアミノ酸配列
配列番号21:C.glutamicum ATCC13869 pta遺伝子塩基配列
配列番号22:C.glutamicum ATCC13869 Ptaアミノ酸配列
配列番号23:C. glutamicum ATCC13032 pta遺伝子塩基配列
配列番号24:C. glutamicum ATCC13032 Ptaアミノ酸配列
配列番号25:C. glutamicum pta遺伝子増幅用プライマー塩基配列
配列番号26:C. glutamicum pta遺伝子増幅用プライマー塩基配列
配列番号27:E. coli MG1655 yadF遺伝子塩基配列
配列番号28:E. coli MG1655 YadFアミノ酸配列
配列番号29:E. coli MG1655 cynT遺伝子塩基配列
配列番号30:E. coli MG1655 CynTアミノ酸配列
【技術分野】
【0001】
本発明は、L-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-アスパラギン、L-アスパラギン酸、L-リジン、L-メチオニン、L-スレオニン、L-イソロイシンなどのL-アミノ酸を発酵により効率よく製造する方法に関する。
【背景技術】
【0002】
L−アミノ酸は、主としてブレビバクテリウム属、コリネバクテリウム属、ミクロバクテリウム属に属するいわゆるコリネ型細菌のL−アミノ酸生産菌またはそれらの変異株を用いた発酵法により製造されている(例えば、非特許文献1参照)。その他の菌株を用いた発酵法によるL−アミノ酸の製造法としては、バチルス属、ストレプトミセス属、ペニシリウム属等の微生物を用いる方法(例えば、特許文献1参照)、シュードモナス属、アースロバクター属、セラチア属、キャンディダ属等の微生物を用いる方法(例えば、特許文献2参照)、バチルス属、シュードモナス属、セラチア属、アエロバクター・アエロゲネス(現エンテロバクター・アエロゲネス)等の微生物を用いる方法(例えば、特許文献3参照)、エシェリヒア・コリの変異株を用いる方法(例えば、特許文献4参照)等が知られている。また、クレブシエラ属、エルビニア属又はパントテア属、エンテロバクター属に属する微生物を用いたL−アミノ酸の製造法も開示されている(例えば、特許文献5〜7参照)。
【0003】
また、組換えDNA技術によりL−アミノ酸の生合成酵素の活性を増強することによって、L−アミノ酸の生産能を増加させる種々の技術が開示されている。例えば、コリネバクテリウム属またはブレビバクテリウム属細菌において、エシェリヒア・コリ又はコリネバクテリウム・グルタミカム由来のクエン酸シンターゼをコードする遺伝子の導入が、コリネ型細菌のL−グルタミン酸生産能の増強に効果的であったことが報告されている(例えば、特許文献8参照)。またコリネ型細菌由来のクエン酸シンターゼ遺伝子のエンテロバクター属、クレブシエラ属、セラチア属、エルビニア属、又はエシェリヒア属に属する腸内細菌への導入が、L-グルタミン酸生産能の増強に効果的であったことが報告されている(例えば、特許文献9参照)。
【0004】
カルボニックアンヒドラーゼは二酸化炭素と重炭酸根の相互変換に関与している酵素である。エシェリヒア・コリはCan(Carbonic anhydrase 2)、CynT(Carbonic anhydrase 1)の2種のカルボニックアンヒドラーゼを有することが報告されており(非特許文献2、非特許文献3)、Canはβ型のカルボニックアンヒドラーゼであり、エシェリヒア・コリが通常大気の二酸化炭素分圧下で生育するために必須であることがわかっている。Can, CynTはそれぞれyadF,cynT遺伝子にコードされている。一方、コリネバクテリウム・グルタミカムにおいては、βタイプとγタイプのカルボニックアンヒドラーゼが見出されており主にβタイプが機能していることが知られている(非特許文献4参照)。
【0005】
カルボニックアンヒドラーゼを用いた有用物質の生産としては、リグノセルロースを含む植物原料からのエタノールの生産における原料の前処理工程における利用(特許文献10参照)が知られている。一方、コリネバクテリウムのβカルボニックアンヒドラーゼの増強が検討されたが、リジンの生産量は増加しないことが報告されており(非特許文献4参照)、βカルボニックアンヒドラーゼの増強が物質生産に有効であること、及びβカルボニックアンヒドラーゼ活性とL-アミノ酸生産性との関係については不明であった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許第3,220,929号明細書
【特許文献2】米国特許第3,563,857号明細書
【特許文献3】特公昭32−9393号公報
【特許文献4】特開平5−244970号公報
【特許文献5】特開2000−106869号公報
【特許文献6】特開2000−189169号公報
【特許文献7】特開2000−189175号公報
【特許文献8】特公平7−121228号公報
【特許文献9】特開2000−189175号公報
【特許文献10】米国特許公開2008−0171370号明細書
【非特許文献】
【0007】
【非特許文献1】明石邦彦ら著 アミノ酸発酵、学会出版センター、195〜215頁、1986年
【非特許文献2】J. Biol. Chem 1992年、267巻、3731-3734
【非特許文献3】Smith KS, Ferry JG (2000). "Prokaryotic carbonic anhydrases." FEMS Microbiol Rev 24(4);335-66.
【非特許文献4】Appl. Microbiol. Biotechnol. 2004年、63巻、592-601
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明はL-アミノ酸、特にL-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-アスパラギン、L-アスパラギン酸、L-リジン、L-メチオニン、L-スレオニン、L-イソロイシンを発酵法によって製造する新規な方法を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者らは上記課題を解決するために鋭意検討を行った。その結果、L-アミノ酸生産能が付与され、カルボニックアンヒドラーゼ(以下、特に断りがなければβ-カルボニックアンヒドラーゼを指す)活性が増強されるように改変されたコリネ型細菌を培養することにより、L-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-アスパラギン、L-アスパラギン酸、L-リジン、L-メチオニン、L-スレオニン、L-イソロイシンなどのL-アミノ酸を効率よく製造できることを見出し、本発明を完成させるに至った。
【0010】
すなわち、本発明は以下のとおりである。
(1)L-アミノ酸生産能を有し、カルボニックアンヒドラーゼ活性が増強されるように改変されたコリネ型細菌を培地で培養して、L-アミノ酸を該培地中又は菌体内に生成蓄積させ、該培地又は菌体よりL-アミノ酸を採取する、L-アミノ酸の製造法。
(2)前記細菌が、カルボニックアンヒドラーゼをコードする遺伝子のコピー数を高めること、又は該遺伝子の発現調節配列を改変することによりカルボニックアンヒドラーゼ活性が増強した細菌である、(1)に記載の製造法。
(3)前記カルボニックアンヒドラーゼをコードする遺伝子が下記(a)又は(b)に示すDNAである(2)に記載の製造法:
(a)配列番号11の塩基番号562〜1182、もしくは配列番号13の塩基配列を含むDNA、または
(b)配列番号11の塩基番号562〜1182、もしくは配列番号13の塩基配列の相補鎖とストリンジェントな条件下でハイブリダイズし、かつ、カルボニックアンヒドラーゼ活性を示すタンパク質をコードするDNA。
(4)前記細菌がさらにD−キシロース−5−リン酸−ホスホケトラーゼ及び/又はフルクトース−6−リン酸ホスホケトラーゼ活性が付与されるように改変された細菌である(1)〜(3)のいずれかに記載の製造法。
(5)前記細菌がさらにホスホトランスアセチラーゼ活性が増強するように改変された細菌である(1)〜(4)のいずれかに記載の製造法。
(6)前記細菌がさらにピルビン酸カルボキシラーゼ活性が増強されるように改変された細菌である(1)〜(5)のいずれかに記載の製造法。
(7)前記細菌がさらにホスホエノールピルビン酸カルボキシラーゼ活性が増強されるように改変された細菌である(1)〜(6)のいずれかに記載の製造法。
(8)前記L-アミノ酸が、L-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-ロイシン、L-システインから選択されるL -アミノ酸である、(1)〜(7)のいずれかに記載の製造法。
【発明の効果】
【0011】
本発明の製造法により、L-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-アスパラギン、L-アスパラギン酸、L-リジン、L-メチオニン、L-スレオニン、L-イソロイシンなどのL-アミノ酸を効率よく製造することができる。
【図面の簡単な説明】
【0012】
【図1】BCA増強株のL-アミノ酸蓄積量を示す図。
【発明を実施するための形態】
【0013】
以下、本発明を詳細に説明する。
<1>本発明の方法に使用されるコリネ型細菌
本発明の方法に使用されるコリネ型細菌は、L-アミノ酸生産能を有し、カルボニックアンヒドラーゼ活性が増強されるように改変されたコリネ型細菌である。本発明の方法に使用されるコリネ型細菌は、L-アミノ酸生産能を有するコリネ型細菌を親株とし、それをカルボニックアンヒドラーゼ活性が増強するように改変することによって得ることができる。本発明の方法に使用されるコリネ型細菌は、本来的にL-アミノ酸生産能を有するものであってもよいし、変異法や組換えDNA技術などを利用した育種によりL-アミノ酸生産能を付与されたものであってもよい。本発明において、「コリネ型細菌」とは、従来ブレビバクテリウム属に分類されていたが、現在コリネバクテリウム属に分類された細菌も含み(Int. J. Syst. Bacteriol., 41, 255(1991))、またコリネバクテリウム属と非常に近縁なブレビバクテリウム属細菌を含む。このようなコリネ型細菌の例として以下のものが挙げられる。
【0014】
コリネバクテリウム・アセトアシドフィラム
コリネバクテリウム・アセトグルタミカム
コリネバクテリウム・アルカノリティカム
コリネバクテリウム・カルナエ
コリネバクテリウム・グルタミカム
コリネバクテリウム・リリウム
コリネバクテリウム・メラセコーラ
コリネバクテリウム・サーモアミノゲネス (コリネバクテリウム・エフィシエンス)
コリネバクテリウム・ハーキュリス
ブレビバクテリウム・ディバリカタム
ブレビバクテリウム・フラバム
ブレビバクテリウム・インマリオフィラム
ブレビバクテリウム・ラクトファーメンタム
ブレビバクテリウム・ロゼウム
ブレビバクテリウム・サッカロリティカム
ブレビバクテリウム・チオゲニタリス
コリネバクテリウム・アンモニアゲネス
ブレビバクテリウム・アルバム
ブレビバクテリウム・セリヌム
ミクロバクテリウム・アンモニアフィラム
具体的には、下記のような菌株を例示することができる。
【0015】
コリネバクテリウム・アセトアシドフィラム ATCC13870
コリネバクテリウム・アセトグルタミカム ATCC15806
コリネバクテリウム・アルカノリティカム ATCC21511
コリネバクテリウム・カルナエ ATCC15991
コリネバクテリウム・グルタミカム ATCC13020, ATCC13032, ATCC13060
コリネバクテリウム・リリウム ATCC15990
コリネバクテリウム・メラセコーラ ATCC17965
コリネバクテリウム・サーモアミノゲネス AJ12340(FERM BP-1539)
コリネバクテリウム・ハーキュリス ATCC13868
ブレビバクテリウム・ディバリカタム ATCC14020
ブレビバクテリウム・フラバム ATCC13826, ATCC14067
ブレビバクテリウム・インマリオフィラム ATCC14068
ブレビバクテリウム・ラクトファーメンタム ATCC13869
ブレビバクテリウム・ロゼウム ATCC13825
ブレビバクテリウム・サッカロリティカム ATCC14066
ブレビバクテリウム・チオゲニタリス ATCC19240
コリネバクテリウム・アンモニアゲネス ATCC6871、ATCC6872
ブレビバクテリウム・アルバム ATCC15111
ブレビバクテリウム・セリヌム ATCC15112
ミクロバクテリウム・アンモニアフィラム ATCC15354
【0016】
これらを入手するには、例えばアメリカン・タイプ・カルチャー・コレクション(住所 12301 Parklawn Drive, Rockville, Maryland 20852 P.O. Box 1549, Manassas, VA 20108, United States of America)より分譲を受けることができる。すなわち、各菌株毎に対応する登録番号が付与されており、この登録番号を利用して分譲を受けることができる(http://www.atcc.org/参照)。各菌株に対応する登録番号はアメリカン・タイプ・カルチャー・コレクションのカタログに記載されている。また、AJ12340株は、1987年10月27日付けで通商産業省工業技術院生命工学工業技術研究所(現独立行政法人 産業技術総合研究所 特許微生物寄託センター)(〒305-5466 日本国茨城県つくば市東1丁目1番地1 中央第6)にFERM BP-1539の受託番号でブダペスト条約に基づいて寄託されている。
【0017】
本発明において、「L−アミノ酸生産能」とは、本発明の方法に使用されるコリネ型細菌を培養したときに、培地中にL−アミノ酸を蓄積する能力をいう。このL−アミノ酸生産能は、コリネ型細菌の野生株の性質として有するものであってもよく、育種によって付与または増強された性質であってもよい。
L−アミノ酸としては、L−リジン、L−グルタミン酸、L−スレオニン、L−バリン、L−ロイシン、L−イソロイシン、L−セリン、L−アスパラギン酸、L−アスパラギン、L−グルタミン、L−アルギニン、L−システイン(シスチン)、L−メチオニン、L−フェニルアラニン、L−トリプトファン、L−チロシン、L−グリシン、L−アラニン、L−プロリン、L−オルニチン、L−シトルリン、L−ホモセリンが挙げられるが、オキサロ酢酸およびアセチルCoA由来のL−アミノ酸が好ましく、特にL−グルタミン酸、L−グルタミン、L−プロリン、L−アルギニン、L−アスパラギン、L−アスパラギン酸、L−リジン、L−メチオニン、L−スレオニン、L−イソロイシンが好ましい。
【0018】
<1−1>L-アミノ酸生産能の付与
以下、コリネ型細菌にL-アミノ酸生産能を付与する方法およびL-アミノ酸生産能が付与されたコリネ型細菌について例を挙げて説明する。
育種によってL−グルタミン酸生産能を付与または増強するための方法としては、例えば、L−グルタミン酸生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。L−グルタミン酸生合成に関与する酵素としては、例えば、グルタミン酸デヒドロゲナーゼ、グルタミンシンテターゼ、グルタミン酸シンターゼ、イソクエン酸デヒドロゲナーゼ、アコニット酸ヒドラターゼ、クエン酸シンターゼ、ホスホエノールピルビン酸カルボキシラーゼ、ピルビン酸カルボキシラーゼ、ピルビン酸デヒドロゲナーゼ、ピルビン酸キナーゼ、ホスホエノールピルビン酸シンターゼ、エノラーゼ、ホスホグリセルムターゼ、ホスホグリセリン酸キナーゼ、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ、トリオースリン酸イソメラーゼ、フルトースビスリン酸アルドラーゼ、ホスホフルクトキナーゼ、グルコースリン酸イソメラーゼなどが挙げられる。
【0019】
これらの遺伝子の発現を増強するための方法としては、これらの遺伝子を含むDNA断片を、適当なプラスミド、例えばコリネ型細菌内でプラスミドの複製増殖機能を司る遺伝子を少なくとも含むプラスミドベクターに導入した増幅プラスミドを導入すること、または、これらの遺伝子を染色体上で接合、転移等により多コピー化すること、またこれらの遺伝子のプロモーター領域に変異を導入することにより達成することもできる。(国際公開パンフレットWO95-34672号参照)
【0020】
上記増幅プラスミドまたは染色体上で多コピー化させる場合、これらの遺伝子を発現させるためのプロモーターはコリネ型細菌において機能するものであればいかなるプロモーターであっても良く、用いる遺伝子自身のプロモーターであってもよい。プロモーターを適宜選択することによっても、遺伝子の発現量の調節が可能である。以上のような方法により、クエン酸シンターゼ遺伝子、フォスフォエノールピルベートカルボキシラーゼ遺伝子、及び/又はグルタミン酸デヒドロゲナーゼ遺伝子の発現が増強するように改変されたコリネ型細菌としては、WO00/18935等に記載されたコリネ型細菌が例示できる。
【0021】
L−グルタミン酸生産能を付与するための改変は、L−グルタミン酸の生合成経路から分岐して他の化合物を生成する反応を触媒する酵素の活性を低下または欠損させることにより行ってもよい。L−グルタミン酸の生合成経路から分岐してL−グルタミン酸以外の化合物を生成する反応を触媒する酵素としては、イソクエン酸リアーゼ、α−ケトグルタル酸デヒドロゲナーゼ、リン酸アセチルトランスフェラーゼ、酢酸キナーゼ、アセトヒドロキシ酸シンターゼ、アセト乳酸シンターゼ、ギ酸アセチルトランスフェラーゼ、乳酸デヒドロゲナーゼ、グルタミン酸デカルボキシラーゼ、1−ピロリンデヒドロゲナーゼなどが挙げられる。
上記のような酵素の活性を低下または欠損させるには、通常の変異処理法によって、染色体上の上記酵素の遺伝子に、細胞中の当該酵素の活性が低下または欠損するような変異を導入すればよい。例えば、遺伝子組換えによって、染色体上の酵素をコードする遺伝子を欠損させたり、プロモーターやシャインダルガルノ(SD)配列等の発現調節配列を改変したりすることなどによって達成される。また、染色体上の酵素をコードする領域にアミノ酸置換(ミスセンス変異)を導入すること、また終始コドンを導入すること(ナンセンス変異)、一〜二塩基付加・欠失するフレームシフト変異を導入すること、遺伝子の一部分を欠失させることによっても達成出来る。(Journal of biological Chemistry 272:8611-8617(1997))また、コード領域が欠失したような変異酵素をコードする遺伝子を構築し、相同組換えなどによって、該遺伝子で染色体上の正常遺伝子を置換することによっても酵素活性を低下または欠損させることができる。
例えば、α−ケトグルタル酸デヒドロゲナーゼ活性を低下させるには該酵素のE1oサブユニットをコードするsucA(odhA)遺伝子を用いて改変すればよい。
sucA遺伝子の塩基配列とそれにコードされるアミノ酸配列を配列番号9,10に示す。例えば、sucA遺伝子の破壊は配列番号1〜6のプライマーを用い、後述の実施例に記載の方法によって行うことができる。
その他にも、α−ケトグルタル酸デヒドロゲナーゼ活性が低下した株として、例えば、以下の株が挙げられる。
ブレビバクテリウム・ラクトファーメンタムΔS株(国際公開95/34672号パンフレット)
ブレビバクテリウム・ラクトファーメンタムAJ12821(FERMBP−4172;フランス特許公報9401748号明細書参照)
ブレビバクテリウム・フラバムAJ12822 (FERMBP−4173;フランス特許公報9401748号明細書参照)
コリネバクテリウム・グルタミカムAJ12823(FERMBP−4174;フランス特許公報9401748号明細書参照)
【0022】
L−グルタミン酸生産能を付与または増強する別の方法として、有機酸アナログや呼吸阻害剤などへの耐性を付与する方法や細胞壁合成阻害剤に対する感受性を付与する方法も挙げられる。例えば、ベンゾピロンまたはナフトキノン類に耐性を付与する方法(特開昭56-1889)、HOQNO耐性を付与する方法(特開昭56-140895)、α-ケトマロン酸耐性を付与する方法(特開昭57-2689)、グアニジン耐性を付与する方法(特開昭56-35981)、ペニシリンに対する感受性を付与する方法(特開平4-88994)などが挙げられる。
このような耐性菌の具体例としては、下記のような菌株が挙げられる。
ブレビバクテリウム・フラバムAJ11355(FERM P-5007;特開昭56-1889号公報参照)
コリネバクテリウム・グルタミカムAJ11368(FERM P- P-5020;特開昭56-1889号公報参照)
ブレビバクテリウム・フラバムAJ11217(FERM P-4318;特開昭57-2689号公報参照)
コリネバクテリウム・グルタミカムAJ11218(FERM-P4319;特開昭57-2689号公報参照)
ブレビバクテリウム・フラバムAJ11564(FERM P-5472;特開昭56-140895公報参照)
ブレビバクテリウム・フラバムAJ11439(FERM P-5136;特開昭56-35981号公報参照)
コリネバクテリウム・グルタミカムH7684(FERM BP-3004;特開平04-88994号公報参照)
【0023】
L−グルタミン生産能を付与するための方法としては、例えば、L−グルタミン生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。例えば、L−グルタミン酸生合成に関与する酵素としては、グルタミンシンテターゼ、グルタミン酸デヒドロゲナーゼが挙げられる(特開2002-300887号公報)。
また、L−グルタミン生産能を付与するための改変は、L−グルタミンの生合成経路から分岐して他の化合物を生成する反応を触媒する酵素の活性を低下または欠損させることにより行ってもよい。例えば、細胞内のグルタミナーゼ活性を低下させることが挙げられる(特開2004-187684号公報)。
【0024】
また、アミノ酸アナログなどへの耐性を付与する方法も挙げられる。具体的には、6-ジアゾ-5-オキソ-ノルロイシン耐性を付与する方法(特開平3-232497号公報)、プリンアナログ耐性および/またはメチオニンスルホキサイド耐性を付与する方法(特開昭61-202694号公報)、α-ケトマロン酸耐性を付与する方法(特開昭56-151495号公報)、グルタミン酸を含有するペプチドに耐性を付与する方法(特開平2-186994号公報)などが挙げられる。
L−グルタミン生産能を有するコリネ型細菌の具体例としては、下記のような菌株が挙げられる。
ブレビバクテリウム・フラバムAJ11573(FERM P-5492) 特開昭56-151495号公報、
ブレビバクテリウム・フラバムAJ12210(FERM P-8123) 特開昭61-202694号公報、
ブレビバクテリウム・フラバムAJ12212(FERM P-8125) 特開昭61-202694号公報、
ブレビバクテリウム・フラバムAJ12418(FERM-BP2205) 特開平2-186994号公報、
ブレビバクテリウム・フラバムDH18(FERM P-11116) 特開平3-232497号公報、
コリネバクテリウム・メラセコラDH344(FERM P-11117) 特開平3-232497号公報、
コリネバクテリウム・グルタミカムAJ11574(FERM P-5493) 特開昭56-151495号公報。
【0025】
L−プロリン生産能を付与するための方法としては、例えば、L−プロリン生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。例えば、L−プロリン生合成に関与する酵素としては、グルタミン酸5‐キナーゼ、γ‐グルタミル−リン酸レダクターゼ、ピロリン−5−カルボキシレートレダクターゼが挙げられる。
【0026】
L−プロリン生産能を付与するための改変は、L−プロリンの生合成経路から分岐して他の化合物を生成する反応を触媒する酵素の活性を低下または欠損させることにより行ってもよい。例えば、細胞内のオルニチンーアミノトランスフェラーゼ活性を低下させることが挙げられる。
【0027】
L−アルギニン生産能を付与するための方法としては、例えば、L−アルギニン生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。L−アルギニン生合成系酵素としては、N−アセチルグルタミルリン酸レダクターゼ(argC)、オルニチンアセチルトランスフェラーゼ(argJ)、N−アセチルグルタメートキナーゼ(argB)、アセチルオルニチントランスアミナーゼ(argD)、オルニチンカルバモイルトランスフェラーゼ(argF)、アルギニノコハク酸シンターゼ(argG)、アルギニノコハク酸リアーゼ(argH)、カルバモイルリン酸シンターゼから選ばれる1種又は2種以上が挙げられる。
【0028】
L−アルギニン生産能を付与する別の方法として、アミノ酸アナログなどへの耐性を付与する方法も挙げられる。このような細菌として、2−チアゾールアラニン耐性に加えて、L−ヒスチジン、L−プロリン、L−スレオニン、L−イソロイシン、L−メチオニンまたはL−トリプトファン要求性を有するコリネ型細菌(特開昭54−44096号公報);ケトマロン酸、フルオロマロン酸又はモノフルオロ酢酸に耐性を有するコリネ型細菌(特開昭57−18989号公報);アルギニノールに耐性を有するコリネ型細菌(特公昭62−24075号公報);または、X−グアニジン(Xは脂肪酸又は脂肪鎖の誘導体)に耐性を有するコリネ型細菌(特開平2−186995号公報);アルギニンヒドロキサメート及び6−アザウラシルに耐性を有するコリネ型細菌(特開昭57-150381号公報)等が挙げられる。
【0029】
なお、L−アルギニン、L−グルタミン、L−プロリンはL−グルタミン酸を骨格としているので、上述のL−グルタミン酸生産菌において、L−グルタミン酸から各L−アミノ酸を生成する反応を触媒する酵素をコードする遺伝子を増幅して育種してもよい。
【0030】
また、L−シトルリン、L−オルニチンもL−アルギニンと生合成経路が共通しており、N−アセチルグルタミン酸シンターゼ(argA)、N−アセチルグルタミルリン酸レダクターゼ(argC)、オルニチンアセチルトランスフェラーゼ(argJ)、N-アセチルグルタミン酸キナーゼ(argB)、アセチルオルニチントランスアミナーゼ(argD)、アセチルオルニチンデアセチラーゼ(argE)の酵素活性を上昇させることによってこれらの生産能を付与することができる。
【0031】
L-システイン生産能を有するコリネ型細菌としては、L−システインによるフィードバック阻害が低減されたセリンアセチルトランスフェラーゼを保持することにより、細胞内のセリンアセチルトランスフェラーゼ活性が上昇したコリネ型細菌(特開2002−233384号公報)が知られている。
【0032】
L−バリン生産能を付与するための方法としては、例えば、L−バリン生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。L−バリン生合成に関与する酵素としては、例えば、ilvBNCオペロンの遺伝子、すなわちilvBNをコードするアセトヒドロキシ酸シンタ−ゼやイソメロリダクターゼ(ilvC)(国際公開00/50624号パンフレット)が挙げられる。尚、ilvBNCオペロンは、L−バリン及び/又はL−イソロイシン及び/又はL−ロイシンによるオペロンの発現調節を受けるので、生成するL−バリンによる発現抑制を解除するためにアテニュエーションを解除することが望ましい。
【0033】
L−バリン生産能を有するコリネ型細菌を得るためには、L-バリン産生を減少させる物質代謝経路に関与する、少なくとも1種の酵素の活性を低下あるいは欠損させることにより行ってもよい。例えば、L-ロイシン合成に関与するスレオニンデヒドラターゼやD-パントセナート合成に関与する酵素の活性を低下させることが考えられる。(国際公開00/50624号パンフレット)
【0034】
L−バリン生産能を付与する別の方法として、アミノ酸アナログなどへの耐性を付与する方法も挙げられる。このような細菌として、L−イソロイシンおよびL−メチオニン要求性,ならびにD−リボ−ス,プリンリボヌクレオシドまたはピリミジンリボヌクレオシドに耐性を有し,かつL−バリン生産能を有する変異株(FERM P-1841、FERM P-29、特公昭53-025034号公報) や、ポリケトイド類に耐性を有する変異株(FERM P-1763、FERM P-1764;特公平06-065314号公報) 、更には酢酸を唯一の炭素源とする培地でL-バリン耐性を示し、且つグルコースを唯一の炭素源とする培地でピルビン酸アナログ(β−フルオロピルビン酸等)に感受性を有する変異株(FERM BP-3006、BP-3007 特許3006929号明細書)が挙げられる。
【0035】
L-アラニン生産能が付与されたコリネ型細菌としては、例えば、H+-ATPase 活性が欠損したコリネ型細菌 (Appl Microbiol Biotechnol. 2001 Nov;57(4):534-40)やアスパラギン酸 β−デカルボキシラーゼ遺伝子が増幅されたコリネ型細菌(特開平07-163383)などが挙げられる。
【0036】
L−リジン生産能が付与されたコリネ型細菌としては、L−リジン生産能を有するL−リジンアナログ耐性株又は代謝制御変異株が挙げられる。具体的には、S−(2−アミノエチル)−システイン(以下、「AEC」と略記する)耐性変異株(ブレビバクテリウム・ラクトファーメンタムAJ11082(NRRL B-11470)株など:特公昭56-1914号公報、特公昭56-1915号公報、特公昭57-14157号公報、特公昭57-14158号公報、特公昭57-30474号公報、特公昭58-10075号公報、特公昭59-4993号公報、特公昭61-35840号公報、特公昭62-24074号公報、特公昭62-36673号公報、特公平5-11958号公報、特公平7-112437号公報、特公平7-112438号公報参照);その生育にL−ホモセリン等のアミノ酸を必要とする変異株(特公昭48-28078号公報、特公昭56-6499号公報参照);AECに耐性を示し、更にL−ロイシン、L−ホモセリン、L−プロリン、L−セリン、L−アルギニン、L−アラニン、L−バリン等のアミノ酸を要求する変異株(米国特許第3708395号及び第3825472号明細書参照);DL−α−アミノ−ε−カプロラクタム、α−アミノ−ラウリルラクタム、アスパラギン酸−アナログ、スルファ剤、キノイド、N−ラウロイルロイシンに耐性を示すL−リジン生産変異株;オキザロ酢酸脱炭酸酵素(デカルボキシラーゼ)または呼吸系酵素阻害剤の耐性を示すL−リジン生産変異株(特開昭50-53588号公報、特開昭50-31093号公報、特開昭52-102498号公報、特開昭53-9394号公報、特開昭53-86089号公報、特開昭55-9783号公報、特開昭55-9759号公報、特開昭56-32995号公報、特開昭56-39778号公報、特公昭53-43591号公報、特公昭53-1833号公報);イノシトールまたは酢酸を要求するL−リジン生産変異株(特開昭55-9784号公報、特開昭56-8692号公報);フルオロピルビン酸または34℃以上の温度に対して感受性を示すL−リジン生産変異株(特開昭55-9783号公報、特開昭53-86090号公報);エチレングリコールに耐性を示し、L−リジンを生産するブレビバクテリウム属またはコリネバクテリウム属の生産変異株(米国特許第4411997号明細書)などが挙げられる。
【0037】
また、L−リジン生合成系の酵素活性を上昇させることによっても、L−リジン生産能が付与されたコリネ型細菌を得ることが出来る。これらの酵素活性の上昇は、酵素をコードする遺伝子のコピー数を細胞内で上昇させること、発現調節配列を改変することによって、達成できる。
L−リジン生合成系酵素をコードする遺伝子としては、ジヒドロジピコリン酸合成酵素遺伝子(dapA)、アスパルトキナーゼ遺伝子(lysC)、ジヒドロジピコリン酸レダクターゼ遺伝子(dapB)、ジアミノピメリン酸脱炭酸酵素遺伝子(lysA)、ジアミノピメリン酸デヒドロゲナーゼ遺伝子(ddh)(以上、国際公開第96/40934号パンフレット)、ホスホエノールピルビン酸カルボキシラーゼ遺伝子(ppc) (特開昭60-87788号公報)、アスパラギン酸アミノトランスフェラーゼ遺伝子(aspC)(特公平6-102028号公報)、ジアミノピメリン酸エピメラーゼ遺伝子(dapF)(特開2003-135066号公報)、アスパラギン酸セミアルデヒド脱水素酵素遺伝子(asd)(国際公開第00/61723号パンフレット)等のジアミノピメリン酸経路の酵素の遺伝子、あるいはホモアコニット酸ヒドラターゼ遺伝子(特開2000-157276号公報)等のアミノアジピン酸経路の酵素等の遺伝子が挙げられる。これらの遺伝子を用いて改変されたコリネ型細菌が、特開平10-215883特開平10-165180WO96/40934などに開示されている。
【0038】
また、アスパルトキナ−ゼIII遺伝子(lysC)は、L−リジンによるフィ−ドバック阻害を受けないように改変した遺伝子を用いることが望ましい。このようなフィ−ドバック阻害を受けないように改変したlysC遺伝子は、米国特許5,932,453号明細書に記載の方法により取得できる。
【0039】
さらに、L−リジン生産能が付与されたコリネ型細菌は、L−リジン以外の化合物を生成する反応を触媒する酵素の活性や、L−リジン生産に負に機能する酵素活性が低下または欠損していてもよい。このような酵素としては、ホモセリンデヒドロゲナーゼ、リジンデカルボキシラーゼ(cadA, ldcC)、マリックエンザイムがあり、該酵素の活性が低下または欠損した株は国際公開第WO95/23864号パンフレットなどに記載されている。
【0040】
L−トリプトファン生産能が付与されたコリネ型細菌として好ましいものは、アントラニル酸合成酵素活性、ホスホグリセリン酸デヒドロゲナーゼ活性もしくはトリプトファンシンターゼ活性のうち、1又は2以上の活性が増強された細菌である。アントラニル酸合成酵素及びホスホグリセリン酸デヒドロゲナーゼは、それぞれL−トリプトファン及びL−セリンによるフィードバック阻害を受けるため、脱感作型の変異酵素を保持させることにより、酵素活性を強化することができる。
【0041】
また、トリプトファンオペロンを含む組換えDNAが導入することによってもL−トリプトファン生産能を付与することができる。また、トリプトファンオペロンのうち、トリプトファンシンターゼをコードする遺伝子(trpBA)の発現を強化することによっても、L−トリプトファン生産能を向上又は付与することができる。トリプトファンシンターゼは、α及びβサブユニットからなり、それぞれtrpA、trpBによってコードされている。トリプトファンオペロンの塩基配列及びtrpA、trpBの塩基配列はGenBank Accession No. J01714に登録されている(国際公開第2005/103275号パンフレット)。
L−トリプトファン生産能が付与されたコリネ型細菌として、ブレビバクテリウム・フラバムAJ11667(特開昭57−174096参照)が挙げられる。
【0042】
L−チロシン生産能が付与されたコリネ型細菌として、コリネバクテリウム・グルタミカムAJ11655(FERM P-5836)(特公平2−6517参照)、ブレビバクテリウム・ラクトファーメンタムAJ12081(FERM P-7249)(特開昭60−70093参照)が挙げられる。
【0043】
L−フェニルアラニン生産能を有するコリネ型細菌としては、チロシン要求性とL−フェニルアラニル−L−チロシン耐性を有する株(特開平5−49489号公報)やブレビバクテリウム・ラクトファーメンタム AJ12637(FERM BP-4160)(フランス特許出願公開第2,686,898号参照)が挙げられる。
【0044】
L−トリプトファン、L−フェニルアラニン、L−チロシンは共に芳香族アミノ酸で生合成系が共通しており、芳香族アミノ酸の生合成系酵素をコードする遺伝子としては、デオキシアラビノ−ヘプツロン酸リン酸シンターゼ(aroG)、3−デヒドロキネートシンターゼ(aroB)、シキミ酸デヒドラターゼ、シキミ酸キナーゼ(aroL)、5−エノール酸ピルビンシキミ酸3−リン酸シンターゼ(aroA)、コリスミ酸シンターゼ(aroC)が挙げられる。(欧州出願公開763127号明細書)従って、これらの酵素をコードする遺伝子をプラスミド、あるいはゲノム上で多コピー化することにより、芳香族アミノ酸の生産能を向上させることができる。また、これらの遺伝子はチロシンリプレッサーによって制御されることが知られており(tyrR)、tyrR遺伝子を欠損させることによって、芳香族アミノ酸の生合成系酵素活性を上昇してもよい。(欧州特許763127号明細書参照)
【0045】
また、L−スレオニン生産能を有するコリネ型細菌としては、コリネバクテリウム・アセトアシドフィラム AJ12318(FERM BP-1172)(米国特許第5,188,949号参照)等が挙げられる。
【0046】
L-ロイシン生産能が付与されたコリネ型細菌としては、ブレビバクテリウム・ラクトファーメンタム(Brevibacterium lactofermentum)AJ3718(FERM P−2516;2−チアゾールアラニン及びβ−ハイドロキシロイシン耐性かつイソロイシン及びメチオニン要求性)が挙げられる。
【0047】
L−イソロイシン生産能を有するコリネ型細菌としてはブレビバクテリウム・フラバム AJ12149(FERM BP-759)(米国特許第4,656,135号参照)等が挙げられる。
【0048】
<1−2> カルボニックアンヒドラーゼ活性の増強
上記のようなL-アミノ酸生産能が付与されたコリネ型細菌を、カルボニックアンヒドラーゼ活性が増強するように改変することによって、本発明の製造法に用いるコリネ型細菌を得ることができる。ただし、カルボニックアンヒドラーゼ活性増強のための改変とL-アミノ酸生産能の付与はどちらを先に行ってもよい。
「カルボニックアンヒドラーゼ活性が増強するように改変された」とは、親株、あるいは野生株に対して細胞当たりのカルボニックアンヒドラーゼ分子の数が増加した場合や、カルボニックアンヒドラーゼ分子当たりの活性が上昇した場合などが該当する。また、比較対象となる野生株とは、例えばコリネバクテリウム・グルタミカム(ブレビバクテリウム・ラクトファーメンタム)ATCC13869株やATCC13032株である。
【0049】
カルボニックアンヒドラーゼ活性が増強されたことの確認は、カルボニックアンヒドラーゼをコードする遺伝子のm-RNAの量を野生型、あるいは非改変株と比較することによって確認出来る。発現量の確認方法としては、ノーザンハイブリダイゼーション、RT-PCRが挙げられる(Molecular cloning(Cold spring Harbor Laboratory Press,Cold spring Harbor(USA),2001))。活性あるいは発現量については、野生株あるいは非改変株と比較して、上昇していればいずれでもよいが、例えば野生株、非改変株と比べて1.5倍以上、より好ましくは2倍以上、さらに好ましくは3倍以上上昇していることが望ましい。
【0050】
カルボニックアンヒドラーゼとは、二酸化炭素と重炭酸根の相互変換に関与している酵素である。(EC 4.2.1.1)。カルボニックアンヒドラーゼ活性は、Wilburらの方法(Wilbur KM, Anderson NG (1948) Electrometric and colorimetric determination of carbonic anhydrase. J Biol Chem 176:147−154)によって測定することができる。
コリネ型細菌のカルボニックアンヒドラーゼをコードする遺伝子(ca遺伝子)としては、βタイプのカルボニックアンヒドラーゼをコードする遺伝子(bca)ととγタイプのカルボニックアンヒドラーゼをコードする遺伝子(gca)の2種類が報告されているが、より好ましくはGenbankに登録されている、C.glutamicum ATCC13032株のNCgl2579 (bcaに相当、accession BA_000036.3 の2837954..2838577の相補鎖)が利用できる。該遺伝子の塩基配列を配列番号13(コード領域は塩基番号1〜621)に、コードされるタンパク質のアミノ酸配列を配列番号14に示す。またC.glutamicum ATCC13869株のbca遺伝子の塩基配列を配列番号11の塩基番号562〜1182に、コードされるタンパク質のアミノ酸配列を配列番号12に示す。
エシェリヒア・コリのカルボニックアンヒドラーゼをコードする遺伝子としては、Can(Carbonic anhydrase 2)、CynT(Carbonic anhydrase 1)の2種のカルボニックアンヒドラーゼをそれぞれコードするyadF,cynT遺伝子が報告されているおり、より好ましくは、Genbankに登録されている、Escherichia coli MG1655のyadF(accession EG_12319)が利用できる。該遺伝子の塩基配列を配列番号27(コード領域201-860)に、コードされるアミノ酸配列を28に示す。また、cynT(accession EG_10176)も利用することができる。cynT遺伝子の塩基配列番号を29(コード領域201-857)に、コードされるアミノ酸配列を30に示す。
【0051】
また、本発明に用いることのできる遺伝子は、コリネ型細菌においてカルボニックアンヒドラーゼ活性を有するタンパク質をコードする限り、他の微生物由来のca遺伝子のホモログ遺伝子を用いてもよい。ca遺伝子のホモログは、BLAST等によって配列番号11の塩基番号562〜1182または配列番号13の塩基配列を参照して、検索出来る(http://blast.genome.jp/)。
【0052】
本発明に用いることが出来るbca遺伝子は既に配列が明らかにされているので、それらの塩基配列に基づいて作製したプライマー、例えば配列番号7及び8に示すプライマーを用いてコリネ型細菌の染色体DNAを鋳型とするPCRにより、bcaとbcaの制御領域を含む領域を取得することができる。他の微生物のbcaのホモログも、同様にして取得され得る。
【0053】
また、コリネ型細菌の種や菌株によってbca遺伝子の塩基配列に差異が存在することがあるため、本発明に用いるbca遺伝子は配列番号11の塩基番号562〜1182または13の配列には限られず、コードされるBcaタンパク質の機能、カルボニックアンヒドラーゼ活性を有する限り、配列番号12または14のアミノ酸配列において、1若しくは複数の位置での1若しくは数個のアミノ酸の置換、欠失、挿入又は付加等を含む配列を有するタンパク質をコードする変異体又は人為的な改変体であってもよい。ここで、「1若しくは数個」とは、アミノ酸残基のタンパク質の立体構造における位置や種類によっても異なるが、具体的には1から20個、好ましくは、1から10個、より好ましくは1から5個である。また、このようなアミノ酸の置換、欠失、挿入、付加、または逆位等には、bca遺伝子を保持する微生物の個体差、種の違いに基づく場合などの天然に生じる変異(mutant又はvariant)によって生じるものも含まれる。
【0054】
上記置換は機能的に変化しない中性変異である保存的置換が好ましい。保存的変異とは、置換部位が芳香族アミノ酸である場合には、phe,trp,tyr間で、置換部位が疎水性アミノ酸である場合には、leu,ile,val間で、極性アミノ酸である場合には、gln,asn間で、塩基性アミノ酸である場合には、lys,arg,his間で、酸性アミノ酸である場合には、asp,glu間で、ヒドロキシル基を持つアミノ酸である場合には、ser,thr間でお互いに置換する変異である。より具体的には、保存的置換としては、alaからser又はthrへの置換、argからgln、his又はlysへの置換、asnからglu、gln、lys、his又はaspへの置換、aspからasn、glu又はglnへの置換、cysからser又はalaへの置換、glnからasn、glu、lys、his、asp又はargへの置換、gluからgly、asn、gln、lys又はaspへの置換、glyからproへの置換、hisからasn、lys、gln、arg又はtyrへの置換、ileからleu、met、val又はpheへの置換、leuからile、met、val又はpheへの置換、lysからasn、glu、gln、his又はargへの置換、metからile、leu、val又はpheへの置換、pheからtrp、tyr、met、ile又はleuへの置換、serからthr又はalaへの置換、thrからser又はalaへの置換、trpからphe又はtyrへの置換、tyrからhis、phe又はtrpへの置換、及び、valからmet、ile又はleuへの置換が挙げられる。
【0055】
さらに、bca遺伝子は、配列番号12あるいは14のアミノ酸配列全体に対して、80%以上、好ましくは90%以上、より好ましくは95%以上、特に好ましくは97%以上の相同性を有し、カルボニックアンヒドラーゼ活性を有するタンパク質をコードする配列を用いることも出来る。また、それぞれ導入する宿主により、遺伝子の縮重性が異なるので、それぞれbcaが導入される宿主で使用しやすいコドンに置換したものでもよい。尚、本明細書において、「相同性」(homology)」は、「同一性」(identity)を指すことがある。
同様にbca遺伝子は、カルボニックアンヒドラーゼ活性を有する限り、N末端側、C末端側が延長したものあるいは削られているものでもよい。例えば延長・削除する長さは、アミノ酸残基で50以下、好ましくは20以下、より好ましくは10以下、特に好ましくは5以下である。より具体的には、配列番号12あるいは14のアミノ酸配列のN末端側50アミノ酸から5アミノ酸、C末端側50アミノ酸から5アミノ酸延長・削除したものでもよい。
【0056】
このようなbca遺伝子と相同な遺伝子は、例えば、部位特異的変異法によって、コードされるタンパク質の特定の部位のアミノ酸残基が置換、欠失、挿入または付加を含むように配列番号11の塩基番号562〜1182、または配列番号13の塩基配列を改変することによって取得することができる。また、以下のような従来知られている変異処理によっても取得され得る。変異処理としては、上記塩基配列をヒドロキシルアミン等でインビトロ処理する方法、および該遺伝子を保持する微生物、例えばコリネ型細菌を、紫外線またはN-メチル-N’-ニトロ-N-ニトロソグアニジン(NTG)もしくはエチルメタンスルフォネート(EMS)等の通常変異処理に用いられている変異剤によって処理する方法、エラ−プロ−ンPCR 、DNA shuffling, StEP−PCRによって、遺伝子組換えにより人工的にbcaに変異を導入して活性の高いbca遺伝子を取得することが出来る。(Firth AE, Patrick WM ;Bioinformatics. 2005 Jun 2; Statistics of protein library construction.)
【0057】
またbca遺伝子は、配列番号11の塩基番号562〜1182または配列番号13の塩基配列と相補的な配列又はこれらの配列から調製され得るプローブとストリンジェントな条件下でハイブリダイズし、カルボニックアンヒドラーゼ活性を有するタンパク質をコードするDNAが挙げられる。ここで、「ストリンジェントな条件」とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。一例を示せば、相同性が高いDNA同士、例えば80, 90, 95 ,または97%以上の相同性を有するDNA同士がハイブリダイズし、それより相同性が低いDNA同士がハイブリダイズしない条件、あるいは通常のサザンハイブリダイゼ−ションの洗いの条件である60℃、1×SSC,0.1%SDS、好ましくは、0.1×SSC、0.1%SDSさらに好ましくは、68℃、0.1×SSC、0.1%SDSに相当する塩濃度、温度で、1回より好ましくは2〜3回洗浄する条件が挙げられる。
【0058】
プローブとして、配列番号11の塩基番号562〜1182、配列番号13の塩基配列の一部の配列を用いることもできる。そのようなプローブは、該塩基配列に基づいて作製したオリゴヌクレオチドをプライマーとし、配列番号11の塩基番号562〜1182の塩基配列、または配列番号13の塩基配列を含むDNA断片を鋳型とするPCRによって作製することができる。例えば、プローブとして、300bp程度の長さのDNA断片を用いる場合には、ハイブリダイゼーションの洗いの条件は、50℃、2×SSC、0.1%SDSが挙げられる。
【0059】
bca遺伝子の発現量の増強は、bca遺伝子のコピー数を高めることによって達成される。例えば、bcaを含む遺伝子をコードする断片を、コリネ型細菌で機能するベクター、好ましくはマルチコピー型のベクターと連結して組換えDNAを作製し、これを上述のようなL−アミノ酸生産能を有する微生物に導入して形質転換すればよい。また、野生型のコリネ型細菌に上記組換えDNAを導入して形質転換株を得、その後当該形質転換株にL−アミノ酸生産能を付与してもよい。また、コピー数の上昇は、bcaをコードする遺伝子を染色体上に1コピーあるいは複数コピー転移させることによっても達成される。染色体上にbca遺伝子が転移したことの確認は、bca遺伝子の一部をプローブとして、サザンハイブリダイゼーションを行うことによって確認出来る。
【0060】
また、bca遺伝子の発現の増強は、bca遺伝子の発現調節領域を改変することによっても達成出来る。例えば、bcaのプロモーターの配列をより強いプロモーターに置換すること、プロモーター配列をコンセンサスに近づけることによって達成出来る。(国際公開第WO00/18935号パンフレット)
【0061】
以下、カルボニックアンヒドラーゼ活性が上昇するように改変したコリネ型細菌の構築方法を示す。これらの方法は、Molecular cloning(Cold spring Harbor Laboratory Press,Cold spring Harbor(USA),2001)等のマニュアルに従って実施出来る。
【0062】
同遺伝子の発現量の増強は、bca遺伝子のコピー数を高めることによって達成でき、コピー数を高めることは、以下のようにプラスミドでbca遺伝子を増幅することによって達成出来る。まずbca遺伝子は、コリネ型細菌の染色体からクローニングする。染色体DNAは、DNA供与体である細菌から、例えば、斎藤、三浦の方法(H. Saito and K.Miura, Biochem.B iophys. Acta, 72, 619 (1963)、生物工学実験書、日本生物工学会編、97〜98頁、培風館、1992年参照)等により調製することができる。PCRに用いるオリゴヌクレオチドは上記の公知情報に基づいて合成でき、例えば配列番号7、8に記載の合成オリゴヌクレオチドを用いbca遺伝子を増幅することが出来る。
【0063】
PCR法により増幅されたbca遺伝子を含む遺伝子断片は、エシェリヒア・コリ及び/またはコリネ型細菌の細胞内において自律複製可能なベクターDNAに接続して組換えDNAを調製し、これをエシェリヒア・コリに導入しておくと、後の操作がしやすくなる。エシェリヒア・コリ細胞内において自律複製可能なベクターとしては、pUC19、pUC18、pHSG299, pHSG399, pHSG398, RSF1010, pBR322, pACYC184, pMW219等が挙げられる。
【0064】
上記DNAをコリネ型細菌で機能するベクターに導入する。コリネ型細菌で機能するベクターとは、例えばコリネ型細菌で自律複製できるプラスミドである。具体的に例示すれば、コリネ型細菌で自律複製可能なプラスミドとしては、例えば、特開平3−210184号公報に記載のプラスミドpCRY30;特開平2−72876号公報及び米国特許5,185,262号公報に記載のプラスミドpCRY21、pCRY2KE、pCRY2KX、pCRY31、pCRY3KE及びpCRY3KX;特開平1−191686号公報に記載のプラスミドpCRY2およびpCRY3;特開昭58−67679号公報に記載のpAM330;特開昭58−77895号公報に記載のpHM1519;特開昭58−192900号公報に記載のpAJ655、pAJ611及びpAJ1844;特開昭57−134500号公報に記載のpCG1;特開昭58−35197号公報に記載のpCG2;特開昭57−183799号公報に記載のpCG4およびpCG11等、特開平10-215883号公報に記載のpVK7を挙げることができる。
また、これらのベクターからコリネ型細菌中でプラスミドを自律複製可能にする能力を持つDNA断片を取り出し、前記エシェリヒア・コリ用のベクターに挿入すると、エシェリヒア・コリ及びコリネ型細菌の両方で自律複製可能ないわゆるシャトルベクターとして使用することができる。
【0065】
これらのベクターは、寄託微生物から次のようにして得られる。対数増殖期に集められた細胞をリゾチーム及びSDSを用いて溶菌し、30000×gで遠心分離して溶解物から得た上澄液にポリエチレングリコールを添加し、セシウムクロライド−エチジウムブロマイド平衡密度勾配遠心分離により分別精製する。
【0066】
bca遺伝子とコリネ型細菌で機能するベクターを連結して組換えDNAを調製するには、 bcaの末端に合うような制限酵素でベクターを切断する。この制限酵素サイトはあらかじめbcaの増幅に用いる合成オリゴヌクレオチドに導入されていてもよい。連結はT4DNAリガーゼ等のリガーゼを用いて行うのが普通である。
【0067】
上記のように調製した組換えプラスミドをコリネ型細菌に導入するには、これまでに報告されている形質転換法に従って行えばよい。例えば、エシェリヒア・コリ K−12について報告されているような、受容菌細胞を塩化カルシウムで処理してDNAの透過性を増す方法(Mandel,M.and Higa,A.,J. Mol. Biol., 53, 159 (1970))があり、バチルス・ズブチリスについて報告されているような、増殖段階の細胞からコンピテントセルを調製してDNAを導入する方法(Duncan,C.H.,Wilson,G.A.and Young,F.E., Gene, 1, 153 (1977))がある。あるいは、バチルス・ズブチリス、放線菌類及び酵母について知られているような、DNA受容菌の細胞を、組換えDNAを容易に取り込むプロトプラストまたはスフェロプラストの状態にして組換えDNAをDNA受容菌に導入する方法(Chang,S. and Choen,S.N., Mol.Gen.Genet., 168, 111 (1979); Bibb,M.J., Ward,J.M. andHopwood,O.A., Nature, 274, 398 (1978); Hinnen,A., Hicks,J.B. and Fink,G.R., Proc. Natl. Acad. Sci. USA, 75 1929 (1978))も応用できる。また、電気パルス法(特開平2-207791号公報)や、接合伝達法(Biotechnology (N Y). 1991 Jan;9(1):84-7)によっても、コリネ型細菌の形質転換を行うことができる。
【0068】
bcaのコピー数を高めることは、bcaをコリネ型細菌の染色体DNA上に複数コピー存在させることによっても達成できる。コリネ型細菌の染色体DNA上にbcaを複数コピー導入するには、染色体DNA上に複数コピー存在する配列を標的に利用して相同組換えにより行う。染色体DNA上に多コピー存在する配列としては、レペティティブDNA、転移因子の端部に存在するインバーテッド・リピートが利用できる。あるいは、特開平2-109985号公報に開示されているように、bcaをトランスポゾンに搭載してこれを転移させて染色体DNA上に多コピー導入することも可能である。(特開平2-109985号、特開平7−107976号、Mol.Gen.Genet.,245, 397-405 (1994)、Plasmid. 2000 Nov;44(3):285-91)。
【0069】
また、宿主で複製できない複製起点あるいは、宿主で複製出来ない複製起点と宿主への接合伝達能を有するプラスミドにbca遺伝子を導入して、染色体上で増幅させる方法も適用できる。例えば用いることが出来るベクターは、pSUP301(Simo等, Bio/Technology 1, 784〜791 (1983) )、pK18mobまたはpK19mob(Schaefer等, Gene 145, 69〜73 (1994) )、pGEM−T(Promega corporation, Madison, WI, USA)、pCR2.1−TOPO(Shuman (1994). Journal of Biological Chemisty 269: 32678〜84; US-A 5487993)、pCR Blunt(Invitrogen, Groningen, Netherlands; Bernard et al., Journal of Molecular Biology, 234: 534〜541 (1993))、pEM1(Schrumpf等,1991, Journal of Bacteriology 173: 4510〜4516)またはpBGS8(spratt等, 1986, Gene, 41:337〜342)等が挙げられる。bca遺伝子を含むプラスミドベクターをコリネ型細菌中に接合または形質転換によって転移させる。接合法は、例えばSchaefer等(Applied and Environmental Microbiology 60, 756〜759 (1994))に記載されている。形質転換法は、例えばTheirbach等(Applied Microbiology and Biotechnology 29, 356〜362 (1988))、DunicanおよびShivinan(Bio/Technology 7, 1067〜1070 (1989))およびTauch等(FEMS Microbiological Letters 123, 343〜347 (1994))に記載されている。
【0070】
また、bcaの活性を上昇させる手段として染色体DNA上またはプラスミド上のbca遺伝子のプロモーター等の発現調節配列を強力なものに置換すること、bcaの発現調節に関与する因子、例えばオペレーターやリプレッサーを改変すること、強力なターミネーターを連結することによっても達成される。(Hamilton et al,; Journal of Bacterology171:4617-4622) 例えば、lacプロモーター、trpプロモーター、trcプロモーター、PS2プロモーター等が強力なプロモーターとして知られている。プロモーターの強度の評価法および強力なプロモーターの例は、Goldsteinらの論文(Prokaryotic promoters in biotechnology. Biotechnol. Annu. Rev., 1995, 1, 105-128)等に記載されている。また、国際公開WO00/18935に開示されているように、目的遺伝子のプロモーター領域に数塩基の塩基置換を導入し、よりコンセンサスに近づける配列に置換し、強力なものに改変することも可能である。例えば、−35領域をTTGACA、TTGCCA配列に、−10領域をTATAAT、TATAAC配列に置換することが考えられる。さらに、リボソーム結合部位(RBS)と開始コドンとの間のスペーサ、特に開始コドンのすぐ上流の配列における数個のヌクレオチドの置換がmRNAの翻訳効率に非常に影響を及ぼすことが知られており、これらを改変することも可能である。
【0071】
bca遺伝子の上流領域としては、例えば、配列番号11の塩基番号1〜561の領域が挙げられる。bca遺伝子上流のプロモーター等の発現調節配列は、プロモーター検索ベクターやGENETYX等の遺伝子解析ソフトを用いて決定することも出来る。これらのプロモーター置換または改変によりbca遺伝子の発現が強化される。発現調節配列の置換は、例えば温度感受性プラスミドを用いて行うことができる。なお、発現調節配列の改変は、bca遺伝子のコピー数を高めることと組み合わせてもよい。
また、発現量の上昇は、m-RNAの生存時間を延長させることや、酵素タンパク質の細胞内での分解を防ぐことによっても達成可能である。
【0072】
本発明の製造法に使用する微生物は、カルボニックアンヒドラーゼ活性の増強に加えて、さらにD-キシロース5−リン酸−ホスホケトラーゼ及び/又はフルクトース6-リン酸ホスホケトラーゼ活性が付与されるように改変された微生物でもよい。
【0073】
D-キシロース5−リン酸−ホスホケトラーゼ活性及びフルクトース6-リン酸ホスホケトラーゼ活性はいずれか一方を活性付与してもよいし、両方を活性付与してもよい。なお、本明細書ではD-キシロース5−リン酸−ホスホケトラーゼとフルクトース6-リン酸ホスホケトラーゼをまとめてホスホケトラーゼと呼ぶことがある。
【0074】
D-キシロース5−リン酸−ホスホケトラーゼ活性とは、リン酸を消費して、キシルロース−5−リン酸をグリセルアルデヒド-3-リン酸とアセチルリン酸に変換し、一分子のH2Oを放出する活性を意味する。この活性は、Goldberg, M.らの文献 (Methods Enzymol., 9, 515-520 (1966) またはL.Meileの文献 (J.Bacteriol. (2001) 183; 2929-2936)に記載の方法によって測定することができる。
【0075】
また、フルクトース6-リン酸ホスホケトラーゼ活性とは、リン酸を消費して、フルクトース6-リン酸をエリスロース-4-リン酸とアセチルリン酸に変換し、一分子のH2Oを放出する活性を意味する。この活性は、Racker, Eの文献 (Methods Enzymol., 5, 276-280 (1962)) またはL.Meileの文献 (J.Bacteriol. (2001) 183; 2929-2936)に記載の方法によって測定することができる。
【0076】
ホスホケトラーゼの活性付与は、ホスホケトラーゼをコードする遺伝子をプラスミドを用いてコリネ型細菌の細胞内に導入すること、当該遺伝子をコリネ型細菌の染色体上に組み込むことなどにより行うことができる。
【0077】
コリネ型細菌は本来的にホスホケトラーゼ活性を有していないため、他の生物由来のホスホケトラーゼ遺伝子を含むプラスミドを細胞内に導入したり、他の生物由来のホスホケトラーゼ遺伝子を染色体上に組み込んだりすることにより、ホスホケトラーゼ活性を付与することができる。
D-キシロース5−リン酸−ホスホケトラーゼをコードする遺伝子は、該酵素活性を有する微生物の染色体DNAを鋳型にしてPCRなどの手段によって得ることができる。このような微生物としては、乳酸菌、メタノール資化性細菌、メタン資化性細菌、ストレプトコッカス属細菌、アセトバクター(Acetobacter)属細菌、ビフィドバクテリウム(Bifidobacterium)属細菌、ラクトバチルス(Lactobacillus)属細菌、チオバチルス(Thiobacillus)属細菌、メチロコッカス(Methylococus)属細菌、ブチリビブリオ(Butyrivibrio)属細菌、フィブロバクター(Fibrobacter)属細菌などの細菌や、キャンディダ(Candida)属、ロドトルラ(Rhodotorula)属、ロドスポリディウム(Rhodosporidium)属、ピキア(Pichia)属、ヤロウィア(Yarrowia)属、ハンセヌラ(Hansenula)属、クルイベロミセス(Kluyveromyces)属、サッカロミセス(Saccharomyces)属、トリコスポロン(Trichosporon)属、ウィンゲア(Wingea) 属などに属する酵母などが挙げられる。
【0078】
フルクトース6-リン酸ホスホケトラーゼをコードする遺伝子は、該酵素活性を有する微生物の染色体DNAを鋳型にしてPCRなどの手段によって得ることができる。このような微生物としては、アセトバクター属細菌、ビフィドバクテリウム属細菌、クロロビウム(Chlorobium)属細菌、ブルセラ(Brucella)属細菌、メチロコッカス属細菌、ガードネレラ( Gardnerella)属細菌などの細菌や、キャンディダ属、ロドトルラ属、サッカロミセス属などに属する酵母などが挙げられる。
【0079】
D-キシロース5−リン酸−ホスホケトラーゼをコードする遺伝子として具体的には、Lactobacillus pentosus MD363 のD-キシロース5−リン酸−ホスホケトラーゼをコードするxpkA 遺伝子を挙げることができる。この塩基配列はEMBL/GenBank データベースにアクセス番号AJ309011 (Posthuma, C.C. et al, Appl. Environ. Microbiol., 68(2), 831-7 (2002))で登録されている(配列番号15)。
また、Lactobacillus plantarum のxpk1遺伝子を使用することもできる。この塩基配列はEMBL/GenBank データベースにアクセス番号NC_004567 Region: complement (2362936..2365302) (Kleerebezem, M., et al, Proc. Natl. Acad. Sci. U.S.A. 100 (4), 1990-1995 (2003)) で登録されている(配列番号17)。
【0080】
その他にも、これらの遺伝子のホモログとして、GenBank Accession No. NC_004567 Complement (3169067-3171478)の Lactobacillus plantarum の遺伝子、GenBank Accession No. NP_736274のアミノ酸配列をコードするStreptococcus agalactiae の遺伝子、GenBank Accession No. NP_267658のアミノ酸配列をコードするLactococcus lactis subsp. Lactisの遺伝子、GenBank Accession No. のNC_005362 696462..698867のLactobacillus johnsonii の遺伝子、GenBank Accession No. YP_193510のアミノ酸配列をコードするLactobacillus acidophilus の遺伝子などが挙げられる。
【0081】
D-キシロース5−リン酸−ホスホケトラーゼ及びフルクトース6-リン酸ホスホケトラーゼの両方の活性を有するタンパク質をコードする遺伝子を用いることもできる。このような遺伝子としては、Bifidobacterium lactisの xfp遺伝子が挙げられ、この塩基配列は、EMBL/ GenBank データベースにアクセス番号AJ293946 (Meile, L. et al, J. Bacteriol., 183(9), 2929-36 (2001)) で登録されている(配列番号19)。
xfp遺伝子のホモログ遺伝子として、GenBank Accession No. NP_696135のアミノ酸配列をコードするBifidobacterium longum の遺伝子、GenBank Accession No. NP_662409のアミノ酸配列をコードするChlorobium tepidum の遺伝子、GenBank Accession No. NP_699578のアミノ酸配列をコードするBrucella suis の遺伝子、GenBank Accession No. YP_223570のアミノ酸配列をコードするBrucella abortus の遺伝子などを用いることもできる。
なお、ホスホケトラーゼ遺伝子は、上記いずれかの塩基配列の相補配列もしくはこの相補配列から調製され得るプローブとストリンジェントな条件下でハイブリダイズし、かつホスホケトラーゼ活性を有するタンパク質をコードするDNAであってもよい。
【0082】
本発明の製造法に使用する微生物は、カルボニックアンヒドラーゼ活性の増強に加えて、さらにホスホトランスアセチラーゼ活性を増強するように改変された微生物でも良い。ホスホトランスアセチラーゼは酢酸代謝に関与している酵素である。エシェリヒア・コリにおいては、酢酸生成の主経路の一部であるアセチル−CoAとリン酸からアセチルリン酸を生成する反応を担っている。一方、コリネバクテリウム・グルタミカムにおいては、酢酸を資化しアセチル−CoAを生成する時にホスホトランスアセチラーゼの活性が上がること、また、ホスホトランスアセチラーゼ活性の負の制御に転写因子であるRamBが関与していることが知られている(Microbiology 1999年 第145巻 p.503-513、Journal of Bacteriology 2004年 Vol.186, No.9 p.2798-2809)。ホスホトランスアセチラーゼ活性増強は、上述したホスホトランスアセチラーゼの活性増強と同様に、ホスホトランスアセチラーゼをコードする遺伝子のコピー数の増加やホスホトランスアセチラーゼをコードする遺伝子のプロモーターの改変などによって行うことができる。また、上記ramB遺伝子を欠損しても良く、ホスホトランスアセチラーゼをコードする遺伝子上流のRamBタンパク質結合部位を改変することによっても達成される。
コリネ型細菌のホスホトランスアセチラーゼをコードする遺伝子(pta遺伝子)としては、Genbankに登録されている、ATCC13032のNCgl2657 (accession NC_003450.3 の2936506..2937891の相補鎖)が利用できる。該遺伝子の塩基配列を配列番号21に、コードされるタンパク質のアミノ酸配列を配列番号22に示す。またC.glutamicumATCC13869株のpta遺伝子の塩基配列を配列番号23の塩基番号1214〜2641に、コードされるタンパク質のアミノ酸配列を配列番号24に示す。
【0083】
また、本発明の遺伝子は、コリネ型細菌においてホスホトランスアセチラーゼ活性を有する限り、他の微生物由来のpta遺伝子のホモログ遺伝子を用いてもよい。pta遺伝子のホモログは、BLAST等によって配列番号23の塩基番号1214〜2641の塩基配列を参照して、検索出来る(http://blast.genome.jp/)。
本発明に用いることが出来るpta遺伝子は、既に配列が明らかにされているので、それらの塩基配列に基づいて作製したプライマー、例えば配列番号25及び26に示すプライマーを用いて、コリネ型細菌の染色体DNAを鋳型とするPCR法(PCR:polymerase chain reaction; White,T.J. et al., Trends Genet. 5, 185 (1989)参照)によって、ptaとptaの制御領域を含む領域を取得することができる。他の微生物のptaのホモログも、同様にして取得され得る。
【0084】
また、コリネ型細菌の種や菌株によってpta遺伝子の塩基配列に差異が存在することがあるため、本発明に用いるpta遺伝子は配列番号23の塩基番号1214〜2641または21の配列には限られず、コードされるPtaタンパク質の機能、ホスホトランスアセチラーゼ活性を有する限り、配列番号24または22のアミノ酸配列において、1若しくは複数の位置での1若しくは数個のアミノ酸の置換、欠失、挿入又は付加等を含む配列を有するタンパク質をコードする変異体又は人為的な改変体であってもよい。ここで、「1〜数個」とは、アミノ酸残基のタンパク質の立体構造における位置や種類によっても異なるが、具体的には1から20個、好ましくは、1から10個、より好ましくは1から5個である。また、このようなアミノ酸の置換、欠失、挿入、付加、または逆位等には、pta遺伝子を保持する微生物の個体差、種の違いに基づく場合などの天然に生じる変異(mutant又はvariant)によって生じるものも含まれる。
【0085】
本発明の製造法に使用するコリネ型細菌は、上記改変に加えて、さらにピルビン酸カルボキシーゼ活性が増強されるように改変された微生物でもよい。ピルビン酸カルボキシーゼをコードする遺伝子は、例えば、コリネ型細菌、バチルス属細菌由来の遺伝子を利用でき、C.glutamicum ATCC13032のpyc遺伝子(Genbank Accession No. NCgl0659)やB.subtilisのpyc遺伝子(欧州特許 1092776号)が利用できる。
【0086】
本発明の製造法に使用するコリネ型細菌は、上記改変に加えて、さらにホスホエノールピルビン酸カルボキシラーゼ活性が増強されるように改変された細菌でもよい。ホスホエノールピルビン酸カルボキシラーゼをコードする遺伝子は、例えば、コリネ型細菌、エシェリヒア属細菌の遺伝子が利用でき、C.glutamicum ATCC13032のppc遺伝子(Genbank Accession No. NCgl1523)や、E.coli MG1655のppc遺伝子(Genbank Accession No. NP_418391)が利用できる。
なお、ホスホエノールピルビン酸カルボキシラーゼはアスパラギン酸にフィードバック阻害を受けることがあるので、アスパラギン酸にフィードバック阻害を受けないように改変することが好ましい。(欧州特許0723011号)
【0087】
<2>L-アミノ酸物質の製造法
上記のようにして得られるコリネ型細菌を培地に培養し、培地中にL-アミノ酸を生成蓄積せしめ、L-アミノ酸を該培地から採取することにより、L-アミノ酸を製造することが出来る。
【0088】
培養に用いる培地は、炭素源、窒素源、無機塩類、その他必要に応じてアミノ酸、ビタミン等の有機微量栄養素を含有する通常の培地を用いることができる。合成培地または天然培地のいずれも使用可能である。培地に使用される炭素源および窒素源は培養する菌株が利用可能であるものならばいずれの種類を用いてもよい。
【0089】
炭素源としては、グルコース、グリセロール、フラクトース、スクロース、マルトース、マンノース、ガラクトース、澱粉加水分解物、糖蜜等の糖類が使用でき、その他、酢酸、クエン酸等の有機酸、エタノール等のアルコール類も単独あるいは他の炭素源と併用して用いることができる。窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、りん酸アンモニウム、酢酸アンモニウム等のアンモニウム塩または硝酸塩等が使用することができる。有機微量栄養素としては、アミノ酸、ビタミン、脂肪酸、核酸、更にこれらのものを含有するペプトン、カザミノ酸、酵母エキス、大豆たん白分解物等が使用でき、生育にアミノ酸などを要求する栄養要求性変異株を使用する場合には要求される栄養素を補添することが好ましい。無機塩類としてはりん酸塩、マグネシウム塩、カルシウム塩、鉄塩、マンガン塩等が使用できる。
【0090】
培養は、好ましくは、発酵温度20〜45℃、pHを3〜9に制御し、通気培養を行う。培養中にpHが下がる場合には、例えば、炭酸カルシウムを加えるか、アンモニアガス等のアルカリで中和する。このような条件下で、好ましくは10時間〜120時間程度培養することにより、培養液中に著量のL−グルタミン酸などのL-アミノ酸が蓄積される。
【0091】
また、L-グルタミン酸を製造する場合、L-グルタミン酸が析出するような条件に調整された液体培地を用いて、培地中にL−グルタミン酸を析出させながら培養を行うことも出来る。L−グルタミン酸が析出する条件としては、例えば、pH5.0〜4.0、好ましくはpH4.5〜4.0、さらに好ましくはpH4.3〜4.0、特に好ましくはpH4.0を挙げることができる(欧州特許出願公開第1078989号明細書)。
【0092】
培養終了後の培養液からL-アミノ酸を採取する方法は、公知の回収方法に従って行えばよい。例えば、培養液から菌体を除去した後に濃縮晶析する方法あるいはイオン交換クロマトグラフィー等によって採取される。L−グルタミン酸が析出するような条件下で培養した場合、培養液中に析出したL−グルタミン酸は、遠心分離又は濾過等により採取することができる。この場合、培地中に溶解しているL−グルタミン酸を晶析した後に、併せて単離してもよい。
【0093】
[実施例]
以下、実施例を挙げて本発明を具体的に説明する。ただし、本発明は以下の実施例に限定されない。
【0094】
1. C.glutamicum ATCC13869 bca増幅株の構築
bca遺伝子増幅の親株として、sucA欠損株を用いた。sucA欠損株は以下の方法で構築できる。
(1−1) sucA欠損株の構築
ATCC13869のsucA欠損株(ATCC13869ΔsucA)は以下のようにして構築した。
α−ケトグルタル酸デヒドロゲナーゼのE1oサブユニットをコードするsucA遺伝子の破壊は、レバンシュークラーゼをコードするsacB遺伝子を搭載したプラスミドpBS3を用いて行った。sacB搭載遺伝子破壊用ベクターの構築は、国際公開2005/113745 号パンフレット及び2005/113744号パンフレットに記載のpBS3を用いた。
【0095】
C.glutamicum ATCC13869株由来のsucAのORFを欠失した遺伝子断片は、既に公開されているC.glutamicum ATCC13032 (GenBank Database Accession No.NC_003450)の該遺伝子の塩基配列(配列番号9)を参考に設計した合成DNAをプライマーとして用いたオーバーラップPCR 法で取得した。具体的にはC.glutamicum ATCC13869株の染色体DNAを鋳型として、配列番号1、2の合成DNAをプライマーとして常法によりPCRを行い、sucA遺伝子N末端側の増幅産物を得た。一方、sucA遺伝子C末端側の増幅産物を得るために、C.glutamicum ATCC13869株ゲノムDNAを鋳型とし、配列番号3、4の合成DNAをプライマーとして常法によりPCRを行った。配列番号2と3は互いに相補的であり、sucAのORFの全配列を欠損させた構造となっている。
次に内部配列を欠失したsucA遺伝子断片を得るために、上記sucA N末側およびC末側の遺伝子産物をそれぞれほぼ等モルとなるように混合し、これを鋳型として配列番号5と6の合成DNAをプライマーとして常法によりPCRを行い変異導入されたsucA遺伝子増幅産物を得た。生成したPCR産物を常法により精製後BamHIで消化し、上述のpBS3 のBamHI部位に挿入する。このDNAを用いて、エシェリヒア・コリJM109のコンピテントセル(宝バイオ社製)に形質転換を行い、IPTG 100μM、X-Gal 40μg/mlおよびKm 25μg/mlを含むLBプレート培地に塗布し、一晩培養し、出現した白色のコロニーを釣り上げ、単コロニー分離し、形質転換体を得る。得られた形質転換体よりプラスミドを抽出し、目的のPCR産物が挿入されていたプラスミドをpBS3ΔsucAと命名した。
【0096】
(1−2)sucA欠損株の作成
上記(1−1)で得られたpBS3ΔsucAはコリネ型細菌の細胞内で自律複製可能とする領域を含まないため、本プラスミドでコリネ型細菌を形質転換した場合、低頻度であるが本プラスミドが相同組換えにより染色体に組み込まれた株が形質転換体として出現した。C.glutamicumATCC13869株を電気パルス法により高濃度のプラスミドpBS3ΔsucAを用いて形質転換し、カナマイシン25μg/mlを含むCM-Dexプレート培地(グルコース 5g/L、ポリペプトン 10g/L、イーストエキストラクト 10g/L、KH2PO4 1g/L、MgSO4・7H2O 0.4g/L、FeSO4・7H2O 0.01g/L、MnSO4・7H2O 0.01g/L、尿素 3g/L、大豆加水分解物 1.2g/L、biotin 10 ug/L、寒天15g/L、 NaOHでpH7.5に調整)に塗布し、31.5℃で約30時間培養した。この培地上に生育した株は該プラスミドのsucA遺伝子断片とATCC13869株ゲノム上の同遺伝子との間で相同組み換えを起こした結果、同ゲノムに該プラスミドに由来するカナマイシン耐性遺伝子およびsacB遺伝子が挿入されている株である。
次にこれらの一回目の組換え体をカナマイシンを含まないCM-Dex液体培地(CM-Dexプレート培地の成分から寒天を除いて作成)にて31.5℃で一晩培養し、適当に希釈した後、カナマイシンを含まない10%ショ糖含有Dex-S10プレート培地(ショ糖 100g/L、ポリペプトン 10g/L、イーストエキストラクト 10g/L、KH2PO4 1g/L、MgSO4・7H2O 0.4g/L、FeSO4・7H2O 0.01g/L、MnSO4・4H2O 0.01g/L、尿素 3g/L、大豆加水分解物 1.2g/L、ビオチン 10μg/L、寒天15g/L、 KOHでpH7.5に調整)に塗布にし、31.5℃にて約30時間培養する。その結果、2回目の相同組み換えによりsacB遺伝子が脱落しシュークロース非感受性となったと推定される株を得ることができる。
【0097】
この様にして得られた株の中には、そのsucA遺伝子がpBS3ΔsucAに由来する変異型に置き換わったものと野生型に戻ったものが含まれる。sucA遺伝子が変異型であるか野生型であるかの確認は、Dex-S10プレート培地にて培養して得られた菌体を直接PCR反応に供し、sucA遺伝子の検出を行うことによって容易に確認できる。sucA遺伝子をPCR増幅するためのプライマー(配列番号5および配列番号6)を用いて分析した際、ATCC13869株の染色体DNAを鋳型にしたものよりもPCR産物の大きさが小さいものをsucA欠損株として以降の実験に使用した。
【0098】
sucA欠損株のL−グルタミン酸の生産能の評価を以下の方法で行った。これらの菌株をCM-Dexプレート培地にて培養して、生育した各菌株を、グルコース 30g、KH2PO4 1g、MgSO4 0.4g、(NH4)2SO4 15g、FeSO4・7H2O 0.01g、MnSO4・7H2O 0.01g、大豆加水分解液 13.7ml、サイアミン塩酸塩 200μg、ビオチン 300μg、及びCaCO3 50gを純水 1L中に含む培地(KOHを用いてpHは8.0に調整されている)20mlを坂口フラスコに分注して、31.5℃にてしんとう培養する。培地中のグルコースを全て消費した時点で培養を終了した。L−グルタミン酸濃度は、培養液上清を適当倍率に水で希釈した後に、バイオテックアナライザー(AS-210 サクラエスアイ(株))により測定した。L-グルタミン酸発酵収率が大きい株を選択し、ATCC13869ΔsucAとした。
【0099】
(1−3) bca増幅用プラスミドの構築
カルボニックアンヒドラーゼ(bca)遺伝子の発現を増強した株を構築するため、pVK9シャトルベクターをBamHIにて処理し、ここに当該酵素をコードするDNA断片(配列番号7と配列番号8をプライマーとし、C.glutamicum ATCC 13869株の染色体DNAを鋳型としたPCRにより増幅し、BamHIで処理することで得た。)を連結し、エシェリヒア・コリJM109のコンピテントセル(宝バイオ社製)に形質転換を行い、IPTG 100μM、X-Gal 40μg/mlおよびCm 25μg/mlを含むLBプレート培地に塗布し、一晩培養した。その後、出現した白色のコロニーを釣り上げ、単コロニー分離し、形質転換体を得た。得られた形質転換体よりプラスミドを抽出し、lacZ遺伝子順向きにbca遺伝子が連結されたプラスミドをpVK9-bcaと命名した。
なお、pVK9はpHSG299(タカラバイオ)のAvaII部位を平滑末端化し、pHK4(特開平05-007491)に含まれるコリネ型細菌内で自律複製可能な領域をBamHIおよびKpnIで切り出し平滑末端化した断片を挿入したシャトルベクターである。
また、配列番号7および配列番号8の合成DNAは、既に公開されているコリネバクテリウム・グルタミカムATCC13032 (GenBank Database Accession No.NC_003450 配列番号13)のカルボニックアンヒドラーゼ遺伝子の塩基配列を参考に設計可能である。
【0100】
(1−4)ATCC13869Δ sucA株へのBCA増幅用プラスミドの導入
ATCC13869ΔsucAをpVK9(コントロール用プラスミド)、及びpVK9-bca(BCA増幅用プラスミド)により形質転換した株を取得した。形質転換は電気パルス法により行い、カナマイシン25μg/mlを含むCM-Dexプレート培地に塗布し、31.5℃で約30時間培養することで得た。それぞれ上記プラスミドを導入した株をATCC13869ΔsucA(pVK9)およびATCC13869ΔsucA(pVK9-bca)と命名した。
【0101】
2. BCA増強ATCC13869ΔsucA株におけるL-グルタミン酸蓄積向上効果の確認
bca増幅効果は1−2に示したフラスコ培養の評価系を用いて評価した。
【0102】
(2−1)BCA増強株のグルタミン酸蓄積
C.glutamicum ATCC13869ΔsucA(pVK9)株およびATCC13869ΔsucA(pVK9-bca)株を用い、BCA増強によるL−グルタミン酸蓄積向上の効果を上記1−2のsucA欠損株評価と同様の方法で培養評価した。培養12時間後の結果を以下の表に示す。L−グルタミン酸蓄積量は、対照株と比べてBCA増強株が高いことが明らかになった(n=4)。
【0103】
【表1】

【0104】
(2−2)BCA増強株のL-アミノ酸蓄積
C.glutamicum ATCC13869ΔsucA(pVK9)株およびATCC13869ΔsucA(pVK9-bca)株を用い、BCA増強によるL−アミノ酸蓄積向上の効果を上記1−2のsucA欠損株の評価と同様の方法で培養評価した。計2株の培養24時間後の培養上清、各1サンプルを0.02N塩酸にて51倍に希釈し、アミノ酸分析器(L−8500(日立製作所製))を用いて各種L−アミノ酸の定量を行った。その結果を図1に示す。BCA増強によってL−アスパラギン酸およびL-アラニンの蓄積量が、対照株と比べて向上することが明らかになった(n=2)。
【0105】
〔配列表の説明〕
配列番号1:C.glutamicum ATCC13869 sucA遺伝子破壊用プライマー塩基配列
配列番号2:C.glutamicum ATCC13869 sucA遺伝子破壊用プライマー塩基配列
配列番号3:C.glutamicum ATCC13869 sucA遺伝子破壊用プライマー塩基配列
配列番号4:C.glutamicum ATCC13869 sucA遺伝子破壊用プライマー塩基配列
配列番号5:C.glutamicum ATCC13869 sucA遺伝子増幅用プライマー塩基配列
配列番号6:C.glutamicum ATCC13869 sucA遺伝子増幅用プライマー塩基配列
配列番号7:C.glutamicum bca遺伝子増幅用プライマー塩基配列
配列番号8:C.glutamicum bca遺伝子増幅用プライマー塩基配列
配列番号9:C.glutamicum ATCC13869 sucA遺伝子塩基配列
配列番号10:C.glutamicum ATCC13869 α-KGDHアミノ酸配列
配列番号11:C.glutamicum ATCC13869 bca遺伝子塩基配列
配列番号12:C.glutamicum ATCC13869 Bcaアミノ酸配列
配列番号13:C. glutamicum ATCC13032 bca遺伝子塩基配列
配列番号14:C. glutamicum ATCC13032 Bcaアミノ酸配列
配列番号15:Lactobacillus pentosus MD363 xpkA遺伝子塩基配列
配列番号16:Lactobacillus pentosus MD363 XpkAアミノ酸配列
配列番号17:Lactobacillus plantarum xpk1遺伝子塩基配列
配列番号18:Lactobacillus plantarum Xpk1アミノ酸配列
配列番号19:Bifidobacterium lactisの xfp遺伝子塩基配列
配列番号20:Bifidobacterium lactisの Xfpアミノ酸配列
配列番号21:C.glutamicum ATCC13869 pta遺伝子塩基配列
配列番号22:C.glutamicum ATCC13869 Ptaアミノ酸配列
配列番号23:C. glutamicum ATCC13032 pta遺伝子塩基配列
配列番号24:C. glutamicum ATCC13032 Ptaアミノ酸配列
配列番号25:C. glutamicum pta遺伝子増幅用プライマー塩基配列
配列番号26:C. glutamicum pta遺伝子増幅用プライマー塩基配列
配列番号27:E. coli MG1655 yadF遺伝子塩基配列
配列番号28:E. coli MG1655 YadFアミノ酸配列
配列番号29:E. coli MG1655 cynT遺伝子塩基配列
配列番号30:E. coli MG1655 CynTアミノ酸配列
【特許請求の範囲】
【請求項1】
L-アミノ酸生産能を有し、カルボニックアンヒドラーゼ活性が増強されるように改変されたコリネ型細菌を培地で培養して、L-アミノ酸を該培地中又は菌体内に生成蓄積させ、該培地又は菌体よりL-アミノ酸を採取する、L-アミノ酸の製造法。
【請求項2】
前記細菌が、カルボニックアンヒドラーゼをコードする遺伝子のコピー数を高めること、又は該遺伝子の発現調節配列を改変することによりカルボニックアンヒドラーゼ活性が増強した細菌である、請求項1に記載の製造法。
【請求項3】
前記カルボニックアンヒドラーゼをコードする遺伝子が下記(a)又は(b)に示すDNAである請求項2に記載の製造法:
(a)配列番号11の塩基番号562〜1182、もしくは配列番号13の塩基配列を含むDNA、または
(b)配列番号11の塩基番号562〜1182、もしくは配列番号13の塩基配列の相補鎖とストリンジェントな条件下でハイブリダイズし、かつ、カルボニックアンヒドラーゼ活性を示すタンパク質をコードするDNA。
【請求項4】
前記細菌がさらにD−キシロース−5−リン酸−ホスホケトラーゼ及び/又はフルクトース−6−リン酸ホスホケトラーゼ活性が付与されるように改変された細菌である請求項1〜3のいずれか一項に記載の製造法。
【請求項5】
前記細菌がさらにホスホトランスアセチラーゼ活性が増強するように改変された細菌である請求項1〜4のいずれか一項に記載の製造法。
【請求項6】
前記細菌がさらにピルビン酸カルボキシラーゼ活性が増強されるように改変された細菌である請求項1〜5のいずれか一項に記載の製造法。
【請求項7】
前記細菌がさらにホスホエノールピルビン酸カルボキシラーゼ活性が増強されるように改変された細菌である請求項1〜6のいずれか一項に記載の製造法。
【請求項8】
前記L-アミノ酸が、L-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-ロイシン、L-システインから選択されるL-アミノ酸である、請求項1〜7のいずれか一項に記載の製造法。
【請求項1】
L-アミノ酸生産能を有し、カルボニックアンヒドラーゼ活性が増強されるように改変されたコリネ型細菌を培地で培養して、L-アミノ酸を該培地中又は菌体内に生成蓄積させ、該培地又は菌体よりL-アミノ酸を採取する、L-アミノ酸の製造法。
【請求項2】
前記細菌が、カルボニックアンヒドラーゼをコードする遺伝子のコピー数を高めること、又は該遺伝子の発現調節配列を改変することによりカルボニックアンヒドラーゼ活性が増強した細菌である、請求項1に記載の製造法。
【請求項3】
前記カルボニックアンヒドラーゼをコードする遺伝子が下記(a)又は(b)に示すDNAである請求項2に記載の製造法:
(a)配列番号11の塩基番号562〜1182、もしくは配列番号13の塩基配列を含むDNA、または
(b)配列番号11の塩基番号562〜1182、もしくは配列番号13の塩基配列の相補鎖とストリンジェントな条件下でハイブリダイズし、かつ、カルボニックアンヒドラーゼ活性を示すタンパク質をコードするDNA。
【請求項4】
前記細菌がさらにD−キシロース−5−リン酸−ホスホケトラーゼ及び/又はフルクトース−6−リン酸ホスホケトラーゼ活性が付与されるように改変された細菌である請求項1〜3のいずれか一項に記載の製造法。
【請求項5】
前記細菌がさらにホスホトランスアセチラーゼ活性が増強するように改変された細菌である請求項1〜4のいずれか一項に記載の製造法。
【請求項6】
前記細菌がさらにピルビン酸カルボキシラーゼ活性が増強されるように改変された細菌である請求項1〜5のいずれか一項に記載の製造法。
【請求項7】
前記細菌がさらにホスホエノールピルビン酸カルボキシラーゼ活性が増強されるように改変された細菌である請求項1〜6のいずれか一項に記載の製造法。
【請求項8】
前記L-アミノ酸が、L-グルタミン酸、L-グルタミン、L-プロリン、L-アルギニン、L-ロイシン、L-システインから選択されるL-アミノ酸である、請求項1〜7のいずれか一項に記載の製造法。
【図1】




【公開番号】特開2012−223091(P2012−223091A)
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願番号】特願2009−194636(P2009−194636)
【出願日】平成21年8月25日(2009.8.25)
【出願人】(000000066)味の素株式会社 (887)
【Fターム(参考)】
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願日】平成21年8月25日(2009.8.25)
【出願人】(000000066)味の素株式会社 (887)
【Fターム(参考)】
[ Back to top ]

