変異型rpsA遺伝子及びL−アミノ酸の製造法
【課題】脂肪酸、又はグリセロール等のアルコールを原料として、エシェリヒア・コリを用いて効率よくL−アミノ酸を製造する方法を提供する。
【解決手段】特定の位置のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有するエシェリヒア・コリのRpsAタンパク質を保持し、かつL−アミノ酸生産能を有するエシェリヒア・コリを、脂肪酸及びアルコールから選ばれる炭素源を含む培地で培養し、該培地からL−アミノ酸を採取することにより、L−アミノ酸を製造する方法。
【解決手段】特定の位置のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有するエシェリヒア・コリのRpsAタンパク質を保持し、かつL−アミノ酸生産能を有するエシェリヒア・コリを、脂肪酸及びアルコールから選ばれる炭素源を含む培地で培養し、該培地からL−アミノ酸を採取することにより、L−アミノ酸を製造する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細菌を用いたL−アミノ酸の製造法に関し、特に脂肪酸、又はグリセロール等のアルコールを原料とするL−アミノ酸の製造法、及び該方法に用いる細菌、並びに該細菌の構築に用いる遺伝子に関する。L−アミノ酸は、動物飼料用の添加物、健康食品の成分、又はアミノ酸輸液等として、産業上有用である。
【背景技術】
【0002】
発酵法によるL−アミノ酸の工業生産においては、炭素源として糖類、すなわち、グルコース、フラクトース、スクロース、廃糖蜜、澱粉加水分解物等が使用されている。また、炭素源として脂肪酸(特許文献1)やグリセロール(特許文献2)を用いたL−アミノ酸の製造法が開示されている。
【0003】
腸内細菌科に属するエシェリヒア属細菌については、適応的な進化を、特定の条件における植え継ぎ培養を行なうことによって誘発する方法が知られている(非特許文献1等)。また、適応的進化を誘発された微生物染色体中の、該進化に対応する変異は、非特許文献2に記載されたCGS法(非特許文献2)などの方法によって探索、同定することが可能である。
【0004】
RpsAタンパク質はリボゾームタンパク質S1とも呼ばれ、エシェリヒア・コリでは生育に不可欠なタンパク質である(非特許文献3)。RpsAタンパク質はリボゾームの30Sサブユニットを構成する最大のタンパク質であり、30Sサブユット中の16S rRNAとmRNAのSD配列との結合を制御していることが知られている(非特許文献4)。
【0005】
しかしながら、脂肪酸や、グリセロール等のアルコールの資化能や、これらの炭素源からのL−アミノ酸の生産能についての適応的進化に関する解析はなされておらず、細菌のRpsAタンパク質の変異とL−アミノ酸生産性との関連についても報告されていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】WO2009/142286
【特許文献2】米国特許出願公開第2009093029号
【非特許文献】
【0007】
【非特許文献1】Fong, S.S. et al., 2005, Genome Res., 15:1365-1372
【非特許文献2】Herring, C.D. et al., 2006, Nat. Genet., 38:1406-1412
【非特許文献3】Sorensen M.A. et al., 1998, J. Mol. Biol., 280(4):561-569
【非特許文献4】Komarova A.V. et al., 2002, RNA., 8(9):1137-1147
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、炭素源、特に脂肪酸、又はグリセロール等のアルコールを原料として、腸内細菌科に属する細菌を用いて効率よくL−アミノ酸を製造する方法、及び該方法に用いる細菌、並びに該細菌の構築に用いる遺伝子を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者は、上記課題を解決するために鋭意研究を行った結果、特定の変異を有するRpsAタンパク質を保持する細菌が、脂肪酸や、グリセロールのようなアルコールを含む培地で効率よくL−アミノ酸を生産することを見出し、本発明を完成するに至った。
すなわち、本発明は以下のとおりである。
【0010】
(1)L−アミノ酸生産能を有する腸内細菌科に属する細菌を、脂肪酸及びアルコールから選ばれる炭素源を含む培地で培養し、該培地からL−アミノ酸を採取する、L−アミノ酸の製造法であって、
前記細菌は、配列番号15又は16のアミノ酸配列を一部に有し、かつ、配列番号15の5位または配列番号16の5位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有する変異型RpsAタンパク質を保持することを特徴とする方法。
(2)前記細菌がエシェリヒア属、エンテロバクター属、又はパントエア属に属する細菌である、前記方法。
(3)前記細菌がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネスである、前記方法。
(4)前記RpsAタンパク質が腸内細菌科に属する細菌由来である、前記方法。
(5)前記RpsAタンパク質がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネス由来である、前記方法。
(6)前記他のアミノ酸残基がチロシン残基である、前記方法。
(7)前記RpsAタンパク質が、前記変異を有する以外は、配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントである、前記方法。
(8)前記変異型RpsAタンパク質を保持する細菌が、前記変異を有さないRpsAタンパク質を発現しないことを特徴とする、前記方法。
(9)前記変異型RpsAタンパク質を保持する細菌が、該RpsAタンパク質をコードする変異型rpsA遺伝子で、染色体上のrpsA遺伝子が置換されたことを特徴とする、前記方法。
(10)前記炭素源が脂肪酸である、前記方法。
(11)前記脂肪酸がオレイン酸である、前記方法。
(12)前記脂肪酸が油脂由来の脂肪酸の混合物である、前記方法。
(13)前記炭素源がアルコールである、前記方法。
(14)前記アルコールがグリセロールである、前記方法。
(15)前記アルコールがエタノールである、前記方法。
(16)前記炭素源が油脂を加水分解することによって得られる脂肪酸とグリセロールの混合物である、前記方法。
(17)配列番号15又は16のアミノ酸配列を一部に有し、かつ、配列番号15の5位または配列番号16の5位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有する変異型RpsAタンパク質を保持する、腸内細菌科に属する細菌。
(18)L−アミノ酸生産能を有する前記細菌。
(19)前記細菌がエシェリヒア属、エンテロバクター属、又はパントエア属に属する、前記細菌。
(20)前記細菌がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネスである、前記細菌。
(21)前記他のアミノ酸残基がチロシン残基である、前記細菌。
(22)前記RpsAタンパク質が、前記変異を有する以外は、配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントである、前記細菌。
(23)配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントであって、かつ、210位のアスパラギン酸残基が他のアミノ酸残基で置換されたアミノ酸配列を有するタンパク質をコードするDNA。
(24)前記他のアミノ酸残基がチロシン残基である、前記DNA。
(25)前記タンパク質は、210位のアスパラギン酸残基が他のアミノ酸残基で置換された以外は配列番号2、配列番号12、又は配列番号14のアミノ酸配列を有する、前記DNA。
(26)前記タンパク質は、腸内細菌科に属する細菌に保持させたときに、脂肪酸及びアルコールから選ばれる炭素源を含む培地での生育を改善する機能を有する、前記DNA。
【発明の効果】
【0011】
本発明により、脂肪酸、又はグリセロール等のアルコールを原料として、腸内細菌科に属する細菌を用いて効率よく、L−リジン等のL−アミノ酸を製造することができる。
【図面の簡単な説明】
【0012】
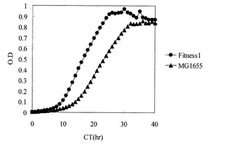
【図1】炭素源としてオレイン酸のみを使用した試験管培養におけるMG1655株及びFitness1株の生育を示す図。「CT」は培養時間、ODは培地の濁度を示す(以下の図でも同様)。
【図2】炭素源としてオレイン酸のみを使用したフラスコ培養におけるMG1655株及びFitness1株の生育を示す図。
【図3】MG1655株、及びFitness1株をオレイン酸のみを炭素源としてフラスコ培養したときの、オレイン酸の消費を示す図。
【図4】炭素源としてオレイン酸のみを使用した試験管培養におけるMG1655、Fitness1、MG1655ΔycaI::att-Cm、及びMG1655ΔycaI::att-Cm,rpsA(D210Y)の各株の生育を示す図。
【図5】炭素源としてグリセロールのみを使用した試験管培養におけるMG1655、Fitness1、MG1655ΔycaI::att-Cm、及びMG1655ΔycaI::att-Cm,rpsA(D210Y)の各株の生育を示す図。
【図6】エシェリヒア・コリMG1655株(配列番号2)、パントエア・アナナティスAJ13355株(配列番号12)、及びエンテロバクター・アエロゲネスAJ110637株株(配列番号14)のRpsAタンパク質のアミノ酸配列のアラインメントを示す図。最下段の「*」は完全に一致したアミノ酸を「:」は強い類似性のあるグループに属しているアミノ酸を、「.」は弱い類似性のあるグループに属しているアミノ酸を、空白は類似性のないアミノ酸をそれぞれ表す。アミノ酸の類似性についての強さの基準は,アミノ酸置換行列PAM250 MATRIX(David W.Mount Bioinfomatics:Sequence and Genome Analysis)を用いて、アミノ酸間のスコアが0.5より大きいか、0.5以下かで分けている。
【発明を実施するための形態】
【0013】
以下、本発明を詳細に説明する。
本発明の方法は、L−アミノ酸生産能を有する腸内細菌科に属する細菌を、脂肪酸及びアルコールから選ばれる炭素源を含む培地で培養し、該培地からL−アミノ酸を採取する、L−アミノ酸の製造法である。本発明においては、特定の変異を有するrpsA遺伝子(以下、「本発明のDNA」と記載することがある。)を保持する細菌を用いる。
以下、本発明のDNA、該DNAを保持する細菌、及び同細菌を用いたL−アミノ酸の製造法について説明する。
【0014】
<1>本発明のDNA
本発明のDNAは、配列番号15又は16のアミノ酸配列を一部に有し、かつ、配列番号15の5位または配列番号16の6位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を保有する変異型RpsAタンパク質をコードするDNAである。配列番号15又は16のアミノ酸配列は、RNAに結合する機能ドメインの一部であり、E.coliのS1タンパク質で6回繰り返されるS1RNA binding domainと定義された領域のうち、N末端から3番目に出てくるモチーフの一部である。S1 RNA binding domainはCell Volume 88, Issue 2, 24 January 1997, Pages 235-242に記載されている。
【0015】
RpsAタンパク質は、細菌における30Sリボゾームサブユニットを構成する最大のタンパク質であり、配列番号15または16の保存配列を有している。本発明における変異型RpsAタンパク質とは、保存配列として有する配列番号15、配列番号16に記載の配列中、5位のアスパラギン酸が他のアミノ酸に置換されたタンパク質を意味し、本変異を有さない野生型タンパク質とは区別される。
【0016】
前記変異を有さないRpsAタンパク質(以下「野生型RpsAタンパク質」と記載することがある。)としては、配列番号15または16の保存配列を有していればいずれでもよいが、これらの配列を有し、かつRpsAタンパク質としての機能が損なわれない限り、そのホモログや人為的改変体等、保存的変異を有するタンパク質であってもよい。RpsAタンパク質の機能としては、腸内細菌科に属する細菌に保持させたとき、又はその量を上昇させたときに、脂肪酸及びアルコールから選ばれる炭素源を含む培地での生育を改善する機能が挙げられる。野生型RpsAタンパク質としては、腸内細菌科に属する細菌、コリネ型細菌等のRpsAタンパク質が挙げられる。腸内細菌科に属する細菌については後述する。
【0017】
野生型RpsAタンパク質としては、具体的には、エシェリヒア・コリ、パントエア・アナナティス、エンテロバクター・アエロゲネスのRpsAタンパク質をコードする遺伝子が利用できる。
【0018】
エシェリヒア・コリのRpsAタンパク質は、GenBank Acession No. NP_415431に登録されており、そのアミノ酸配列を配列番号2に示す。また、該タンパク質をコードするrpsA遺伝子の塩基配列を配列番号1に示す。
【0019】
パントエア・アナナティスAJ13355株、及びエンテロバクター・アエロゲネスAJ110637株のRpsAタンパク質のアミノ酸配列を、それぞれ配列番号12及び14に示す。また、これらのタンパク質をコードする各々のrpsA遺伝子の塩基配列を、配列番号11及び13に示す。
【0020】
上記エシェリヒア・コリ、パントエア・アナナティス、及びエンテロバクター・アエロゲネスの各々の野生型RpsAタンパク質は、配列番号17の保存配列を有している。各RpsAタンパク質のアミノ酸配列のアラインメント(CLUSTAL W (1.83) multiple sequence alignmentで作成)を図6に示す。この配列を有するrpsAタンパク質は、野生型RpsAタンパク質の好ましい一形態である。
【0021】
また、野生型RpsAタンパク質は、RpsAタンパク質としての機能が損なわれない限り、上記アミノ酸配列を有するものの他、それらのホモログや人為的改変体等、又は保存的変異を有するタンパク質であってもよい。このようなホモログ、人為的改変体、又は保存的変異を有するタンパク質を、保存的バリアントと記載する。
【0022】
RpsAタンパク質の保存的バリアントとしては、例えば配列番号2、12、14、又は17のアミノ酸配列において、1若しくは数個の位置での1若しくは数個のアミノ酸の置換、欠失、挿入又は付加等を含む配列を有するタンパク質であってもよい。
【0023】
「1若しくは数個」とは、アミノ酸残基のタンパク質の立体構造における位置やアミノ酸残基の種類によっても異なるが、具体的には好ましくは1〜20個、より好ましくは1〜10個、さらに好ましくは1〜5個を意味する。また、保存的変異の代表的なものは、保存的置換である。保存的置換とは、置換部位が芳香族アミノ酸である場合には、Phe、Trp、Tyr間で、置換部位が疎水性アミノ酸である場合には、Leu、Ile、Val間で、極性アミノ酸である場合には、Gln、Asn間で、塩基性アミノ酸である場合には、Lys、Arg、His間で、酸性アミノ酸である場合には、Asp、Glu間で、ヒドロキシル基を持つアミノ酸である場合には、Ser、Thr間でお互いに置換する変異である。保存的置換とみなされる置換としては、具体的には、AlaからSer又はThrへの置換、ArgからGln、His又はLysへの置換、AsnからGlu、Gln、Lys、His又はAspへの置換、AspからAsn、Glu又はGlnへの置換、CysからSer又はAlaへの置換、GlnからAsn、Glu、Lys、His、Asp又はArgへの置換、GluからGly、Asn、Gln、Lys又はAspへの置換、GlyからProへの置換、HisからAsn、Lys、Gln、Arg又はTyrへの置換、IleからLeu、Met、Val又はPheへの置換、LeuからIle、Met、Val又はPheへの置換、LysからAsn、Glu、Gln、His又はArgへの置換、MetからIle、Leu、Val又はPheへの置換、PheからTrp、Tyr、Met、Ile又はLeuへの置換、SerからThr又はAlaへの置換、ThrからSer又はAlaへの置換、TrpからPhe又はTyrへの置換、TyrからHis、Phe又はTrpへの置換、及び、ValからMet、Ile又はLeuへの置換が挙げられる。また、上記のようなアミノ酸の置換、欠失、挿入、付加、または逆位等には、遺伝子が由来する微生物の個体差、種の違いに基づく場合などの天然に生じる変異(mutant又はvariant)によって生じるものも含まれる。このようなタンパク質は、例えば、部位特異的変異法によって、コードされるタンパク質の特定の部位のアミノ酸残基が置換、欠失、挿入または付加を含むように野生型rpsA遺伝子の塩基配列を改変することによって取得することができる。
【0024】
さらに、上記のような保存的変異を有するRpsAタンパク質は、アミノ酸配列全体に対して、例えば80%以上、好ましくは90%以上、より好ましくは95%以上、より好ましくは97%以上、より好ましくは98%以上、特に好ましくは99%以上の相同性を有し、かつ、野生型RpsAタンパク質と同等の機能を有するタンパク質であってもよい。
【0025】
野生型rpsA遺伝子は、上記のようなアミノ酸配列をコードするものであれば、エシェリヒア・コリ、パントエア・アナナティス、及びエンテロバクター・アエロゲネス等のrpsA遺伝子に限らず、任意のコドンをそれと等価のコドンに置換したものであってもよい。
【0026】
また、野生型rpsA遺伝子は、配列番号1、11、又は13の相補配列又はその相補配列から調製され得るプローブとストリンジェントな条件下でハイブリダイズし、配列番号2、12又は14のアミノ酸配列を有するRpsAタンパク質と同等の機能を有するタンパク質をコードするDNAであってもよい。ここで、「ストリンジェントな条件」とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。一例を示せば、相同性が高いDNA同士、例えば80%以上、好ましくは90%以上、より好ましくは95%以上、より好ましくは97%以上、より好ましくは98%以上、特に好ましくは99%以上の相同性を有するDNA同士がハイブリダイズし、それより相同性が低いDNA同士がハイブリダイズしない条件、あるいは通常のサザンハイブリダイゼーションの洗いの条件である60℃、1×SSC、0.1% SDS、好ましくは、0.1×SSC、0.1% SDS、さらに好ましくは、68℃、0.1×SSC、0.1% SDSに相当する塩濃度、温度で、1回、より好ましくは2〜3回洗浄する条件が挙げられる。
【0027】
プローブとしては、rpsA遺伝子の相補配列の一部を用いることもできる。そのようなプローブは、公知の遺伝子配列に基づいて作製したオリゴヌクレオチドをプライマーとし、これらの塩基配列を含むDNA断片を鋳型とするPCRによって作製することができる。例えば、プローブとして、300 bp程度の長さのDNA断片を用いる場合には、ハイブリダイゼーションの洗いの条件は、50℃、2×SSC、0.1% SDSが挙げられる。
【0028】
上記したRpsAタンパク質の保存的バリアント及びそれをコードするRpsA遺伝子に関する記載は、後述のL−アミノ酸生産菌について記載した他の遺伝子についても同様に適用される。
【0029】
上記変異型RpsAタンパク質をコードするDNA(「変異型rpsA遺伝子」とも記載する。)は、実施例に記載したように、エシェリヒア・コリをオレイン酸ナトリウム等の脂肪酸を炭素源とする培地で継体培養を繰返し、脂肪酸の資化能が向上した株からrpsA遺伝子を単離することによって取得することができるが、本発明により変異点が明らかになったので、化学合成、又は野生型rpsA遺伝子に210位のアスパラギン酸残基が他のアミノ酸残基で置換されるような変異を導入することによって、取得することができる。変異の導入は、変異を含むDNA断片で野生型rpsA遺伝子の相当する部分を置換えるか(カセット変異導入法)、部位特異的変異法、クロスオーバーPCR法等によって行うことができる。
【0030】
例えば、腸内細菌科に属する細菌、例えばMG1655株等の野生型エシェリヒア・コリのゲノムDNAを鋳型とし、配列番号5および6に示す合成オリゴヌクレオチドをプライマーとするPCRによって、210位のアスパラギン酸残基がチロシン残基で置換される変異(以下、「D210Y変異」とも記載する。)を持つrpsA遺伝子断片を取得することができる。前記プライマーのチロシン残基に相当する位置を他のアミノ酸残基のコドンに変更することによって、210位のアスパラギン酸残基を他のアミノ酸残基に置換することができる。
【0031】
尚、「210位のアスパラギン酸残基」とは、配列番号2における210位に相当するアスパラギン酸残基を意味する。すなわち、「210位」とは相対的な位置を示すものであって、例えば、210位よりもN末端側の一アミノ酸残基が欠失している場合は、N末端から209番目(開始コドンによってコードされるメチニオン残基を含む)のアミノ酸残基は「210位」である。また、210位よりもN末端側に一アミノ酸残基挿入されている場合は、N末端から211番目のアミノ酸残基が「210位」である。
【0032】
<2>本発明の細菌
本発明に用いる細菌は、L−アミノ酸生産能を有する腸内細菌科に属する細菌であって、かつ、変異型rpsA遺伝子を保持する細菌である。
L−アミノ酸生産能とは、本発明に用いる細菌(以下、「本発明の細菌」ともいう)を培地中で培養したときに、L−アミノ酸を生成し、培地中または菌体内に蓄積する能力をいう。L−アミノ酸の生産能を有する細菌としては、本来的にL−アミノ酸の生産能を有するものであってもよいが、後述の細菌を、変異法や組換えDNA技術を利用して、L−アミノ酸の生産能を有するように改変したものであってもよい。
【0033】
L−アミノ酸の種類は特に制限されないが、L−リジン、L−オルニチン、L−アルギニン、L−ヒスチジン、L−シトルリン等の塩基性アミノ酸、L−イソロイシン、L−アラニン、L−バリン、L−ロイシン、L−グリシン等の脂肪族アミノ酸、L−スレオニン、L−セリン等のヒドロキシモノアミノカルボン酸であるアミノ酸、L−プロリン等の環式アミノ酸、L−フェニルアラニン、L−チロシン、L−トリプトファン等の芳香族アミノ酸、L−システイン、L−シスチン、L−メチオニン等の含硫アミノ酸、L−グルタミン酸、L−アスパラギン酸等の酸性アミノ酸、L−グルタミン、L−アスパラギン等の側鎖にアミド基を持つアミノ酸が挙げられる。本発明の微生物は2種類以上のアミノ酸の生産能を有するものであってもよい。
【0034】
本発明においてL−アミノ酸とは、フリー体のL−アミノ酸とL−アミノ酸塩、たとえば硫酸塩、塩酸塩、炭酸塩を含む。
【0035】
本発明の細菌を得るために用いる腸内細菌科に属する細菌としては、特に限定されないが、エシェリヒア、エンテロバクター、エルビニア、クレブシエラ、パントエア、フォトルハブドゥス、プロビデンシア、サルモネラ、セラチア、シゲラ、モルガネラ、イェルシニア等の属に属する細菌を含む。特に、NCBI (National Center for Biotechnology Information)のデータベース(http://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?id=91347)で用いられている分類法により腸内細菌科に分類されている細菌が好ましい。
【0036】
エシェリヒア属に属する細菌とは、特に制限されないが、当該細菌が微生物学の専門家に知られている分類により、エシェリヒア属に分類されていることを意味する。例えば、ナイトハルトらの著書(Neidhardt, F. C. Ed. 1996. Escherichia coli and Salmonella: Cellular and Molecular Biology/Second Edition pp. 2477-2483. Table 1. American
Society for Microbiology Press, Washington, D.C.)に記述されている系統のものが含まれる。具体的には、プロトタイプの野生株K12株由来のエシェリヒア・コリ W3110
(ATCC 27325)、エシェリヒア・コリ MG1655 (ATCC 47076)等が挙げられる。
【0037】
これらの菌株は、例えばアメリカン・タイプ・カルチャー・コレクション(住所 P.O. Box 1549 Manassas, VA 20108, United States of America)より分譲を受けることが出来る。すなわち各菌株に対応する登録番号が付与されており、この登録番号を利用して分譲を受けることが出来る。各菌株に対応する登録番号は、アメリカン・タイプ・カルチャー・コレクションのカタログに記載されている。以下に記載する他のATCC菌株も同様である。
【0038】
パントエア属に属する細菌とは、当該細菌が微生物学の専門家に知られている分類により、パントエア属に分類されていることを意味する。エンテロバクター・アグロメランスのある種のものは、最近、16S rRNAの塩基配列分析等に基づき、パントエア・アグロメランス、パントエア・アナナティス、パントエア・ステワルティイその他に再分類された(Int. J. Syst. Bacteriol., 43, 162-173 (1993))。本発明において、パントエア属に属する細菌には、このようにパントエア属に再分類された細菌も含まれる。
【0039】
パントエア・アナナティスとしては、パントエア・アナナティスAJ13355株(FERM BP-6614)、AJ13356株(FERM BP-6615)、AJ13601株(FERM BP-7207)及びそれらの誘導体を用いることができる。これらの株は、分離された当時はエンテロバクター・アグロメランスと同定され、エンテロバクター・アグロメランスとして寄託されたが、上記のとおり、16S rRNAの塩基配列解析などにより、パントエア・アナナティスに再分類されている。
【0040】
エンテロバクター属細菌とは、特に制限されないが、当該細菌が微生物学の専門家に知られている分類により、エンテロバクター属に分類されていることを意味する。例えば、エンテロバクター・アグロメランス(Enterobacter agglomerans)、エンテロバクター・アエロゲネス(Enterobacter aerogenes)等が挙げられる。具体的には欧州特許出願公開EP952221号に例示された菌株を使用することが出来る。エンテロバクター属の代表的な株としては、エンテロバクター・アグロメランスATCC12287株やエンテロバクター・アエロゲネスATCC13048株、エンテロバクター・アエロゲネスNBRC12010株(Biotechonol Bioeng.2007 Mar 27; 98(2) 340-348)、エンテロバクター・アエロゲネスAJ110637(FERM BP-10955)株が挙げられる。
【0041】
<2−1>L−アミノ酸生産菌、及びL−アミノ酸生産能の付与又は増強
以下、腸内細菌科に属するL−アミノ酸生菌、並びに細菌にL−アミノ酸生産能を付与する方法、又は細菌のL−アミノ酸生産能を増強する方法について述べる。
【0042】
L−アミノ酸生産能を付与するには、栄養要求性変異株、L−アミノ酸のアナログ耐性株又は代謝制御変異株の取得や、L−アミノ酸の生合成系酵素の発現が増強された組換え株の創製等、従来、コリネ型細菌又はエシェリヒア属細菌等のアミノ酸生産菌の育種に採用されてきた方法を適用することができる(アミノ酸発酵、(株)学会出版センター、1986年5月30日初版発行、第77〜100頁参照)。ここで、L−アミノ酸生産菌の育種において、付与される栄養要求性、アナログ耐性、代謝制御変異等の性質は、単独でもよく、2種又は3種以上であってもよい。また、発現が増強されるL−アミノ酸生合成系酵素も、単独であっても、2種又は3種以上であってもよい。さらに、栄養要求性、アナログ耐性、代謝制御変異等の性質の付与と、生合成系酵素の増強が組み合わされてもよい。
【0043】
L−アミノ酸生産能を有する栄養要求性変異株、アナログ耐性株、又は代謝制御変異株を取得するには、親株又は野生株を通常の変異処理、すなわちX線や紫外線の照射、またはN−メチル−N’−ニトロ−N−ニトロソグアニジン等の変異剤処理などによって処理し、得られた変異株の中から、栄養要求性、アナログ耐性、又は代謝制御変異を示し、かつL−アミノ酸生産能を有するものを選択することによって得ることができる。
【0044】
また、L−アミノ酸生産能の付与又は増強は、遺伝子組換えによって、酵素活性を増強することによっても行うことが出来る。酵素活性の増強は、例えば、L−アミノ酸の生合成に関与する酵素をコードする遺伝子の発現が増強するように細菌を改変する方法を挙げることができる。遺伝子の発現を増強するための方法としては、遺伝子を含むDNA断片を、適当なプラスミド、例えば微生物内でプラスミドの複製増殖機能を司る遺伝子を少なくとも含むプラスミドベクターに導入した増幅プラスミドを導入すること、または、これらの遺伝子を染色体上で接合、転移等により多コピー化すること、またこれらの遺伝子のプロモーター領域に変異を導入することにより達成することもできる(国際公開パンフレットWO95/34672号参照)。
【0045】
上記増幅プラスミドまたは染色体上に目的遺伝子を導入する場合、これらの遺伝子を発現させるためのプロモーターは腸内細菌科において機能するものであればいかなるプロモーターであっても良く、用いる遺伝子自身のプロモーターであってもよいし、改変したものでもよい。コリネ型細菌で強力に機能するプロモーターを適宜選択することや、プロモーターの−35、−10領域をコンセンサス配列に近づけることによっても遺伝子の発現量の調節が可能である。以上のような、酵素遺伝子の発現を増強する方法は、WO00/18935号パンフレット、欧州特許出願公開1010755号明細書等に記載されている。
【0046】
以下、細菌にL−アミノ酸生産能を付与する方法、及びL−アミノ酸生産能が付与された細菌について例示する。
【0047】
L−リジン生産菌
エシェリヒア・コリのL−リジン生産菌の例としては、L−リジンアナログに耐性を有する変異株が挙げられる。L−リジンアナログはエシェリヒア・コリの生育を阻害するが、この阻害は、L−リジンが培地に共存するときには完全にまたは部分的に解除される。L−リジンアナログの例としては、オキサリジン、リジンヒドロキサメート、S−(2−アミノエチル)−L−システイン(AEC)、γ−メチルリジン、α−クロロカプロラクタムなどが挙げられるが、これらに限定されない。これらのリジンアナログに対して耐性を有する変異株は、エシェリヒア・コリを通常の人工変異処理に付すことによって得ることができる。L−リジンの生産に有用な細菌株の具体例としては、E. coli AJ11442 (FERM BP-1543, NRRL B-12185; 米国特許第4,346,170号参照)及びE. coli VL611が挙げられる。これらの微生物では、アスパルトキナーゼのL−リジンによるフィードバック阻害が解除されている。
【0048】
WC196株は、E. coliのL−リジン生産菌として使用できる。この菌株は、E. coli K-12に由来するW3110株から取得された株で、352位のスレオニンをイソロイシンに置換することによりL−リジンによるフィードバック阻害が解除されたアスパルトキナーゼIIIをコードする変異型lysC遺伝子(米国特許第5,661,012号)でW3110株の染色体上の野生型lysC遺伝子を置き換えた後、AEC耐性を付与することにより育種された(米国特許第5,827,698号)。同株は、Escherichia coli AJ13069と命名され、1994年12月6日、工業技術院生命工学工業技術研究所(現 独立行政法人 産業技術総合研究所 特許生物寄託センター、〒305-8566 日本国茨城県つくば市東1丁目1番地1 中央第6)に受託番号FERM P-14690として寄託され、1995年9月29日にブダペスト条約に基づく国際寄託に移管され、受託番号FERM BP-5252が付与されている(米国特許第5,827,698号)。
【0049】
L−リジン生産菌又はそれを誘導するための親株の例としては、L−リジン生合成系酵素をコードする遺伝子の1種以上の発現が増大している株も挙げられる。かかる遺伝子の例としては、ジヒドロジピコリン酸シンターゼ遺伝子(dapA)、アスパルトキナーゼ遺伝子(lysC)、ジヒドロジピコリン酸レダクターゼ遺伝子(dapB)、ジアミノピメリン酸デカルボキシラーゼ遺伝子(lysA)、ジアミノピメリン酸デヒドロゲナーゼ遺伝子(ddh) (米国特許第6,040,160号)、フォスフォエノールピルビン酸カルボキシラーゼ遺伝子(ppc)、アスパルテートセミアルデヒドデヒドロゲナーゼ遺伝子(asd)及びアスパルターゼ遺伝子(aspA) (EP 1253195 A)が挙げられるが、これらに限定されない。また、親株は、エネルギー効率に関与する遺伝子(cyo) (EP 1170376 A)、ニコチンアミドヌクレオチドトランスヒドロゲナーゼをコードする遺伝子(pntAB) (米国特許第5,830,716号)、L−リジン排出活性を有するタンパク質をコードするybjE遺伝子(WO2005/073390)、グルタミン酸デヒドロゲナーゼをコードする遺伝子(gdhA)(Gene23:199-209(1983))または、これらの任意の組み合わせの遺伝子の発現レベルが増大していてもよい。なお、カッコ内は、それらの遺伝子の略記号である。
【0050】
エシェリヒア・コリ由来の野生型ジヒドロジピコリン酸合成酵素はL−リジンによるフィードバック阻害を受けることが知られており、エシェリヒア・コリ由来の野生型アスパルトキナーゼはL−リジンによる抑制及びフィードバック阻害を受けることが知られている。したがって、dapA遺伝子及びlysC遺伝子を用いる場合、これらの遺伝子は、L−リジンによるフィードバック阻害を受けない変異型遺伝子であることが好ましい。
【0051】
L−リジンによるフィードバック阻害を受けない変異型ジヒドロジピコリン酸合成酵素をコードするDNAとしては、118位のヒスチジン残基がチロシン残基に置換された配列を有するタンパク質をコードするDNAが挙げられる。また、L−リジンによるフィードバック阻害を受けない変異型アスパルトキナーゼをコードするDNAとしては、352位のスレオニン残基がイソロイシン残基に置換、323位のグリシン残基がアスパラギン残基に置換、318位のメチオニンがイソロイシンに置換された配列を有するAKIIIをコードするDNAが挙げられる(これらの変異体については米国特許第5661012号及び第6040160号明細書参照)。変異型DNAはPCRなどによる部位特異的変異法により取得することができる。
【0052】
なお、変異型変異型ジヒドロジピコリン酸合成酵素をコードする変異型dapA及び変異型アスパルトキナーゼをコードする変異型lysCを含むプラスミドとして、広宿主域プラスミドRSFD80、pCAB1、pCABD2が知られている(米国特許第6040160号明細書)。RSFD80で形質転換されたエシェリヒア・コリ JM109株(米国特許第6040160号明細書)は、AJ12396と命名され、同株は1993年10月28日に通産省工業技術院生命工学工業技術研究所(現 独立行政法人 産業技術総合研究所 特許生物寄託センター)に受託番号FERM P-13936として寄託され、1994年11月1日にブダペスト条約に基づく国際寄託に移管され、FERM BP-4859の受託番号のもとで寄託されている。RSFD80は、AJ12396株から、公知の方法によって取得することができる。
【0053】
L−リジン生産菌又はそれを誘導するための親株の例としては、L−リジンの生合成経路から分岐してL−リジン以外の化合物を生成する反応を触媒する酵素の活性が低下または欠損している株も挙げられる。L−リジンの生合成経路から分岐してL−リジン以外の化合物を生成する反応を触媒する酵素の例としては、ホモセリンデヒドロゲナーゼ、リジンデカルボキシラーゼ(米国特許第5,827,698号)、及び、リンゴ酸酵素(WO2005/010175)が挙げられる。ここで、リジンデカルボキシラーゼ活性を低下または欠損させるためには、リジンデカルボキシラーゼをコードするcadA遺伝子とldcC遺伝子の両方の発現を低下させることが好ましい。(国際公開第WO2006/038695号パンフレット)
【0054】
cadA遺伝子とldcC遺伝子が破壊された菌株としては、エシェリヒア・コリWC196LC(WC196ΔcadAΔldcC)(US5,827,698、US20060160191)が挙げられる。WC196LC株は、AJ110692と命名され、2008年10月7日に独立行政法人 産業技術総合研究所 特許生物寄託センター(〒305-8566 日本国茨城県つくば市東1丁目1番地1 中央第6)に国際寄託され、受託番号FERM BP-11027が付与されている。
【0055】
L−スレオニン生産菌
L−スレオニン生産菌又はそれを誘導するための親株の例としては、E. coli TDH-6/pVIC40 (VKPM B-3996) (米国特許第5,175,107号、米国特許第5,705,371号)、E. coli 472T23/pYN7 (ATCC 98081) (米国特許第5,631,157号)、E. coli NRRL-21593 (米国特許第5,939,307号)、E. coli FERM BP-3756 (米国特許第5,474,918号)、E. coli FERM BP-3519及びFERM BP-3520 (米国特許第5,376,538号)、E. coli MG442 (Gusyatiner et al., Genetika (in Russian), 14, 947-956 (1978))、E. coli VL643及びVL2055 (EP 1149911 A)などが挙げられるが、これらに限定されない。
【0056】
TDH-6株はthrC遺伝子を欠損し、スクロース資化性であり、また、そのilvA遺伝子がリーキー(leaky)変異を有する。この株はまた、rhtA遺伝子に、高濃度のスレオニンまたはホモセリンに対する耐性を付与する変異を有する。B-3996株は、RSF1010由来ベクターに、変異thrA遺伝子を含むthrA*BCオペロンを挿入したプラスミドpVIC40を保持する。この変異thrA遺伝子は、スレオニンによるフィードバック阻害が実質的に解除されたアスパルトキナーゼホモセリンデヒドロゲナーゼIをコードする。B-3996株は、1987年11月19日、オールユニオン・サイエンティフィック・センター・オブ・アンチビオティクス(Nagatinskaya Street 3-A, 117105 Moscow, Russia)に、受託番号RIA 1867で寄託されている。この株は、また、1987年4月7日、ルシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオルガニズムズ(VKPM)に、受託番号B-3996で寄託されている。
【0057】
E. coli VKPM B-5318 (EP 0593792B)も、L−スレオニン生産菌又はそれを誘導するための親株として使用できる。B-5318株は、イソロイシン非要求性であり、プラスミドpVIC40中のスレオニンオペロンの制御領域が、温度感受性ラムダファージC1リプレッサー及びPRプロモーターにより置換されている。VKPM B-5318は、1990年5月3日、ルシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオルガニズムズ(VKPM) (1 Dorozhny proezd., 1 Moscow 117545, Russia)に、受託番号VKPM B-5318で寄託されている。
【0058】
好ましくは、本発明に用いる細菌は、さらに、下記の遺伝子の1種以上の発現が増大するように改変されたものである。
−スレオニンによるフィードバック阻害に耐性のアスパルトキナーゼホモセリンデヒドロゲナーゼIをコードする変異thrA遺伝子
−ホモセリンキナーゼをコードするthrB遺伝子
−スレオニンシンターゼをコードするthrC遺伝子
−推定トランスメンブランタンパク質をコードするrhtA遺伝子
−アスパルテート−β−セミアルデヒドデヒドロゲナーゼをコードするasd遺伝子
−アスパルテートアミノトランスフェラーゼ(アスパルテートトランスアミナーゼ)をコードするaspC遺伝子
【0059】
E. coliのアスパルトキナーゼホモセリンデヒドロゲナーゼIをコードするthrA遺伝子は明らかにされている(ヌクレオチド番号337〜2799, GenBank accession NC_000913.2, gi: 49175990)。thrA遺伝子は、E. coli K-12の染色体において、thrL遺伝子とthrB遺伝子との間に位置する。E. coliのホモセリンキナーゼをコードするthrB遺伝子は明らかにされている(ヌクレオチド番号2801〜3733, GenBank accession NC_000913.2, gi: 49175990)。thrB遺伝子は、E. coli K-12の染色体において、thrA遺伝子とthrC遺伝子との間に位置する。E. coliのスレオニンシンターゼをコードするthrC遺伝子は明らかにされている(ヌクレオチド番号3734〜5020, GenBank accession NC_000913.2, gi: 49175990)。thrC遺伝子は、E. coli K-12の染色体において、thrB遺伝子とyaaXオープンリーディングフレームとの間に位置する。これら三つの遺伝子は、全て、単一のスレオニンオペロンとして機能する。スレオニンオペロンの発現を増大させるには、転写に影響するアテニュエーター領域を、好ましくは、オペロンから除去する(WO2005/049808, WO2003/097839)。
【0060】
スレオニンによるフィードバック阻害に耐性のアスパルトキナーゼホモセリンデヒドロゲナーゼIをコードする変異thrA遺伝子、ならびに、thrB遺伝子及びthrC遺伝子は、スレオニン生産株E. coli VKPM B-3996に存在する周知のプラスミドpVIC40から一つのオペロンとして取得できる。プラスミドpVIC40の詳細は、米国特許第5,705,371号に記載されている。
【0061】
rhtA遺伝子は、グルタミン輸送系の要素をコードするglnHPQ オペロンに近いE. coli染色体の18分に存在する。rhtA遺伝子は、ORF1 (ybiF遺伝子, ヌクレオチド番号764〜1651,
GenBank accession number AAA218541, gi:440181)と同一であり、pexB遺伝子とompX遺伝子との間に位置する。ORF1によりコードされるタンパク質を発現するユニットは、rhtA遺伝子と呼ばれている(rht: ホモセリン及びスレオニンに耐性)。また、rhtA23変異が、ATG開始コドンに対して-1位のG→A置換であることが判明している(ABSTRACTS of the 17th International Congress of Biochemistry and Molecular Biology in conjugation with Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California August 24-29, 1997, abstract No. 457, EP 1013765 A)。
【0062】
E. coliのasd遺伝子は既に明らかにされており(ヌクレオチド番号3572511〜3571408, GenBank accession NC_000913.1, gi:16131307)、その遺伝子の塩基配列に基づいて作製されたプライマーを用いるPCRにより得ることができる(White, T. J., Arnheim, N., and Erlich, H. A. 1989. Trends Genet. 5: 185-189参照)。他の微生物のasd遺伝子も同様に得ることができる。
【0063】
また、E. coliのaspC遺伝子も既に明らかにされており(ヌクレオチド番号983742〜984932, GenBank accession NC_000913.1, gi:16128895)、PCRにより得ることができる。他の微生物のaspC遺伝子も同様に得ることができる。
【0064】
L−システイン生産菌
L−システイン生産菌又はそれを誘導するための親株の例としては、フィードバック阻害耐性のセリンアセチルトランスフェラーゼをコードする異なるcysEアレルで形質転換されたE. coli JM15(米国特許第6,218,168号、ロシア特許出願第2003121601号)、細胞に毒性の物質を排出するのに適したタンパク質をコードする過剰発現遺伝子を有するE. coli W3110 (米国特許第5,972,663号)、システインデスルフォヒドラーゼ活性が低下したE. coli株 (JP11155571A2)、cysB遺伝子によりコードされる正のシステインレギュロンの転写制御因子の活性が上昇したE. coli W3110 (WO0127307A1)などの菌株が挙げられるが、これらに限定されない。
【0065】
L−ロイシン生産菌
L−ロイシン生産菌又はそれを誘導するための親株の例としては、ロイシン耐性のE. coli株 (例えば、57株 (VKPM B-7386, 米国特許第6,124,121号))またはβ−2−チエニルアラニン、3−ヒドロキシロイシン、4−アザロイシン、5,5,5-トリフルオロロイシンなどのロイシンアナログ耐性のE. coli株(特公昭62-34397号及び特開平8-70879号)、WO96/06926に記載された遺伝子工学的方法で得られたE. coli株、E. coli H-9068 (特開平8-70879号)など株が挙げられるが、これらに限定されない。
【0066】
本発明に用いる細菌は、L−ロイシン生合成に関与する遺伝子の1種以上の発現が増大されることにより改良されていてもよい。このような遺伝子の例としては、好ましくはL−ロイシンによるフィードバック阻害が解除されたイソプロピルマレートシンターゼをコードする変異leuA遺伝子(米国特許第6,403,342号)に代表される、leuABCDオペロンの遺伝子が挙げられる。さらに、本発明に用いる細菌は、細菌の細胞からL−アミノ酸を排出するタンパク質をコードする遺伝子の1種以上の発現が増大されることにより改良されていてもよい。このような遺伝子の例としては、b2682遺伝子及びb2683遺伝子(ygaZH遺伝子) (EP 1239041 A2)が挙げられる。
【0067】
L−ヒスチジン生産菌
L−ヒスチジン生産菌又はそれを誘導するための親株の例としては、E. coli 24株 (VKPM B-5945, RU2003677)、E. coli 80株 (VKPM B-7270, RU2119536)、E. coli NRRL B-12116 - B12121 (米国特許第4,388,405号)、E. coli H-9342 (FERM BP-6675)及びH-9343 (FERM BP-6676) (米国特許第6,344,347号)、E. coli H-9341 (FERM BP-6674) (EP1085087)、E. coli AI80/pFM201 (米国特許第6,258,554号)など株が挙げられるが、これらに限定されない。
【0068】
L−ヒスチジン生産菌又はそれを誘導するための親株の例としては、L−ヒスチジン生合成系酵素をコードする遺伝子の1種以上の発現が増大した株も挙げられる。かかる遺伝子の例としては、ATPフォスフォリボシルトランスフェラーゼ遺伝子(hisG)、フォスフォリボシルAMPサイクロヒドロラーゼ遺伝子(hisI)、フォスフォリボシル-ATPピロフォスフォヒドロラーゼ遺伝子(hisI)、フォスフォリボシルフォルミミノ-5-アミノイミダゾールカルボキサミドリボタイドイソメラーゼ遺伝子(hisA)、アミドトランスフェラーゼ遺伝子(hisH)、ヒスチジノールフォスフェイトアミノトランスフェラーゼ遺伝子(hisC)、ヒスチジノールフォスファターゼ遺伝子(hisB)、ヒスチジノールデヒドロゲナーゼ遺伝子(hisD)などが挙げられる。
【0069】
hisG及びhisBHAFIにコードされるL−ヒスチジン生合成系酵素はL−ヒスチジンにより阻害されることが知られており、従って、L−ヒスチジン生産能は、ATPフォスフォリボシルトランスフェラーゼ遺伝子(hisG)にフィードバック阻害への耐性を付与する変異を導入することにより効率的に増大させることができる(ロシア特許第2003677号及び第2119536号)。
【0070】
L−ヒスチジン生産能を有する株の具体例としては、L−ヒスチジン生合成系酵素をコードするDNAを保持するベクターを導入したE. coli FERM-P 5038及び5048 (特開昭56-005099号)、アミノ酸輸送の遺伝子を導入したE. coli株(EP1016710A)、スルファグアニジン、DL-1,2,4-トリアゾール-3-アラニン及びストレプトマイシンに対する耐性を付与したE. coli 80株(VKPM B-7270, ロシア特許第2119536号)などの菌株が挙げられる。
【0071】
L−グルタミン酸生産菌
L−グルタミン酸生産菌又はそれを誘導するための親株の例としては、E. coli VL334thrC+ (EP 1172433)などの菌株が挙げられるが、これらに限定されない。E. coli VL334 (VKPM B-1641)は、thrC遺伝子及びilvA遺伝子に変異を有するL−イソロイシン及びL−スレオニン要求性株である(米国特許第4,278,765号)。thrC遺伝子の野生型アレルは、野生型E. coli K12株 (VKPM B-7)の細胞で増殖したバクテリオファージP1を用いる一般的形質導入法により導入された。この結果、L−イソロイシン要求性のL−グルタミン酸生産菌VL334thrC+ (VKPM B-8961) が得られた。
【0072】
L−グルタミン酸生産菌又はそれを誘導するための親株の例としては、L−グルタミン酸生合成系酵素をコードする遺伝子の1種以上の発現が増大した株が挙げられるが、これらに限定されない。かかる遺伝子の例としては、グルタメートデヒドロゲナーゼ(gdhA)、グルタミンシンテターゼ(glnA)、グルタメートシンテターゼ(gltAB)、イソシトレートデヒドロゲナーゼ(icdA)、アコニテートヒドラターゼ(acnA, acnB)、シトレートシンターゼ(gltA)、フォスフォエノールピルベートカルボシラーゼ(ppc)、ピルベートデヒドロゲナーゼ(aceEF, lpdA)、ピルベートキナーゼ(pykA, pykF)、フォスフォエノールピルベートシンターゼ(ppsA)、エノラーゼ(eno)、フォスフォグリセロムターゼ(pgmA, pgmI)、フォスフォグリセレートキナーゼ(pgk)、グリセルアルデヒド-3-フォスフェートデヒドロゲナーゼ(gapA)、トリオースフォスフェートイソメラーゼ(tpiA)、フルクトースビスフォスフェートアルドラーゼ(fbp)、フォスフォフルクトキナーゼ(pfkA, pfkB)、グルコースフォスフェートイソメラーゼ(pgi)などが挙げられる。
【0073】
シトレートシンテターゼ遺伝子、フォスフォエノールピルベートカルボキシラーゼ遺伝子、及び/またはグルタメートデヒドロゲナーゼ遺伝子の発現が増大するように改変された株の例としては、EP1078989A、EP955368A及びEP952221Aに開示されたものが挙げられる。
【0074】
L−グルタミン酸生産菌又はそれを誘導するための親株の例としては、L−グルタミン酸の生合成経路から分岐してL−グルタミン酸以外の化合物の合成を触媒する酵素の活性が低下または欠損している株も挙げられる。このような酵素の例としては、イソシトレートリアーゼ(aceA)、α-ケトグルタレートデヒドロゲナーゼ(sucA)、フォスフォトランスアセチラーゼ(pta)、アセテートキナーゼ(ack)、アセトヒドロキシ酸シンターゼ(ilvG)、アセトラクテートシンターゼ(ilvI)、フォルメートアセチルトランスフェラーゼ(pfl)、ラクテートデヒドロゲナーゼ(ldh)、グルタメートデカルボキシラーゼ(gadAB)、γ-グルタミル転移酵素(ggt)、γ-グルタミルシステイン合成酵素(gshA)、γ-グルタミン酸プトレシン合成酵素(ycjK)などが挙げられる。α-ケトグルタレートデヒドロゲナーゼ活性が欠損した、または、α-ケトグルタレートデヒドロゲナーゼ活性が低下したエシェリヒア・コリ、及び、それらの取得方法は米国特許第5,378,616 号及び第5,573,945号に記載されている。
【0075】
具体例としては下記のものが挙げられる。
E. coli W3110sucA::Kmr
E. coli AJ12624 (FERM BP-3853)
E. coli AJ12628 (FERM BP-3854)
E. coli AJ12949 (FERM BP-4881)
【0076】
E. coli W3110sucA::Kmr は、E. coli W3110のα-ケトグルタレートデヒドロゲナーゼ遺伝子(以下、「sucA遺伝子」ともいう)を破壊することにより得られた株である。この株は、α-ケトグルタレートデヒドロゲナーゼを完全に欠損している。
【0077】
L−グルタミン酸生産菌の他の例としては、アスパラギン酸代謝拮抗物質に耐性を有するエシェリヒア・コリが挙げられる。このような株は、α-ケトグルタレートデヒドロゲナーゼを欠損していてもよく、例えば、E. coli AJ13199 (FERM BP-5807) (米国特許第5.908,768号)、さらにL−グルタミン酸分解能が低下したFFRM P-12379(米国特許第5,393,671号); AJ13138 (FERM BP-5565) (米国特許第6,110,714号)などの菌株が挙げられる。
【0078】
パントアエ・アナナティスのL−グルタミン酸生産菌の例としては、パントエア・アナナティスAJ13355株が挙げられる。同株は、静岡県磐田市の土壌から、低pHでL−グルタミン酸及び炭素源を含む培地で増殖できる株として分離された株である。パントエア・アナナティスAJ13355は、1998年2月19日に、独立行政法人 産業技術総合研究所 特許生物寄託センター(住所 〒305-8566 日本国茨城県つくば市東1丁目1番地1 中央第6)に、受託番号FERM P-16644として寄託され、1999年1月11日にブダペスト条約に基づく国際寄託に移管され、受託番号FERM BP-6614が付与されている。尚、同株は、分離された当時はエンテロバクター・アグロメランス(Enterobacter agglomerans)と同定され、エンテロバクター・アグロメランスAJ13355として寄託されたが、近年16S rRNAの塩基配列解析などにより、パントエア・アナナティス(Pantoea ananatis)に再分類されている。
【0079】
また、パントアエ・アナナティスのL−グルタミン酸生産菌として、α-ケトグルタレートデヒドロゲナーゼ(αKGDH)活性が欠損した、または、αKGDH活性が低下したパントエア属に属する細菌が挙げられる。このような株としては、AJ13355株のαKGDH-E1サブユニット遺伝子(sucA)を欠損させたAJ13356(米国特許第6,331,419号)、及びAJ13355株から粘液質低生産変異株として選択されたSC17株由来のsucA遺伝子欠損株であるSC17sucA(米国特許第6,596,517号)がある。AJ13356は、1998年2月19日、工業技術院生命工学工業技術研究所(現 独立行政法人 産業技術総合研究所 特許生物寄託センター、〒305-8566 日本国茨城県つくば市東1丁目1番地1 中央第6)に受託番号FERM P-16645として寄託され、1999年1月11日にブダペスト条約に基づく国際寄託に移管され、受託番号FERM BP-6616が付与されている。AJ13355及びAJ13356は、上記寄託機関にEnterobacter agglomeransとして寄託されているが、本明細書では、Pantoea ananatisとして記載する。また、SC17sucA株は、ブライベートナンバーAJ417株が付与され、2004年2月26日に産業技術総合研究所特許生物寄託センターに受託番号FERM BP-08646として寄託されている。
【0080】
さらに、パントエア・アナナティスのL−グルタミン酸生産菌として、SC17sucA/RSFCPG+pSTVCB株、AJ13601株、NP106株、及びNA1株が挙げられる。SC17sucA/RSFCPG+pSTVCB株は、SC17sucA株に、エシェリヒア・コリ由来のクエン酸シンターゼ遺伝子(gltA)、ホスホエノールピルビン酸カルボキシラーゼ遺伝子(ppsA)、およびグルタメートデヒドロゲナーゼ遺伝子(gdhA)を含むプラスミドRSFCPG、並びに、ブレビバクテリウム・ラクトファーメンタム由来のクエン酸シンターゼ遺伝子(gltA)を含むプラスミドpSTVCBを導入して得た株である。AJ13601株は、このSC17sucA/RSFCPG+pSTVCB株から低pH下で高濃度のL−グルタミン酸に耐性を示す株として選択された株である。また、NP106株は、実施例に記載したように、AJ13601株からプラスミドRSFCPG+pSTVCBを脱落させた株である。AJ13601株は、1999年8月18日に、独立行政法人 産業技術総合研究所 特許生物寄託センター(〒305-8566 日本国茨城県つくば市東1丁目1番地1 中央第6)に受託番号FERM P-17516として寄託され、2000年7月6日にブダペスト条約に基づく国際寄託に移管され、受託番号FERM BP-7207が付与されている。
【0081】
L−フェニルアラニン生産菌
L−フェニルアラニン生産菌又はそれを誘導するための親株の例としては、E. coli AJ12739 (tyrA::Tn10, tyrR) (VKPM B-8197)、変異型pheA34遺伝子を保持するE. coli HW1089 (ATCC 55371) (米国特許第 5,354,672号)、E. coli MWEC101-b (KR8903681)、E.coli NRRL B-12141, NRRL B-12145, NRRL B-12146及びNRRL B-12147 (米国特許第4,407,952号)などの菌株が挙げられるが、これらに限定されない。また、親株として、E. coli K-12 [W3110 (tyrA)/pPHAB] (FERM BP-3566)、E. coli K-12 [W3110 (tyrA)/pPHAD] (FERM BP-12659)、E. coli K-12 [W3110 (tyrA)/pPHATerm] (FERM BP-12662)及びAJ 12604と命名されたE. coli K-12 [W3110 (tyrA)/pBR-aroG4, pACMAB] (FERM BP-3579)も使用できる(EP 488424 B1)。さらに、yedA遺伝子またはyddG遺伝子にコードされるタンパク質の活性が増大したエシェリヒア・コリのL−フェニルアラニン生産菌も使用できる(米国特許出願公開2003/0148473 A1及び2003/0157667 A1)。
【0082】
L−トリプトファン生産菌
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、変異trpS遺伝子によりコードされるトリプトファニル-tRNAシンテターゼが欠損したE. coli JP4735/pMU3028 (DSM10122)及びJP6015/pMU91 (DSM10123) (米国特許第5,756,345号)、セリンによるフィードバック阻害を受けないフォスフォグリセリレートデヒドロゲナーゼをコードするserAアレル及びトリプトファンによるフィードバック阻害を受けないアントラニレートシンターゼをコードするtrpEアレルを有するE. coli SV164 (pGH5) (米国特許第6,180,373号)、トリプトファナーゼが欠損したE. coli AGX17 (pGX44) (NRRL B-12263)及びAGX6(pGX50)aroP (NRRL B-12264) (米国特許第4,371,614号)、フォスフォエノールピルビン酸生産能が増大したE. coli AGX17/pGX50,pACKG4-pps (WO9708333, 米国特許第6,319,696号)などの菌株が挙げられるが、これらに限定されない。yedA遺伝子またはyddG遺伝子にコードされるタンパク質の活性が増大したエシェリヒア・コリのL−トリプトファン生産菌も使用できる(米国特許出願公開2003/0148473 A1及び2003/0157667 A1)。
【0083】
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、アントラニレートシンターゼ(trpE)、フォスフォグリセレートデヒドロゲナーゼ(serA)、及び、トリプトファンシンターゼ(trpAB)から選ばれる酵素の活性の一種以上が増大した株も挙げられる。アントラニレートシンターゼ及びフォスフォグリセレートデヒドロゲナーゼは共にL−トリプトファン及びL−セリンによるフィードバック阻害を受けるので、フィードバック阻害を解除する変異をこれらの酵素に導入してもよい。このような変異を有する株の具体例としては、脱感作型アントラニレートシンターゼを保持するE. coli SV164、及び、フィードバック阻害が解除されたフォスフォグリセレートデヒドロゲナーゼをコードする変異serA遺伝子を含むプラスミドpGH5 (WO 94/08031)をE. coli SV164に導入することにより得られた形質転換株が挙げられる。
【0084】
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、阻害解除型アントラニレートシンターゼをコードする遺伝子を含むトリプトファンオペロンが導入された株(特開昭57-71397号, 特開昭62-244382号, 米国特許第4,371,614号)も挙げられる。さらに、トリプトファンオペロン(trpBA)中のトリプトファンシンターゼをコードする遺伝子の発現を増大させることによりL−トリプトファン生産能を付与してもよい。トリプトファンシンターゼは、それぞれtrpA及びtrpB遺伝子によりコードされるα及びβサブユニットからなる。さらに、イソシトレートリアーゼ-マレートシンターゼオペロンの発現を増大させることによりL−トリプトファン生産能を改良してもよい(WO2005/103275)。
【0085】
L−プロリン生産菌
L−プロリン生産菌又はそれを誘導するための親株の例としては、ilvA遺伝子が欠損し、L−プロリンを生産できるE. coli 702ilvA (VKPM B-8012) (EP 1172433)などの菌株が挙げられるが、これらに限定されない。
【0086】
本発明に用いる細菌は、L−プロリン生合成に関与する遺伝子の一種以上の発現を増大することにより改良してもよい。L−プロリン生産菌に好ましい遺伝子の例としては、L−プロリンによるフィードバック阻害が解除されたグルタメートキナーゼをコードするproB遺伝子(ドイツ特許第3127361号)が挙げられる。さらに、本発明に用いる細菌は、細菌の細胞からL−アミノ酸を排出するタンパク質をコードする遺伝子の一種以上の発現が増大することにより改良してもよい。このような遺伝子としては、b2682 遺伝子及びb2683遺伝子(ygaZH遺伝子) (EP1239041 A2)が挙げられる。
【0087】
L−プロリン生産能を有するエシェリヒア・コリの例としては、NRRL B-12403及びNRRL B-12404 (英国特許第2075056号)、VKPM B-8012 (ロシア特許出願2000124295)、ドイツ特許第3127361号に記載のプラスミド変異体、Bloom F.R. et al (The 15th Miami winter symposium, 1983, p.34)に記載のプラスミド変異体などのE. coli 株が挙げられる。
【0088】
L−アルギニン生産菌
L−アルギニン生産菌又はそれを誘導するための親株の例としては、E. coli 237株 (VKPM B-7925) (米国特許出願公開2002/058315 A1)、及び、変異N-アセチルグルタメートシンターゼを保持するその誘導株(ロシア特許出願第2001112869号)、E. coli 382株 (VKPM B-7926) (EP1170358A1)、N-アセチルグルタメートシンテターゼをコードするargA遺伝子が導入されたアルギニン生産株(EP1170361A1)などの菌株が挙げられるが、これらに限定されない。
【0089】
L−アルギニン生産菌又はそれを誘導するための親株の例としては、L−アルギニン生合成系酵素をコードする遺伝子の1種以上の発現が増大した株も挙げられる。かかる遺伝子の例としては、N-アセチルグルタミルフォスフェートレダクターゼ遺伝子(argC)、オルニチンアセチルトランスフェラーゼ遺伝子(argJ)、N-アセチルグルタメートキナーゼ遺伝子(argB)、アセチルオルニチントランスアミナーゼ遺伝子(argD)、オルニチンカルバモイルトランスフェラーゼ遺伝子(argF)、アルギノコハク酸シンテターゼ遺伝子(argG)、アルギノコハク酸リアーゼ遺伝子(argH)、カルバモイルフォスフェートシンテターゼ遺伝子(carAB)が挙げられる。
【0090】
L−バリン生産菌
L−バリン生産菌又はそれを誘導するための親株の例としては、ilvGMEDAオペロンを過剰発現するように改変された株(米国特許第5,998,178号)が挙げられるが、これらに限定されない。アテニュエーションに必要なilvGMEDAオペロンの領域を除去し、生産されるL−バリンによりオペロンの発現が減衰しないようにすることが好ましい。さらに、オペロンのilvA遺伝子が破壊され、スレオニンデアミナーゼ活性が減少することが好ましい。
【0091】
L−バリン生産菌又はそれを誘導するための親株の例としては、アミノアシルt-RNAシンテターゼの変異を有する変異株(米国特許第5,658,766号)も挙げられる。例えば、イソロイシンtRNAシンテターゼをコードするileS 遺伝子に変異を有するE. coli VL1970が使用できる。E. coli VL1970は、1988年6月24日、ルシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオルガニズムズ(VKPM) (1 Dorozhny proezd., 1 Moscow 117545, Russia)に、受託番号VKPM B-4411で寄託されている。
さらに、生育にリポ酸を要求する、及び/または、H+-ATPaseを欠失している変異株(WO96/06926)を親株として用いることができる。
【0092】
L−イソロイシン生産菌
L−イソロイシン生産菌又はそれを誘導するための親株の例としては、6−ジメチルアミノプリンに耐性を有する変異株(特開平5-304969号)、チアイソロイシン、イソロイシンヒドロキサメートなどのイソロイシンアナログに耐性を有する変異株、さらにDL-エチオニン及び/またはアルギニンヒドロキサメートに耐性を有する変異株(特開平5-130882号).が挙げられるが、これらに限定されない。さらに、スレオニンデアミナーゼ、アセトヒドロキシ酸シンターゼなどのL−イソロイシン生合成に関与するタンパク質をコードする遺伝子で形質転換された組換え株もまた親株として使用できる(特開平2-458号, FR 0356739, 及び米国特許第5,998,178号)。
【0093】
L−アスパラギン酸生産菌
L−アスパラギンは、アスパラギン酸へアミノ基を付与することにより生産される(Boehlein, S. K., Richards, N. G. J., & Schuster, S. M. (1994a) J. Biol. Chem. 269, 7450-7457.)。したがって、エシェリヒア・コリのL−アスパラギン生産菌として、L−アスパラギン酸生産菌のアスパラギンシンテターゼが増強されたエシェリヒア・コリ菌株が挙げられる。
【0094】
本発明の細菌は、脂肪酸、又はグリセロール等のアルコールを資化する能力が高められていてもよい。
脂肪酸資化能は、例えば、fadR遺伝子の発現を弱化させること、もしくは同遺伝子を欠損させること、fadI、fadJ、fadL、fadE、fadD、fadB、又はfadA遺伝子等の脂肪酸資化に関与する遺伝子の発現を増強することにより、高めることができる(WO2009/142286)。
【0095】
グリセロール資化能は、glpR遺伝子(EP1715056)の発現を弱化するか、glpA、glpB、glpC、glpD、glpE、glpF、glpG、glpK、glpQ、glpT、glpX、tpiA、gldA、dhaK、dhaL、dhaM、dhaR、fsa及びtalC遺伝子等のグリセロール代謝遺伝子(EP1715055A)の発現を増強すること、又は、グリセロールデヒドロゲナーゼ(gldA)、ジハイドロキシアセトンキナーゼ(dhaKLM, dak)遺伝子、フルクトースー6−リン酸アルドラーゼ(fsaB)の発現を強化すること(WO2008/102861)によって、高めることができる。
【0096】
本発明に用いる細菌は、エタノール資化性を有する細菌であり、元来エタノールの資化性を有する細菌、エタノールの資化性を付与された組換え株、又はエタノールの資化性が高まった変異株でもよい。
【0097】
エシェリヒア・コリに関しては、嫌気条件でエタノールを生成する酵素として、以下の反応を可逆的に触媒するアセトアルデヒドデヒドロゲナーゼとアルコールデヒドロゲナーゼ活性を有するAdhEの存在が知られている。エシェリヒア・コリのAdhEをコードするadhE遺伝子の配列は、 HYPERLINK "mailto:WO2009031565@" WO2009/031565、米国特許出願公開第2009068712号に開示されている。
【0098】
アセチル-CoA + NADH + H+ → アセトアルデヒド + NAD+ + CoA
アセトアルデヒド + NADH + H+ → エタノール + NAD+
【0099】
エタノールを炭素源に用いる場合は、好気的にエタノールを資化できる細菌を用いることが好ましい。エシェリヒア・コリは、好気条件ではエタノールは資化できないが、好気的にエタノールを資化できるように改変された株を用いてもよい。元来好気的にエタノールを資化できない細菌を、好気的にエタノールを資化できるように改変するには、例えば、好気条件で機能する非天然型プロモーターの制御下で発現するように改変されたadh遺伝子を保持させること、又は、好気的にエタノールを資化できることを可能にする変異をコード領域内に有する変異型adhE遺伝子を保持させることが挙げられる(Clark D. P., and Cronan, J. E. Jr. 1980. J. Bacteriol. 144: 179-184; Membrillo-Hernandez, J. et al. 2000. J. Biol. Chem. 275: 33869-33875)。さらに、この変異型adhE遺伝子は、好気条件で機能する非天然型プロモーターの制御下で発現するものであってもよい。
【0100】
エシェリヒア・コリは、アルコールデヒドロゲナーゼをコードする遺伝子の上流のプロモーターを好気的に機能するプロモーターに置換することによって、好気条件でアルコールデヒドロゲナーゼが発現し、好気的にエタノールを資化できるようになる(WO2008/010565号パンフレット)。好気条件で機能する非天然型プロモーターとして、好気条件で或る特定レベルを超えてadhE遺伝子を発現することができる任意のプロモーターを用いることができる。好気条件は、振盪、通気及び撹拌等の方法によって酸素が供給される細菌の培養に通常用いられるものであり得る。具体的には、好気条件で遺伝子を発現することが知られている任意のプロモーターを用いることができる。例えば、解糖、ペントースリン酸経路、TCAサイクル、アミノ酸生合成経路等に関与する遺伝子のプロモーターを用いることができる。さらに、λファージのPtacプロモーター、lacプロモーター、trpプロモーター、trcプロモーター、PRプロモーター、又はPLプロモーターは全て、好気条件で機能する強いプロモーターであることが知られており、これらを用いることが好ましい。
【0101】
前記のような変異を有するAdhE変異体として具体的には、エシェリヒア・コリのAdhEの568位のグルタミン酸残基がグルタミン酸及びアスパラギン酸以外のアミノ酸残基、例えばリジンで置換された変異体(Glu568Lys、E568K)がある(国際公開パンフレットWO2008/010565号公報)。
【0102】
さらに、前記AdhE変異体は、以下の追加的変異を含んでいてもよい。
A)560位のグルタミン酸残基の他のアミノ酸残基、例えばリジン残基への置換
B)566位のフェニルアラニン残基の他のアミノ酸残基、例えばバリン残基への置換、
C)22位のグルタミン酸残基、236位のメチオニン残基、461位のチロシン残基、554位のイソロイシン残基、及び786位のアラニン残基の他のアミノ酸残基、例えばそれぞれグリシン残基、バリン残基、システイン残基、セリン残基、及びバリン残基への置換、又は
D)上記変異の組合わせ。
【0103】
「好気的にエタノールを資化できる」とは、エタノールを単一炭素源とする最少液体培地もしくは固体培地にて、好気条件で生育可能であることを意味する。「好気条件」は前記と同様に、振盪、通気及び撹拌等の方法によって酸素が供給される細菌の培養に通常用いられるものであり得る。また、「好気的にエタノールを資化できる」とは、AdhEタンパク質のレベルに関して、Clark及びCronan(J. Bacteriol., 141, 177-183 (1980))の方法によって測定された無細胞抽出物におけるアルコールデヒドロゲナーゼ活性は、タンパク質1mg当たり1.5ユニット以上、好ましくは5ユニット以上、及びより好ましくは10ユニット以上であることを意味する。
【0104】
また、本発明の細菌は、ピルビン酸シンターゼ、または、ピルビン酸:NADP+オキシドレダクターゼの活性が増大するように改変された菌株であってもよい。ピルビン酸シンターゼの、あるいは、ピルビン酸:NADP+オキシドレダクターゼ活性が増大するように改変するには、ピルビン酸シンターゼ、または、ピルビン酸:NADP+オキシドレダクターゼ活性が、親株、例えば野生株や非改変株と比べて増大するように改変することが好ましい。尚、微生物が元来ピルビン酸シンターゼ活性を有していない場合、同酵素活性を有するように改変された微生物は、ピルビン酸シンターゼ、または、ピルビン酸:NADP+オキシドレダクターゼ活性が、非改変株に比べて増大している。
【0105】
本発明における「ピルビン酸シンターゼ」とは、アセチル-CoAとCO2からピルビン酸を生成する下記の反応を、電子供与体存在下、例えばフェレドキシンあるいはフラボドキシン存在下で可逆的に触媒する酵素(EC 1.2.7.1)を意味する。ピルビン酸シンターゼは、PSと略称されることもあり、ピルビン酸オキシドレダクターゼ、ピルビン酸フェレドキシンオキシドレダクターゼ、ピルビン酸フラボドキシンオキシドレダクターゼ、または、ピルビン酸オキシドレダクターゼと命名されている場合もある。電子供与体としては、フェレドキシンまたはフラボドキシンを用いることが出来る。
【0106】
還元型フェレドキシン + アセチル-CoA + CO2 → 酸化型フェレドキシン + ピルビン酸 +
CoA
【0107】
ピルビン酸シンターゼの活性が増強されたことの確認は、増強前の微生物と、増強後の微生物より粗酵素液を調製し、そのピルビン酸シンターゼ活性を比較することにより達成される。ピルビン酸シンターゼの活性は、例えば、Yoonらの方法(Yoon, K. S. et al. 1997. Arch. Microbiol. 167: 275-279)に従って測定できる。例えば、電子受容体としての酸化型メチルビオロゲンとCoAと粗酵素液を含む反応液にピルビン酸を添加した際に、ピルビン酸の脱炭酸反応によって増大する還元型メチルビオロゲンの量を分光学的に測定することによって、測定可能である。酵素活性1ユニット(U)は1分間あたり1μmolのメチルビオロゲンの還元量で表される。親株がピルビン酸シンターゼ活性を有している場合、親株と比較して、好ましくは1.5倍以上、より好ましくは2倍以上、さらに好ましくは3倍以上酵素活性が上昇していることが望ましい。また親株がピルビン酸シンターゼ活性を有していない場合には、ピルビン酸シンターゼ遺伝子を導入することにより、ピルビン酸シンターゼが生成されていればよいが、酵素活性が測定できる程度に強化されていることが好ましく、好ましくは0.001U/mg(菌体タンパク質)以上、より好ましくは0.005U/mg以上、さらに好ましくは0.01U/mg以上が望ましい。ピルビン酸シンターゼは、酸素に対して感受性であり、一般的に活性発現や測定は困難であることも多い(Buckel, W.and Golding, B. T. 2006. Ann. Rev. of Microbiol. 60: 27-49)。したがって、酵素活性の測定に際しては、反応容器中の酸素濃度を低下させて酵素反応を行うことが好ましい。
【0108】
ピルビン酸シンターゼをコードする遺伝子は、クロロビウム・テピダム(Chlorobium tepidum)、ハイドロジェノバクター・サーモファイラス(Hydrogenobacter thermophilus)等、還元的TCAサイクルを持つ細菌のピルビン酸シンターゼ遺伝子を利用することが可能である。また、エシェリヒア・コリ(Escherichia coli)をはじめとする、腸内細菌群に属する細菌由来のピルビン酸シンターゼ遺伝子を利用することも可能である。さらに、ピルビン酸シンターゼをコードする遺伝子は、メタノコッカス・マリパルディス(Methanococcus maripaludis)、メタノカルドコッカス・ジャナスチ(Methanocaldococcus jannaschii)、メタノサーモバクター・サーマトトロフィカス(Methanothermobacter thermautotrophicus)などの独立栄養性メタン生成古細菌(autotrophic methanogens)のピルビン酸シンターゼ遺伝子を利用することが可能である。
【0109】
<2−2>エシェリヒア・コリに変異型RpsAタンパク質を保持させる方法
本発明の細菌は、上述したようなL−アミノ酸生産能を有するエシェリヒア・コリを、210位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有するエシェリヒア・コリのRpsAタンパク質(以下、「変異型RpsAタンパク質」と記載することがある。)を保持するように改変することによって取得できる。また、本発明の細菌は、変異型RpsAタンパク質を保持するように改変された細菌に、L−アミノ酸生産能を付与することによっても、取得できる。
【0110】
腸内細菌科に属する細菌に変異型RpsAタンパク質を保持させるには、変異型RpsAタンパク質をコードする変異型rpsA遺伝子を腸内細菌科に属する細菌に導入するか、染色体上の野生型rpsA遺伝子に210位のアスパラギン酸残基が他のアミノ酸残基で置換されるような変異を導入すればよい。
【0111】
変異型rpsA遺伝子を腸内細菌科に属する細菌に導入するには、例えば、変異型rpsA遺伝子を含むベクターで腸内細菌科に属する細菌を形質転換すればよい。また、変異型RpsA遺伝子を、レペティティブDNA、転移因子の端部に存在するインバーテッド・リピート、又はトランスポゾン等を用いて腸内細菌科に属する細菌の染色体上に存在させてもよい。
前記ベクターとしては、pUC19、pUC18、pHSG299、pHSG399、pHSG398、RSF1010、pBR322、pACYC184、pMW118、pMW219等ラスミドベクター、λ1059、λBF101、M13mp9等のファージベクターが挙げられる。またトランスポゾンとしては、Mu、Tn10、Tn5等が挙げられる。
【0112】
変異型rpsA遺伝子を発現させるためのプロモーター等の発現調節配列は、rpsA遺伝子固有のものであってもよいし、他の遺伝子由来のプロモーター又は人工プロモーターであってもよい。そのようなプロモーターとしては、lacプロモーター、trpプロモーター、trcプロモーター、tacプロモーター、ラムダファージのPRプロモーター、PLプロモーター、PL-tacプロモーター、tetプロモーター等が挙げられる。
【0113】
本発明の細菌は、野生型RpsAタンパク質を保持しないことが好ましい。このような細菌は、野生型RpsA遺伝子が発現しないように染色体上のrpsA遺伝子を改変すること、例えばrps遺伝子を破壊することによって取得することができる。また、染色体上のrpsA遺伝子を変異型rpsA遺伝子で置換することによって、野生型RpsAタンパク質を保持せず、かつ、変異型RpsAタンパク質を保持する細菌を得ることができる。このような遺伝子置換を行う方法としては、例えば「Redドリブンインテグレーション(Red-driven integration)」と呼ばれる方法(Datsenko, K. A, and Wanner, B. L. Proc. Natl. Acad. Sci. U S A. 97:6640-6645 (2000))や、Redドリブンインテグレーション法とλファージ由来の切り出しシステム(Cho, E. H., Gumport, R. I., Gardner, J. F. J. Bacteriol. 184: 5200-5203 (2002))とを組合わせた方法(WO2005/010175号参照)等の直鎖状DNAを用いる方法や、温度感受性複製起点を含むプラスミド、接合伝達可能なプラスミドを用いる方法、宿主内で複製起点を持たないスイサイドベクターを利用する方法などがある(米国特許第6303383号明細書、または特開平05-007491号公報)。また、変異型rpsA遺伝子を保持する細菌から、P1トランスダクション、相同組換え法、又はλ-Red法等によって、任意の腸内細菌科に属する細菌菌株に変異型rpsA遺伝子を導入することもできる。
【0114】
本発明の細菌は、上記RpsAタンパク質をコードする遺伝子を染色体上に保持していればいずれでもよいが、細胞内に2コピー、あるいは3コピー以上有していてもよい。またrpsA遺伝子は破壊や欠失が難しいこともあるので、一旦変異型遺伝子を細胞内に導入してから野生型rpsA遺伝子と変異型遺伝子を置き換えることが望ましい。
【0115】
<3>L−アミノ酸の製造法
本発明の細菌を、脂肪酸及びアルコールから選ばれる炭素源を含む培地で培養し、該培地からL−アミノ酸を採取することにより、L−アミノ酸を製造することができる。炭素源は、脂肪酸及びアルコールの一方を含んでいてもよく、これらの両方を含んでいてもよい。
【0116】
脂肪酸とは、一般式 CnHmCOOH(n+1、m+1は、それぞれ、脂肪酸に含まれる炭素数、水素数を表す)で表わすことができる長鎖炭化水素の1価のカルボン酸を指す。一般的に炭素数が12以上のものを長鎖脂肪酸と呼ぶことが多い。脂肪酸は、その炭素数と不飽和度によって様々な種類が存在する。また、脂肪酸は、油脂の構成成分であり、油脂の種類によって脂肪酸の組成も異なることが知られている。ミリスチン酸(C13H27COOH)は炭素数14の飽和脂肪酸であり、ヤシ油、パーム油に含まれる。パルミチン酸(C15H31COOH)は炭素数16の飽和脂肪酸であり、植物油脂一般に多く含まれる。ステアリン酸(C17H35COOH)は、炭素数18の飽和脂肪酸であり、動物性脂肪・植物性油に多く含まれる。オレイン酸(C17H33COOH)は、炭素数18の一価の不飽和脂肪酸であり、動物性脂肪や植物油に多く含まれる。リノール酸(C17H31COOH)は炭素数18で9位と12位にシス型二重結合を2つ持っている多価不飽和脂肪酸である。脂肪酸としては、上記の長鎖脂肪酸の混合物を用いることも出来る。脂肪酸の混合物を炭素源として用いる場合、脂肪酸の混合比率は、本発明の方法に使用する細菌が炭素源として資化できる濃度比率であればいずれでもかまわない。油脂の加水分解物から、グリセロールを除いた脂肪酸の混合物を利用することも可能である。
【0117】
アルコールとしては、グリセロール、エタノール、ブタノール、プロパノール、脂肪族アルコール、芳香属アルコール等が挙げられる。
グリセロールは、正式名称Propane-1,2,3-triolである物質を指す。グリセロールは、純粋なグリセロールであってもよいが、粗グリセロールであってもよい。粗グリセロールとは、工業的に生産される不純物を含むグリセロールをいう。粗グリセロールは、油脂を高温、高圧下で水と接触させ加水分解することによって、あるいは、バイオディーゼル燃料生産のためのエステル化反応によって、工業的に生産される。バイオディーゼル燃料とは、油脂とメタノールからエステル交換反応により生成する脂肪酸メチルエステルのことであり、この反応の副生物として粗グリセロールが生成する(Fukuda, H., Kondo, A., and Noda, H. 2001, J. Biosci. Bioeng. 92, 405-416を参照のこと)。バイオディーゼル燃料生産プロセスでは、エステル交換にはアルカリ触媒法が用いられることが多く、中和時に酸を加えるため、水と不純物を含んだ純度70〜95重量%程度の粗グリセロールが生成する。バイオディーゼル燃料生産において産生される粗グリセロールは、水に加えて、残存メタノールや触媒であるNaOH等のアルカリとその中和に用いられるK2SO4等の酸との塩を不純物として含んでいる。メーカーや製法により差はあるが、このような塩類やメタノールは数パーセントに達する。ここでナトリウム、カリウム、塩化物イオン、硫酸イオン等の、アルカリやその中和に用いられた酸に由来するイオン類は、粗グリセロールの重量に対し、2〜7%、好ましくは3〜6%、さらに好ましくは4〜5.8%含まれていることが好ましい。メタノールは、不純物として含まれていなくてもよいが、望ましくは0.01%以下含まれていることが好ましい。
【0118】
さらに、粗グリセロール中には、微量の金属、有機酸、リン、脂肪酸などを含むことがある。含まれる有機酸としては、蟻酸、酢酸等が挙げられ、不純物として含まれていなくてもよいが、望ましくは0.01%以下含まれていることが好ましい。粗グリセロールに含まれる微量の金属としては、微生物の生育に必要な微量金属が好ましく、例えばマグネシウム、鉄、カルシウム、マンガン、銅、亜鉛等が挙げられる。マグネシウム、鉄、カルシウムは、粗グリセロールの重量に対し、合計で0.00001〜0.1%、好ましくは0.0005〜0.1%、より好ましくは0.004〜0.05%、さらに好ましくは0.007〜0.01%含まれていることが好ましい。マンガン、銅、亜鉛としては、合計で0.000005〜0.01%、より好ましくは0.000007〜0.005%、さらに好ましくは0.00001〜0.001%含まれていることが好ましい。
【0119】
粗グリセロールのグリセロールの純度としては10%以上であればよく、好ましくは50%以上であり、さらに好ましくは70%以上、特に好ましくは80%以上である。不純物の含有量が上記の範囲を満たす限り、グリセロールの純度は90%以上であってもよい。
粗グリセロールを用いる場合は、グリセロールの純度に応じて、グリセロールの量として上記濃度となるように粗グリセロールを培地に添加すればよい。また、グリセロール及び粗グリセロールの両方を培地に添加してもよい。
【0120】
炭素源は、油脂の加水分解物であってもよい。脂肪酸及び/又はグリセロールを含む限り、油脂の加水分解物を含む培地は、「脂肪酸又はアルコールを含む培地」に相当する。
油脂は、脂肪酸とグリセロールのエステルであり、トリグリセリド(triglyceride)とも呼ばれる。油脂としては、加水分解反応が可能であれば、常温で液体のものを指す脂肪油(oil)、固体のものを指す脂肪(fat)など、どのようなものも使用することが出来る。また、動物由来(魚類を含む)油脂と植物由来油脂のすべてが使用可能であり、1種または2種以上を組み合わせて使用することも出来る。原料として用いる油脂は、純粋な油脂であってもよいし、油脂以外の物質を含む混合物であってもよい。例えば、油脂が植物由来のものである場合は、油脂を含む植物抽出物又はその分画物が挙げられる。
【0121】
動物油脂として、バター、豚脂、牛脂、羊脂等、クジラ油、イワシ油、ニシン油等をあげることができる。植物油脂としては、パーム油、オリーブ油、菜種油、大豆油、米糠油、クルミ油、ゴマ油、ピーナッツ油等が挙げられるが、これらに限定されるものではない。パーム油はアブラヤシの果実からとれる油脂であり、近年バイオディーセル(biodiesel)燃料としての利用が盛んになり、生産量が高まっている。アブラヤシ(oil palm)は、ヤシ科アブラヤシ属(Elaeis)に分類される植物の総称である。粗パーム油(crude palm oil)は、一般的に搾油工場で生産される未精製のパーム油を指し、粗パーム油として取引が行われている。また、微細藻類にも油脂を蓄積するものが知られており(Chisti, Y. 2007. Biotechnol Adv. 25: 294-306)、藻体から抽出することも可能である。藻体内には油脂以外にも糖類、タンパク質、アミノ酸などの有機物が含まれているが、これらを含む混合物を加水分解して炭素源として用いても構わない。
【0122】
油脂としては、加水分解により生じる脂肪酸種が、本発明の方法に使用する細菌が炭素源として資化できるものであり、それらの含量がより高い油脂が望ましい。L−アミノ酸生産能を有する細菌が資化できる長鎖の脂肪酸種としては、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、オレイン酸などが挙げられる。
【0123】
油脂の加水分解物とは、上記油脂を化学的あるいは酵素により加水分解したものを指し、脂肪酸とグリセロールの混合物を指す。工業的な加水分解法としては、高温(250-260℃)、高圧(5-6MPa)下で油脂と水を交流接触させる連続高温加水分解法が一般的に行われている。また、酵素を用いて低温(30℃前後)で反応を行うことも工業的に行われている(Jaeger, K. E. et al. 1994. FEMS Microbiol. Rev. 15: 29-63)。前記酵素としては、油脂の加水分解反応を触媒する酵素リパーゼを用いることが出来る。リパーゼは工業的に重要な酵素であり、様々な産業的利用がなされている(Hasan, F. etal. 2006. Enzyme and Microbiol. Technol. 39: 235-251)。油脂の加水分解物は、脂肪酸とグリセロールの混合物であり、パーム油等の一般的な油脂の加水分解物に含まれる脂肪酸に対するグリセロールの重量比は10%程度であることが知られている。油脂の加水分解物としては、脂肪酸及び/又はグリセロールを含む限り特に制限されない。例えば、油脂の加水分解物をそのまま用いることも出来るが、脂肪酸、グリセロールの一部を除いて使うことも可能であるし、脂肪酸やグリセロールを加えて使用することも出来る。この時のグリセロールの脂肪酸に対する重量比は、好ましくは5〜20:100、より好ましくは7.5〜15:100である。
【0124】
なお、脂肪酸の濃度は、ガスクロマトグラフィ(Hashimoto, K. et al. 1996. Biosci.Biotechnol. Biochem. 70:22-30)やHPLC(Lin, J. T. et al. 1998. J. Chromatogr. A. 808: 43-49)により測定することが可能である。
【0125】
培地に加える脂肪酸、または油脂の加水分解物に含まれる脂肪酸は、水にミセル化するナトリウムやカリウムなどとのアルカリ金属塩として用いることが望ましい。しかしながら、脂肪酸のナトリウム塩やカリウム塩の溶解度も発酵原料として用いるのには十分ではない場合がある。そこで、L−アミノ酸生産能を有する細菌が炭素源として脂肪酸をより効率よく資化できるようにするために、乳化を行う等、均一化を促進する工程を加えることが好ましい。例えば乳化方法として、乳化促進剤や界面活性剤を加える等が考えられる。ここで乳化促進剤としては、リン脂質やステロールが挙げられる。また界面活性剤としては、非イオン界面活性剤では、ポリ(オキシエチレン)ソルビタンモノオレイン酸エステル(Tween 80)などのポリオキシエチレンソルビタン脂肪酸エステル、n-オクチルβ-D-グルコシドなどのアルキルグルコシド、ショ糖ステアリン酸エステルなどのショ糖脂肪酸エステル、ポリグリセリンステアリン酸エステルなどのポリグリセリン脂肪酸エステル等が挙げられる。両性イオン界面活性剤としては、アルキルベタインであるN,N-ジメチル-N-ドデシルグリシンベタインなどが挙げられる。これ以外にも、トライトンX-100(Triton X-100)、ポリオキシエチレン(20)セチルエーテル(Brij-58)やノニルフェノールエトキシレート(Tergitol NP-40)等の一般的に生物学の分野で用いられる界面活性剤が利用可能である。
【0126】
さらに、脂肪酸の乳化や均一化を促進するための操作も有効である。この操作は、脂肪酸の乳化や均一化を促進する操作であれば、どのような操作でも構わない。具体的には、ホモジナイザー処理、ホモミキサー処理、超音波処理、高圧処理、高温処理などが挙げられるが、ホモジナイザー処理、超音波処理およびこれらの組合せがより好ましい。
【0127】
上記界面活性剤による処理と、ホモジナイザー処理及び/または超音波処理を組み合わせることが特に好ましく、これらの処理は、脂肪酸がより安定なアルカリ条件下で行われることが望ましい。アルカリ条件としては、pH9以上が望ましく、より望ましくはpH10以上である。
【0128】
本発明の方法で使用する培地に含まれる、脂肪酸、又はアルコールの量は、本発明の方法に使用する細菌が炭素源として資化できる限り幾らでもよいが、培地中に単独の炭素源として添加する場合、10w/v%以下、好ましくは5w/v%以下、さらに好ましくは2w/v%以下含まれることが好ましい。また、培地中に単独の炭素源として添加する場合、0.2w/v%以上、好ましくは0.5w/v%以上、さらに好ましくは1.0w/v%以上含まれていることが望ましい。
【0129】
さらに、本発明の方法に使用する培地には、脂肪酸、又はアルコールに加え、他の炭素源を添加してもよい。好ましいのは、グルコース、フラクトース、スクロース、ラクトース、ガラクトース、廃糖蜜、澱粉加水分解物やバイオマスの加水分解により得られた糖液などの糖類、フマール酸、クエン酸、コハク酸等の有機酸類である。なお他の炭素源を用いる場合には、炭素源中の脂肪酸、又はアルコールの比率が10重量%以上、好ましくは30重量%以上、より好ましくは50重量%以上であることが好ましい。
【0130】
また、流加培地として使用する場合は、流加培地に単独の炭素源として添加する場合、流加後の培地中の濃度が5w/v%以下、好ましくは2w/v%以下、さらに好ましくは1w/v%以下で含まれることが好ましい。また、流加培地に単独の炭素源として添加する場合、0.01w/v%以上、好ましくは0.02w/v%以上、さらに好ましくは0.05w/v%以上の量にて制御することが好ましい。
【0131】
なお、本発明において、脂肪酸又はアルコールは、培養の全工程において一定濃度含まれてもよいし、流加培地のみあるいは初発培地のみに添加されていてもよく、その他の炭素源が充足していれば、一定時間脂肪酸及び/又はアルコールが不足している期間があってもよい。一定時間とは、例えば発酵全体の時間のうち10%、20%、最大で30%の時間で脂肪酸及び/又はアルコールが不足していてもよい。このように一時的に脂肪酸及び/又はアルコールの濃度が0になることがあっても、脂肪酸又はアルコールを含む培地での培養期間が存在する場合は、本発明の「脂肪酸又はアルコールを含む培地で培養する」との文言に含まれる。
【0132】
培地中に添加する炭素源以外の成分としては、窒素源、無機イオン及び必要に応じその他の有機成分を用いることができる。本発明の培地中に含まれる窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、酢酸アンモニウム、ウレア等のアンモニウム塩または硝酸塩等が使用することができ、pH調整に用いられるアンモニアガス、アンモニア水も窒素源として利用できる。また、ペプトン、酵母エキス、肉エキス、麦芽エキス、コーンスティープリカー、大豆加水分解物等も利用出来る。培地中にこれらの窒素源が1種のみ含まれていてもよいし、2種以上含まれてもよい。これらの窒素源は、初発培地にも流加培地にも用いることができる。また、初発培地、流加培地とも、同じ窒素源を用いてもよいし、流加培地の窒素源を初発培地の窒素源と変更してもよい。
【0133】
本発明の培地には、炭素源、窒素源の他にリン酸源、硫黄源が含まれていることが好ましい。リン酸源としては、リン酸2水素カリウム、リン酸水素2カリウム、ピロリン酸などのリン酸ポリマー等が利用出来る。また、硫黄源とは、硫黄原子を含んでいるものであればいずれでもよいが、硫酸塩、チオ硫酸塩、亜硫酸塩等の硫酸塩、システイン、シスチン、グルタチオン等の含硫アミノ酸が望ましく、なかでも硫酸アンモニウムが望ましい。
【0134】
また、培地には、上記成分の他に、増殖促進因子(増殖促進効果を持つ栄養素)が含まれていてもよい。増殖促進因子とは、微量金属類、アミノ酸、ビタミン、核酸、更にこれらのものを含有するペプトン、カザミノ酸、酵母エキス、大豆たん白分解物等が使用できる。微量金属類としては、鉄、マンガン、マグネシウム、カルシウム等が挙げられ、ビタミンとしては、ビタミンB1、ビタミンB2、ビタミンB6、ニコチン酸、ニコチン酸アミド、ビタミンB12等が挙げられる。これらの増殖促進因子は初発培地に含まれていてもよいし、流加培地に含まれていてもよい。
【0135】
また、生育にアミノ酸などを要求する栄養要求性変異株を使用する場合には、培地に要求される栄養素を補添することが好ましい。L-リジン生産菌は、後述のようにL-リジン生合成経路が強化されており、L-リジン分解能が弱化されているものが多いので、L-スレオニン、L-ホモセリン、L-イソロイシン、L-メチオニンから選ばれる1種又は2種以上を添加することが望ましい。初発培地と流加培地は、培地組成が同じであってもよく、異なっていてもよい。また、初発培地と流加培地は、硫黄濃度が同じであってもよく、異なっていてもよい。さらには、流加培地の流加が多段階で行われる場合、各々の流加培地の組成は同じであってもよく、異なっていてもよい。
【0136】
培養は、発酵温度20〜45℃、特に好ましくは33〜42℃で通気培養を行うことが好ましい。ここで酸素濃度は、5〜50%に、望ましくは10%程度に調節して行う。また、pHを5〜9に制御し、通気培養を行うことが好ましい。培養中にpHが下がる場合には、例えば、炭酸カルシウムを加えるか、アンモニアガス、アンモニア水等のアルカリで中和することができる。このような条件下で、好ましくは10時間〜120時間程度培養することにより、培養液中に著量のL-アミノ酸が蓄積される。
【0137】
本発明においては、L-アミノ酸蓄積を一定以上に保つために、細菌の培養を種培養と本培養とに分けて行ってもよく、種培養をフラスコ等を用いたしんとう培養、又は回分培養で行い、本培養を流加培養、又は連続培養で行ってもよく、種培養、本培養ともに回分培養で行ってもよい。
【0138】
本発明において、流加培養あるいは、連続培養を行う際には、一時的に脂肪酸もしくはアルコール、またはその他の炭素源の流加が停止するように間欠的に流加培地を流加してもよい。また、流加を行う時間の最大で30%以下、望ましくは20%以下、特に望ましくは10%以下で流加培地の供給を停止することが好ましい。流加培養液を間欠的に流加させる場合には、流加培地を一定時間添加し、2回目以降の添加はある添加期に先行する添加停止期において発酵培地中の炭素源が枯渇するときのpH上昇または溶存酸素濃度の上昇がコンピューターで検出されるときに開始するように制御を行い、培養槽内の基質濃度を常に自動的に低レベルに維持してもよい(米国特許5,912,113号明細書)。
【0139】
流加培養に用いられる流加培地は、脂肪酸又はアルコールとその他の炭素源及び増殖促進効果を持つ栄養素(増殖促進因子)を含む培地が好ましく、発酵培地中の脂肪酸濃度が一定以下になるように制御してもよい。
流加培地に加えるその他の炭素源としては、グルコース、スクロース、フルクトースが好ましく、増殖促進因子としては、窒素源、リン酸、アミノ酸等が好ましい。窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、酢酸アンモニウム、ウレア等のアンモニウム塩または硝酸塩等を使用することができる。またリン酸源としては、リン酸2水素カリウム、リン酸水素2カリウムが使用でき、アミノ酸としては、栄養要求性変異株を使用する場合には要求される栄養素を補添することが好ましい。また、流加培地は1種でもよく、2種以上の培地を混合してもよい。2種以上の流加培地を用いる場合、それらの培地は混合して1つのフィード缶により流加させてもよいし、複数のフィード缶で流加させてもよい。
【0140】
本発明で連続培養法を用いる場合には、引き抜きは流加と同時に行ってもよいし、一部引き抜いたあとで流加を行ってもよい。また培養液をL-アミノ酸と細胞を含んだまま引き抜いて、細胞だけ発酵槽に戻す菌体を再利用する連続培養法でもよい(フランス特許2669935号明細書参照)。連続的あるいは間欠的に栄養源を流加する方法は流加培養と同様の方法が用いられる。
【0141】
菌体を再利用する連続培養法とは、予定したアミノ酸濃度に達したときに、発酵培地を間欠的にあるいは連続して引き抜き、L-アミノ酸のみを取り出し、菌体を含むろ過残留物を発酵槽中に再循環させる方法であり、例えばフランス特許2669935号明細書を参照にして実施することができる。
【0142】
ここで、培養液を間欠的に引き抜く場合には、予定したL-アミノ酸濃度に到達したときに、L-アミノ酸を一部引き抜いて、新たに培地を流加して培養を行うとよい。また、添加する培地の量は、最終的に引き抜く前の培養液量と同量になるように設定することが好ましい。ここで同量とは、引き抜く前の培養液量と93〜107%の程度の量を意味する。
【0143】
培養液を連続的に引き抜く場合には、栄養培地を流加させると同時に、あるいは流加させたあとに引き抜きを開始することが望ましく、例えば引き抜き開始時間としては流加を始めてから5時間以内、望ましくは3時間以内、さらに望ましくは1時間以内である。また引き抜く培養液量としては、流加させる量と同量で引き抜くことが好ましい。
【0144】
また、L−リジン等の塩基性アミノ酸を製造する際には、培養中のpHが6.5〜9.0、培養終了時の培地のpHが7.2〜9.0となるように制御し、培地中の重炭酸イオン及び/又は炭酸イオンが少なくとも20mM以上存在する培養期があるようにし、前記重炭酸イオン及び/又は炭酸イオンを塩基性アミノ酸のカウンタイオンとする方法で発酵し、目的の塩基性アミノ酸を回収する方法で製造を行ってもよい(特開2002-65287、US2002-0025564A、EP 1813677A)。
【0145】
塩基性アミノ酸を生産する能力を有する微生物を培地中で好気培養するに際して、炭酸イオンもしくは重炭酸イオン又はこれらの両方を、塩基性アミノ酸の主なカウンタイオンとして利用することができる。塩基性アミノ酸のカウンタイオンとして必要な量の重炭酸イオン及び/又は炭酸イオンを培地中に存在させる方法としては、培養中の培地のpHが6.5〜9.0、好ましくは6.5〜8.0、培養終了時の培地のpHが7.2〜9.0となるように制御し、さらに、発酵中の発酵槽内圧力が正となるように制御するか、又は、炭酸ガスもしくは炭酸ガスを含む混合ガスを培地に供給することが知られている(特開2002-65287、米国特許出願公開第20020025564号、EP1813677A)。
【0146】
本発明においては、発酵中の発酵槽内の圧力が正となるように制御すること、及び、炭酸ガスもしくは炭酸ガスを含む混合ガスを培地に供給することの両方を行ってもよい。いずれの場合も、培地中の重炭酸イオン及び/又は炭酸イオンが、好ましくは20mM以上、より好ましくは30mM以上、特に好ましくは40mM以上存在する培養期があるようにすることが好ましい。発酵槽内圧力、炭酸ガス又は炭酸ガスを含む混合ガスの供給量、又は制限された給気量は、例えば培地中の重炭酸イオン又は炭酸イオンを測定することや、pHやアンモニア濃度を測定することによって、決定することができる。
【0147】
上記態様においては、培養中の培地のpHが6.0〜9.0、好ましくは6.5〜8.0、培養終了時の培地のpHが7.2〜9.0となるように制御する。上記態様によれば、従来の方法に比べて、カウンタイオンとして必要な量の重炭酸イオン及び/又は炭酸イオンを培地中に存在させるための培地のpHを低く抑えることが可能となる。アンモニアでpHを制御する場合、pHを高めるためにアンモニアが供給され、塩基性アミノ酸のN源となり得る。培地に含まれる塩基性アミノ酸以外のカチオンとしては、培地成分由来のK、Na、Mg、Ca等が挙げられる。これらは、好ましくは総カチオンの50%以下であることが好ましい。
【0148】
また、発酵中の発酵槽内圧力が正となるようにするには、例えば、給気圧を排気圧より高くすればよい。発酵槽内圧力を正にすることによって、発酵により生成する炭酸ガスが培養液に溶解し、重炭酸イオン又は炭酸イオンを生じ、これらは塩基性アミノ酸のカウンタイオンとなり得る。発酵槽内圧力として具体的には、ゲージ圧(大気圧に対する差圧)で、0.03〜0.2MPa、好ましくは0.05〜0.15MPa、さらに好ましくは0.1〜0.3MPaが挙げられる。また、培養液に炭酸ガス、又は炭酸ガスを含む混合ガスを供給することによって、培養液に炭酸ガスを溶解させてもよい。さらには、培養液に炭酸ガス又は炭酸ガスを含む混合ガスを供給しつつ、発酵槽内圧力が正となるように調節してもよい。
【0149】
発酵槽内圧力を正に調節するには、例えば、給気圧を排気圧よりも高くするように設定すればよい。また、培養液に炭酸ガスを供給する場合は、例えば、純炭酸ガス、又は炭酸ガスを5体積%以上含む混合ガスを吹き込めばよい。
【0150】
尚、培地に重炭酸イオン及び/又は炭酸イオンを溶解させる上記の方法は、単独でもよいし、複数を組み合わせてもよい。
【0151】
従来法では、通常、生成する塩基牲アミノ酸のカウンタアニオンとすべく、十分量の硫酸アンモニウムや塩化アンモニウムが、又、栄養成分として蛋白等の硫酸分解物もしくは塩酸分解物が培地に添加され、これらから与えられる硫酸イオン、塩化物イオンが培地に含まれる。従って、弱酸性である炭酸イオン濃度は培養中極めて低く、ppm単位である。上記態様では、これら硫酸イオン、塩化物イオンを減じ、微生物が発酵中に放出する炭酸ガスを上記発酵環境にて培地中に溶解せしめ、カウンタイオンとすることに特徴がある。したがって、上記態様においては、硫酸イオンや塩化物イオンを生育に必要な量以上培地に添加する必要はない。好ましくは、培養当初は硫酸アンモニウム等を培地に適当量フィードし、培養途中でフィードを止める。あるいは、培地中の炭酸イオン又は重炭酸イオンの溶存量とのバランスを保ちつつ、硫酸アンモニウム等をフィードしてもよい。また、塩基性アミノ酸の窒素源として、アンモニアを培地にフィードしてもよい。アンモニアは、単独で、又は他の気体とともに培地に供給することができる。
【0152】
培地に含まれる重炭酸イオン及び/又は炭酸イオン以外の他のアニオンの濃度は、微生物の生育に必要な量であれば、低いことが好ましい。このようなアニオンには、塩化物イオン、硫酸イオン、リン酸イオン、イオン化した有機酸、及び水酸化物イオン等が挙げられる。これらの他のイオンのモル濃度の合計は、好ましくは通常は900mM以下、より好ましくは700mM以下、特により好ましくは500mM以下、さらに好ましくは300mM以下、特に好ましくは200mM以下である。
【0153】
上記態様においては、硫酸イオン、及び/又は、塩化物イオンの使用量を削減することが目的の一つであり、培地に含まれる硫酸イオンもしくは塩化物イオン、又はこれらの合計は、通常、700mM以下、好ましくは500mM以下、より好ましくは300mM以下、さらに好ましくは200mM以下、特に好ましくは100mM以下である。
【0154】
通常は、塩基性アミノ酸のカウンタイオン源として培地に硫酸アンモニウムを添加すると、硫酸イオンによって培養液中の炭酸ガスが放出してしまう。それに対して、上記態様においては、過剰量の硫酸アンモニウムを培地に添加する必要がないので、炭酸ガスを発酵液中に容易に溶解させることができる。
【0155】
また、上記態様においては、「塩基性アミノ酸の生産を阻害しない」程度に培地中の総アンモニア濃度を制御することが好ましい。そのような条件としては、例えば、最適な条件において塩基性アミノ酸を生産する場合の収率及び/又は生産性に比べて、好ましくは50%以上、より好ましくは70%以上、特に好ましくは90%以上の収率及び/又は生産性が得られる条件が含まれる。具体的には、培地中の総アンモニア濃度としては、好ましくは300mM以下、より好ましくは250mM、特に好ましくは200mM以下の濃度が挙げられる。アンモニアの解離度はpHが高くなると低下する。解離していないアンモニアは、アンモニウムイオンよりも菌に対して毒性が強い。そのため、総アンモニア濃度の上限は、培養液のpHにも依存する。すなわち、培養液のpHが高いほど、許容される総アンモニア濃度は低くなる。したがって、前記「塩基性アミノ酸の生産を阻害しない」総アンモニア濃度は、pH毎に設定することが好ましい。しかし、培養中の最も高いpHにおいて許容される総アンモニア濃度範囲を、培養期間を通じての総アンモニア濃度の上限値範囲としてもよい。
【0156】
一方、微生物の生育及び塩基性物質の生産に必要な窒素源としての総アンモニア濃度としては、培養中にアンモニアが継続して枯渇しない窒素源が不足することにより微生物による目的物質の生産性を低下させない限り特に制限されず、適宜設定することができる。例えば、培養中にアンモニア濃度を経時的に測定し、培地中のアンモニアが枯渇したら少量のアンモニアを培地に添加してもよい。アンモニアを添加したときの濃度としては、特に制限されないが、例えば、総アンモニア濃度として好ましくは1mM以上、より好ましくは10mM以上、特に好ましくは20mM以上の濃度が挙げられる。
【0157】
発酵液からのL−アミノ酸の回収は通常イオン交換樹脂法(Nagai,H.et al., Separation Science and Technology, 39(16),3691-3710)、沈殿法、膜分離法(特開平9-164323号、特開平9-173792号)、晶析法(WO2008/078448、WO2008/078646)、その他の公知の方法を組み合わせることにより実施できる。なお、菌体内にL−アミノ酸が蓄積する場合には、例えば菌体を超音波などにより破砕し、遠心分離によって菌体を除去して得られる上清からイオン交換樹脂法などによって、L−アミノ酸を回収することができる。
【0158】
尚、回収されるL−アミノ酸は、L−アミノ酸以外に細菌菌体、培地成分、水分、及び細菌の代謝副産物を含んでいてもよい。採取されたL−アミノ酸の純度は、50%以上、好ましくは85%以上、特に好ましくは95%以上である (JP1214636B, USP 5,431,933, 4,956,471, 4,777,051, 4946654, 5,840,358, 6,238,714, US2005/0025878))。
【0159】
また、L−アミノ酸が培地中に析出する場合は、遠心分離又は濾過等により回収することができる。また、培地中に析出したL−アミノ酸は、培地中に溶解しているL−アミノ酸を晶析した後に、併せて単離してもよい。
【実施例】
【0160】
以下、実施例により本発明をさらに具体的に説明する。
〔実施例1〕脂肪酸の資化性が向上した菌株の取得
エシェリヒア・コリの野生株K12株由来のMG1655 (ATCC 47076)を親株として、脂肪酸資化性の向上した菌株の取得を試みた。MG1655は、アメリカン・タイプ・カルチャー・コレクション(住所 12301 Parklawn Drive, Rockville, Maryland 20852P.O. Box 1549, Manassas, VA 20108, United States of America)より入手することができる。
【0161】
MG1655株を、M9オレイン酸ナトリウム寒天培地(HClを用いてpH7.0に調製)上で24時間静置培養した。生育した細胞を掻き取り、0.85% NaCl水溶液にけん濁して、M9オレイン酸ナトリウム試験管用液体培地5mLを入れたL字試験管に、波長600nmの濁度が0.00625となるように植菌した。恒温振とう培養装置TN-2612(アドバンテック社製)を用いて、37℃、70rpmの条件で20時間培養を行った後、M9オレイン酸ナトリウム試験管用液体培地5mLを入れたL字試験管に培養液10μLを植え継いだ。同様の植え継ぎ培養を22回繰り返し、計445時間培養を行なった後、M9オレイン酸ナトリウム寒天培地上で24時間静置培養してシングルコロニーを採取し、Fitness1株と命名した。
【0162】
上記Fitness1株を、M9オレイン酸ナトリウム試験管用液体培地5mLにて終OD600がおよそ0.6となるまで37℃にて培養した後、培養液と等量の40%グリセロール溶液を加えて攪拌した後、適当量ずつ分注し、−80℃で保存した。これを、Fitness1株のグリセロールストックと呼ぶ。
上記培地の組成を以下に示す。濃度単位は全て終濃度を示す。
【0163】
〔M9オレイン酸ナトリウム寒天培地組成〕
オレイン酸ナトリウム(純正化学社製) 2g/L
Tween 80 *)(ナカライテスク社製) 0.5%(v/v)
Na2HPO4 6g/L
KH2PO4 3g/L
NaCl 0.5g/L
NH4Cl 1g/L
MgSO4・7H2O 0.246g/L
チアミン 0.5mg/L
寒天 15g/L
*):ポリ(オキシエチレン)ソルビタンモノオレイン酸エステル
【0164】
〔M9オレイン酸ナトリウム試験管用液体培地組成〕
オレイン酸ナトリウム(純正化学社製) 1g/L
Tween 80(ナカライテスク社製) 0.5%(v/v)
Na2HPO4 6g/L
KH2PO4 3g/L
NaCl 0.5g/L
NH4Cl 1g/L
MgSO4・7H2O 0.246g/L
チアミン 0.5mg/L
【0165】
〔実施例2〕脂肪酸の資化性が向上した微生物の培養
Fitness1株のグリセロールストックを、M9オレイン酸ナトリウム寒天培地(HClを用いてpH7.0に調製)上で24時間静置培養した。生育した細胞を掻き取り、0.85% NaCl水溶液にけん濁して、M9オレイン酸ナトリウム試験管用液体培地5mLを入れたL字試験管に、波長600nmの濁度が0.005となるように植菌して恒温振とう培養装置TN-2612(アドバンテック社製)を用いて温度37℃、70rpmの条件で20時間培養したところ、同様の方法で培養したMG1655と比較して有意な生育の向上を示した(図1)。
【0166】
また、Fitness1株のグリセロールストックを、M9オレイン酸ナトリウム寒天培地(HClを用いてpH7.0に調製)上で24時間静置培養し、寒天培地上の細胞を掻き取り、0.85% NaCl水溶液にけん濁して、M9特級オレイン酸フラスコ用液体培地20mLを入れた500mL坂口フラスコに、波長600nmの濁度が0.01となるように植菌した。レシプロ型培養装置で攪拌速度200rpm、37℃の条件で47時間培養した。培養途中の培地を採取し、等量の10% Tween80水溶液と混合した後、波長600nmの濁度と、培養液中のオレイン酸濃度をHashimotoら(Hashimoto, K. et al. 1996. Biosci. Biotechnol. Biochem. 70:22-30)に記載の方法でガスクロマトグラフィー分析により、測定した。その結果、Fitness1株は同様の方法で培養したMG1655と比較して、有意な生育の向上と脂肪酸消費速度の向上を示した(図2、図3)。
上記培地の組成を以下に示す。濃度単位は全て終濃度を示す。
【0167】
〔M9特級オレイン酸フラスコ用液体培地組成〕
オレイン酸(ナカライテスク社製特級) 2g/L
Tween 80(ナカライテスク社製) 0.5%(v/v)
Na2HPO4 6g/L
KH2PO4 3g/L
NaCl 0.5g/L
NH4Cl 1g/L
MgSO4・7H2O 0.246g/L
チアミン 0.5mg/L
【0168】
〔実施例3〕Fitness1株が持つ変異の同定
Herringら(Herring, C.D. et al., 2006, Nat. Genet., 38:1406-1412)に記載されたCGS法を用いて、Fitness1株が持つ染色体上の変異点を探索した。その結果、Fitness1株では、MG1655株のrpsA遺伝子の塩基配列(配列番号1)における628位のGがTに変異していることが明らかとなった。
【0169】
この変異によって、MG1655株のrpsA遺伝子によってコードされるRpsAタンパク質のアミノ酸配列(配列番号2)において、210位のアスパラギン酸残基がチロシン残基に置換されていることが明らかとなった。この変異をRpsA(D210Y)変異と命名した。
Fitness1株が持つ変異型rpsA遺伝子の塩基配列、及び同遺伝子がコードする変異型RpsAのアミノ酸配列を、配列番号3及び4に示す。
【0170】
種々の生物のrpsA遺伝子ホモログのアミノ酸配列の210位近傍の配列を比較したところ、210位のアスパラギン酸残基は原核生物から真核生物に至るまで種間で保存性が高いことが判明した。rpsA遺伝子はエシェリヒア・コリなど腸内細菌群では必須遺伝子とされており、このような遺伝子の保存性の高いアミノ酸残基の適応的変異が大きな生育の改善をもたらすことを予測することは困難であった。また、変異型RpsAを保持することによる効果は、腸内細菌群のみならず、幅広い属種でも期待される。
【0171】
〔実施例4〕エシェリヒア・コリへのRpsA(D210Y)変異の導入
野生型rpsA遺伝子を持つエシェリヒア・コリ菌株に、RpsA(D210Y)変異を導入した。
まず、染色体上でrpsA近傍に位置するFitness1株染色体上のycaI遺伝子を欠損した菌株を構築した。pMW118-attL-Cm-attR (特開2005-58227号公報(WO2005/010175)に記載)プラスミドを鋳型として、λファージのアタッチメントサイトの配列attLとattRの両端に対応する配列をプライマーの3’末端に、ycaI遺伝子の一部に対応するプライマーの5’末端に有する配列番号7及び8に示す合成オリゴヌクレオチドをプライマーに用いてPCRを行い、λ-red法(米国特許出願公開第2006/0160191号公報、Datsenko, K. A, and Wanner, B. L. Proc. Natl. Acad. Sci. U S A. 97:6640-6645 (2000))を用いて、ycaI遺伝子を欠損したFitness1ΔycaI::att-Cm株を構築した。pMW118-attL-Cm-attRは、pMW118(宝バイオ社製)にλファージのアタッチメントサイトであるattL及びattR遺伝子と抗生物質耐性遺伝子であるcat遺伝子を挿入したプラスミドであり、attL-cat-attRの順で挿入されている。
【0172】
Fitness1ΔycaI::att-Cm株から、常法に従いP1ライセートを取得し、MG1655に形質導入を行なって、RpsA(D210Y)変異を染色体上に持つMG1655ΔycaI::att-Cm,rpsA(D210Y)株を構築した。また、Fitness1ΔycaI::att-Cm株の構築に用いたものと同じpMW118(attL-Cm-attR) (特開2005−58227号公報(特許文献2)に記載)を鋳型とし、配列番号7及び8合成オリゴヌクレオチドをプライマーに用いてPCRを行い、同様のλ-red法でMG1655の染色体上のycaI遺伝子を欠損した菌株であるMG1655ΔycaI::att-Cm株を構築した。実施例1と同様にして、同株のグリセロールストックを作製した。
【0173】
尚、MG1655株のゲノムDNAを鋳型として、配列番号5および6に示すような合成オリゴヌクレオチドをプライマーとし、PCR法によってRpsA(D210Y)変異を含む遺伝子断片を構築し、クロスオーバーPCR法、λ-red法、相同組み換え法などを適宜組み合わせて、RpsA(D210Y)変異をエシェリヒア・コリに導入することができる。
【0174】
〔実施例5〕脂肪酸を炭素源とする培地での、RpsA(D210Y)変異による生育向上効果
MG1655ΔycaI::att-Cm,rpsA(D210Y)株のグリセロールストックを、M9オレイン酸ナトリウム寒天培地(HClを用いてpH7.0に調製)上で24時間静置培養した。生育した細胞を掻き取り、0.85% NaCl水溶液にけん濁して、M9オレイン酸ナトリウム試験管用液体培地5mLを入れたL字試験管に波長600nmの濁度が0.005となるように植菌した。恒温振とう培養装置TN-2612(アドバンテック社製)を用いて37℃、70rpmの条件で20時間培養した。その結果、同様の方法で培養したMG1655またはMG1655ΔycaI::att-Cm株と比較して有意な生育の向上を示した(図4)。
【0175】
〔実施例6〕グリセロールを炭素源とする培地での、RpsA(D210Y)変異の生育向上効果
MG1655ΔycaI::att-Cm,rpsA(D210Y)株のグリセロールストックを、M9オレイン酸ナトリウム寒天培地(HClを用いてpH7.0に調製)上で24時間静置培養した。生育した細胞を掻き取り、0.85% NaCl水溶液にけん濁して、M9グリセロール試験管用液体培地5mLを入れたL字試験管に波長600nmの濁度が0.005となるように植菌した。恒温振とう培養装置TN-2612(アドバンテック社製)を用いて37℃、70rpmの条件で20時間培養したとた。その結果、同様の方法で培養したMG1655またはMG1655ΔycaI::att-Cm株と比較して有意な生育の向上を示した(図5)。
上記培地の組成を以下に示す。濃度単位は全て終濃度を示す。
【0176】
〔M9グリセロール試験管用液体培地組成〕
グリセロール(純正化学社製特級) 1g/L
Tween 80(ナカライテスク社製) 0.5%(v/v)
Na2HPO4 6g/L
KH2PO4 3g/L
NaCl 0.5g/L
NH4Cl 1g/L
MgSO4・7H2O 0.246g/L
チアミン 0.5mg/L
【0177】
〔実施例7〕L−リジン生産菌WC196LC/pCABD2へのRpsA(D210Y)変異の導入
Fitness1ΔycaI::att-Cm株から、常法に従いP1ライセートを取得し、L−リジン生産菌WC196LC/pCABD2株(米国特許出願公開第2006/0160191号公報)を宿主として、P1形質導入法を用いてWC196ΔLCΔycaI::att-Cm,rpsA(D210Y)/pCABD2株を構築した。WC196LC(WCΔcadAΔldcC)株(FERM BP-11027)は、エシェリヒア・コリWC196のリジンデカルボキシラーゼ遺伝子cadA及びldcCを、Red-driven integration法(Datsenko, K. A. and Wanner, B. L., 2000. Proc. Natl. Acad. Sci. USA. 97: 6640-6645)とλファージ由来の切り出しシステム(Cho, E. H., Gumport, R. I., Gardner, J. F. J. Bacteriol. 184: 5200-5203 (2002))とを組合わせた方法(WO2005/010175号参照)により、破壊した株である。この株に、pCABD2を導入したのがWC196LC/pCABD2株である。pCABD2は、L−リジンによるフィードバック阻害が解除された変異を有するE. coli由来のジヒドロジピコリン酸合成酵素(DDPS)をコードする変異型dapA遺伝子と、L−リジンによるフィードバック阻害が解除された変異を有するE. coli由来のアスパルトキナーゼIIIをコードする変異型lysC遺伝子と、E. coli由来のジヒドロジピコリン酸レダクターゼをコードするdapB遺伝子と、ブレビバクテリウム・ラクトファーメンタム由来ジアミノピメリン酸デヒドロゲナーゼをコードするddh遺伝子を含んでいる。
【0178】
WC196LCΔycaI::att-Cm,rpsA(D210Y)/pCABD2株を20mg/Lのストレプトマイシンを含むL培地にて、終OD600がおよそ0.6となるまで37℃で培養した。実施例1と同様にして、グリセロールストックを作製した。
【0179】
〔実施例8〕RpsA(D210Y)変異を導入したL−リジン生産菌の脂肪酸またはグリセロールを炭素源とするL−リジン生産能の評価
実施例7で得られたWC196LCΔycaI::att-Cm,rpsA(D210Y)/pCABD2株のグリセロールストックを融解し、その100μLを、20 mg/Lのストレプトマイシンを含むLプレートに均一に塗布し、37℃にて24時間静置培養した。プレートのおよそ1/4量の菌体を、0.5mLの生理食塩水にけん濁し、分光光度計U-2000(日立社製)で波長600nmの濁度を測定した。得られた菌を含むけん濁液を、500 mL容バッフル付三角フラスコの、20 mg/Lのストレプトマイシンを含む発酵培地(下記に示す)の40 mLに、波長600nmの濁度が0.2になる液量で接種し、ロータリー振とう培養装置InnOva 4430 (New Brunswick Scientific社製)で回転攪拌数200rpm、37℃において48時間培養した。
【0180】
本培養における炭素源としては、オレイン酸ナトリウム、またはグリセロールを用い、乳化促進剤としてTween 80を終濃度0.5%(v/v)となるように添加したものを用いた。総炭素源量は10g/Lとした。エシェリヒア・コリがTween80を資化できないことは、M9最小培地にTween80を添加した培地を用いて別途確認した。
【0181】
上記の条件で、48時間培養を行い、培地中に蓄積したL−リジンの量をバイオテックアナライザーAS310(サクラ精機社製)を用いて測定した。また、培地中に添加した炭素源を全て消費したことを、オレイン酸についてはガスクロマトグラフィGC-2014(Shimadsu社製)、グリセロールについてはバイオテックアナライザーBF-5(王子計測機器)を用いて確認した。さらに、培養終了直後にTween80溶液を終濃度1.0%(v/v)となるように添加して、適宜希釈して分光光度計U-2000(日立社製)で波長600nmの濁度を測定することにより、培養終了時の菌体量を測定した。
WC196LC/pCABD2株およびWC196LCΔycaI::att-Cm/pCABD2株についても、同様の培養を行った。
【0182】
本培養に用いたオレイン酸を炭素源とする発酵培地の組成を以下に示す。単位g/Lおよび%(volume/volume換算)は、全て終濃度を示す。
【0183】
オレイン酸ナトリウム(純正化学社製 一級品) 10 g/L
Tween 80 0.5 %
MgSO4・7H2O 1 g/L
PIPES 20g/L
(NH4)2SO4 16 g/L
KH2PO4 1 g/L
FeSO4・7H2O 0.01 g/L
MnSO4・7H2O 0.082 g/L
Yeast Extract(Difco社製) 2 g/L
【0184】
オレイン酸ナトリウムは、HClでpH7.5に調整し、115℃で10分オートクレーブした。
Tween 80は、Nalgene 0.45μmフィルター(Nalgene社製)でフィルター滅菌した。
MgSO4・7H2Oは、115℃で10分オートクレーブした。
PIPESは、NaOHでpH7.5に調整し、115℃で10分オートクレーブした。
上記以外の成分は、それらを混合した後 KOHでpH7.5に調整し、115℃で10分オートクレーブした。
上記のように各成分を5つの区に分けて別殺菌した後、それらを混合した。
【0185】
本培養に用いたグリセロールを炭素源とする発酵培地の組成を以下に示す。単位g/Lおよび%(volume/volume換算)は、全て終濃度を示す。
【0186】
グリセロール(純正化学社製特級) 10 g/L
Tween 80 0.5 %
MgSO4・7H2O 1 g/L
PIPES (pH7.5) 20g/L
(NH4)2SO4 16 g/L
KH2PO4 1 g/L
FeSO4・7H2O 0.01 g/L
MnSO4・7H2O 0.082 g/L
Yeast Extract(Difco社製) 2 g/L
【0187】
グリセロールは、115℃で10分オートクレーブを行なった。
Tween 80は、Nalgene 0.45μmフィルター(Nalgene社製)でフィルター滅菌した。
MgSO4・7H2Oは、115℃で10分オートクレーブした。
PIPESは、NaOHでpH7.5に調整し、115℃で10分オートクレーブした。
上記以外の成分は、それらを混合した後 KOHでpH7.5に調整し、115℃で10分オートクレーブした。
上記のように各成分を5つの区に分けて別殺菌した後、それらを混合した。
【0188】
本培養の結果を表1に示す。Lys(g/L)は、フラスコに蓄積したL−リジン量を示す。RpsA(D210Y)変異導入株(WC196LCΔycaI::att-Cm,rpsA(D210Y)/pCABD2株)は、対照株(WC196LC/pCABD2株およびWC196LCΔycaI::att-Cm/pCABD2株)と比較して、有意に高いL−リジン生産を示した。RpsA(D210Y)変異導入により、L−リジン生産能が向上することが示された。
【0189】
【表1】

【0190】
〔実施例9〕WC196LC株へのエタノール資化性の付与
L−リジン生産菌にエタノール資化性を付与するため、変異型アルコールデヒドロゲナーゼ遺伝子(adhE*)の導入を行った。変異型アルコールデヒドロゲナーゼ遺伝子として、MG1655::PL-tacadhE*(WO2008/010565参照)由来の遺伝子を用いた。MG1655::PL-tacadhE*株は、クロラムフェニコール耐性遺伝子(cat)と、PL-tacプロモーターにより制御される変異型adhE遺伝子が連結したDNA断片を、エシェリヒア・コリMG1655株のゲノムに挿入して得た株である。この変異型adhE遺伝子は、好気的条件下で活性を維持するアルコールデヒドロゲナーゼをコードしている。
【0191】
cat遺伝子をゲノムから除去できるようにするため、cat遺伝子を、ラムダファージのアタッチメントサイトとテトラサイクリン耐性遺伝子を連結したDNA断片(att-tet)で置き換えた。cat遺伝子のatt-tet遺伝子への置き換えは、λ-red法を用いた。cat遺伝子をatt-tet遺伝子で置換えるためのプライマーとして、配列番号9及び10のプライマーを使用した。こうして、MG1655::PL-tacadhE*のcat遺伝子がatt-tet遺伝子で置き換えられたMG1655-att-tet-PL-tacadhE*株を得た。
【0192】
L−リジン生産菌にエタノール資化性を付与するため、MG1655-att-tet-PL-tacadhE*株から常法に従いP1ライセートを取得し、L−リジン生産菌WC196LC株を宿主としてP1形質導入法を用いて、WC196LC-att-tet-PL-tacadhE*株を得た。
次に、PL-tacプロモーター上流に導入されたatt-tet遺伝子を除去するために、ヘルパープラスミドpMW-intxis-ts(米国特許出願公開20060141586)を使用した。pMW-intxis-tsは、λファージのインテグラーゼ(Int)をコードする遺伝子、及びエクシジョナーゼ(Xis)をコードする遺伝子を搭載し、温度感受性の複製能を有するプラスミドである。
【0193】
上記で得られたWC196LC-att-tet-PL-tacadhE*株のコンピテントセルを常法に従って作製し、ヘルパープラスミドpMW-intxis-tsにて形質転換し、30℃で50 mg/Lのアンピシリンを含むLB寒天培地上にて平板培養し、アンピシリン耐性株を選択した。pMW-intxis-tsプラスミドを除去するために、形質転換株をLB寒天培地上、42℃で培養し、得られたコロニーのアンピシリン耐性、及びテトラサイクリン耐性を試験し、アンピシリン感受性株を取得した。こうして、att-tet及びpMW-intxis-tsが脱落しているPL-tacadhE*導入株を取得した。この株をWC196LC PL-tacadhE*株と名づけた。
【0194】
〔実施例10〕WC196LC PL-tacadhE*株へのRpsA(D210Y)変異およびL−リジン生産用プラスミド(pCABD2)の導入
Fitness1ΔycaI::att-Cm株から、常法に従いP1ライセートを取得し、L−リジン生産菌WC196LC PL-tacadhE*株を宿主としてP1形質導入法を用いて、WC196LC PL-tacadhE*ΔycaI::att-Cm,rpsA(D210Y)株を構築した。また、同様に、MG1655ΔycaI::att-Cm株からP1ライセートを取得し、WC196LC PL-tacadhE*株を宿主としてP1形質導入法を用いて、WC196LC PL-tacadhE*ΔycaI::att-Cm株を構築した。
【0195】
WC196LC PL-tacadhE*ΔycaI::att-Cm,rpsA(D210Y)株およびWC196LC PL-tacadhE*ΔycaI::att-Cm株を、pCABD2で常法に従い形質転換し、WC196 PL-tacadhE*ΔycaI::att-Cm,rpsA(D210Y)/pCABD2株、及び、WC196LC PL-tacadhE*ΔycaI::att-Cmを得た。これらの株を20mg/Lのストレプトマイシンを含むL培地にて終OD600がおよそ0.6となるまで37℃にて培養し、実施例1と同様にしてグリセロールストックを作製した。
【0196】
〔実施例11〕RpsA(D210Y)変異導入株のエタノールからのL−リジン生産能の評価
実施例10で得られた各株のグリセロールストックを融解し、各100μLを、20mg/Lのストレプトマイシンを含むLプレートに均一に塗布し、37℃にて15時間培養する。得られた菌体を0.85%の食塩水に懸濁し、初発OD600=0.25となるように、太試験管(内径18 mm)の、20mg/Lのストレプトマイシンを含む発酵培地の5 mLに接種し、往復振とう培養装置で、攪拌120rpmの条件下、37℃で培養する。
エタノールを炭素源とする発酵培地の組成を以下に示す。
【0197】
〔エタノール炭素源L−リジン発酵培地組成〕
エタノール 10 ml/L
(NH4)2SO4 24 g/L
K2HPO4 1.0 g/L
MgSO4・7H2O 1.0 g/L
FeSO4・7H2O 0.01 g/L
MnSO4・5H2O 0.01 g/L
イーストエキストラクト 2.0 g/L
CaCO3(日本薬局方) 30 g/L
上記成分を最終量が1Lとなるように溶解し、KOHでpH5.7に調整し、115℃で10分オートクレーブを行う。但し、エタノール、MgSO4・7H2O、及びCaCO3は別に殺菌する。エタノールはフィルターろ過により滅菌する。MgSO4・7H2Oは蒸留水に溶解してオートクレーブする。CaCO3は、180℃で2時間乾熱滅菌する。抗生物質として、20mg/Lのストレプトマイシンを添加する。
【0198】
16時間培養後、培地中に蓄積したL−リジンの量を公知の方法(サクラ精機 バイオテックアナライザーAS210)により測定する。
【技術分野】
【0001】
本発明は、細菌を用いたL−アミノ酸の製造法に関し、特に脂肪酸、又はグリセロール等のアルコールを原料とするL−アミノ酸の製造法、及び該方法に用いる細菌、並びに該細菌の構築に用いる遺伝子に関する。L−アミノ酸は、動物飼料用の添加物、健康食品の成分、又はアミノ酸輸液等として、産業上有用である。
【背景技術】
【0002】
発酵法によるL−アミノ酸の工業生産においては、炭素源として糖類、すなわち、グルコース、フラクトース、スクロース、廃糖蜜、澱粉加水分解物等が使用されている。また、炭素源として脂肪酸(特許文献1)やグリセロール(特許文献2)を用いたL−アミノ酸の製造法が開示されている。
【0003】
腸内細菌科に属するエシェリヒア属細菌については、適応的な進化を、特定の条件における植え継ぎ培養を行なうことによって誘発する方法が知られている(非特許文献1等)。また、適応的進化を誘発された微生物染色体中の、該進化に対応する変異は、非特許文献2に記載されたCGS法(非特許文献2)などの方法によって探索、同定することが可能である。
【0004】
RpsAタンパク質はリボゾームタンパク質S1とも呼ばれ、エシェリヒア・コリでは生育に不可欠なタンパク質である(非特許文献3)。RpsAタンパク質はリボゾームの30Sサブユニットを構成する最大のタンパク質であり、30Sサブユット中の16S rRNAとmRNAのSD配列との結合を制御していることが知られている(非特許文献4)。
【0005】
しかしながら、脂肪酸や、グリセロール等のアルコールの資化能や、これらの炭素源からのL−アミノ酸の生産能についての適応的進化に関する解析はなされておらず、細菌のRpsAタンパク質の変異とL−アミノ酸生産性との関連についても報告されていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】WO2009/142286
【特許文献2】米国特許出願公開第2009093029号
【非特許文献】
【0007】
【非特許文献1】Fong, S.S. et al., 2005, Genome Res., 15:1365-1372
【非特許文献2】Herring, C.D. et al., 2006, Nat. Genet., 38:1406-1412
【非特許文献3】Sorensen M.A. et al., 1998, J. Mol. Biol., 280(4):561-569
【非特許文献4】Komarova A.V. et al., 2002, RNA., 8(9):1137-1147
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、炭素源、特に脂肪酸、又はグリセロール等のアルコールを原料として、腸内細菌科に属する細菌を用いて効率よくL−アミノ酸を製造する方法、及び該方法に用いる細菌、並びに該細菌の構築に用いる遺伝子を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者は、上記課題を解決するために鋭意研究を行った結果、特定の変異を有するRpsAタンパク質を保持する細菌が、脂肪酸や、グリセロールのようなアルコールを含む培地で効率よくL−アミノ酸を生産することを見出し、本発明を完成するに至った。
すなわち、本発明は以下のとおりである。
【0010】
(1)L−アミノ酸生産能を有する腸内細菌科に属する細菌を、脂肪酸及びアルコールから選ばれる炭素源を含む培地で培養し、該培地からL−アミノ酸を採取する、L−アミノ酸の製造法であって、
前記細菌は、配列番号15又は16のアミノ酸配列を一部に有し、かつ、配列番号15の5位または配列番号16の5位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有する変異型RpsAタンパク質を保持することを特徴とする方法。
(2)前記細菌がエシェリヒア属、エンテロバクター属、又はパントエア属に属する細菌である、前記方法。
(3)前記細菌がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネスである、前記方法。
(4)前記RpsAタンパク質が腸内細菌科に属する細菌由来である、前記方法。
(5)前記RpsAタンパク質がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネス由来である、前記方法。
(6)前記他のアミノ酸残基がチロシン残基である、前記方法。
(7)前記RpsAタンパク質が、前記変異を有する以外は、配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントである、前記方法。
(8)前記変異型RpsAタンパク質を保持する細菌が、前記変異を有さないRpsAタンパク質を発現しないことを特徴とする、前記方法。
(9)前記変異型RpsAタンパク質を保持する細菌が、該RpsAタンパク質をコードする変異型rpsA遺伝子で、染色体上のrpsA遺伝子が置換されたことを特徴とする、前記方法。
(10)前記炭素源が脂肪酸である、前記方法。
(11)前記脂肪酸がオレイン酸である、前記方法。
(12)前記脂肪酸が油脂由来の脂肪酸の混合物である、前記方法。
(13)前記炭素源がアルコールである、前記方法。
(14)前記アルコールがグリセロールである、前記方法。
(15)前記アルコールがエタノールである、前記方法。
(16)前記炭素源が油脂を加水分解することによって得られる脂肪酸とグリセロールの混合物である、前記方法。
(17)配列番号15又は16のアミノ酸配列を一部に有し、かつ、配列番号15の5位または配列番号16の5位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有する変異型RpsAタンパク質を保持する、腸内細菌科に属する細菌。
(18)L−アミノ酸生産能を有する前記細菌。
(19)前記細菌がエシェリヒア属、エンテロバクター属、又はパントエア属に属する、前記細菌。
(20)前記細菌がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネスである、前記細菌。
(21)前記他のアミノ酸残基がチロシン残基である、前記細菌。
(22)前記RpsAタンパク質が、前記変異を有する以外は、配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントである、前記細菌。
(23)配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントであって、かつ、210位のアスパラギン酸残基が他のアミノ酸残基で置換されたアミノ酸配列を有するタンパク質をコードするDNA。
(24)前記他のアミノ酸残基がチロシン残基である、前記DNA。
(25)前記タンパク質は、210位のアスパラギン酸残基が他のアミノ酸残基で置換された以外は配列番号2、配列番号12、又は配列番号14のアミノ酸配列を有する、前記DNA。
(26)前記タンパク質は、腸内細菌科に属する細菌に保持させたときに、脂肪酸及びアルコールから選ばれる炭素源を含む培地での生育を改善する機能を有する、前記DNA。
【発明の効果】
【0011】
本発明により、脂肪酸、又はグリセロール等のアルコールを原料として、腸内細菌科に属する細菌を用いて効率よく、L−リジン等のL−アミノ酸を製造することができる。
【図面の簡単な説明】
【0012】
【図1】炭素源としてオレイン酸のみを使用した試験管培養におけるMG1655株及びFitness1株の生育を示す図。「CT」は培養時間、ODは培地の濁度を示す(以下の図でも同様)。
【図2】炭素源としてオレイン酸のみを使用したフラスコ培養におけるMG1655株及びFitness1株の生育を示す図。
【図3】MG1655株、及びFitness1株をオレイン酸のみを炭素源としてフラスコ培養したときの、オレイン酸の消費を示す図。
【図4】炭素源としてオレイン酸のみを使用した試験管培養におけるMG1655、Fitness1、MG1655ΔycaI::att-Cm、及びMG1655ΔycaI::att-Cm,rpsA(D210Y)の各株の生育を示す図。
【図5】炭素源としてグリセロールのみを使用した試験管培養におけるMG1655、Fitness1、MG1655ΔycaI::att-Cm、及びMG1655ΔycaI::att-Cm,rpsA(D210Y)の各株の生育を示す図。
【図6】エシェリヒア・コリMG1655株(配列番号2)、パントエア・アナナティスAJ13355株(配列番号12)、及びエンテロバクター・アエロゲネスAJ110637株株(配列番号14)のRpsAタンパク質のアミノ酸配列のアラインメントを示す図。最下段の「*」は完全に一致したアミノ酸を「:」は強い類似性のあるグループに属しているアミノ酸を、「.」は弱い類似性のあるグループに属しているアミノ酸を、空白は類似性のないアミノ酸をそれぞれ表す。アミノ酸の類似性についての強さの基準は,アミノ酸置換行列PAM250 MATRIX(David W.Mount Bioinfomatics:Sequence and Genome Analysis)を用いて、アミノ酸間のスコアが0.5より大きいか、0.5以下かで分けている。
【発明を実施するための形態】
【0013】
以下、本発明を詳細に説明する。
本発明の方法は、L−アミノ酸生産能を有する腸内細菌科に属する細菌を、脂肪酸及びアルコールから選ばれる炭素源を含む培地で培養し、該培地からL−アミノ酸を採取する、L−アミノ酸の製造法である。本発明においては、特定の変異を有するrpsA遺伝子(以下、「本発明のDNA」と記載することがある。)を保持する細菌を用いる。
以下、本発明のDNA、該DNAを保持する細菌、及び同細菌を用いたL−アミノ酸の製造法について説明する。
【0014】
<1>本発明のDNA
本発明のDNAは、配列番号15又は16のアミノ酸配列を一部に有し、かつ、配列番号15の5位または配列番号16の6位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を保有する変異型RpsAタンパク質をコードするDNAである。配列番号15又は16のアミノ酸配列は、RNAに結合する機能ドメインの一部であり、E.coliのS1タンパク質で6回繰り返されるS1RNA binding domainと定義された領域のうち、N末端から3番目に出てくるモチーフの一部である。S1 RNA binding domainはCell Volume 88, Issue 2, 24 January 1997, Pages 235-242に記載されている。
【0015】
RpsAタンパク質は、細菌における30Sリボゾームサブユニットを構成する最大のタンパク質であり、配列番号15または16の保存配列を有している。本発明における変異型RpsAタンパク質とは、保存配列として有する配列番号15、配列番号16に記載の配列中、5位のアスパラギン酸が他のアミノ酸に置換されたタンパク質を意味し、本変異を有さない野生型タンパク質とは区別される。
【0016】
前記変異を有さないRpsAタンパク質(以下「野生型RpsAタンパク質」と記載することがある。)としては、配列番号15または16の保存配列を有していればいずれでもよいが、これらの配列を有し、かつRpsAタンパク質としての機能が損なわれない限り、そのホモログや人為的改変体等、保存的変異を有するタンパク質であってもよい。RpsAタンパク質の機能としては、腸内細菌科に属する細菌に保持させたとき、又はその量を上昇させたときに、脂肪酸及びアルコールから選ばれる炭素源を含む培地での生育を改善する機能が挙げられる。野生型RpsAタンパク質としては、腸内細菌科に属する細菌、コリネ型細菌等のRpsAタンパク質が挙げられる。腸内細菌科に属する細菌については後述する。
【0017】
野生型RpsAタンパク質としては、具体的には、エシェリヒア・コリ、パントエア・アナナティス、エンテロバクター・アエロゲネスのRpsAタンパク質をコードする遺伝子が利用できる。
【0018】
エシェリヒア・コリのRpsAタンパク質は、GenBank Acession No. NP_415431に登録されており、そのアミノ酸配列を配列番号2に示す。また、該タンパク質をコードするrpsA遺伝子の塩基配列を配列番号1に示す。
【0019】
パントエア・アナナティスAJ13355株、及びエンテロバクター・アエロゲネスAJ110637株のRpsAタンパク質のアミノ酸配列を、それぞれ配列番号12及び14に示す。また、これらのタンパク質をコードする各々のrpsA遺伝子の塩基配列を、配列番号11及び13に示す。
【0020】
上記エシェリヒア・コリ、パントエア・アナナティス、及びエンテロバクター・アエロゲネスの各々の野生型RpsAタンパク質は、配列番号17の保存配列を有している。各RpsAタンパク質のアミノ酸配列のアラインメント(CLUSTAL W (1.83) multiple sequence alignmentで作成)を図6に示す。この配列を有するrpsAタンパク質は、野生型RpsAタンパク質の好ましい一形態である。
【0021】
また、野生型RpsAタンパク質は、RpsAタンパク質としての機能が損なわれない限り、上記アミノ酸配列を有するものの他、それらのホモログや人為的改変体等、又は保存的変異を有するタンパク質であってもよい。このようなホモログ、人為的改変体、又は保存的変異を有するタンパク質を、保存的バリアントと記載する。
【0022】
RpsAタンパク質の保存的バリアントとしては、例えば配列番号2、12、14、又は17のアミノ酸配列において、1若しくは数個の位置での1若しくは数個のアミノ酸の置換、欠失、挿入又は付加等を含む配列を有するタンパク質であってもよい。
【0023】
「1若しくは数個」とは、アミノ酸残基のタンパク質の立体構造における位置やアミノ酸残基の種類によっても異なるが、具体的には好ましくは1〜20個、より好ましくは1〜10個、さらに好ましくは1〜5個を意味する。また、保存的変異の代表的なものは、保存的置換である。保存的置換とは、置換部位が芳香族アミノ酸である場合には、Phe、Trp、Tyr間で、置換部位が疎水性アミノ酸である場合には、Leu、Ile、Val間で、極性アミノ酸である場合には、Gln、Asn間で、塩基性アミノ酸である場合には、Lys、Arg、His間で、酸性アミノ酸である場合には、Asp、Glu間で、ヒドロキシル基を持つアミノ酸である場合には、Ser、Thr間でお互いに置換する変異である。保存的置換とみなされる置換としては、具体的には、AlaからSer又はThrへの置換、ArgからGln、His又はLysへの置換、AsnからGlu、Gln、Lys、His又はAspへの置換、AspからAsn、Glu又はGlnへの置換、CysからSer又はAlaへの置換、GlnからAsn、Glu、Lys、His、Asp又はArgへの置換、GluからGly、Asn、Gln、Lys又はAspへの置換、GlyからProへの置換、HisからAsn、Lys、Gln、Arg又はTyrへの置換、IleからLeu、Met、Val又はPheへの置換、LeuからIle、Met、Val又はPheへの置換、LysからAsn、Glu、Gln、His又はArgへの置換、MetからIle、Leu、Val又はPheへの置換、PheからTrp、Tyr、Met、Ile又はLeuへの置換、SerからThr又はAlaへの置換、ThrからSer又はAlaへの置換、TrpからPhe又はTyrへの置換、TyrからHis、Phe又はTrpへの置換、及び、ValからMet、Ile又はLeuへの置換が挙げられる。また、上記のようなアミノ酸の置換、欠失、挿入、付加、または逆位等には、遺伝子が由来する微生物の個体差、種の違いに基づく場合などの天然に生じる変異(mutant又はvariant)によって生じるものも含まれる。このようなタンパク質は、例えば、部位特異的変異法によって、コードされるタンパク質の特定の部位のアミノ酸残基が置換、欠失、挿入または付加を含むように野生型rpsA遺伝子の塩基配列を改変することによって取得することができる。
【0024】
さらに、上記のような保存的変異を有するRpsAタンパク質は、アミノ酸配列全体に対して、例えば80%以上、好ましくは90%以上、より好ましくは95%以上、より好ましくは97%以上、より好ましくは98%以上、特に好ましくは99%以上の相同性を有し、かつ、野生型RpsAタンパク質と同等の機能を有するタンパク質であってもよい。
【0025】
野生型rpsA遺伝子は、上記のようなアミノ酸配列をコードするものであれば、エシェリヒア・コリ、パントエア・アナナティス、及びエンテロバクター・アエロゲネス等のrpsA遺伝子に限らず、任意のコドンをそれと等価のコドンに置換したものであってもよい。
【0026】
また、野生型rpsA遺伝子は、配列番号1、11、又は13の相補配列又はその相補配列から調製され得るプローブとストリンジェントな条件下でハイブリダイズし、配列番号2、12又は14のアミノ酸配列を有するRpsAタンパク質と同等の機能を有するタンパク質をコードするDNAであってもよい。ここで、「ストリンジェントな条件」とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。一例を示せば、相同性が高いDNA同士、例えば80%以上、好ましくは90%以上、より好ましくは95%以上、より好ましくは97%以上、より好ましくは98%以上、特に好ましくは99%以上の相同性を有するDNA同士がハイブリダイズし、それより相同性が低いDNA同士がハイブリダイズしない条件、あるいは通常のサザンハイブリダイゼーションの洗いの条件である60℃、1×SSC、0.1% SDS、好ましくは、0.1×SSC、0.1% SDS、さらに好ましくは、68℃、0.1×SSC、0.1% SDSに相当する塩濃度、温度で、1回、より好ましくは2〜3回洗浄する条件が挙げられる。
【0027】
プローブとしては、rpsA遺伝子の相補配列の一部を用いることもできる。そのようなプローブは、公知の遺伝子配列に基づいて作製したオリゴヌクレオチドをプライマーとし、これらの塩基配列を含むDNA断片を鋳型とするPCRによって作製することができる。例えば、プローブとして、300 bp程度の長さのDNA断片を用いる場合には、ハイブリダイゼーションの洗いの条件は、50℃、2×SSC、0.1% SDSが挙げられる。
【0028】
上記したRpsAタンパク質の保存的バリアント及びそれをコードするRpsA遺伝子に関する記載は、後述のL−アミノ酸生産菌について記載した他の遺伝子についても同様に適用される。
【0029】
上記変異型RpsAタンパク質をコードするDNA(「変異型rpsA遺伝子」とも記載する。)は、実施例に記載したように、エシェリヒア・コリをオレイン酸ナトリウム等の脂肪酸を炭素源とする培地で継体培養を繰返し、脂肪酸の資化能が向上した株からrpsA遺伝子を単離することによって取得することができるが、本発明により変異点が明らかになったので、化学合成、又は野生型rpsA遺伝子に210位のアスパラギン酸残基が他のアミノ酸残基で置換されるような変異を導入することによって、取得することができる。変異の導入は、変異を含むDNA断片で野生型rpsA遺伝子の相当する部分を置換えるか(カセット変異導入法)、部位特異的変異法、クロスオーバーPCR法等によって行うことができる。
【0030】
例えば、腸内細菌科に属する細菌、例えばMG1655株等の野生型エシェリヒア・コリのゲノムDNAを鋳型とし、配列番号5および6に示す合成オリゴヌクレオチドをプライマーとするPCRによって、210位のアスパラギン酸残基がチロシン残基で置換される変異(以下、「D210Y変異」とも記載する。)を持つrpsA遺伝子断片を取得することができる。前記プライマーのチロシン残基に相当する位置を他のアミノ酸残基のコドンに変更することによって、210位のアスパラギン酸残基を他のアミノ酸残基に置換することができる。
【0031】
尚、「210位のアスパラギン酸残基」とは、配列番号2における210位に相当するアスパラギン酸残基を意味する。すなわち、「210位」とは相対的な位置を示すものであって、例えば、210位よりもN末端側の一アミノ酸残基が欠失している場合は、N末端から209番目(開始コドンによってコードされるメチニオン残基を含む)のアミノ酸残基は「210位」である。また、210位よりもN末端側に一アミノ酸残基挿入されている場合は、N末端から211番目のアミノ酸残基が「210位」である。
【0032】
<2>本発明の細菌
本発明に用いる細菌は、L−アミノ酸生産能を有する腸内細菌科に属する細菌であって、かつ、変異型rpsA遺伝子を保持する細菌である。
L−アミノ酸生産能とは、本発明に用いる細菌(以下、「本発明の細菌」ともいう)を培地中で培養したときに、L−アミノ酸を生成し、培地中または菌体内に蓄積する能力をいう。L−アミノ酸の生産能を有する細菌としては、本来的にL−アミノ酸の生産能を有するものであってもよいが、後述の細菌を、変異法や組換えDNA技術を利用して、L−アミノ酸の生産能を有するように改変したものであってもよい。
【0033】
L−アミノ酸の種類は特に制限されないが、L−リジン、L−オルニチン、L−アルギニン、L−ヒスチジン、L−シトルリン等の塩基性アミノ酸、L−イソロイシン、L−アラニン、L−バリン、L−ロイシン、L−グリシン等の脂肪族アミノ酸、L−スレオニン、L−セリン等のヒドロキシモノアミノカルボン酸であるアミノ酸、L−プロリン等の環式アミノ酸、L−フェニルアラニン、L−チロシン、L−トリプトファン等の芳香族アミノ酸、L−システイン、L−シスチン、L−メチオニン等の含硫アミノ酸、L−グルタミン酸、L−アスパラギン酸等の酸性アミノ酸、L−グルタミン、L−アスパラギン等の側鎖にアミド基を持つアミノ酸が挙げられる。本発明の微生物は2種類以上のアミノ酸の生産能を有するものであってもよい。
【0034】
本発明においてL−アミノ酸とは、フリー体のL−アミノ酸とL−アミノ酸塩、たとえば硫酸塩、塩酸塩、炭酸塩を含む。
【0035】
本発明の細菌を得るために用いる腸内細菌科に属する細菌としては、特に限定されないが、エシェリヒア、エンテロバクター、エルビニア、クレブシエラ、パントエア、フォトルハブドゥス、プロビデンシア、サルモネラ、セラチア、シゲラ、モルガネラ、イェルシニア等の属に属する細菌を含む。特に、NCBI (National Center for Biotechnology Information)のデータベース(http://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?id=91347)で用いられている分類法により腸内細菌科に分類されている細菌が好ましい。
【0036】
エシェリヒア属に属する細菌とは、特に制限されないが、当該細菌が微生物学の専門家に知られている分類により、エシェリヒア属に分類されていることを意味する。例えば、ナイトハルトらの著書(Neidhardt, F. C. Ed. 1996. Escherichia coli and Salmonella: Cellular and Molecular Biology/Second Edition pp. 2477-2483. Table 1. American
Society for Microbiology Press, Washington, D.C.)に記述されている系統のものが含まれる。具体的には、プロトタイプの野生株K12株由来のエシェリヒア・コリ W3110
(ATCC 27325)、エシェリヒア・コリ MG1655 (ATCC 47076)等が挙げられる。
【0037】
これらの菌株は、例えばアメリカン・タイプ・カルチャー・コレクション(住所 P.O. Box 1549 Manassas, VA 20108, United States of America)より分譲を受けることが出来る。すなわち各菌株に対応する登録番号が付与されており、この登録番号を利用して分譲を受けることが出来る。各菌株に対応する登録番号は、アメリカン・タイプ・カルチャー・コレクションのカタログに記載されている。以下に記載する他のATCC菌株も同様である。
【0038】
パントエア属に属する細菌とは、当該細菌が微生物学の専門家に知られている分類により、パントエア属に分類されていることを意味する。エンテロバクター・アグロメランスのある種のものは、最近、16S rRNAの塩基配列分析等に基づき、パントエア・アグロメランス、パントエア・アナナティス、パントエア・ステワルティイその他に再分類された(Int. J. Syst. Bacteriol., 43, 162-173 (1993))。本発明において、パントエア属に属する細菌には、このようにパントエア属に再分類された細菌も含まれる。
【0039】
パントエア・アナナティスとしては、パントエア・アナナティスAJ13355株(FERM BP-6614)、AJ13356株(FERM BP-6615)、AJ13601株(FERM BP-7207)及びそれらの誘導体を用いることができる。これらの株は、分離された当時はエンテロバクター・アグロメランスと同定され、エンテロバクター・アグロメランスとして寄託されたが、上記のとおり、16S rRNAの塩基配列解析などにより、パントエア・アナナティスに再分類されている。
【0040】
エンテロバクター属細菌とは、特に制限されないが、当該細菌が微生物学の専門家に知られている分類により、エンテロバクター属に分類されていることを意味する。例えば、エンテロバクター・アグロメランス(Enterobacter agglomerans)、エンテロバクター・アエロゲネス(Enterobacter aerogenes)等が挙げられる。具体的には欧州特許出願公開EP952221号に例示された菌株を使用することが出来る。エンテロバクター属の代表的な株としては、エンテロバクター・アグロメランスATCC12287株やエンテロバクター・アエロゲネスATCC13048株、エンテロバクター・アエロゲネスNBRC12010株(Biotechonol Bioeng.2007 Mar 27; 98(2) 340-348)、エンテロバクター・アエロゲネスAJ110637(FERM BP-10955)株が挙げられる。
【0041】
<2−1>L−アミノ酸生産菌、及びL−アミノ酸生産能の付与又は増強
以下、腸内細菌科に属するL−アミノ酸生菌、並びに細菌にL−アミノ酸生産能を付与する方法、又は細菌のL−アミノ酸生産能を増強する方法について述べる。
【0042】
L−アミノ酸生産能を付与するには、栄養要求性変異株、L−アミノ酸のアナログ耐性株又は代謝制御変異株の取得や、L−アミノ酸の生合成系酵素の発現が増強された組換え株の創製等、従来、コリネ型細菌又はエシェリヒア属細菌等のアミノ酸生産菌の育種に採用されてきた方法を適用することができる(アミノ酸発酵、(株)学会出版センター、1986年5月30日初版発行、第77〜100頁参照)。ここで、L−アミノ酸生産菌の育種において、付与される栄養要求性、アナログ耐性、代謝制御変異等の性質は、単独でもよく、2種又は3種以上であってもよい。また、発現が増強されるL−アミノ酸生合成系酵素も、単独であっても、2種又は3種以上であってもよい。さらに、栄養要求性、アナログ耐性、代謝制御変異等の性質の付与と、生合成系酵素の増強が組み合わされてもよい。
【0043】
L−アミノ酸生産能を有する栄養要求性変異株、アナログ耐性株、又は代謝制御変異株を取得するには、親株又は野生株を通常の変異処理、すなわちX線や紫外線の照射、またはN−メチル−N’−ニトロ−N−ニトロソグアニジン等の変異剤処理などによって処理し、得られた変異株の中から、栄養要求性、アナログ耐性、又は代謝制御変異を示し、かつL−アミノ酸生産能を有するものを選択することによって得ることができる。
【0044】
また、L−アミノ酸生産能の付与又は増強は、遺伝子組換えによって、酵素活性を増強することによっても行うことが出来る。酵素活性の増強は、例えば、L−アミノ酸の生合成に関与する酵素をコードする遺伝子の発現が増強するように細菌を改変する方法を挙げることができる。遺伝子の発現を増強するための方法としては、遺伝子を含むDNA断片を、適当なプラスミド、例えば微生物内でプラスミドの複製増殖機能を司る遺伝子を少なくとも含むプラスミドベクターに導入した増幅プラスミドを導入すること、または、これらの遺伝子を染色体上で接合、転移等により多コピー化すること、またこれらの遺伝子のプロモーター領域に変異を導入することにより達成することもできる(国際公開パンフレットWO95/34672号参照)。
【0045】
上記増幅プラスミドまたは染色体上に目的遺伝子を導入する場合、これらの遺伝子を発現させるためのプロモーターは腸内細菌科において機能するものであればいかなるプロモーターであっても良く、用いる遺伝子自身のプロモーターであってもよいし、改変したものでもよい。コリネ型細菌で強力に機能するプロモーターを適宜選択することや、プロモーターの−35、−10領域をコンセンサス配列に近づけることによっても遺伝子の発現量の調節が可能である。以上のような、酵素遺伝子の発現を増強する方法は、WO00/18935号パンフレット、欧州特許出願公開1010755号明細書等に記載されている。
【0046】
以下、細菌にL−アミノ酸生産能を付与する方法、及びL−アミノ酸生産能が付与された細菌について例示する。
【0047】
L−リジン生産菌
エシェリヒア・コリのL−リジン生産菌の例としては、L−リジンアナログに耐性を有する変異株が挙げられる。L−リジンアナログはエシェリヒア・コリの生育を阻害するが、この阻害は、L−リジンが培地に共存するときには完全にまたは部分的に解除される。L−リジンアナログの例としては、オキサリジン、リジンヒドロキサメート、S−(2−アミノエチル)−L−システイン(AEC)、γ−メチルリジン、α−クロロカプロラクタムなどが挙げられるが、これらに限定されない。これらのリジンアナログに対して耐性を有する変異株は、エシェリヒア・コリを通常の人工変異処理に付すことによって得ることができる。L−リジンの生産に有用な細菌株の具体例としては、E. coli AJ11442 (FERM BP-1543, NRRL B-12185; 米国特許第4,346,170号参照)及びE. coli VL611が挙げられる。これらの微生物では、アスパルトキナーゼのL−リジンによるフィードバック阻害が解除されている。
【0048】
WC196株は、E. coliのL−リジン生産菌として使用できる。この菌株は、E. coli K-12に由来するW3110株から取得された株で、352位のスレオニンをイソロイシンに置換することによりL−リジンによるフィードバック阻害が解除されたアスパルトキナーゼIIIをコードする変異型lysC遺伝子(米国特許第5,661,012号)でW3110株の染色体上の野生型lysC遺伝子を置き換えた後、AEC耐性を付与することにより育種された(米国特許第5,827,698号)。同株は、Escherichia coli AJ13069と命名され、1994年12月6日、工業技術院生命工学工業技術研究所(現 独立行政法人 産業技術総合研究所 特許生物寄託センター、〒305-8566 日本国茨城県つくば市東1丁目1番地1 中央第6)に受託番号FERM P-14690として寄託され、1995年9月29日にブダペスト条約に基づく国際寄託に移管され、受託番号FERM BP-5252が付与されている(米国特許第5,827,698号)。
【0049】
L−リジン生産菌又はそれを誘導するための親株の例としては、L−リジン生合成系酵素をコードする遺伝子の1種以上の発現が増大している株も挙げられる。かかる遺伝子の例としては、ジヒドロジピコリン酸シンターゼ遺伝子(dapA)、アスパルトキナーゼ遺伝子(lysC)、ジヒドロジピコリン酸レダクターゼ遺伝子(dapB)、ジアミノピメリン酸デカルボキシラーゼ遺伝子(lysA)、ジアミノピメリン酸デヒドロゲナーゼ遺伝子(ddh) (米国特許第6,040,160号)、フォスフォエノールピルビン酸カルボキシラーゼ遺伝子(ppc)、アスパルテートセミアルデヒドデヒドロゲナーゼ遺伝子(asd)及びアスパルターゼ遺伝子(aspA) (EP 1253195 A)が挙げられるが、これらに限定されない。また、親株は、エネルギー効率に関与する遺伝子(cyo) (EP 1170376 A)、ニコチンアミドヌクレオチドトランスヒドロゲナーゼをコードする遺伝子(pntAB) (米国特許第5,830,716号)、L−リジン排出活性を有するタンパク質をコードするybjE遺伝子(WO2005/073390)、グルタミン酸デヒドロゲナーゼをコードする遺伝子(gdhA)(Gene23:199-209(1983))または、これらの任意の組み合わせの遺伝子の発現レベルが増大していてもよい。なお、カッコ内は、それらの遺伝子の略記号である。
【0050】
エシェリヒア・コリ由来の野生型ジヒドロジピコリン酸合成酵素はL−リジンによるフィードバック阻害を受けることが知られており、エシェリヒア・コリ由来の野生型アスパルトキナーゼはL−リジンによる抑制及びフィードバック阻害を受けることが知られている。したがって、dapA遺伝子及びlysC遺伝子を用いる場合、これらの遺伝子は、L−リジンによるフィードバック阻害を受けない変異型遺伝子であることが好ましい。
【0051】
L−リジンによるフィードバック阻害を受けない変異型ジヒドロジピコリン酸合成酵素をコードするDNAとしては、118位のヒスチジン残基がチロシン残基に置換された配列を有するタンパク質をコードするDNAが挙げられる。また、L−リジンによるフィードバック阻害を受けない変異型アスパルトキナーゼをコードするDNAとしては、352位のスレオニン残基がイソロイシン残基に置換、323位のグリシン残基がアスパラギン残基に置換、318位のメチオニンがイソロイシンに置換された配列を有するAKIIIをコードするDNAが挙げられる(これらの変異体については米国特許第5661012号及び第6040160号明細書参照)。変異型DNAはPCRなどによる部位特異的変異法により取得することができる。
【0052】
なお、変異型変異型ジヒドロジピコリン酸合成酵素をコードする変異型dapA及び変異型アスパルトキナーゼをコードする変異型lysCを含むプラスミドとして、広宿主域プラスミドRSFD80、pCAB1、pCABD2が知られている(米国特許第6040160号明細書)。RSFD80で形質転換されたエシェリヒア・コリ JM109株(米国特許第6040160号明細書)は、AJ12396と命名され、同株は1993年10月28日に通産省工業技術院生命工学工業技術研究所(現 独立行政法人 産業技術総合研究所 特許生物寄託センター)に受託番号FERM P-13936として寄託され、1994年11月1日にブダペスト条約に基づく国際寄託に移管され、FERM BP-4859の受託番号のもとで寄託されている。RSFD80は、AJ12396株から、公知の方法によって取得することができる。
【0053】
L−リジン生産菌又はそれを誘導するための親株の例としては、L−リジンの生合成経路から分岐してL−リジン以外の化合物を生成する反応を触媒する酵素の活性が低下または欠損している株も挙げられる。L−リジンの生合成経路から分岐してL−リジン以外の化合物を生成する反応を触媒する酵素の例としては、ホモセリンデヒドロゲナーゼ、リジンデカルボキシラーゼ(米国特許第5,827,698号)、及び、リンゴ酸酵素(WO2005/010175)が挙げられる。ここで、リジンデカルボキシラーゼ活性を低下または欠損させるためには、リジンデカルボキシラーゼをコードするcadA遺伝子とldcC遺伝子の両方の発現を低下させることが好ましい。(国際公開第WO2006/038695号パンフレット)
【0054】
cadA遺伝子とldcC遺伝子が破壊された菌株としては、エシェリヒア・コリWC196LC(WC196ΔcadAΔldcC)(US5,827,698、US20060160191)が挙げられる。WC196LC株は、AJ110692と命名され、2008年10月7日に独立行政法人 産業技術総合研究所 特許生物寄託センター(〒305-8566 日本国茨城県つくば市東1丁目1番地1 中央第6)に国際寄託され、受託番号FERM BP-11027が付与されている。
【0055】
L−スレオニン生産菌
L−スレオニン生産菌又はそれを誘導するための親株の例としては、E. coli TDH-6/pVIC40 (VKPM B-3996) (米国特許第5,175,107号、米国特許第5,705,371号)、E. coli 472T23/pYN7 (ATCC 98081) (米国特許第5,631,157号)、E. coli NRRL-21593 (米国特許第5,939,307号)、E. coli FERM BP-3756 (米国特許第5,474,918号)、E. coli FERM BP-3519及びFERM BP-3520 (米国特許第5,376,538号)、E. coli MG442 (Gusyatiner et al., Genetika (in Russian), 14, 947-956 (1978))、E. coli VL643及びVL2055 (EP 1149911 A)などが挙げられるが、これらに限定されない。
【0056】
TDH-6株はthrC遺伝子を欠損し、スクロース資化性であり、また、そのilvA遺伝子がリーキー(leaky)変異を有する。この株はまた、rhtA遺伝子に、高濃度のスレオニンまたはホモセリンに対する耐性を付与する変異を有する。B-3996株は、RSF1010由来ベクターに、変異thrA遺伝子を含むthrA*BCオペロンを挿入したプラスミドpVIC40を保持する。この変異thrA遺伝子は、スレオニンによるフィードバック阻害が実質的に解除されたアスパルトキナーゼホモセリンデヒドロゲナーゼIをコードする。B-3996株は、1987年11月19日、オールユニオン・サイエンティフィック・センター・オブ・アンチビオティクス(Nagatinskaya Street 3-A, 117105 Moscow, Russia)に、受託番号RIA 1867で寄託されている。この株は、また、1987年4月7日、ルシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオルガニズムズ(VKPM)に、受託番号B-3996で寄託されている。
【0057】
E. coli VKPM B-5318 (EP 0593792B)も、L−スレオニン生産菌又はそれを誘導するための親株として使用できる。B-5318株は、イソロイシン非要求性であり、プラスミドpVIC40中のスレオニンオペロンの制御領域が、温度感受性ラムダファージC1リプレッサー及びPRプロモーターにより置換されている。VKPM B-5318は、1990年5月3日、ルシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオルガニズムズ(VKPM) (1 Dorozhny proezd., 1 Moscow 117545, Russia)に、受託番号VKPM B-5318で寄託されている。
【0058】
好ましくは、本発明に用いる細菌は、さらに、下記の遺伝子の1種以上の発現が増大するように改変されたものである。
−スレオニンによるフィードバック阻害に耐性のアスパルトキナーゼホモセリンデヒドロゲナーゼIをコードする変異thrA遺伝子
−ホモセリンキナーゼをコードするthrB遺伝子
−スレオニンシンターゼをコードするthrC遺伝子
−推定トランスメンブランタンパク質をコードするrhtA遺伝子
−アスパルテート−β−セミアルデヒドデヒドロゲナーゼをコードするasd遺伝子
−アスパルテートアミノトランスフェラーゼ(アスパルテートトランスアミナーゼ)をコードするaspC遺伝子
【0059】
E. coliのアスパルトキナーゼホモセリンデヒドロゲナーゼIをコードするthrA遺伝子は明らかにされている(ヌクレオチド番号337〜2799, GenBank accession NC_000913.2, gi: 49175990)。thrA遺伝子は、E. coli K-12の染色体において、thrL遺伝子とthrB遺伝子との間に位置する。E. coliのホモセリンキナーゼをコードするthrB遺伝子は明らかにされている(ヌクレオチド番号2801〜3733, GenBank accession NC_000913.2, gi: 49175990)。thrB遺伝子は、E. coli K-12の染色体において、thrA遺伝子とthrC遺伝子との間に位置する。E. coliのスレオニンシンターゼをコードするthrC遺伝子は明らかにされている(ヌクレオチド番号3734〜5020, GenBank accession NC_000913.2, gi: 49175990)。thrC遺伝子は、E. coli K-12の染色体において、thrB遺伝子とyaaXオープンリーディングフレームとの間に位置する。これら三つの遺伝子は、全て、単一のスレオニンオペロンとして機能する。スレオニンオペロンの発現を増大させるには、転写に影響するアテニュエーター領域を、好ましくは、オペロンから除去する(WO2005/049808, WO2003/097839)。
【0060】
スレオニンによるフィードバック阻害に耐性のアスパルトキナーゼホモセリンデヒドロゲナーゼIをコードする変異thrA遺伝子、ならびに、thrB遺伝子及びthrC遺伝子は、スレオニン生産株E. coli VKPM B-3996に存在する周知のプラスミドpVIC40から一つのオペロンとして取得できる。プラスミドpVIC40の詳細は、米国特許第5,705,371号に記載されている。
【0061】
rhtA遺伝子は、グルタミン輸送系の要素をコードするglnHPQ オペロンに近いE. coli染色体の18分に存在する。rhtA遺伝子は、ORF1 (ybiF遺伝子, ヌクレオチド番号764〜1651,
GenBank accession number AAA218541, gi:440181)と同一であり、pexB遺伝子とompX遺伝子との間に位置する。ORF1によりコードされるタンパク質を発現するユニットは、rhtA遺伝子と呼ばれている(rht: ホモセリン及びスレオニンに耐性)。また、rhtA23変異が、ATG開始コドンに対して-1位のG→A置換であることが判明している(ABSTRACTS of the 17th International Congress of Biochemistry and Molecular Biology in conjugation with Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California August 24-29, 1997, abstract No. 457, EP 1013765 A)。
【0062】
E. coliのasd遺伝子は既に明らかにされており(ヌクレオチド番号3572511〜3571408, GenBank accession NC_000913.1, gi:16131307)、その遺伝子の塩基配列に基づいて作製されたプライマーを用いるPCRにより得ることができる(White, T. J., Arnheim, N., and Erlich, H. A. 1989. Trends Genet. 5: 185-189参照)。他の微生物のasd遺伝子も同様に得ることができる。
【0063】
また、E. coliのaspC遺伝子も既に明らかにされており(ヌクレオチド番号983742〜984932, GenBank accession NC_000913.1, gi:16128895)、PCRにより得ることができる。他の微生物のaspC遺伝子も同様に得ることができる。
【0064】
L−システイン生産菌
L−システイン生産菌又はそれを誘導するための親株の例としては、フィードバック阻害耐性のセリンアセチルトランスフェラーゼをコードする異なるcysEアレルで形質転換されたE. coli JM15(米国特許第6,218,168号、ロシア特許出願第2003121601号)、細胞に毒性の物質を排出するのに適したタンパク質をコードする過剰発現遺伝子を有するE. coli W3110 (米国特許第5,972,663号)、システインデスルフォヒドラーゼ活性が低下したE. coli株 (JP11155571A2)、cysB遺伝子によりコードされる正のシステインレギュロンの転写制御因子の活性が上昇したE. coli W3110 (WO0127307A1)などの菌株が挙げられるが、これらに限定されない。
【0065】
L−ロイシン生産菌
L−ロイシン生産菌又はそれを誘導するための親株の例としては、ロイシン耐性のE. coli株 (例えば、57株 (VKPM B-7386, 米国特許第6,124,121号))またはβ−2−チエニルアラニン、3−ヒドロキシロイシン、4−アザロイシン、5,5,5-トリフルオロロイシンなどのロイシンアナログ耐性のE. coli株(特公昭62-34397号及び特開平8-70879号)、WO96/06926に記載された遺伝子工学的方法で得られたE. coli株、E. coli H-9068 (特開平8-70879号)など株が挙げられるが、これらに限定されない。
【0066】
本発明に用いる細菌は、L−ロイシン生合成に関与する遺伝子の1種以上の発現が増大されることにより改良されていてもよい。このような遺伝子の例としては、好ましくはL−ロイシンによるフィードバック阻害が解除されたイソプロピルマレートシンターゼをコードする変異leuA遺伝子(米国特許第6,403,342号)に代表される、leuABCDオペロンの遺伝子が挙げられる。さらに、本発明に用いる細菌は、細菌の細胞からL−アミノ酸を排出するタンパク質をコードする遺伝子の1種以上の発現が増大されることにより改良されていてもよい。このような遺伝子の例としては、b2682遺伝子及びb2683遺伝子(ygaZH遺伝子) (EP 1239041 A2)が挙げられる。
【0067】
L−ヒスチジン生産菌
L−ヒスチジン生産菌又はそれを誘導するための親株の例としては、E. coli 24株 (VKPM B-5945, RU2003677)、E. coli 80株 (VKPM B-7270, RU2119536)、E. coli NRRL B-12116 - B12121 (米国特許第4,388,405号)、E. coli H-9342 (FERM BP-6675)及びH-9343 (FERM BP-6676) (米国特許第6,344,347号)、E. coli H-9341 (FERM BP-6674) (EP1085087)、E. coli AI80/pFM201 (米国特許第6,258,554号)など株が挙げられるが、これらに限定されない。
【0068】
L−ヒスチジン生産菌又はそれを誘導するための親株の例としては、L−ヒスチジン生合成系酵素をコードする遺伝子の1種以上の発現が増大した株も挙げられる。かかる遺伝子の例としては、ATPフォスフォリボシルトランスフェラーゼ遺伝子(hisG)、フォスフォリボシルAMPサイクロヒドロラーゼ遺伝子(hisI)、フォスフォリボシル-ATPピロフォスフォヒドロラーゼ遺伝子(hisI)、フォスフォリボシルフォルミミノ-5-アミノイミダゾールカルボキサミドリボタイドイソメラーゼ遺伝子(hisA)、アミドトランスフェラーゼ遺伝子(hisH)、ヒスチジノールフォスフェイトアミノトランスフェラーゼ遺伝子(hisC)、ヒスチジノールフォスファターゼ遺伝子(hisB)、ヒスチジノールデヒドロゲナーゼ遺伝子(hisD)などが挙げられる。
【0069】
hisG及びhisBHAFIにコードされるL−ヒスチジン生合成系酵素はL−ヒスチジンにより阻害されることが知られており、従って、L−ヒスチジン生産能は、ATPフォスフォリボシルトランスフェラーゼ遺伝子(hisG)にフィードバック阻害への耐性を付与する変異を導入することにより効率的に増大させることができる(ロシア特許第2003677号及び第2119536号)。
【0070】
L−ヒスチジン生産能を有する株の具体例としては、L−ヒスチジン生合成系酵素をコードするDNAを保持するベクターを導入したE. coli FERM-P 5038及び5048 (特開昭56-005099号)、アミノ酸輸送の遺伝子を導入したE. coli株(EP1016710A)、スルファグアニジン、DL-1,2,4-トリアゾール-3-アラニン及びストレプトマイシンに対する耐性を付与したE. coli 80株(VKPM B-7270, ロシア特許第2119536号)などの菌株が挙げられる。
【0071】
L−グルタミン酸生産菌
L−グルタミン酸生産菌又はそれを誘導するための親株の例としては、E. coli VL334thrC+ (EP 1172433)などの菌株が挙げられるが、これらに限定されない。E. coli VL334 (VKPM B-1641)は、thrC遺伝子及びilvA遺伝子に変異を有するL−イソロイシン及びL−スレオニン要求性株である(米国特許第4,278,765号)。thrC遺伝子の野生型アレルは、野生型E. coli K12株 (VKPM B-7)の細胞で増殖したバクテリオファージP1を用いる一般的形質導入法により導入された。この結果、L−イソロイシン要求性のL−グルタミン酸生産菌VL334thrC+ (VKPM B-8961) が得られた。
【0072】
L−グルタミン酸生産菌又はそれを誘導するための親株の例としては、L−グルタミン酸生合成系酵素をコードする遺伝子の1種以上の発現が増大した株が挙げられるが、これらに限定されない。かかる遺伝子の例としては、グルタメートデヒドロゲナーゼ(gdhA)、グルタミンシンテターゼ(glnA)、グルタメートシンテターゼ(gltAB)、イソシトレートデヒドロゲナーゼ(icdA)、アコニテートヒドラターゼ(acnA, acnB)、シトレートシンターゼ(gltA)、フォスフォエノールピルベートカルボシラーゼ(ppc)、ピルベートデヒドロゲナーゼ(aceEF, lpdA)、ピルベートキナーゼ(pykA, pykF)、フォスフォエノールピルベートシンターゼ(ppsA)、エノラーゼ(eno)、フォスフォグリセロムターゼ(pgmA, pgmI)、フォスフォグリセレートキナーゼ(pgk)、グリセルアルデヒド-3-フォスフェートデヒドロゲナーゼ(gapA)、トリオースフォスフェートイソメラーゼ(tpiA)、フルクトースビスフォスフェートアルドラーゼ(fbp)、フォスフォフルクトキナーゼ(pfkA, pfkB)、グルコースフォスフェートイソメラーゼ(pgi)などが挙げられる。
【0073】
シトレートシンテターゼ遺伝子、フォスフォエノールピルベートカルボキシラーゼ遺伝子、及び/またはグルタメートデヒドロゲナーゼ遺伝子の発現が増大するように改変された株の例としては、EP1078989A、EP955368A及びEP952221Aに開示されたものが挙げられる。
【0074】
L−グルタミン酸生産菌又はそれを誘導するための親株の例としては、L−グルタミン酸の生合成経路から分岐してL−グルタミン酸以外の化合物の合成を触媒する酵素の活性が低下または欠損している株も挙げられる。このような酵素の例としては、イソシトレートリアーゼ(aceA)、α-ケトグルタレートデヒドロゲナーゼ(sucA)、フォスフォトランスアセチラーゼ(pta)、アセテートキナーゼ(ack)、アセトヒドロキシ酸シンターゼ(ilvG)、アセトラクテートシンターゼ(ilvI)、フォルメートアセチルトランスフェラーゼ(pfl)、ラクテートデヒドロゲナーゼ(ldh)、グルタメートデカルボキシラーゼ(gadAB)、γ-グルタミル転移酵素(ggt)、γ-グルタミルシステイン合成酵素(gshA)、γ-グルタミン酸プトレシン合成酵素(ycjK)などが挙げられる。α-ケトグルタレートデヒドロゲナーゼ活性が欠損した、または、α-ケトグルタレートデヒドロゲナーゼ活性が低下したエシェリヒア・コリ、及び、それらの取得方法は米国特許第5,378,616 号及び第5,573,945号に記載されている。
【0075】
具体例としては下記のものが挙げられる。
E. coli W3110sucA::Kmr
E. coli AJ12624 (FERM BP-3853)
E. coli AJ12628 (FERM BP-3854)
E. coli AJ12949 (FERM BP-4881)
【0076】
E. coli W3110sucA::Kmr は、E. coli W3110のα-ケトグルタレートデヒドロゲナーゼ遺伝子(以下、「sucA遺伝子」ともいう)を破壊することにより得られた株である。この株は、α-ケトグルタレートデヒドロゲナーゼを完全に欠損している。
【0077】
L−グルタミン酸生産菌の他の例としては、アスパラギン酸代謝拮抗物質に耐性を有するエシェリヒア・コリが挙げられる。このような株は、α-ケトグルタレートデヒドロゲナーゼを欠損していてもよく、例えば、E. coli AJ13199 (FERM BP-5807) (米国特許第5.908,768号)、さらにL−グルタミン酸分解能が低下したFFRM P-12379(米国特許第5,393,671号); AJ13138 (FERM BP-5565) (米国特許第6,110,714号)などの菌株が挙げられる。
【0078】
パントアエ・アナナティスのL−グルタミン酸生産菌の例としては、パントエア・アナナティスAJ13355株が挙げられる。同株は、静岡県磐田市の土壌から、低pHでL−グルタミン酸及び炭素源を含む培地で増殖できる株として分離された株である。パントエア・アナナティスAJ13355は、1998年2月19日に、独立行政法人 産業技術総合研究所 特許生物寄託センター(住所 〒305-8566 日本国茨城県つくば市東1丁目1番地1 中央第6)に、受託番号FERM P-16644として寄託され、1999年1月11日にブダペスト条約に基づく国際寄託に移管され、受託番号FERM BP-6614が付与されている。尚、同株は、分離された当時はエンテロバクター・アグロメランス(Enterobacter agglomerans)と同定され、エンテロバクター・アグロメランスAJ13355として寄託されたが、近年16S rRNAの塩基配列解析などにより、パントエア・アナナティス(Pantoea ananatis)に再分類されている。
【0079】
また、パントアエ・アナナティスのL−グルタミン酸生産菌として、α-ケトグルタレートデヒドロゲナーゼ(αKGDH)活性が欠損した、または、αKGDH活性が低下したパントエア属に属する細菌が挙げられる。このような株としては、AJ13355株のαKGDH-E1サブユニット遺伝子(sucA)を欠損させたAJ13356(米国特許第6,331,419号)、及びAJ13355株から粘液質低生産変異株として選択されたSC17株由来のsucA遺伝子欠損株であるSC17sucA(米国特許第6,596,517号)がある。AJ13356は、1998年2月19日、工業技術院生命工学工業技術研究所(現 独立行政法人 産業技術総合研究所 特許生物寄託センター、〒305-8566 日本国茨城県つくば市東1丁目1番地1 中央第6)に受託番号FERM P-16645として寄託され、1999年1月11日にブダペスト条約に基づく国際寄託に移管され、受託番号FERM BP-6616が付与されている。AJ13355及びAJ13356は、上記寄託機関にEnterobacter agglomeransとして寄託されているが、本明細書では、Pantoea ananatisとして記載する。また、SC17sucA株は、ブライベートナンバーAJ417株が付与され、2004年2月26日に産業技術総合研究所特許生物寄託センターに受託番号FERM BP-08646として寄託されている。
【0080】
さらに、パントエア・アナナティスのL−グルタミン酸生産菌として、SC17sucA/RSFCPG+pSTVCB株、AJ13601株、NP106株、及びNA1株が挙げられる。SC17sucA/RSFCPG+pSTVCB株は、SC17sucA株に、エシェリヒア・コリ由来のクエン酸シンターゼ遺伝子(gltA)、ホスホエノールピルビン酸カルボキシラーゼ遺伝子(ppsA)、およびグルタメートデヒドロゲナーゼ遺伝子(gdhA)を含むプラスミドRSFCPG、並びに、ブレビバクテリウム・ラクトファーメンタム由来のクエン酸シンターゼ遺伝子(gltA)を含むプラスミドpSTVCBを導入して得た株である。AJ13601株は、このSC17sucA/RSFCPG+pSTVCB株から低pH下で高濃度のL−グルタミン酸に耐性を示す株として選択された株である。また、NP106株は、実施例に記載したように、AJ13601株からプラスミドRSFCPG+pSTVCBを脱落させた株である。AJ13601株は、1999年8月18日に、独立行政法人 産業技術総合研究所 特許生物寄託センター(〒305-8566 日本国茨城県つくば市東1丁目1番地1 中央第6)に受託番号FERM P-17516として寄託され、2000年7月6日にブダペスト条約に基づく国際寄託に移管され、受託番号FERM BP-7207が付与されている。
【0081】
L−フェニルアラニン生産菌
L−フェニルアラニン生産菌又はそれを誘導するための親株の例としては、E. coli AJ12739 (tyrA::Tn10, tyrR) (VKPM B-8197)、変異型pheA34遺伝子を保持するE. coli HW1089 (ATCC 55371) (米国特許第 5,354,672号)、E. coli MWEC101-b (KR8903681)、E.coli NRRL B-12141, NRRL B-12145, NRRL B-12146及びNRRL B-12147 (米国特許第4,407,952号)などの菌株が挙げられるが、これらに限定されない。また、親株として、E. coli K-12 [W3110 (tyrA)/pPHAB] (FERM BP-3566)、E. coli K-12 [W3110 (tyrA)/pPHAD] (FERM BP-12659)、E. coli K-12 [W3110 (tyrA)/pPHATerm] (FERM BP-12662)及びAJ 12604と命名されたE. coli K-12 [W3110 (tyrA)/pBR-aroG4, pACMAB] (FERM BP-3579)も使用できる(EP 488424 B1)。さらに、yedA遺伝子またはyddG遺伝子にコードされるタンパク質の活性が増大したエシェリヒア・コリのL−フェニルアラニン生産菌も使用できる(米国特許出願公開2003/0148473 A1及び2003/0157667 A1)。
【0082】
L−トリプトファン生産菌
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、変異trpS遺伝子によりコードされるトリプトファニル-tRNAシンテターゼが欠損したE. coli JP4735/pMU3028 (DSM10122)及びJP6015/pMU91 (DSM10123) (米国特許第5,756,345号)、セリンによるフィードバック阻害を受けないフォスフォグリセリレートデヒドロゲナーゼをコードするserAアレル及びトリプトファンによるフィードバック阻害を受けないアントラニレートシンターゼをコードするtrpEアレルを有するE. coli SV164 (pGH5) (米国特許第6,180,373号)、トリプトファナーゼが欠損したE. coli AGX17 (pGX44) (NRRL B-12263)及びAGX6(pGX50)aroP (NRRL B-12264) (米国特許第4,371,614号)、フォスフォエノールピルビン酸生産能が増大したE. coli AGX17/pGX50,pACKG4-pps (WO9708333, 米国特許第6,319,696号)などの菌株が挙げられるが、これらに限定されない。yedA遺伝子またはyddG遺伝子にコードされるタンパク質の活性が増大したエシェリヒア・コリのL−トリプトファン生産菌も使用できる(米国特許出願公開2003/0148473 A1及び2003/0157667 A1)。
【0083】
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、アントラニレートシンターゼ(trpE)、フォスフォグリセレートデヒドロゲナーゼ(serA)、及び、トリプトファンシンターゼ(trpAB)から選ばれる酵素の活性の一種以上が増大した株も挙げられる。アントラニレートシンターゼ及びフォスフォグリセレートデヒドロゲナーゼは共にL−トリプトファン及びL−セリンによるフィードバック阻害を受けるので、フィードバック阻害を解除する変異をこれらの酵素に導入してもよい。このような変異を有する株の具体例としては、脱感作型アントラニレートシンターゼを保持するE. coli SV164、及び、フィードバック阻害が解除されたフォスフォグリセレートデヒドロゲナーゼをコードする変異serA遺伝子を含むプラスミドpGH5 (WO 94/08031)をE. coli SV164に導入することにより得られた形質転換株が挙げられる。
【0084】
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、阻害解除型アントラニレートシンターゼをコードする遺伝子を含むトリプトファンオペロンが導入された株(特開昭57-71397号, 特開昭62-244382号, 米国特許第4,371,614号)も挙げられる。さらに、トリプトファンオペロン(trpBA)中のトリプトファンシンターゼをコードする遺伝子の発現を増大させることによりL−トリプトファン生産能を付与してもよい。トリプトファンシンターゼは、それぞれtrpA及びtrpB遺伝子によりコードされるα及びβサブユニットからなる。さらに、イソシトレートリアーゼ-マレートシンターゼオペロンの発現を増大させることによりL−トリプトファン生産能を改良してもよい(WO2005/103275)。
【0085】
L−プロリン生産菌
L−プロリン生産菌又はそれを誘導するための親株の例としては、ilvA遺伝子が欠損し、L−プロリンを生産できるE. coli 702ilvA (VKPM B-8012) (EP 1172433)などの菌株が挙げられるが、これらに限定されない。
【0086】
本発明に用いる細菌は、L−プロリン生合成に関与する遺伝子の一種以上の発現を増大することにより改良してもよい。L−プロリン生産菌に好ましい遺伝子の例としては、L−プロリンによるフィードバック阻害が解除されたグルタメートキナーゼをコードするproB遺伝子(ドイツ特許第3127361号)が挙げられる。さらに、本発明に用いる細菌は、細菌の細胞からL−アミノ酸を排出するタンパク質をコードする遺伝子の一種以上の発現が増大することにより改良してもよい。このような遺伝子としては、b2682 遺伝子及びb2683遺伝子(ygaZH遺伝子) (EP1239041 A2)が挙げられる。
【0087】
L−プロリン生産能を有するエシェリヒア・コリの例としては、NRRL B-12403及びNRRL B-12404 (英国特許第2075056号)、VKPM B-8012 (ロシア特許出願2000124295)、ドイツ特許第3127361号に記載のプラスミド変異体、Bloom F.R. et al (The 15th Miami winter symposium, 1983, p.34)に記載のプラスミド変異体などのE. coli 株が挙げられる。
【0088】
L−アルギニン生産菌
L−アルギニン生産菌又はそれを誘導するための親株の例としては、E. coli 237株 (VKPM B-7925) (米国特許出願公開2002/058315 A1)、及び、変異N-アセチルグルタメートシンターゼを保持するその誘導株(ロシア特許出願第2001112869号)、E. coli 382株 (VKPM B-7926) (EP1170358A1)、N-アセチルグルタメートシンテターゼをコードするargA遺伝子が導入されたアルギニン生産株(EP1170361A1)などの菌株が挙げられるが、これらに限定されない。
【0089】
L−アルギニン生産菌又はそれを誘導するための親株の例としては、L−アルギニン生合成系酵素をコードする遺伝子の1種以上の発現が増大した株も挙げられる。かかる遺伝子の例としては、N-アセチルグルタミルフォスフェートレダクターゼ遺伝子(argC)、オルニチンアセチルトランスフェラーゼ遺伝子(argJ)、N-アセチルグルタメートキナーゼ遺伝子(argB)、アセチルオルニチントランスアミナーゼ遺伝子(argD)、オルニチンカルバモイルトランスフェラーゼ遺伝子(argF)、アルギノコハク酸シンテターゼ遺伝子(argG)、アルギノコハク酸リアーゼ遺伝子(argH)、カルバモイルフォスフェートシンテターゼ遺伝子(carAB)が挙げられる。
【0090】
L−バリン生産菌
L−バリン生産菌又はそれを誘導するための親株の例としては、ilvGMEDAオペロンを過剰発現するように改変された株(米国特許第5,998,178号)が挙げられるが、これらに限定されない。アテニュエーションに必要なilvGMEDAオペロンの領域を除去し、生産されるL−バリンによりオペロンの発現が減衰しないようにすることが好ましい。さらに、オペロンのilvA遺伝子が破壊され、スレオニンデアミナーゼ活性が減少することが好ましい。
【0091】
L−バリン生産菌又はそれを誘導するための親株の例としては、アミノアシルt-RNAシンテターゼの変異を有する変異株(米国特許第5,658,766号)も挙げられる。例えば、イソロイシンtRNAシンテターゼをコードするileS 遺伝子に変異を有するE. coli VL1970が使用できる。E. coli VL1970は、1988年6月24日、ルシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオルガニズムズ(VKPM) (1 Dorozhny proezd., 1 Moscow 117545, Russia)に、受託番号VKPM B-4411で寄託されている。
さらに、生育にリポ酸を要求する、及び/または、H+-ATPaseを欠失している変異株(WO96/06926)を親株として用いることができる。
【0092】
L−イソロイシン生産菌
L−イソロイシン生産菌又はそれを誘導するための親株の例としては、6−ジメチルアミノプリンに耐性を有する変異株(特開平5-304969号)、チアイソロイシン、イソロイシンヒドロキサメートなどのイソロイシンアナログに耐性を有する変異株、さらにDL-エチオニン及び/またはアルギニンヒドロキサメートに耐性を有する変異株(特開平5-130882号).が挙げられるが、これらに限定されない。さらに、スレオニンデアミナーゼ、アセトヒドロキシ酸シンターゼなどのL−イソロイシン生合成に関与するタンパク質をコードする遺伝子で形質転換された組換え株もまた親株として使用できる(特開平2-458号, FR 0356739, 及び米国特許第5,998,178号)。
【0093】
L−アスパラギン酸生産菌
L−アスパラギンは、アスパラギン酸へアミノ基を付与することにより生産される(Boehlein, S. K., Richards, N. G. J., & Schuster, S. M. (1994a) J. Biol. Chem. 269, 7450-7457.)。したがって、エシェリヒア・コリのL−アスパラギン生産菌として、L−アスパラギン酸生産菌のアスパラギンシンテターゼが増強されたエシェリヒア・コリ菌株が挙げられる。
【0094】
本発明の細菌は、脂肪酸、又はグリセロール等のアルコールを資化する能力が高められていてもよい。
脂肪酸資化能は、例えば、fadR遺伝子の発現を弱化させること、もしくは同遺伝子を欠損させること、fadI、fadJ、fadL、fadE、fadD、fadB、又はfadA遺伝子等の脂肪酸資化に関与する遺伝子の発現を増強することにより、高めることができる(WO2009/142286)。
【0095】
グリセロール資化能は、glpR遺伝子(EP1715056)の発現を弱化するか、glpA、glpB、glpC、glpD、glpE、glpF、glpG、glpK、glpQ、glpT、glpX、tpiA、gldA、dhaK、dhaL、dhaM、dhaR、fsa及びtalC遺伝子等のグリセロール代謝遺伝子(EP1715055A)の発現を増強すること、又は、グリセロールデヒドロゲナーゼ(gldA)、ジハイドロキシアセトンキナーゼ(dhaKLM, dak)遺伝子、フルクトースー6−リン酸アルドラーゼ(fsaB)の発現を強化すること(WO2008/102861)によって、高めることができる。
【0096】
本発明に用いる細菌は、エタノール資化性を有する細菌であり、元来エタノールの資化性を有する細菌、エタノールの資化性を付与された組換え株、又はエタノールの資化性が高まった変異株でもよい。
【0097】
エシェリヒア・コリに関しては、嫌気条件でエタノールを生成する酵素として、以下の反応を可逆的に触媒するアセトアルデヒドデヒドロゲナーゼとアルコールデヒドロゲナーゼ活性を有するAdhEの存在が知られている。エシェリヒア・コリのAdhEをコードするadhE遺伝子の配列は、 HYPERLINK "mailto:WO2009031565@" WO2009/031565、米国特許出願公開第2009068712号に開示されている。
【0098】
アセチル-CoA + NADH + H+ → アセトアルデヒド + NAD+ + CoA
アセトアルデヒド + NADH + H+ → エタノール + NAD+
【0099】
エタノールを炭素源に用いる場合は、好気的にエタノールを資化できる細菌を用いることが好ましい。エシェリヒア・コリは、好気条件ではエタノールは資化できないが、好気的にエタノールを資化できるように改変された株を用いてもよい。元来好気的にエタノールを資化できない細菌を、好気的にエタノールを資化できるように改変するには、例えば、好気条件で機能する非天然型プロモーターの制御下で発現するように改変されたadh遺伝子を保持させること、又は、好気的にエタノールを資化できることを可能にする変異をコード領域内に有する変異型adhE遺伝子を保持させることが挙げられる(Clark D. P., and Cronan, J. E. Jr. 1980. J. Bacteriol. 144: 179-184; Membrillo-Hernandez, J. et al. 2000. J. Biol. Chem. 275: 33869-33875)。さらに、この変異型adhE遺伝子は、好気条件で機能する非天然型プロモーターの制御下で発現するものであってもよい。
【0100】
エシェリヒア・コリは、アルコールデヒドロゲナーゼをコードする遺伝子の上流のプロモーターを好気的に機能するプロモーターに置換することによって、好気条件でアルコールデヒドロゲナーゼが発現し、好気的にエタノールを資化できるようになる(WO2008/010565号パンフレット)。好気条件で機能する非天然型プロモーターとして、好気条件で或る特定レベルを超えてadhE遺伝子を発現することができる任意のプロモーターを用いることができる。好気条件は、振盪、通気及び撹拌等の方法によって酸素が供給される細菌の培養に通常用いられるものであり得る。具体的には、好気条件で遺伝子を発現することが知られている任意のプロモーターを用いることができる。例えば、解糖、ペントースリン酸経路、TCAサイクル、アミノ酸生合成経路等に関与する遺伝子のプロモーターを用いることができる。さらに、λファージのPtacプロモーター、lacプロモーター、trpプロモーター、trcプロモーター、PRプロモーター、又はPLプロモーターは全て、好気条件で機能する強いプロモーターであることが知られており、これらを用いることが好ましい。
【0101】
前記のような変異を有するAdhE変異体として具体的には、エシェリヒア・コリのAdhEの568位のグルタミン酸残基がグルタミン酸及びアスパラギン酸以外のアミノ酸残基、例えばリジンで置換された変異体(Glu568Lys、E568K)がある(国際公開パンフレットWO2008/010565号公報)。
【0102】
さらに、前記AdhE変異体は、以下の追加的変異を含んでいてもよい。
A)560位のグルタミン酸残基の他のアミノ酸残基、例えばリジン残基への置換
B)566位のフェニルアラニン残基の他のアミノ酸残基、例えばバリン残基への置換、
C)22位のグルタミン酸残基、236位のメチオニン残基、461位のチロシン残基、554位のイソロイシン残基、及び786位のアラニン残基の他のアミノ酸残基、例えばそれぞれグリシン残基、バリン残基、システイン残基、セリン残基、及びバリン残基への置換、又は
D)上記変異の組合わせ。
【0103】
「好気的にエタノールを資化できる」とは、エタノールを単一炭素源とする最少液体培地もしくは固体培地にて、好気条件で生育可能であることを意味する。「好気条件」は前記と同様に、振盪、通気及び撹拌等の方法によって酸素が供給される細菌の培養に通常用いられるものであり得る。また、「好気的にエタノールを資化できる」とは、AdhEタンパク質のレベルに関して、Clark及びCronan(J. Bacteriol., 141, 177-183 (1980))の方法によって測定された無細胞抽出物におけるアルコールデヒドロゲナーゼ活性は、タンパク質1mg当たり1.5ユニット以上、好ましくは5ユニット以上、及びより好ましくは10ユニット以上であることを意味する。
【0104】
また、本発明の細菌は、ピルビン酸シンターゼ、または、ピルビン酸:NADP+オキシドレダクターゼの活性が増大するように改変された菌株であってもよい。ピルビン酸シンターゼの、あるいは、ピルビン酸:NADP+オキシドレダクターゼ活性が増大するように改変するには、ピルビン酸シンターゼ、または、ピルビン酸:NADP+オキシドレダクターゼ活性が、親株、例えば野生株や非改変株と比べて増大するように改変することが好ましい。尚、微生物が元来ピルビン酸シンターゼ活性を有していない場合、同酵素活性を有するように改変された微生物は、ピルビン酸シンターゼ、または、ピルビン酸:NADP+オキシドレダクターゼ活性が、非改変株に比べて増大している。
【0105】
本発明における「ピルビン酸シンターゼ」とは、アセチル-CoAとCO2からピルビン酸を生成する下記の反応を、電子供与体存在下、例えばフェレドキシンあるいはフラボドキシン存在下で可逆的に触媒する酵素(EC 1.2.7.1)を意味する。ピルビン酸シンターゼは、PSと略称されることもあり、ピルビン酸オキシドレダクターゼ、ピルビン酸フェレドキシンオキシドレダクターゼ、ピルビン酸フラボドキシンオキシドレダクターゼ、または、ピルビン酸オキシドレダクターゼと命名されている場合もある。電子供与体としては、フェレドキシンまたはフラボドキシンを用いることが出来る。
【0106】
還元型フェレドキシン + アセチル-CoA + CO2 → 酸化型フェレドキシン + ピルビン酸 +
CoA
【0107】
ピルビン酸シンターゼの活性が増強されたことの確認は、増強前の微生物と、増強後の微生物より粗酵素液を調製し、そのピルビン酸シンターゼ活性を比較することにより達成される。ピルビン酸シンターゼの活性は、例えば、Yoonらの方法(Yoon, K. S. et al. 1997. Arch. Microbiol. 167: 275-279)に従って測定できる。例えば、電子受容体としての酸化型メチルビオロゲンとCoAと粗酵素液を含む反応液にピルビン酸を添加した際に、ピルビン酸の脱炭酸反応によって増大する還元型メチルビオロゲンの量を分光学的に測定することによって、測定可能である。酵素活性1ユニット(U)は1分間あたり1μmolのメチルビオロゲンの還元量で表される。親株がピルビン酸シンターゼ活性を有している場合、親株と比較して、好ましくは1.5倍以上、より好ましくは2倍以上、さらに好ましくは3倍以上酵素活性が上昇していることが望ましい。また親株がピルビン酸シンターゼ活性を有していない場合には、ピルビン酸シンターゼ遺伝子を導入することにより、ピルビン酸シンターゼが生成されていればよいが、酵素活性が測定できる程度に強化されていることが好ましく、好ましくは0.001U/mg(菌体タンパク質)以上、より好ましくは0.005U/mg以上、さらに好ましくは0.01U/mg以上が望ましい。ピルビン酸シンターゼは、酸素に対して感受性であり、一般的に活性発現や測定は困難であることも多い(Buckel, W.and Golding, B. T. 2006. Ann. Rev. of Microbiol. 60: 27-49)。したがって、酵素活性の測定に際しては、反応容器中の酸素濃度を低下させて酵素反応を行うことが好ましい。
【0108】
ピルビン酸シンターゼをコードする遺伝子は、クロロビウム・テピダム(Chlorobium tepidum)、ハイドロジェノバクター・サーモファイラス(Hydrogenobacter thermophilus)等、還元的TCAサイクルを持つ細菌のピルビン酸シンターゼ遺伝子を利用することが可能である。また、エシェリヒア・コリ(Escherichia coli)をはじめとする、腸内細菌群に属する細菌由来のピルビン酸シンターゼ遺伝子を利用することも可能である。さらに、ピルビン酸シンターゼをコードする遺伝子は、メタノコッカス・マリパルディス(Methanococcus maripaludis)、メタノカルドコッカス・ジャナスチ(Methanocaldococcus jannaschii)、メタノサーモバクター・サーマトトロフィカス(Methanothermobacter thermautotrophicus)などの独立栄養性メタン生成古細菌(autotrophic methanogens)のピルビン酸シンターゼ遺伝子を利用することが可能である。
【0109】
<2−2>エシェリヒア・コリに変異型RpsAタンパク質を保持させる方法
本発明の細菌は、上述したようなL−アミノ酸生産能を有するエシェリヒア・コリを、210位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有するエシェリヒア・コリのRpsAタンパク質(以下、「変異型RpsAタンパク質」と記載することがある。)を保持するように改変することによって取得できる。また、本発明の細菌は、変異型RpsAタンパク質を保持するように改変された細菌に、L−アミノ酸生産能を付与することによっても、取得できる。
【0110】
腸内細菌科に属する細菌に変異型RpsAタンパク質を保持させるには、変異型RpsAタンパク質をコードする変異型rpsA遺伝子を腸内細菌科に属する細菌に導入するか、染色体上の野生型rpsA遺伝子に210位のアスパラギン酸残基が他のアミノ酸残基で置換されるような変異を導入すればよい。
【0111】
変異型rpsA遺伝子を腸内細菌科に属する細菌に導入するには、例えば、変異型rpsA遺伝子を含むベクターで腸内細菌科に属する細菌を形質転換すればよい。また、変異型RpsA遺伝子を、レペティティブDNA、転移因子の端部に存在するインバーテッド・リピート、又はトランスポゾン等を用いて腸内細菌科に属する細菌の染色体上に存在させてもよい。
前記ベクターとしては、pUC19、pUC18、pHSG299、pHSG399、pHSG398、RSF1010、pBR322、pACYC184、pMW118、pMW219等ラスミドベクター、λ1059、λBF101、M13mp9等のファージベクターが挙げられる。またトランスポゾンとしては、Mu、Tn10、Tn5等が挙げられる。
【0112】
変異型rpsA遺伝子を発現させるためのプロモーター等の発現調節配列は、rpsA遺伝子固有のものであってもよいし、他の遺伝子由来のプロモーター又は人工プロモーターであってもよい。そのようなプロモーターとしては、lacプロモーター、trpプロモーター、trcプロモーター、tacプロモーター、ラムダファージのPRプロモーター、PLプロモーター、PL-tacプロモーター、tetプロモーター等が挙げられる。
【0113】
本発明の細菌は、野生型RpsAタンパク質を保持しないことが好ましい。このような細菌は、野生型RpsA遺伝子が発現しないように染色体上のrpsA遺伝子を改変すること、例えばrps遺伝子を破壊することによって取得することができる。また、染色体上のrpsA遺伝子を変異型rpsA遺伝子で置換することによって、野生型RpsAタンパク質を保持せず、かつ、変異型RpsAタンパク質を保持する細菌を得ることができる。このような遺伝子置換を行う方法としては、例えば「Redドリブンインテグレーション(Red-driven integration)」と呼ばれる方法(Datsenko, K. A, and Wanner, B. L. Proc. Natl. Acad. Sci. U S A. 97:6640-6645 (2000))や、Redドリブンインテグレーション法とλファージ由来の切り出しシステム(Cho, E. H., Gumport, R. I., Gardner, J. F. J. Bacteriol. 184: 5200-5203 (2002))とを組合わせた方法(WO2005/010175号参照)等の直鎖状DNAを用いる方法や、温度感受性複製起点を含むプラスミド、接合伝達可能なプラスミドを用いる方法、宿主内で複製起点を持たないスイサイドベクターを利用する方法などがある(米国特許第6303383号明細書、または特開平05-007491号公報)。また、変異型rpsA遺伝子を保持する細菌から、P1トランスダクション、相同組換え法、又はλ-Red法等によって、任意の腸内細菌科に属する細菌菌株に変異型rpsA遺伝子を導入することもできる。
【0114】
本発明の細菌は、上記RpsAタンパク質をコードする遺伝子を染色体上に保持していればいずれでもよいが、細胞内に2コピー、あるいは3コピー以上有していてもよい。またrpsA遺伝子は破壊や欠失が難しいこともあるので、一旦変異型遺伝子を細胞内に導入してから野生型rpsA遺伝子と変異型遺伝子を置き換えることが望ましい。
【0115】
<3>L−アミノ酸の製造法
本発明の細菌を、脂肪酸及びアルコールから選ばれる炭素源を含む培地で培養し、該培地からL−アミノ酸を採取することにより、L−アミノ酸を製造することができる。炭素源は、脂肪酸及びアルコールの一方を含んでいてもよく、これらの両方を含んでいてもよい。
【0116】
脂肪酸とは、一般式 CnHmCOOH(n+1、m+1は、それぞれ、脂肪酸に含まれる炭素数、水素数を表す)で表わすことができる長鎖炭化水素の1価のカルボン酸を指す。一般的に炭素数が12以上のものを長鎖脂肪酸と呼ぶことが多い。脂肪酸は、その炭素数と不飽和度によって様々な種類が存在する。また、脂肪酸は、油脂の構成成分であり、油脂の種類によって脂肪酸の組成も異なることが知られている。ミリスチン酸(C13H27COOH)は炭素数14の飽和脂肪酸であり、ヤシ油、パーム油に含まれる。パルミチン酸(C15H31COOH)は炭素数16の飽和脂肪酸であり、植物油脂一般に多く含まれる。ステアリン酸(C17H35COOH)は、炭素数18の飽和脂肪酸であり、動物性脂肪・植物性油に多く含まれる。オレイン酸(C17H33COOH)は、炭素数18の一価の不飽和脂肪酸であり、動物性脂肪や植物油に多く含まれる。リノール酸(C17H31COOH)は炭素数18で9位と12位にシス型二重結合を2つ持っている多価不飽和脂肪酸である。脂肪酸としては、上記の長鎖脂肪酸の混合物を用いることも出来る。脂肪酸の混合物を炭素源として用いる場合、脂肪酸の混合比率は、本発明の方法に使用する細菌が炭素源として資化できる濃度比率であればいずれでもかまわない。油脂の加水分解物から、グリセロールを除いた脂肪酸の混合物を利用することも可能である。
【0117】
アルコールとしては、グリセロール、エタノール、ブタノール、プロパノール、脂肪族アルコール、芳香属アルコール等が挙げられる。
グリセロールは、正式名称Propane-1,2,3-triolである物質を指す。グリセロールは、純粋なグリセロールであってもよいが、粗グリセロールであってもよい。粗グリセロールとは、工業的に生産される不純物を含むグリセロールをいう。粗グリセロールは、油脂を高温、高圧下で水と接触させ加水分解することによって、あるいは、バイオディーゼル燃料生産のためのエステル化反応によって、工業的に生産される。バイオディーゼル燃料とは、油脂とメタノールからエステル交換反応により生成する脂肪酸メチルエステルのことであり、この反応の副生物として粗グリセロールが生成する(Fukuda, H., Kondo, A., and Noda, H. 2001, J. Biosci. Bioeng. 92, 405-416を参照のこと)。バイオディーゼル燃料生産プロセスでは、エステル交換にはアルカリ触媒法が用いられることが多く、中和時に酸を加えるため、水と不純物を含んだ純度70〜95重量%程度の粗グリセロールが生成する。バイオディーゼル燃料生産において産生される粗グリセロールは、水に加えて、残存メタノールや触媒であるNaOH等のアルカリとその中和に用いられるK2SO4等の酸との塩を不純物として含んでいる。メーカーや製法により差はあるが、このような塩類やメタノールは数パーセントに達する。ここでナトリウム、カリウム、塩化物イオン、硫酸イオン等の、アルカリやその中和に用いられた酸に由来するイオン類は、粗グリセロールの重量に対し、2〜7%、好ましくは3〜6%、さらに好ましくは4〜5.8%含まれていることが好ましい。メタノールは、不純物として含まれていなくてもよいが、望ましくは0.01%以下含まれていることが好ましい。
【0118】
さらに、粗グリセロール中には、微量の金属、有機酸、リン、脂肪酸などを含むことがある。含まれる有機酸としては、蟻酸、酢酸等が挙げられ、不純物として含まれていなくてもよいが、望ましくは0.01%以下含まれていることが好ましい。粗グリセロールに含まれる微量の金属としては、微生物の生育に必要な微量金属が好ましく、例えばマグネシウム、鉄、カルシウム、マンガン、銅、亜鉛等が挙げられる。マグネシウム、鉄、カルシウムは、粗グリセロールの重量に対し、合計で0.00001〜0.1%、好ましくは0.0005〜0.1%、より好ましくは0.004〜0.05%、さらに好ましくは0.007〜0.01%含まれていることが好ましい。マンガン、銅、亜鉛としては、合計で0.000005〜0.01%、より好ましくは0.000007〜0.005%、さらに好ましくは0.00001〜0.001%含まれていることが好ましい。
【0119】
粗グリセロールのグリセロールの純度としては10%以上であればよく、好ましくは50%以上であり、さらに好ましくは70%以上、特に好ましくは80%以上である。不純物の含有量が上記の範囲を満たす限り、グリセロールの純度は90%以上であってもよい。
粗グリセロールを用いる場合は、グリセロールの純度に応じて、グリセロールの量として上記濃度となるように粗グリセロールを培地に添加すればよい。また、グリセロール及び粗グリセロールの両方を培地に添加してもよい。
【0120】
炭素源は、油脂の加水分解物であってもよい。脂肪酸及び/又はグリセロールを含む限り、油脂の加水分解物を含む培地は、「脂肪酸又はアルコールを含む培地」に相当する。
油脂は、脂肪酸とグリセロールのエステルであり、トリグリセリド(triglyceride)とも呼ばれる。油脂としては、加水分解反応が可能であれば、常温で液体のものを指す脂肪油(oil)、固体のものを指す脂肪(fat)など、どのようなものも使用することが出来る。また、動物由来(魚類を含む)油脂と植物由来油脂のすべてが使用可能であり、1種または2種以上を組み合わせて使用することも出来る。原料として用いる油脂は、純粋な油脂であってもよいし、油脂以外の物質を含む混合物であってもよい。例えば、油脂が植物由来のものである場合は、油脂を含む植物抽出物又はその分画物が挙げられる。
【0121】
動物油脂として、バター、豚脂、牛脂、羊脂等、クジラ油、イワシ油、ニシン油等をあげることができる。植物油脂としては、パーム油、オリーブ油、菜種油、大豆油、米糠油、クルミ油、ゴマ油、ピーナッツ油等が挙げられるが、これらに限定されるものではない。パーム油はアブラヤシの果実からとれる油脂であり、近年バイオディーセル(biodiesel)燃料としての利用が盛んになり、生産量が高まっている。アブラヤシ(oil palm)は、ヤシ科アブラヤシ属(Elaeis)に分類される植物の総称である。粗パーム油(crude palm oil)は、一般的に搾油工場で生産される未精製のパーム油を指し、粗パーム油として取引が行われている。また、微細藻類にも油脂を蓄積するものが知られており(Chisti, Y. 2007. Biotechnol Adv. 25: 294-306)、藻体から抽出することも可能である。藻体内には油脂以外にも糖類、タンパク質、アミノ酸などの有機物が含まれているが、これらを含む混合物を加水分解して炭素源として用いても構わない。
【0122】
油脂としては、加水分解により生じる脂肪酸種が、本発明の方法に使用する細菌が炭素源として資化できるものであり、それらの含量がより高い油脂が望ましい。L−アミノ酸生産能を有する細菌が資化できる長鎖の脂肪酸種としては、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、オレイン酸などが挙げられる。
【0123】
油脂の加水分解物とは、上記油脂を化学的あるいは酵素により加水分解したものを指し、脂肪酸とグリセロールの混合物を指す。工業的な加水分解法としては、高温(250-260℃)、高圧(5-6MPa)下で油脂と水を交流接触させる連続高温加水分解法が一般的に行われている。また、酵素を用いて低温(30℃前後)で反応を行うことも工業的に行われている(Jaeger, K. E. et al. 1994. FEMS Microbiol. Rev. 15: 29-63)。前記酵素としては、油脂の加水分解反応を触媒する酵素リパーゼを用いることが出来る。リパーゼは工業的に重要な酵素であり、様々な産業的利用がなされている(Hasan, F. etal. 2006. Enzyme and Microbiol. Technol. 39: 235-251)。油脂の加水分解物は、脂肪酸とグリセロールの混合物であり、パーム油等の一般的な油脂の加水分解物に含まれる脂肪酸に対するグリセロールの重量比は10%程度であることが知られている。油脂の加水分解物としては、脂肪酸及び/又はグリセロールを含む限り特に制限されない。例えば、油脂の加水分解物をそのまま用いることも出来るが、脂肪酸、グリセロールの一部を除いて使うことも可能であるし、脂肪酸やグリセロールを加えて使用することも出来る。この時のグリセロールの脂肪酸に対する重量比は、好ましくは5〜20:100、より好ましくは7.5〜15:100である。
【0124】
なお、脂肪酸の濃度は、ガスクロマトグラフィ(Hashimoto, K. et al. 1996. Biosci.Biotechnol. Biochem. 70:22-30)やHPLC(Lin, J. T. et al. 1998. J. Chromatogr. A. 808: 43-49)により測定することが可能である。
【0125】
培地に加える脂肪酸、または油脂の加水分解物に含まれる脂肪酸は、水にミセル化するナトリウムやカリウムなどとのアルカリ金属塩として用いることが望ましい。しかしながら、脂肪酸のナトリウム塩やカリウム塩の溶解度も発酵原料として用いるのには十分ではない場合がある。そこで、L−アミノ酸生産能を有する細菌が炭素源として脂肪酸をより効率よく資化できるようにするために、乳化を行う等、均一化を促進する工程を加えることが好ましい。例えば乳化方法として、乳化促進剤や界面活性剤を加える等が考えられる。ここで乳化促進剤としては、リン脂質やステロールが挙げられる。また界面活性剤としては、非イオン界面活性剤では、ポリ(オキシエチレン)ソルビタンモノオレイン酸エステル(Tween 80)などのポリオキシエチレンソルビタン脂肪酸エステル、n-オクチルβ-D-グルコシドなどのアルキルグルコシド、ショ糖ステアリン酸エステルなどのショ糖脂肪酸エステル、ポリグリセリンステアリン酸エステルなどのポリグリセリン脂肪酸エステル等が挙げられる。両性イオン界面活性剤としては、アルキルベタインであるN,N-ジメチル-N-ドデシルグリシンベタインなどが挙げられる。これ以外にも、トライトンX-100(Triton X-100)、ポリオキシエチレン(20)セチルエーテル(Brij-58)やノニルフェノールエトキシレート(Tergitol NP-40)等の一般的に生物学の分野で用いられる界面活性剤が利用可能である。
【0126】
さらに、脂肪酸の乳化や均一化を促進するための操作も有効である。この操作は、脂肪酸の乳化や均一化を促進する操作であれば、どのような操作でも構わない。具体的には、ホモジナイザー処理、ホモミキサー処理、超音波処理、高圧処理、高温処理などが挙げられるが、ホモジナイザー処理、超音波処理およびこれらの組合せがより好ましい。
【0127】
上記界面活性剤による処理と、ホモジナイザー処理及び/または超音波処理を組み合わせることが特に好ましく、これらの処理は、脂肪酸がより安定なアルカリ条件下で行われることが望ましい。アルカリ条件としては、pH9以上が望ましく、より望ましくはpH10以上である。
【0128】
本発明の方法で使用する培地に含まれる、脂肪酸、又はアルコールの量は、本発明の方法に使用する細菌が炭素源として資化できる限り幾らでもよいが、培地中に単独の炭素源として添加する場合、10w/v%以下、好ましくは5w/v%以下、さらに好ましくは2w/v%以下含まれることが好ましい。また、培地中に単独の炭素源として添加する場合、0.2w/v%以上、好ましくは0.5w/v%以上、さらに好ましくは1.0w/v%以上含まれていることが望ましい。
【0129】
さらに、本発明の方法に使用する培地には、脂肪酸、又はアルコールに加え、他の炭素源を添加してもよい。好ましいのは、グルコース、フラクトース、スクロース、ラクトース、ガラクトース、廃糖蜜、澱粉加水分解物やバイオマスの加水分解により得られた糖液などの糖類、フマール酸、クエン酸、コハク酸等の有機酸類である。なお他の炭素源を用いる場合には、炭素源中の脂肪酸、又はアルコールの比率が10重量%以上、好ましくは30重量%以上、より好ましくは50重量%以上であることが好ましい。
【0130】
また、流加培地として使用する場合は、流加培地に単独の炭素源として添加する場合、流加後の培地中の濃度が5w/v%以下、好ましくは2w/v%以下、さらに好ましくは1w/v%以下で含まれることが好ましい。また、流加培地に単独の炭素源として添加する場合、0.01w/v%以上、好ましくは0.02w/v%以上、さらに好ましくは0.05w/v%以上の量にて制御することが好ましい。
【0131】
なお、本発明において、脂肪酸又はアルコールは、培養の全工程において一定濃度含まれてもよいし、流加培地のみあるいは初発培地のみに添加されていてもよく、その他の炭素源が充足していれば、一定時間脂肪酸及び/又はアルコールが不足している期間があってもよい。一定時間とは、例えば発酵全体の時間のうち10%、20%、最大で30%の時間で脂肪酸及び/又はアルコールが不足していてもよい。このように一時的に脂肪酸及び/又はアルコールの濃度が0になることがあっても、脂肪酸又はアルコールを含む培地での培養期間が存在する場合は、本発明の「脂肪酸又はアルコールを含む培地で培養する」との文言に含まれる。
【0132】
培地中に添加する炭素源以外の成分としては、窒素源、無機イオン及び必要に応じその他の有機成分を用いることができる。本発明の培地中に含まれる窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、酢酸アンモニウム、ウレア等のアンモニウム塩または硝酸塩等が使用することができ、pH調整に用いられるアンモニアガス、アンモニア水も窒素源として利用できる。また、ペプトン、酵母エキス、肉エキス、麦芽エキス、コーンスティープリカー、大豆加水分解物等も利用出来る。培地中にこれらの窒素源が1種のみ含まれていてもよいし、2種以上含まれてもよい。これらの窒素源は、初発培地にも流加培地にも用いることができる。また、初発培地、流加培地とも、同じ窒素源を用いてもよいし、流加培地の窒素源を初発培地の窒素源と変更してもよい。
【0133】
本発明の培地には、炭素源、窒素源の他にリン酸源、硫黄源が含まれていることが好ましい。リン酸源としては、リン酸2水素カリウム、リン酸水素2カリウム、ピロリン酸などのリン酸ポリマー等が利用出来る。また、硫黄源とは、硫黄原子を含んでいるものであればいずれでもよいが、硫酸塩、チオ硫酸塩、亜硫酸塩等の硫酸塩、システイン、シスチン、グルタチオン等の含硫アミノ酸が望ましく、なかでも硫酸アンモニウムが望ましい。
【0134】
また、培地には、上記成分の他に、増殖促進因子(増殖促進効果を持つ栄養素)が含まれていてもよい。増殖促進因子とは、微量金属類、アミノ酸、ビタミン、核酸、更にこれらのものを含有するペプトン、カザミノ酸、酵母エキス、大豆たん白分解物等が使用できる。微量金属類としては、鉄、マンガン、マグネシウム、カルシウム等が挙げられ、ビタミンとしては、ビタミンB1、ビタミンB2、ビタミンB6、ニコチン酸、ニコチン酸アミド、ビタミンB12等が挙げられる。これらの増殖促進因子は初発培地に含まれていてもよいし、流加培地に含まれていてもよい。
【0135】
また、生育にアミノ酸などを要求する栄養要求性変異株を使用する場合には、培地に要求される栄養素を補添することが好ましい。L-リジン生産菌は、後述のようにL-リジン生合成経路が強化されており、L-リジン分解能が弱化されているものが多いので、L-スレオニン、L-ホモセリン、L-イソロイシン、L-メチオニンから選ばれる1種又は2種以上を添加することが望ましい。初発培地と流加培地は、培地組成が同じであってもよく、異なっていてもよい。また、初発培地と流加培地は、硫黄濃度が同じであってもよく、異なっていてもよい。さらには、流加培地の流加が多段階で行われる場合、各々の流加培地の組成は同じであってもよく、異なっていてもよい。
【0136】
培養は、発酵温度20〜45℃、特に好ましくは33〜42℃で通気培養を行うことが好ましい。ここで酸素濃度は、5〜50%に、望ましくは10%程度に調節して行う。また、pHを5〜9に制御し、通気培養を行うことが好ましい。培養中にpHが下がる場合には、例えば、炭酸カルシウムを加えるか、アンモニアガス、アンモニア水等のアルカリで中和することができる。このような条件下で、好ましくは10時間〜120時間程度培養することにより、培養液中に著量のL-アミノ酸が蓄積される。
【0137】
本発明においては、L-アミノ酸蓄積を一定以上に保つために、細菌の培養を種培養と本培養とに分けて行ってもよく、種培養をフラスコ等を用いたしんとう培養、又は回分培養で行い、本培養を流加培養、又は連続培養で行ってもよく、種培養、本培養ともに回分培養で行ってもよい。
【0138】
本発明において、流加培養あるいは、連続培養を行う際には、一時的に脂肪酸もしくはアルコール、またはその他の炭素源の流加が停止するように間欠的に流加培地を流加してもよい。また、流加を行う時間の最大で30%以下、望ましくは20%以下、特に望ましくは10%以下で流加培地の供給を停止することが好ましい。流加培養液を間欠的に流加させる場合には、流加培地を一定時間添加し、2回目以降の添加はある添加期に先行する添加停止期において発酵培地中の炭素源が枯渇するときのpH上昇または溶存酸素濃度の上昇がコンピューターで検出されるときに開始するように制御を行い、培養槽内の基質濃度を常に自動的に低レベルに維持してもよい(米国特許5,912,113号明細書)。
【0139】
流加培養に用いられる流加培地は、脂肪酸又はアルコールとその他の炭素源及び増殖促進効果を持つ栄養素(増殖促進因子)を含む培地が好ましく、発酵培地中の脂肪酸濃度が一定以下になるように制御してもよい。
流加培地に加えるその他の炭素源としては、グルコース、スクロース、フルクトースが好ましく、増殖促進因子としては、窒素源、リン酸、アミノ酸等が好ましい。窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、酢酸アンモニウム、ウレア等のアンモニウム塩または硝酸塩等を使用することができる。またリン酸源としては、リン酸2水素カリウム、リン酸水素2カリウムが使用でき、アミノ酸としては、栄養要求性変異株を使用する場合には要求される栄養素を補添することが好ましい。また、流加培地は1種でもよく、2種以上の培地を混合してもよい。2種以上の流加培地を用いる場合、それらの培地は混合して1つのフィード缶により流加させてもよいし、複数のフィード缶で流加させてもよい。
【0140】
本発明で連続培養法を用いる場合には、引き抜きは流加と同時に行ってもよいし、一部引き抜いたあとで流加を行ってもよい。また培養液をL-アミノ酸と細胞を含んだまま引き抜いて、細胞だけ発酵槽に戻す菌体を再利用する連続培養法でもよい(フランス特許2669935号明細書参照)。連続的あるいは間欠的に栄養源を流加する方法は流加培養と同様の方法が用いられる。
【0141】
菌体を再利用する連続培養法とは、予定したアミノ酸濃度に達したときに、発酵培地を間欠的にあるいは連続して引き抜き、L-アミノ酸のみを取り出し、菌体を含むろ過残留物を発酵槽中に再循環させる方法であり、例えばフランス特許2669935号明細書を参照にして実施することができる。
【0142】
ここで、培養液を間欠的に引き抜く場合には、予定したL-アミノ酸濃度に到達したときに、L-アミノ酸を一部引き抜いて、新たに培地を流加して培養を行うとよい。また、添加する培地の量は、最終的に引き抜く前の培養液量と同量になるように設定することが好ましい。ここで同量とは、引き抜く前の培養液量と93〜107%の程度の量を意味する。
【0143】
培養液を連続的に引き抜く場合には、栄養培地を流加させると同時に、あるいは流加させたあとに引き抜きを開始することが望ましく、例えば引き抜き開始時間としては流加を始めてから5時間以内、望ましくは3時間以内、さらに望ましくは1時間以内である。また引き抜く培養液量としては、流加させる量と同量で引き抜くことが好ましい。
【0144】
また、L−リジン等の塩基性アミノ酸を製造する際には、培養中のpHが6.5〜9.0、培養終了時の培地のpHが7.2〜9.0となるように制御し、培地中の重炭酸イオン及び/又は炭酸イオンが少なくとも20mM以上存在する培養期があるようにし、前記重炭酸イオン及び/又は炭酸イオンを塩基性アミノ酸のカウンタイオンとする方法で発酵し、目的の塩基性アミノ酸を回収する方法で製造を行ってもよい(特開2002-65287、US2002-0025564A、EP 1813677A)。
【0145】
塩基性アミノ酸を生産する能力を有する微生物を培地中で好気培養するに際して、炭酸イオンもしくは重炭酸イオン又はこれらの両方を、塩基性アミノ酸の主なカウンタイオンとして利用することができる。塩基性アミノ酸のカウンタイオンとして必要な量の重炭酸イオン及び/又は炭酸イオンを培地中に存在させる方法としては、培養中の培地のpHが6.5〜9.0、好ましくは6.5〜8.0、培養終了時の培地のpHが7.2〜9.0となるように制御し、さらに、発酵中の発酵槽内圧力が正となるように制御するか、又は、炭酸ガスもしくは炭酸ガスを含む混合ガスを培地に供給することが知られている(特開2002-65287、米国特許出願公開第20020025564号、EP1813677A)。
【0146】
本発明においては、発酵中の発酵槽内の圧力が正となるように制御すること、及び、炭酸ガスもしくは炭酸ガスを含む混合ガスを培地に供給することの両方を行ってもよい。いずれの場合も、培地中の重炭酸イオン及び/又は炭酸イオンが、好ましくは20mM以上、より好ましくは30mM以上、特に好ましくは40mM以上存在する培養期があるようにすることが好ましい。発酵槽内圧力、炭酸ガス又は炭酸ガスを含む混合ガスの供給量、又は制限された給気量は、例えば培地中の重炭酸イオン又は炭酸イオンを測定することや、pHやアンモニア濃度を測定することによって、決定することができる。
【0147】
上記態様においては、培養中の培地のpHが6.0〜9.0、好ましくは6.5〜8.0、培養終了時の培地のpHが7.2〜9.0となるように制御する。上記態様によれば、従来の方法に比べて、カウンタイオンとして必要な量の重炭酸イオン及び/又は炭酸イオンを培地中に存在させるための培地のpHを低く抑えることが可能となる。アンモニアでpHを制御する場合、pHを高めるためにアンモニアが供給され、塩基性アミノ酸のN源となり得る。培地に含まれる塩基性アミノ酸以外のカチオンとしては、培地成分由来のK、Na、Mg、Ca等が挙げられる。これらは、好ましくは総カチオンの50%以下であることが好ましい。
【0148】
また、発酵中の発酵槽内圧力が正となるようにするには、例えば、給気圧を排気圧より高くすればよい。発酵槽内圧力を正にすることによって、発酵により生成する炭酸ガスが培養液に溶解し、重炭酸イオン又は炭酸イオンを生じ、これらは塩基性アミノ酸のカウンタイオンとなり得る。発酵槽内圧力として具体的には、ゲージ圧(大気圧に対する差圧)で、0.03〜0.2MPa、好ましくは0.05〜0.15MPa、さらに好ましくは0.1〜0.3MPaが挙げられる。また、培養液に炭酸ガス、又は炭酸ガスを含む混合ガスを供給することによって、培養液に炭酸ガスを溶解させてもよい。さらには、培養液に炭酸ガス又は炭酸ガスを含む混合ガスを供給しつつ、発酵槽内圧力が正となるように調節してもよい。
【0149】
発酵槽内圧力を正に調節するには、例えば、給気圧を排気圧よりも高くするように設定すればよい。また、培養液に炭酸ガスを供給する場合は、例えば、純炭酸ガス、又は炭酸ガスを5体積%以上含む混合ガスを吹き込めばよい。
【0150】
尚、培地に重炭酸イオン及び/又は炭酸イオンを溶解させる上記の方法は、単独でもよいし、複数を組み合わせてもよい。
【0151】
従来法では、通常、生成する塩基牲アミノ酸のカウンタアニオンとすべく、十分量の硫酸アンモニウムや塩化アンモニウムが、又、栄養成分として蛋白等の硫酸分解物もしくは塩酸分解物が培地に添加され、これらから与えられる硫酸イオン、塩化物イオンが培地に含まれる。従って、弱酸性である炭酸イオン濃度は培養中極めて低く、ppm単位である。上記態様では、これら硫酸イオン、塩化物イオンを減じ、微生物が発酵中に放出する炭酸ガスを上記発酵環境にて培地中に溶解せしめ、カウンタイオンとすることに特徴がある。したがって、上記態様においては、硫酸イオンや塩化物イオンを生育に必要な量以上培地に添加する必要はない。好ましくは、培養当初は硫酸アンモニウム等を培地に適当量フィードし、培養途中でフィードを止める。あるいは、培地中の炭酸イオン又は重炭酸イオンの溶存量とのバランスを保ちつつ、硫酸アンモニウム等をフィードしてもよい。また、塩基性アミノ酸の窒素源として、アンモニアを培地にフィードしてもよい。アンモニアは、単独で、又は他の気体とともに培地に供給することができる。
【0152】
培地に含まれる重炭酸イオン及び/又は炭酸イオン以外の他のアニオンの濃度は、微生物の生育に必要な量であれば、低いことが好ましい。このようなアニオンには、塩化物イオン、硫酸イオン、リン酸イオン、イオン化した有機酸、及び水酸化物イオン等が挙げられる。これらの他のイオンのモル濃度の合計は、好ましくは通常は900mM以下、より好ましくは700mM以下、特により好ましくは500mM以下、さらに好ましくは300mM以下、特に好ましくは200mM以下である。
【0153】
上記態様においては、硫酸イオン、及び/又は、塩化物イオンの使用量を削減することが目的の一つであり、培地に含まれる硫酸イオンもしくは塩化物イオン、又はこれらの合計は、通常、700mM以下、好ましくは500mM以下、より好ましくは300mM以下、さらに好ましくは200mM以下、特に好ましくは100mM以下である。
【0154】
通常は、塩基性アミノ酸のカウンタイオン源として培地に硫酸アンモニウムを添加すると、硫酸イオンによって培養液中の炭酸ガスが放出してしまう。それに対して、上記態様においては、過剰量の硫酸アンモニウムを培地に添加する必要がないので、炭酸ガスを発酵液中に容易に溶解させることができる。
【0155】
また、上記態様においては、「塩基性アミノ酸の生産を阻害しない」程度に培地中の総アンモニア濃度を制御することが好ましい。そのような条件としては、例えば、最適な条件において塩基性アミノ酸を生産する場合の収率及び/又は生産性に比べて、好ましくは50%以上、より好ましくは70%以上、特に好ましくは90%以上の収率及び/又は生産性が得られる条件が含まれる。具体的には、培地中の総アンモニア濃度としては、好ましくは300mM以下、より好ましくは250mM、特に好ましくは200mM以下の濃度が挙げられる。アンモニアの解離度はpHが高くなると低下する。解離していないアンモニアは、アンモニウムイオンよりも菌に対して毒性が強い。そのため、総アンモニア濃度の上限は、培養液のpHにも依存する。すなわち、培養液のpHが高いほど、許容される総アンモニア濃度は低くなる。したがって、前記「塩基性アミノ酸の生産を阻害しない」総アンモニア濃度は、pH毎に設定することが好ましい。しかし、培養中の最も高いpHにおいて許容される総アンモニア濃度範囲を、培養期間を通じての総アンモニア濃度の上限値範囲としてもよい。
【0156】
一方、微生物の生育及び塩基性物質の生産に必要な窒素源としての総アンモニア濃度としては、培養中にアンモニアが継続して枯渇しない窒素源が不足することにより微生物による目的物質の生産性を低下させない限り特に制限されず、適宜設定することができる。例えば、培養中にアンモニア濃度を経時的に測定し、培地中のアンモニアが枯渇したら少量のアンモニアを培地に添加してもよい。アンモニアを添加したときの濃度としては、特に制限されないが、例えば、総アンモニア濃度として好ましくは1mM以上、より好ましくは10mM以上、特に好ましくは20mM以上の濃度が挙げられる。
【0157】
発酵液からのL−アミノ酸の回収は通常イオン交換樹脂法(Nagai,H.et al., Separation Science and Technology, 39(16),3691-3710)、沈殿法、膜分離法(特開平9-164323号、特開平9-173792号)、晶析法(WO2008/078448、WO2008/078646)、その他の公知の方法を組み合わせることにより実施できる。なお、菌体内にL−アミノ酸が蓄積する場合には、例えば菌体を超音波などにより破砕し、遠心分離によって菌体を除去して得られる上清からイオン交換樹脂法などによって、L−アミノ酸を回収することができる。
【0158】
尚、回収されるL−アミノ酸は、L−アミノ酸以外に細菌菌体、培地成分、水分、及び細菌の代謝副産物を含んでいてもよい。採取されたL−アミノ酸の純度は、50%以上、好ましくは85%以上、特に好ましくは95%以上である (JP1214636B, USP 5,431,933, 4,956,471, 4,777,051, 4946654, 5,840,358, 6,238,714, US2005/0025878))。
【0159】
また、L−アミノ酸が培地中に析出する場合は、遠心分離又は濾過等により回収することができる。また、培地中に析出したL−アミノ酸は、培地中に溶解しているL−アミノ酸を晶析した後に、併せて単離してもよい。
【実施例】
【0160】
以下、実施例により本発明をさらに具体的に説明する。
〔実施例1〕脂肪酸の資化性が向上した菌株の取得
エシェリヒア・コリの野生株K12株由来のMG1655 (ATCC 47076)を親株として、脂肪酸資化性の向上した菌株の取得を試みた。MG1655は、アメリカン・タイプ・カルチャー・コレクション(住所 12301 Parklawn Drive, Rockville, Maryland 20852P.O. Box 1549, Manassas, VA 20108, United States of America)より入手することができる。
【0161】
MG1655株を、M9オレイン酸ナトリウム寒天培地(HClを用いてpH7.0に調製)上で24時間静置培養した。生育した細胞を掻き取り、0.85% NaCl水溶液にけん濁して、M9オレイン酸ナトリウム試験管用液体培地5mLを入れたL字試験管に、波長600nmの濁度が0.00625となるように植菌した。恒温振とう培養装置TN-2612(アドバンテック社製)を用いて、37℃、70rpmの条件で20時間培養を行った後、M9オレイン酸ナトリウム試験管用液体培地5mLを入れたL字試験管に培養液10μLを植え継いだ。同様の植え継ぎ培養を22回繰り返し、計445時間培養を行なった後、M9オレイン酸ナトリウム寒天培地上で24時間静置培養してシングルコロニーを採取し、Fitness1株と命名した。
【0162】
上記Fitness1株を、M9オレイン酸ナトリウム試験管用液体培地5mLにて終OD600がおよそ0.6となるまで37℃にて培養した後、培養液と等量の40%グリセロール溶液を加えて攪拌した後、適当量ずつ分注し、−80℃で保存した。これを、Fitness1株のグリセロールストックと呼ぶ。
上記培地の組成を以下に示す。濃度単位は全て終濃度を示す。
【0163】
〔M9オレイン酸ナトリウム寒天培地組成〕
オレイン酸ナトリウム(純正化学社製) 2g/L
Tween 80 *)(ナカライテスク社製) 0.5%(v/v)
Na2HPO4 6g/L
KH2PO4 3g/L
NaCl 0.5g/L
NH4Cl 1g/L
MgSO4・7H2O 0.246g/L
チアミン 0.5mg/L
寒天 15g/L
*):ポリ(オキシエチレン)ソルビタンモノオレイン酸エステル
【0164】
〔M9オレイン酸ナトリウム試験管用液体培地組成〕
オレイン酸ナトリウム(純正化学社製) 1g/L
Tween 80(ナカライテスク社製) 0.5%(v/v)
Na2HPO4 6g/L
KH2PO4 3g/L
NaCl 0.5g/L
NH4Cl 1g/L
MgSO4・7H2O 0.246g/L
チアミン 0.5mg/L
【0165】
〔実施例2〕脂肪酸の資化性が向上した微生物の培養
Fitness1株のグリセロールストックを、M9オレイン酸ナトリウム寒天培地(HClを用いてpH7.0に調製)上で24時間静置培養した。生育した細胞を掻き取り、0.85% NaCl水溶液にけん濁して、M9オレイン酸ナトリウム試験管用液体培地5mLを入れたL字試験管に、波長600nmの濁度が0.005となるように植菌して恒温振とう培養装置TN-2612(アドバンテック社製)を用いて温度37℃、70rpmの条件で20時間培養したところ、同様の方法で培養したMG1655と比較して有意な生育の向上を示した(図1)。
【0166】
また、Fitness1株のグリセロールストックを、M9オレイン酸ナトリウム寒天培地(HClを用いてpH7.0に調製)上で24時間静置培養し、寒天培地上の細胞を掻き取り、0.85% NaCl水溶液にけん濁して、M9特級オレイン酸フラスコ用液体培地20mLを入れた500mL坂口フラスコに、波長600nmの濁度が0.01となるように植菌した。レシプロ型培養装置で攪拌速度200rpm、37℃の条件で47時間培養した。培養途中の培地を採取し、等量の10% Tween80水溶液と混合した後、波長600nmの濁度と、培養液中のオレイン酸濃度をHashimotoら(Hashimoto, K. et al. 1996. Biosci. Biotechnol. Biochem. 70:22-30)に記載の方法でガスクロマトグラフィー分析により、測定した。その結果、Fitness1株は同様の方法で培養したMG1655と比較して、有意な生育の向上と脂肪酸消費速度の向上を示した(図2、図3)。
上記培地の組成を以下に示す。濃度単位は全て終濃度を示す。
【0167】
〔M9特級オレイン酸フラスコ用液体培地組成〕
オレイン酸(ナカライテスク社製特級) 2g/L
Tween 80(ナカライテスク社製) 0.5%(v/v)
Na2HPO4 6g/L
KH2PO4 3g/L
NaCl 0.5g/L
NH4Cl 1g/L
MgSO4・7H2O 0.246g/L
チアミン 0.5mg/L
【0168】
〔実施例3〕Fitness1株が持つ変異の同定
Herringら(Herring, C.D. et al., 2006, Nat. Genet., 38:1406-1412)に記載されたCGS法を用いて、Fitness1株が持つ染色体上の変異点を探索した。その結果、Fitness1株では、MG1655株のrpsA遺伝子の塩基配列(配列番号1)における628位のGがTに変異していることが明らかとなった。
【0169】
この変異によって、MG1655株のrpsA遺伝子によってコードされるRpsAタンパク質のアミノ酸配列(配列番号2)において、210位のアスパラギン酸残基がチロシン残基に置換されていることが明らかとなった。この変異をRpsA(D210Y)変異と命名した。
Fitness1株が持つ変異型rpsA遺伝子の塩基配列、及び同遺伝子がコードする変異型RpsAのアミノ酸配列を、配列番号3及び4に示す。
【0170】
種々の生物のrpsA遺伝子ホモログのアミノ酸配列の210位近傍の配列を比較したところ、210位のアスパラギン酸残基は原核生物から真核生物に至るまで種間で保存性が高いことが判明した。rpsA遺伝子はエシェリヒア・コリなど腸内細菌群では必須遺伝子とされており、このような遺伝子の保存性の高いアミノ酸残基の適応的変異が大きな生育の改善をもたらすことを予測することは困難であった。また、変異型RpsAを保持することによる効果は、腸内細菌群のみならず、幅広い属種でも期待される。
【0171】
〔実施例4〕エシェリヒア・コリへのRpsA(D210Y)変異の導入
野生型rpsA遺伝子を持つエシェリヒア・コリ菌株に、RpsA(D210Y)変異を導入した。
まず、染色体上でrpsA近傍に位置するFitness1株染色体上のycaI遺伝子を欠損した菌株を構築した。pMW118-attL-Cm-attR (特開2005-58227号公報(WO2005/010175)に記載)プラスミドを鋳型として、λファージのアタッチメントサイトの配列attLとattRの両端に対応する配列をプライマーの3’末端に、ycaI遺伝子の一部に対応するプライマーの5’末端に有する配列番号7及び8に示す合成オリゴヌクレオチドをプライマーに用いてPCRを行い、λ-red法(米国特許出願公開第2006/0160191号公報、Datsenko, K. A, and Wanner, B. L. Proc. Natl. Acad. Sci. U S A. 97:6640-6645 (2000))を用いて、ycaI遺伝子を欠損したFitness1ΔycaI::att-Cm株を構築した。pMW118-attL-Cm-attRは、pMW118(宝バイオ社製)にλファージのアタッチメントサイトであるattL及びattR遺伝子と抗生物質耐性遺伝子であるcat遺伝子を挿入したプラスミドであり、attL-cat-attRの順で挿入されている。
【0172】
Fitness1ΔycaI::att-Cm株から、常法に従いP1ライセートを取得し、MG1655に形質導入を行なって、RpsA(D210Y)変異を染色体上に持つMG1655ΔycaI::att-Cm,rpsA(D210Y)株を構築した。また、Fitness1ΔycaI::att-Cm株の構築に用いたものと同じpMW118(attL-Cm-attR) (特開2005−58227号公報(特許文献2)に記載)を鋳型とし、配列番号7及び8合成オリゴヌクレオチドをプライマーに用いてPCRを行い、同様のλ-red法でMG1655の染色体上のycaI遺伝子を欠損した菌株であるMG1655ΔycaI::att-Cm株を構築した。実施例1と同様にして、同株のグリセロールストックを作製した。
【0173】
尚、MG1655株のゲノムDNAを鋳型として、配列番号5および6に示すような合成オリゴヌクレオチドをプライマーとし、PCR法によってRpsA(D210Y)変異を含む遺伝子断片を構築し、クロスオーバーPCR法、λ-red法、相同組み換え法などを適宜組み合わせて、RpsA(D210Y)変異をエシェリヒア・コリに導入することができる。
【0174】
〔実施例5〕脂肪酸を炭素源とする培地での、RpsA(D210Y)変異による生育向上効果
MG1655ΔycaI::att-Cm,rpsA(D210Y)株のグリセロールストックを、M9オレイン酸ナトリウム寒天培地(HClを用いてpH7.0に調製)上で24時間静置培養した。生育した細胞を掻き取り、0.85% NaCl水溶液にけん濁して、M9オレイン酸ナトリウム試験管用液体培地5mLを入れたL字試験管に波長600nmの濁度が0.005となるように植菌した。恒温振とう培養装置TN-2612(アドバンテック社製)を用いて37℃、70rpmの条件で20時間培養した。その結果、同様の方法で培養したMG1655またはMG1655ΔycaI::att-Cm株と比較して有意な生育の向上を示した(図4)。
【0175】
〔実施例6〕グリセロールを炭素源とする培地での、RpsA(D210Y)変異の生育向上効果
MG1655ΔycaI::att-Cm,rpsA(D210Y)株のグリセロールストックを、M9オレイン酸ナトリウム寒天培地(HClを用いてpH7.0に調製)上で24時間静置培養した。生育した細胞を掻き取り、0.85% NaCl水溶液にけん濁して、M9グリセロール試験管用液体培地5mLを入れたL字試験管に波長600nmの濁度が0.005となるように植菌した。恒温振とう培養装置TN-2612(アドバンテック社製)を用いて37℃、70rpmの条件で20時間培養したとた。その結果、同様の方法で培養したMG1655またはMG1655ΔycaI::att-Cm株と比較して有意な生育の向上を示した(図5)。
上記培地の組成を以下に示す。濃度単位は全て終濃度を示す。
【0176】
〔M9グリセロール試験管用液体培地組成〕
グリセロール(純正化学社製特級) 1g/L
Tween 80(ナカライテスク社製) 0.5%(v/v)
Na2HPO4 6g/L
KH2PO4 3g/L
NaCl 0.5g/L
NH4Cl 1g/L
MgSO4・7H2O 0.246g/L
チアミン 0.5mg/L
【0177】
〔実施例7〕L−リジン生産菌WC196LC/pCABD2へのRpsA(D210Y)変異の導入
Fitness1ΔycaI::att-Cm株から、常法に従いP1ライセートを取得し、L−リジン生産菌WC196LC/pCABD2株(米国特許出願公開第2006/0160191号公報)を宿主として、P1形質導入法を用いてWC196ΔLCΔycaI::att-Cm,rpsA(D210Y)/pCABD2株を構築した。WC196LC(WCΔcadAΔldcC)株(FERM BP-11027)は、エシェリヒア・コリWC196のリジンデカルボキシラーゼ遺伝子cadA及びldcCを、Red-driven integration法(Datsenko, K. A. and Wanner, B. L., 2000. Proc. Natl. Acad. Sci. USA. 97: 6640-6645)とλファージ由来の切り出しシステム(Cho, E. H., Gumport, R. I., Gardner, J. F. J. Bacteriol. 184: 5200-5203 (2002))とを組合わせた方法(WO2005/010175号参照)により、破壊した株である。この株に、pCABD2を導入したのがWC196LC/pCABD2株である。pCABD2は、L−リジンによるフィードバック阻害が解除された変異を有するE. coli由来のジヒドロジピコリン酸合成酵素(DDPS)をコードする変異型dapA遺伝子と、L−リジンによるフィードバック阻害が解除された変異を有するE. coli由来のアスパルトキナーゼIIIをコードする変異型lysC遺伝子と、E. coli由来のジヒドロジピコリン酸レダクターゼをコードするdapB遺伝子と、ブレビバクテリウム・ラクトファーメンタム由来ジアミノピメリン酸デヒドロゲナーゼをコードするddh遺伝子を含んでいる。
【0178】
WC196LCΔycaI::att-Cm,rpsA(D210Y)/pCABD2株を20mg/Lのストレプトマイシンを含むL培地にて、終OD600がおよそ0.6となるまで37℃で培養した。実施例1と同様にして、グリセロールストックを作製した。
【0179】
〔実施例8〕RpsA(D210Y)変異を導入したL−リジン生産菌の脂肪酸またはグリセロールを炭素源とするL−リジン生産能の評価
実施例7で得られたWC196LCΔycaI::att-Cm,rpsA(D210Y)/pCABD2株のグリセロールストックを融解し、その100μLを、20 mg/Lのストレプトマイシンを含むLプレートに均一に塗布し、37℃にて24時間静置培養した。プレートのおよそ1/4量の菌体を、0.5mLの生理食塩水にけん濁し、分光光度計U-2000(日立社製)で波長600nmの濁度を測定した。得られた菌を含むけん濁液を、500 mL容バッフル付三角フラスコの、20 mg/Lのストレプトマイシンを含む発酵培地(下記に示す)の40 mLに、波長600nmの濁度が0.2になる液量で接種し、ロータリー振とう培養装置InnOva 4430 (New Brunswick Scientific社製)で回転攪拌数200rpm、37℃において48時間培養した。
【0180】
本培養における炭素源としては、オレイン酸ナトリウム、またはグリセロールを用い、乳化促進剤としてTween 80を終濃度0.5%(v/v)となるように添加したものを用いた。総炭素源量は10g/Lとした。エシェリヒア・コリがTween80を資化できないことは、M9最小培地にTween80を添加した培地を用いて別途確認した。
【0181】
上記の条件で、48時間培養を行い、培地中に蓄積したL−リジンの量をバイオテックアナライザーAS310(サクラ精機社製)を用いて測定した。また、培地中に添加した炭素源を全て消費したことを、オレイン酸についてはガスクロマトグラフィGC-2014(Shimadsu社製)、グリセロールについてはバイオテックアナライザーBF-5(王子計測機器)を用いて確認した。さらに、培養終了直後にTween80溶液を終濃度1.0%(v/v)となるように添加して、適宜希釈して分光光度計U-2000(日立社製)で波長600nmの濁度を測定することにより、培養終了時の菌体量を測定した。
WC196LC/pCABD2株およびWC196LCΔycaI::att-Cm/pCABD2株についても、同様の培養を行った。
【0182】
本培養に用いたオレイン酸を炭素源とする発酵培地の組成を以下に示す。単位g/Lおよび%(volume/volume換算)は、全て終濃度を示す。
【0183】
オレイン酸ナトリウム(純正化学社製 一級品) 10 g/L
Tween 80 0.5 %
MgSO4・7H2O 1 g/L
PIPES 20g/L
(NH4)2SO4 16 g/L
KH2PO4 1 g/L
FeSO4・7H2O 0.01 g/L
MnSO4・7H2O 0.082 g/L
Yeast Extract(Difco社製) 2 g/L
【0184】
オレイン酸ナトリウムは、HClでpH7.5に調整し、115℃で10分オートクレーブした。
Tween 80は、Nalgene 0.45μmフィルター(Nalgene社製)でフィルター滅菌した。
MgSO4・7H2Oは、115℃で10分オートクレーブした。
PIPESは、NaOHでpH7.5に調整し、115℃で10分オートクレーブした。
上記以外の成分は、それらを混合した後 KOHでpH7.5に調整し、115℃で10分オートクレーブした。
上記のように各成分を5つの区に分けて別殺菌した後、それらを混合した。
【0185】
本培養に用いたグリセロールを炭素源とする発酵培地の組成を以下に示す。単位g/Lおよび%(volume/volume換算)は、全て終濃度を示す。
【0186】
グリセロール(純正化学社製特級) 10 g/L
Tween 80 0.5 %
MgSO4・7H2O 1 g/L
PIPES (pH7.5) 20g/L
(NH4)2SO4 16 g/L
KH2PO4 1 g/L
FeSO4・7H2O 0.01 g/L
MnSO4・7H2O 0.082 g/L
Yeast Extract(Difco社製) 2 g/L
【0187】
グリセロールは、115℃で10分オートクレーブを行なった。
Tween 80は、Nalgene 0.45μmフィルター(Nalgene社製)でフィルター滅菌した。
MgSO4・7H2Oは、115℃で10分オートクレーブした。
PIPESは、NaOHでpH7.5に調整し、115℃で10分オートクレーブした。
上記以外の成分は、それらを混合した後 KOHでpH7.5に調整し、115℃で10分オートクレーブした。
上記のように各成分を5つの区に分けて別殺菌した後、それらを混合した。
【0188】
本培養の結果を表1に示す。Lys(g/L)は、フラスコに蓄積したL−リジン量を示す。RpsA(D210Y)変異導入株(WC196LCΔycaI::att-Cm,rpsA(D210Y)/pCABD2株)は、対照株(WC196LC/pCABD2株およびWC196LCΔycaI::att-Cm/pCABD2株)と比較して、有意に高いL−リジン生産を示した。RpsA(D210Y)変異導入により、L−リジン生産能が向上することが示された。
【0189】
【表1】

【0190】
〔実施例9〕WC196LC株へのエタノール資化性の付与
L−リジン生産菌にエタノール資化性を付与するため、変異型アルコールデヒドロゲナーゼ遺伝子(adhE*)の導入を行った。変異型アルコールデヒドロゲナーゼ遺伝子として、MG1655::PL-tacadhE*(WO2008/010565参照)由来の遺伝子を用いた。MG1655::PL-tacadhE*株は、クロラムフェニコール耐性遺伝子(cat)と、PL-tacプロモーターにより制御される変異型adhE遺伝子が連結したDNA断片を、エシェリヒア・コリMG1655株のゲノムに挿入して得た株である。この変異型adhE遺伝子は、好気的条件下で活性を維持するアルコールデヒドロゲナーゼをコードしている。
【0191】
cat遺伝子をゲノムから除去できるようにするため、cat遺伝子を、ラムダファージのアタッチメントサイトとテトラサイクリン耐性遺伝子を連結したDNA断片(att-tet)で置き換えた。cat遺伝子のatt-tet遺伝子への置き換えは、λ-red法を用いた。cat遺伝子をatt-tet遺伝子で置換えるためのプライマーとして、配列番号9及び10のプライマーを使用した。こうして、MG1655::PL-tacadhE*のcat遺伝子がatt-tet遺伝子で置き換えられたMG1655-att-tet-PL-tacadhE*株を得た。
【0192】
L−リジン生産菌にエタノール資化性を付与するため、MG1655-att-tet-PL-tacadhE*株から常法に従いP1ライセートを取得し、L−リジン生産菌WC196LC株を宿主としてP1形質導入法を用いて、WC196LC-att-tet-PL-tacadhE*株を得た。
次に、PL-tacプロモーター上流に導入されたatt-tet遺伝子を除去するために、ヘルパープラスミドpMW-intxis-ts(米国特許出願公開20060141586)を使用した。pMW-intxis-tsは、λファージのインテグラーゼ(Int)をコードする遺伝子、及びエクシジョナーゼ(Xis)をコードする遺伝子を搭載し、温度感受性の複製能を有するプラスミドである。
【0193】
上記で得られたWC196LC-att-tet-PL-tacadhE*株のコンピテントセルを常法に従って作製し、ヘルパープラスミドpMW-intxis-tsにて形質転換し、30℃で50 mg/Lのアンピシリンを含むLB寒天培地上にて平板培養し、アンピシリン耐性株を選択した。pMW-intxis-tsプラスミドを除去するために、形質転換株をLB寒天培地上、42℃で培養し、得られたコロニーのアンピシリン耐性、及びテトラサイクリン耐性を試験し、アンピシリン感受性株を取得した。こうして、att-tet及びpMW-intxis-tsが脱落しているPL-tacadhE*導入株を取得した。この株をWC196LC PL-tacadhE*株と名づけた。
【0194】
〔実施例10〕WC196LC PL-tacadhE*株へのRpsA(D210Y)変異およびL−リジン生産用プラスミド(pCABD2)の導入
Fitness1ΔycaI::att-Cm株から、常法に従いP1ライセートを取得し、L−リジン生産菌WC196LC PL-tacadhE*株を宿主としてP1形質導入法を用いて、WC196LC PL-tacadhE*ΔycaI::att-Cm,rpsA(D210Y)株を構築した。また、同様に、MG1655ΔycaI::att-Cm株からP1ライセートを取得し、WC196LC PL-tacadhE*株を宿主としてP1形質導入法を用いて、WC196LC PL-tacadhE*ΔycaI::att-Cm株を構築した。
【0195】
WC196LC PL-tacadhE*ΔycaI::att-Cm,rpsA(D210Y)株およびWC196LC PL-tacadhE*ΔycaI::att-Cm株を、pCABD2で常法に従い形質転換し、WC196 PL-tacadhE*ΔycaI::att-Cm,rpsA(D210Y)/pCABD2株、及び、WC196LC PL-tacadhE*ΔycaI::att-Cmを得た。これらの株を20mg/Lのストレプトマイシンを含むL培地にて終OD600がおよそ0.6となるまで37℃にて培養し、実施例1と同様にしてグリセロールストックを作製した。
【0196】
〔実施例11〕RpsA(D210Y)変異導入株のエタノールからのL−リジン生産能の評価
実施例10で得られた各株のグリセロールストックを融解し、各100μLを、20mg/Lのストレプトマイシンを含むLプレートに均一に塗布し、37℃にて15時間培養する。得られた菌体を0.85%の食塩水に懸濁し、初発OD600=0.25となるように、太試験管(内径18 mm)の、20mg/Lのストレプトマイシンを含む発酵培地の5 mLに接種し、往復振とう培養装置で、攪拌120rpmの条件下、37℃で培養する。
エタノールを炭素源とする発酵培地の組成を以下に示す。
【0197】
〔エタノール炭素源L−リジン発酵培地組成〕
エタノール 10 ml/L
(NH4)2SO4 24 g/L
K2HPO4 1.0 g/L
MgSO4・7H2O 1.0 g/L
FeSO4・7H2O 0.01 g/L
MnSO4・5H2O 0.01 g/L
イーストエキストラクト 2.0 g/L
CaCO3(日本薬局方) 30 g/L
上記成分を最終量が1Lとなるように溶解し、KOHでpH5.7に調整し、115℃で10分オートクレーブを行う。但し、エタノール、MgSO4・7H2O、及びCaCO3は別に殺菌する。エタノールはフィルターろ過により滅菌する。MgSO4・7H2Oは蒸留水に溶解してオートクレーブする。CaCO3は、180℃で2時間乾熱滅菌する。抗生物質として、20mg/Lのストレプトマイシンを添加する。
【0198】
16時間培養後、培地中に蓄積したL−リジンの量を公知の方法(サクラ精機 バイオテックアナライザーAS210)により測定する。
【特許請求の範囲】
【請求項1】
L−アミノ酸生産能を有する腸内細菌科に属する細菌を、脂肪酸及びアルコールから選ばれる炭素源を含む培地で培養し、該培地からL−アミノ酸を採取する、L−アミノ酸の製造法であって、
前記細菌は、配列番号15又は16のアミノ酸配列を一部に有し、かつ、配列番号15の5位または配列番号16の5位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有する変異型RpsAタンパク質を保持することを特徴とする方法。
【請求項2】
前記細菌がエシェリヒア属、エンテロバクター属、又はパントエア属に属する細菌である、請求項1に記載の方法。
【請求項3】
前記細菌がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネスである、請求項1に記載の方法。
【請求項4】
前記RpsAタンパク質が腸内細菌科に属する細菌由来である、請求項1〜3に記載の方法。
【請求項5】
前記RpsAタンパク質がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネス由来である、請求項1〜4に記載の方法。
【請求項6】
前記他のアミノ酸残基がチロシン残基である、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記RpsAタンパク質が、前記変異を有する以外は、配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントである、請求項1〜6のいずれか一項に記載の方法。
【請求項8】
前記変異型RpsAタンパク質を保持する細菌が、前記変異を有さないRpsAタンパク質を発現しないことを特徴とする、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
前記変異型RpsAタンパク質を保持する細菌が、該RpsAタンパク質をコードする変異型rpsA遺伝子で、染色体上のrpsA遺伝子が置換されたことを特徴とする、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
前記炭素源が脂肪酸である、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
前記脂肪酸がオレイン酸である、請求項10に記載の方法。
【請求項12】
前記脂肪酸が油脂由来の脂肪酸の混合物である、請求項10に記載の方法。
【請求項13】
前記炭素源がアルコールである、請求項1〜9のいずれか一項に記載の方法。
【請求項14】
前記アルコールがグリセロールである、請求項13に記載の方法。
【請求項15】
前記アルコールがエタノールである、請求項13に記載の方法。
【請求項16】
前記炭素源が油脂を加水分解することによって得られる脂肪酸とグリセロールの混合物である、請求項1〜9のいずれか一項に記載の方法。
【請求項17】
配列番号15又は16のアミノ酸配列を一部に有し、かつ、配列番号15の5位または配列番号16の5位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有する変異型RpsAタンパク質を保持する、腸内細菌科に属する細菌。
【請求項18】
L−アミノ酸生産能を有する請求項18に記載の細菌。
【請求項19】
前記細菌がエシェリヒア属、エンテロバクター属、又はパントエア属に属する、請求項17又は18に記載の細菌。
【請求項20】
前記細菌がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネスである、請求項17〜19のいずれか一項に記載の細菌。
【請求項21】
前記他のアミノ酸残基がチロシン残基である、請求項17〜20のいずれか一項に記載の細菌。
【請求項22】
前記RpsAタンパク質が、前記変異を有する以外は、配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントである、請求項17〜21のいずれか一項に記載の細菌。
【請求項23】
配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントであって、かつ、210位のアスパラギン酸残基が他のアミノ酸残基で置換されたアミノ酸配列を有するタンパク質をコードするDNA。
【請求項24】
前記他のアミノ酸残基がチロシン残基である、請求項23に記載のDNA。
【請求項25】
前記タンパク質は、210位のアスパラギン酸残基が他のアミノ酸残基で置換された以外は配列番号2、配列番号12、又は配列番号14のアミノ酸配列を有する、請求項23又は24に記載のDNA。
【請求項26】
前記タンパク質は、腸内細菌科に属する細菌に保持させたときに、脂肪酸及びアルコールから選ばれる炭素源を含む培地での生育を改善する機能を有する、請求項23〜25のいずれか一項に記載のDNA。
【請求項1】
L−アミノ酸生産能を有する腸内細菌科に属する細菌を、脂肪酸及びアルコールから選ばれる炭素源を含む培地で培養し、該培地からL−アミノ酸を採取する、L−アミノ酸の製造法であって、
前記細菌は、配列番号15又は16のアミノ酸配列を一部に有し、かつ、配列番号15の5位または配列番号16の5位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有する変異型RpsAタンパク質を保持することを特徴とする方法。
【請求項2】
前記細菌がエシェリヒア属、エンテロバクター属、又はパントエア属に属する細菌である、請求項1に記載の方法。
【請求項3】
前記細菌がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネスである、請求項1に記載の方法。
【請求項4】
前記RpsAタンパク質が腸内細菌科に属する細菌由来である、請求項1〜3に記載の方法。
【請求項5】
前記RpsAタンパク質がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネス由来である、請求項1〜4に記載の方法。
【請求項6】
前記他のアミノ酸残基がチロシン残基である、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記RpsAタンパク質が、前記変異を有する以外は、配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントである、請求項1〜6のいずれか一項に記載の方法。
【請求項8】
前記変異型RpsAタンパク質を保持する細菌が、前記変異を有さないRpsAタンパク質を発現しないことを特徴とする、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
前記変異型RpsAタンパク質を保持する細菌が、該RpsAタンパク質をコードする変異型rpsA遺伝子で、染色体上のrpsA遺伝子が置換されたことを特徴とする、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
前記炭素源が脂肪酸である、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
前記脂肪酸がオレイン酸である、請求項10に記載の方法。
【請求項12】
前記脂肪酸が油脂由来の脂肪酸の混合物である、請求項10に記載の方法。
【請求項13】
前記炭素源がアルコールである、請求項1〜9のいずれか一項に記載の方法。
【請求項14】
前記アルコールがグリセロールである、請求項13に記載の方法。
【請求項15】
前記アルコールがエタノールである、請求項13に記載の方法。
【請求項16】
前記炭素源が油脂を加水分解することによって得られる脂肪酸とグリセロールの混合物である、請求項1〜9のいずれか一項に記載の方法。
【請求項17】
配列番号15又は16のアミノ酸配列を一部に有し、かつ、配列番号15の5位または配列番号16の5位のアスパラギン酸残基が他のアミノ酸残基で置換される変異を有する変異型RpsAタンパク質を保持する、腸内細菌科に属する細菌。
【請求項18】
L−アミノ酸生産能を有する請求項18に記載の細菌。
【請求項19】
前記細菌がエシェリヒア属、エンテロバクター属、又はパントエア属に属する、請求項17又は18に記載の細菌。
【請求項20】
前記細菌がエシェリヒア・コリ、パントエア・アナナティス、又はエンテロバクター・アエロゲネスである、請求項17〜19のいずれか一項に記載の細菌。
【請求項21】
前記他のアミノ酸残基がチロシン残基である、請求項17〜20のいずれか一項に記載の細菌。
【請求項22】
前記RpsAタンパク質が、前記変異を有する以外は、配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントである、請求項17〜21のいずれか一項に記載の細菌。
【請求項23】
配列番号17のアミノ酸配列を有するタンパク質又はその保存的バリアントであって、かつ、210位のアスパラギン酸残基が他のアミノ酸残基で置換されたアミノ酸配列を有するタンパク質をコードするDNA。
【請求項24】
前記他のアミノ酸残基がチロシン残基である、請求項23に記載のDNA。
【請求項25】
前記タンパク質は、210位のアスパラギン酸残基が他のアミノ酸残基で置換された以外は配列番号2、配列番号12、又は配列番号14のアミノ酸配列を有する、請求項23又は24に記載のDNA。
【請求項26】
前記タンパク質は、腸内細菌科に属する細菌に保持させたときに、脂肪酸及びアルコールから選ばれる炭素源を含む培地での生育を改善する機能を有する、請求項23〜25のいずれか一項に記載のDNA。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−74795(P2013−74795A)
【公開日】平成25年4月25日(2013.4.25)
【国際特許分類】
【出願番号】特願2010−25000(P2010−25000)
【出願日】平成22年2月8日(2010.2.8)
【出願人】(000000066)味の素株式会社 (887)
【Fターム(参考)】
【公開日】平成25年4月25日(2013.4.25)
【国際特許分類】
【出願日】平成22年2月8日(2010.2.8)
【出願人】(000000066)味の素株式会社 (887)
【Fターム(参考)】
[ Back to top ]

